液相色谱-四极杆飞行时间质谱法快速筛查与确证中华鳖中未知着色剂
2015-03-24李诗言郑重莺张海琪何中央
李诗言, 王 扬, 周 凡, 郑重莺, 张海琪, 何中央*, 何 欣
(1. 浙江省水产质量检测中心, 浙江 杭州 310023; 2. 浙江工商大学食品与生物工程学院, 浙江 杭州 310035)
研究论文
液相色谱-四极杆飞行时间质谱法快速筛查与确证中华鳖中未知着色剂
李诗言1, 王 扬1, 周 凡1, 郑重莺1, 张海琪1, 何中央1*, 何 欣2
(1. 浙江省水产质量检测中心, 浙江 杭州 310023; 2. 浙江工商大学食品与生物工程学院, 浙江 杭州 310035)
建立了液相色谱-四极杆飞行时间质谱(LC-Q-TOF MS)对中华鳖中未知着色剂的快速筛查方法。20个中华鳖样品经过简易的乙腈提取净化后,利用液相色谱-二极管阵列检测器(LC-DAD)对未知着色剂进行定位。选定其中响应最强的样品S7,同时在线获取其在不同洗脱程序下未知着色剂定位时间段的质谱信息,经阴性样品扣除本底后匹配获得一对精确质量数差异在5 mDa以内的特征提取离子(分别为564.397 73 Da和564.395 61 Da)。通过质谱定性分析处理软件对上述特征提取离子对进行分子式生成,确认两者分子式为C40H52O2,推测其同为未知着色剂。结合该未知着色剂的紫外-可见光谱信息与文献资料,推断该化合物可能为角黄素。通过角黄素标准品建立的飞行时间质谱“二级确证谱库”对样品中未知着色剂进行进一步的匹配确证,最终确证其为角黄素。本研究讨论了基于LC-Q-TOF MS方法的化合物筛查策略,实验表明其可快速对中华鳖中的未知着色剂进行筛查和确证。
液相色谱-四极杆-飞行时间质谱法;未知物鉴定;着色剂;中华鳖
对于化合物的筛查方法大致可以归类为以下3种:(i)目标化合物筛查:通过标准品获得化合物信息进行匹配筛查;(ii)半目标化合物筛查:没有化合物标准品,通过已有的筛查化合物列表和相关信息进行匹配筛查;(iii)未知化合物筛查:化合物完全未知,通过提取化合物相应信息进行综合分析推断化合物构成,再进一步进行筛查与确证[1]。目前对于未知化合物的鉴定工作,主要通过核磁共振、红外光谱、质谱等仪器手段。其中飞行时间质谱因其具有高分辨率和高质量数准确度等特点,被认为是在未知化合物筛查鉴定方面的一种有效技术手段[2]。未知化合物筛查分析工作需要处理海量数据,没有相应的数据分析软件,就需要耗费大量的处理时间。通过结合色谱分离技术与软件信息学技术,飞行时间质谱可进一步提高筛查效率,并能对复杂样品基质中未知化合物进行筛查确证,目前该技术已经开始在食品安全分析、环境可持续污染物分析以及药物代谢分析等领域得到了应用[3-8]。
近年来,有不法商贩把养殖的中华鳖着色染黄后冒充野生鳖售卖,以获取更大的经济利益。这些着色剂成分不明,对人体存在着潜在的食品安全风险。本研究通过高效液相色谱-四极杆飞行时间质谱法对中华鳖体内未知着色剂进行定性分析,结合紫外光谱数据、软件信息处理等方法综合推测出未知着色剂并进行确证,探讨了基于飞行时间质谱技术的未知物筛查方法策略,为相关执法、监督工作提供了检测依据,具有重要的现实意义。
1 实验部分
1.1 仪器、试剂与材料
Agilent 1290-6540液相色谱-四极杆-飞行时间质谱仪(LC-Q-TOF MS),配有二极管阵列检测器(DAD)和Dual Agilent Jet Stream Electrospray Ionization(Dual AJS ESI)源(美国安捷伦公司);菲恰尔TDL-5A离心机(上海菲恰尔分析仪器有限公司); MassHunter工作站(美国安捷伦公司); Sigma 2-6E离心机(德国Sigma公司); N-EVAP 112水浴式氮吹浓缩仪(美国Organomation Associates, Inc.); IKA MS 3 BS 25快速混匀器(德国IKA集团); Milli-Q超纯水系统(美国Millipore公司)。
角黄素标准品(CAS: 514-78-3,纯度98.3%,德国Dr. Ehrenstorfer公司);乙腈、甲醇(色谱纯,美国TEDIA公司);甲酸(HPLC纯,美国ROE Scientific Inc.)。
20个中华鳖样品在杭州地区农贸市场购得,均体色异常发黄。取靠近皮肤组织肌肉部分(包括皮肤)绞碎制成均匀糜状样品。
1.2 实验步骤
1.2.1 样品制备
称取2.0 g(精确到0.01 g)中华鳖糜状肉质样品于50 mL聚四氟乙烯螺旋盖离心管中,加入10 mL乙腈充分涡旋混合均匀后超声提取10 min, 3 500 r/min转速下离心5 min,取上清液;重复上述提取步骤,合并上清液,在不超过40 ℃下氮吹至近干;用乙腈定容至1 mL, 8 000 r/min转速下离心2 min,取上清液过滤膜,待上机测定。
1.2.2 中华鳖中未知着色剂的LC-DAD/Q-TOF MS筛查分析
对中华鳖样品进行LC-DAD检测,同时在线进行Q-TOF MS数据采集。结合紫外光谱数据,利用安捷伦公司的质谱定性分析数据处理软件(MassHunter Qualitative Analysis B.5.00)对样品进行分析,凭借内置算法分子特征提取(molecular feature extraction, MFE)和分子式生成(molecular formula generation, MFG)软件对疑似未知着色剂进行定性分析。
1.2.3 中华鳖中未知着色剂的确证
购买1.2.2节分析得出的疑似目标化合物标准品,建立其一级筛查谱库和二级确证谱库,对中华鳖中未知着色剂进行匹配筛查确证。
1.3 实验条件
1.3.1 色谱条件
色谱方法A 色谱柱:Agilent ZORBAX Eclipse Plus C18柱(100 mm×2.1 mm, 3.5 μm)。柱温:30 ℃。进样量:5 μL。DAD扫描波长:250~800 nm。流动相:A为5 mmol/L乙酸铵溶液(含0.1%(v/v)甲酸), B为乙腈;流速:250 μL/min;梯度洗脱程序:0~2 min, 5%B; 2~8 min, 5%B~80%B; 8~15 min, 80%B~90%B; 15~16 min, 90%B~98%B; 16~20 min, 98%B。
色谱方法B 梯度洗脱程序:0~1 min, 90%B; 1~5 min, 90%B~98%B; 5~7 min, 98%B;其余条件同色谱方法A。
1.3.2 质谱条件
离子源:Dual AJS ESI源;扫描方式:正离子全扫描。一级质谱数据采集为单极质谱全扫描模式,扫描范围:m/z50~1 000,采集速率为2 spectra/s。二级质谱数据采集为目标离子采集模式,扫描范围:m/z50~1 000,采集速率为2 spectra/s,碰撞能量为10、20和40 eV。采集数据时采用参比液(含有C5H4N4,其离子精确质量数为121.050 873 Da)实时质量校准。
1.3.3 数据处理参数
MFE按下面参数条件进行:目标数据类型为小分子化合物,色谱方式进样;提取峰高强度大于500;提取离子最大带电荷数2;同一化合物离子数目为2或者更多;其他参数为缺省。MFG按下面参数条件进行:匹配总得分(overall score)涉及质量得分(mass score)、同位素强度得分(isotope abundance score)以及同位素间距得分(isotope spacing score)3个因素,三者的权重值分别为100、60和50;元素组成及个数范围:C(3~500)、H(5~1 000)、O(0~20)、N(0~20)、S(0~10)、F(0~10)、P(0~10)、Cl(0~10)和Br(0~10);其他参数为缺省。
1.3.4 着色剂筛查谱库
利用安捷伦公司的个人化合物数据库软件(personal compound datebase and library, PCDL)建立了包括角黄素、柠檬黄、诱惑红等43种禁用和限用红黄色着色剂的“双谱库”(一级筛查谱库和二级确证谱库)。其中一级筛查谱库通过化合物分子式以及精确质量数等信息建立;二级确证谱库通过化合物标准品,采集相应化合物的MS/MS谱图信息建立。
2 结果与讨论
2.1 样品前处理
常见的红黄类色素种类繁多,化学性质差异大(如有脂溶性的苏丹红类色素,也有水溶性的苋菜红色素等),找到合适的提取试剂非常重要。有报道[9-11]显示乙腈能够提取食品中的苏丹红类色素、碱性橙类色素、罗丹明类色素、叶黄素、胭脂红和苋菜红等色素。乙腈极性适中,能够同时提取极性和极性偏弱类化合物,适用范围较广泛。在周法东等[11]的研究中采用乙腈作为提取试剂,超声辅助简易提取了肉制品中的8种不同化学性质的红色色素,本研究参考了其前处理方法,对2.0 g中华鳖肉质样品采用20 mL乙腈分两次超声辅助简易萃取,浓缩后上样分析。肉类样品主要的基质干扰物为蛋白质与脂肪,以乙腈为提取试剂提取,相比乙酸乙酯与丙酮提取的基质脂肪含量较少,且乙腈的蛋白质沉淀作用能够获得更为纯净的基质,更有利于后续的筛查分析。
2.2 未知着色剂的LC-DAD分析
由于已知中华鳖样品中的着色剂呈红黄色,因此通过DAD数据对目标化合物进行定位分析是可行的方法[12]。为了更有效地获取目标化合物的质谱信息,本研究采用阴性样品对照,外加两次在不同色谱条件下洗脱进行双定位,获取两次质谱信息并进行交叉匹配来排除干扰。未知着色剂的化学性质不明,因此首先采用色谱方法A进行定位分析,其洗脱条件被设计为一个大梯度的洗脱程序(从5%低比例有机相到98%高比例有机相),保证了极性化合物和弱极性化合物都能被洗脱下来。按照1.3.1节中色谱方法A对20个中华鳖样品进行LC-DAD/Q-TOF MS检测,结果20个样品中有14个样品在15.1 min左右出现可见光区波长段响应峰,该峰最大吸收波长为470 nm,符合红黄色物质的吸收波长范围,确定其为目标化合物响应峰。结合色谱方法A参数可知目标化合物在高比例有机相时间段(80%以上比例的有机相)出峰,推测目标化合物为弱极性化合物,因此设计高比例有机相的色谱方法B(从90%有机相到98%有机相)作为 第二次色谱分离的条件。色谱方法B在保证目标化合物得以顺利洗脱的同时,能够排除色谱方法A中部分极性稍强的共流出化合物对后续质谱分析的干扰。选取在色谱方法A中响应最强编号为S7的样品按照1.3.1节中色谱方法B再次进行LC-DAD/Q-TOF MS检测,未知着色剂在两次DAD检测的保留时间分别为15.099 min和5.032 min(见图1)。
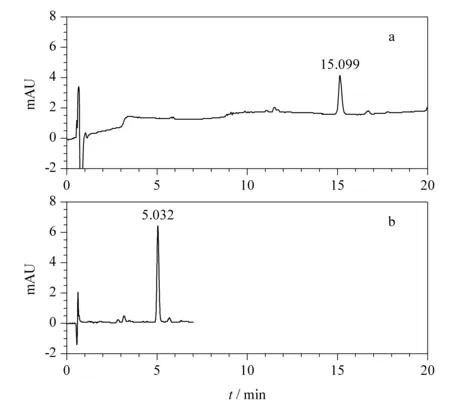
图 1 S7号样品的LC-DAD谱图Fig. 1 LC-DAD chromatograms of the S7 sample a. LC-DAD detection with chromatographic process A: Agilent ZORBAX Eclipse Plus C18 column (100 mm×2.1 mm, 3.5 μm); column temperature: 30 ℃; injection: 5 μL; DAD detection wavelengths: 250-800 nm; mobile phases: 5 mmol/L ammonium acetate (containing 0.1%(v/v) formic acid) (A) and acetonitrile (B); flow rate: 250 μL/min; gradient elution program: 0-2 min, 5%B; 2-8 min, 5%B-80%B; 8-15 min, 80%B-90%B; 15-16 min, 90%B-98%B; 16-20 min, 98%B. b. LC-DAD detection with chromatographic process B: gradient elution program: 0-1 min, 90%B; 1-5 min, 90%B-98%B; 5-7 min, 98%B. Others are the same as chromatographic process A.
2.3 未知着色剂的LC-Q-TOF MS分析
2.3.1 分子特征提取
在色谱方法A和B条件下S7号样品的总离子流图(total ion chromatogram, TIC)见图2。参照LC-DAD检测结果定位着色剂,按照1.3.3节中MFE算法参数,分别提取S7号样品和阴性样品在色谱方法A条件下14.500~16.000 min时间段的特征化合物信息,以及色谱方法B条件下4.500~5.500 min时间段的特征化合物信息。一般在筛查未知化合物的工作中对精确质量数相差要求控制在5 mDa以内[13]。按此条件将色谱方法A和B下获取的化合物质谱信息扣除阴性样品本底后进行交叉匹配,共筛查出一对精确质量数分别为564.397 73 Da和564.395 61 Da的匹配离子对。两者编号分别为化合物5和化合物8,保留时间分别为15.196 min和5.108 min,质量偏差为2.12 mDa(见表1),推测其同为未知着色剂。通常对于未知化合物的鉴定分析工作需要研究人员靠视觉经验从总离子流图中提取化合物的质谱信息。由于样品基质的复杂性,从谱图数据中找出有效的化合物信息是非常困难的。基于MassHunter软件的MFE算法可根据采集所得质谱数据的保留时间以及精确质量数,将化合物的相关质谱信息从海量的质谱数据中提取出来,有效提高了未知化合物的提取效率。

图 2 S7号样品的LC-Q-TOF MS总离子流图Fig. 2 Total ion chromatograms of the S7 sample by LC-Q-TOF MS a. LC-Q-TOF MS detection with chromatographic process A; b. LC-Q-TOF MS detection with chromatographic process B. The chromatographic processes A and B are the same as in Fig. 1.表 1 不同梯度洗脱条件下中华鳖中疑似未知化合物提取交叉匹配结果Table 1 Results of suspected non-target compound molecular feature extraction cross-mapping in Chinese softshell turtle with different gradient elution programs

ChromatographicprocessSampleNon-targetscreeningresulta)CompoundcodeRT/minΔRTb)/minMass/DaΔMassc)/mDaAS714515.1960.097564.397732.12BS7-22085.1080.076564.39561
a) The number of MFE compound results excluded negative sample background spectrum information in gradient elution programs A and B. b) The ΔRT of the retention times (RTs) of selected compound in LC-DAD and LC-Q-TOF MS chromatograms. c) The difference between the observed mass of the selected compound detected by different LC methods.
2.3.2 分子式生成
基于MassHunter软件的MFG算法,同时参照了提取化合物的同位素分布和质量精确度数据,匹配结果能够剔除大部分不正确的分子式,提高了未知化合物鉴定分析的准确度和可靠性。按照1.3.3节中MFG算法参数对MFE结果中色谱方法A的化合物5和色谱方法B的化合物8进行分子式生成,结果两者最佳匹配分子式均为C40H52O2(见图3),匹配得分为97.11和96.73。通过分子式生成进一步验证了色谱方法A和色谱方法B下分别提取的化合物5和化合物8同为疑似目标着色剂,并确定了该未知着色剂的分子式为C40H52O2。

图 3 S7号样品中疑似未知化合物的MFG结果Fig. 3 MFG results of the suspected non-target compound in the S7 sample
2.4 未知着色剂的确证
未知着色剂的分子式确认为C40H52O2,最大吸收波长为470 nm,参照文献[14,15],推断该未知着色剂可能为角黄素(canthaxanthin)。按照1.2.3节的方法,添加角黄素标准品数据进入着色剂筛查“双谱库”,并对S7号样品进行“双谱库”匹配确证。结果S7号样品经一级谱库筛查检出角黄素,匹配得分为97.27;二级谱库确证结果匹配得分为89.31。从S7样品在10 eV碰撞能量下的二级质谱碎片镜像对比图(见图4)中可以看出,S7号样品的疑似化合物母离子(m/z565.402 93)的子离子碎片m/z133.064 17、203.142 71、363.267 13、413.283 91、473.339 54能够与角黄素标准品的子离子碎片匹配上。由于样品基质的干扰,部分干扰离子如m/z566.498 08影响了匹配得分,但从局部放大图可以看出,未知着色剂的母离子同位素峰匹配良好,完全满足欧盟2002/657/EC决议中对高分辨率质谱确证化合物的定性要求。经过“双谱库”的筛查鉴定,最终确证了中华鳖中未知着色剂为角黄素。
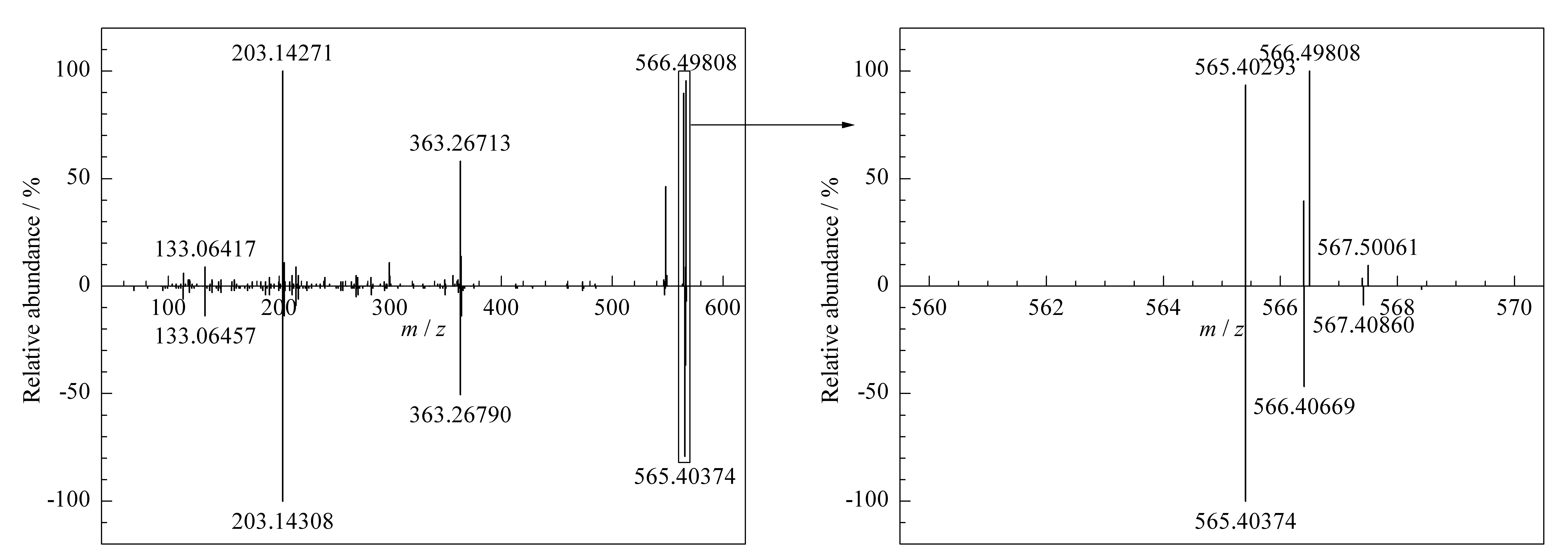
图 4 S7号样品中疑似未知化合物的二级质谱碎片镜像对比图Fig. 4 Mirror image of MS/MS of suspected non-target compound in the S7 sample
2.5 基于LC-Q-TOF MS技术的筛查分析策略
在LC-Q-TOF MS筛查方法中,对于化合物的定性鉴定工作主要是通过与预先建立好的质谱谱库匹配来进行的,即半目标化合物筛查。如在林慧等[16]的研究中通过LC-Q-TOF MS方法对牛肉中未知色素进行筛查和谱库匹配筛查,结果成功检出了刚果红;Domínguez-Romero等[17]同样通过LC-Q-TOF MS技术对尿液中200种运动类药物进行筛查确证,其中大部分药物运用筛查谱库进行半目标化合物筛查,少部分药物与其代谢物通过质谱信息进行推断鉴定。本研究初始按照1.2.1节方法进行样品预处理,采用1.3.1节的仪器条件(采用色谱方法A)上机分析,运用1.3.4节的着色剂一级筛查谱库(最初未包含角黄素)进行初筛,结果未有任何着色剂检出。这说明在实际筛查检测工作中,“双谱库”的建设对于LC-Q-TOF MS的筛查分析至关重要。筛查谱库越完善,筛查的范围也就越广,鉴定结果就越准确,检测效率也就越高[18]。
由于谱库建设的局限性,检测人员时常会面对未知化合物的筛查鉴定工作,LC-Q-TOF MS技术对于未知化合物的鉴定优势便是能够获得化合物的精确质量数进而确定其分子式,并通过二级碎片信息进行结构推断。但在实际样品中,复杂的基质使得化合物的提取信息过于庞杂,因此就需要运用其他技术手段来进一步缩小筛查范围。本研究考虑要未知化合物为有色物质,因此通过在线LC-DAD的检测结果来辅助定位目标化合物。同时,为了进一步减少样品基质带来的化合物信息干扰,本研究采用不同色谱方法进行双定位并利用阴性样品去除本底。将两次色谱方法下定位提取的质谱信息进行交叉匹配,最终获得了疑似目标化合物即角黄素的精确质量数和分子式,提高了化合物的鉴定效率。
3 结论
本研究建立了一种快速鉴定中华鳖中未知着色剂的LC-Q-TOF MS分析方法,并从实际样品中成功筛查出未知着色剂为角黄素。该方法结合软件信息学优势,具有效率高、准确度高的特点。该研究思路对其他基质中未知化合物的鉴定分析工作提供了参考意义。由于仅仅采用了LC-MS手段进行鉴定,因此该策略对于情况更为复杂的化合物信息推断存在一定的局限性,这就需要通过其他技术手段(如核磁共振谱和红外光谱等)来进一步对未知化合物进行确证分析。
[1] Bletsou A A, Jeon J, Hollender J, et al. TrAC-Trends Anal Chem, 2015, 66: 32
[2] Cherta L, Portolés T, Pitarch E, et al. Food Chem, 2015, 188: 301
[3] Lin L Y, Yang L Z, Yan L J, et al. Journal of Food Safety & Quality (林立毅, 杨黎忠, 严丽娟, 等. 食品安全质量检测学报), 2013, 4(3): 899
[4] Xie H B, Zhou M Y, Zhao H F, et al. Chinese Journal of Chromatography (谢寒冰, 周明莹, 赵海峰, 等. 色谱), 2014, 32(5): 493
[5] Perez-Parada A, Aguera A, del Mar Gomez-Ramos M, et al. Rapid Commun Mass Spectrom, 2011, 25: 731
[6] Yu B F, Wen L L, Song Y H, et al. Spectroscopy and Spectral Analysis (俞博凡, 温丽丽, 宋永会, 等. 光谱学与光谱分析), 2011, 31(8): 2259
[7] Bi Y F, Wang Y L, Ye N, et al. Chinese Journal of Chromatography (毕言锋, 王亦琳, 叶妮, 等. 色谱), 2015, 33(7): 704
[8] Chen L, Cai S Y, Lu Q H. Chinese Journal of Pharmaceutical Analysis (陈露, 蔡姗英, 鲁秋红. 药物分析杂志), 2013, 33(12): 2129
[9] Lin H L, Zhong B P, Hua Y Y. Chinese Journal of Health Laboratory Technology (林宏琳, 钟碧萍, 华永有. 中国卫生检验杂志), 2014, 24(2): 156
[10] Yang W W, Qiu J, Gao G, et al. Journal of Anhui Agricultural Sciences (杨文文, 邱静, 高贵, 等. 安徽农业科学), 2013, 41(24): 10108
[11] Zhou F D, Liu X J, Lai C Y, et al. Meat Research (周法东, 刘宪军, 来创业, 等. 肉类研究), 2013, 27(6): 19
[12] Hu L, Lei S R, Guo L A, et al. Chinese Journal of Analytical Chemistry (胡莉, 雷绍荣, 郭灵安, 等. 分析化学), 2013, 41(1): 110
[13] Aguera A, Jesus Martinez Bueno M, Fernandez-Alba A R. Environ Sci Pollut Res, 2013, 20(6): 3496
[14] Caballo C, Costi E M, Sicilia M D, et al. Food Chem, 2012, 134(2): 1244
[15] Bo H B, Xing Y X, Luo L L, et al. Chinese Journal of Analysis Laboratory (薄海波, 星玉秀, 雒丽丽, 等. 分析试验室), 2009, 28(11): 48
[16] Lin H, Xu C X, Yan C R, et al. Chinese Journal of Chromatography (林慧, 徐春详, 颜春荣, 等. 色谱), 2013, 31(9): 914
[17] Domínguez-Romero J C, García-Reyes J F, Lara-Ortega F J, et al. Talanta, 2015, 134(1): 74
[18] Ibanez M, Sancho J V, Hernandez F, et al. TrAC-Trends Anal Chem, 2008, 27(5): 481
Rapid screening and confirmation of non-target pigment in Chinese softshell turtle by liquid chromatography coupled to time of flight mass spectrometry
LI Shiyan1, WANG Yang1, ZHOU Fan1, ZHENG Chongying1,ZHANG Haiqi1, HE Zhongyang1*, HE Xin2
(1.AquaticProductsQualityInspectionCenterofZhejiangProvince,Hangzhou310023,China;2.SchoolofFoodScienceandBiotechnology,ZhejiangGongshangUniversity,Hangzhou310035,China)
A method of non-target pigment screening in Chinese softshell turtle has been established by using liquid chromatography coupled to time of flight mass spectrometry (LC-Q-TOF MS). After being purified by a simple acetonitrile extraction work, the non-target pigment in 20 Chinese softshell turtle samples was detected by liquid chromatography-photodiode array detection (LC-DAD). The S7 sample, which has a strong spectral response, was chosen to extract the mass spectrometry information of the non-target pigment on different gradient elution conditions. In order to get the characteristic molecular mass ion (564.397 73 Da and 564.395 61 Da) of the non-target pigment, qualitative spectral full scan with negative sample was used. The molecular formula generation data and the literature information prompted speculation that the non-target pigment was canthaxanthin with the formula of C40H52O2. By comparing the canthaxanthin standard material MS/MS information, the result was confirmed accurate. A strategy of LC-Q-TOF MS method for the qualitative analysis of unknown compounds is discussed, and the results indicated that the described method can be effectively applied to qualitative analysis for non-target pigment in Chinese softshell turtle.
liquid chromatography-quadrupole time of fight mass spectrometry (LC-Q-TOF MS); non-target compound identification; pigment; Chinese softshell turtle
10.3724/SP.J.1123.2015.08008
浙江省科技厅公益技术研究农业项目(2013C32062,2015C32029);浙江省自然科学基金项目(LQ14C190001);2013年浙江省农业标准化研究项目.
2015-08-09
O658
A
1000-8713(2015)12-1251-06
* 通讯联系人.E-mail:hzyzjsc@163.com.
