基于电迁移的蛋白质制备技术和方法新进展
2015-03-24郝斐然张养军钱小红
郝斐然, 付 斌, 张养军, 钱小红
(军事医学科学院放射与辐射医学研究所, 北京蛋白质组研究中心, 蛋白质组学国家重点实验室, 北京 102206)
专论与综述
基于电迁移的蛋白质制备技术和方法新进展
郝斐然, 付 斌, 张养军*, 钱小红*
(军事医学科学院放射与辐射医学研究所, 北京蛋白质组研究中心, 蛋白质组学国家重点实验室, 北京 102206)
基于电迁移的蛋白质制备技术是对一类分离和制备技术的统称,其特征是在电场的作用下对目标物质进行分离和纯化制备,这种技术在生物大分子和蛋白质组的研究中应用广泛。基于电迁移的制备技术主要包括制备型电泳、制备型电色谱、制备型等电聚焦和自由流电泳等。本文对每种制备型电迁移装置的设计、特点和基于该种装置的各种应用方法的优缺点进行了详细阐述,并列举了一些实例。另外,微量级制备型电泳因分离度高、回收率高以及高效快速的优点,在微量级生物样本分析中发挥着日益重要的作用,近年来备受关注,本文也着重关注了这方面的进展,并对基于电迁移的制备技术做了展望。
电迁移制备技术;制备型电泳;制备型电色谱;制备型等电聚焦;自由流电泳;微量级制备型电泳;蛋白质;综述
蛋白质的分离纯化对蛋白质以及蛋白质组的研究和应用具有重要意义,但由于蛋白质种类多,动态范围宽,其分离和制备面临巨大挑战[1]。目前常用的蛋白质分离制备技术主要包括高效液相色谱和电迁移技术。随着蛋白质特别是蛋白质组学研究的深入,这两种技术都取得了很大进展。本文主要对基于电迁移的蛋白质分离制备技术的新进展进行评述。基于电迁移的蛋白质制备技术是对一类蛋白质制备技术的统称,其特征是在电场的作用下对目标物质进行分离和纯化制备[2]。基于电迁移的分离技术的原理是利用样品相对分子质量大小不同和所带电荷差异等,使其在电场中迁移的速度不同,从而实现彼此分离。被分离的样品再经过诸如制备型洗脱装置、馏分收集器等收集装置收集后即可实现样品的制备。按照样品在电迁移分离过程中受力的差异,可将其分为制备型电泳、制备型电色谱、制备型等电聚焦以及自由流电泳等。按照所用的分离介质的不同,又可将基于电迁移的制备技术分为固相介质制备技术和无介质制备技术。而依据制备量级的不同,还可分为大量级制备技术和微量级制备技术[3-6]。本文针对以上不同类别的制备型电迁移装置设计及其应用进行评述和展望。
1 制备型电泳装置及应用
制备电泳是依据分离对象带电性质差异,进而产生电迁移速率不同来进行分离,并以此纯化和制备生物样品的一种方法[7]。与常规的分析型电泳相比,制备电泳上样量大、可在线收集制备所需的目标物质,以便进一步深入分析。制备电泳技术现在已经在核酸、多肽及蛋白质等生物物质的制备中得到了广泛的应用[8-10]。
传统的制备型电泳均为制备型凝胶电泳,以变性或非变性聚丙烯酰胺凝胶作为分离介质,将两个缓冲液槽安装在垂直电泳系统凝胶的上下两端,以电场作为驱动力实现样品的分离。收集样品时,传统的制备电泳一般将半透膜放置在凝胶底部,用于截留脱离凝胶的大分子样品并减少电解时产生的气泡干扰,起到稳定电流的作用。另外,在凝胶底部不断有缓冲液流过与半透膜之间较微小的空间,通过凝胶下端的管道,带出这些从分离凝胶中迁移出的生物大分子物质,如蛋白质等,实现这些生物大分子的分离制备。
制备电泳的典型装置可追溯于1964年Ornstein[11]提出的圆盘电泳原理。其中具有代表性的应用是1968年Lewis等[12]利用制备电泳纯化牛生长激素和催乳素。但在这些实例中,制备电泳并非专门的分离制备仪器而只是利用圆盘电泳的简单装置。Lewis等在实验中使用了两种不同长度的分离介质凝胶柱,凝胶柱的截面积均为15.8 cm2,长度分别为3.4 和6.8 cm,周围采用冷却水保持凝胶柱外侧温度在5 ℃以下。凝胶柱下方用流速为1 mL/min的0.05 mmol/L NH4HCO3缓冲液作为流动相,从凝胶柱迁移出的蛋白质被携带至馏分收集器,每个馏分为2 mL。同时他们的装置还附加有流动池,采用紫外吸收方法进行检测,对分离的蛋白质进行在线紫外吸收分析。
Lewis等[12]将50 mg牛脑垂体提取物上样到直径为4.5 cm的圆盘电泳装置上,经过5 h的电泳,收集其中紫外吸收峰最强的馏分,并在相同条件下再次进行制备电泳,收集同样时间的馏分。类似于采用分析型液相色谱方法多次上样多次收集同一馏分的蛋白质制备方法,借此实现较大规模的目标物质的制备。
此后,日本科学家Akaiwa[13]也设计了多套制备电泳装置。其中一套装置如图1所示,使用的是圆柱形的凝胶,凝胶外部配置有大体积的正极电极液槽,同时起到冷却作用。凝胶下部有收集通道,与正极电极液槽中的电极液以半透膜相隔,以收集从凝胶中迁移出的蛋白质。采用这种装置,Akaiwa分离并制备了人血红蛋白、结合珠蛋白的混合物以及双白蛋白。虽然Akaiwa的装置在设计上比前人的制备装置前进了一步,如设有专门用于蛋白质制备的收集通道、专门的连接部件和循环冷却水散热部件,但由于整个装置仍然与圆盘电泳原理相同,因此分离与制备效果并没有实质性的提升。在这种模式下,要提高分辨率就必然要增加凝胶长度,导致电泳时间的增长。例如,Akaiwa在分离与制备蛋白质时,收集了100个馏分,用时约9 h。

图 1 Akaiwa设计的制备电泳装置原理示意图Fig. 1 Schematic diagram of the preparative electrophoresis apparatus designed by Akaiwa
1986年,Carpenter等[14]设计了一套平板制备电泳系统,用于分离制备蛋白质样品。这套系统使用3 mm厚的聚丙烯酰胺凝胶作为固相介质,在凝胶中插入相距0.5 mm的两张半透膜,上游的半透膜所接触的凝胶浓度为4%,下游的半透膜接触的凝胶浓度为35%,这样就能使相对分子质量在10至1 000 kDa的蛋白质滞留在两张膜之间,并被流过的电极液所洗脱,从而实现分离和收集的目的。洗脱过程可以是连续的,流速为0.25 mL/min;也可以是有间断的,平均流速为0.025 mL/min,每600 s进行一次收集,收集时放空整个收集腔,放空时间为40 s。整个过程中要随时防止气泡产生,以免干扰电泳正常进行。Lim等[15]进一步设计了如图2所示的一套新型制备电泳系统。这套装置有两个电泳槽,较大的电泳槽用于进行制备电泳分离,较小的则用于进行Bio-Marker对比实验。制备电泳区底部有半透膜,凝胶底部有收集通道,通过外部的输液泵不断地将电极缓冲液输送至此收集通道,带走从凝胶底部迁移出的蛋白质,完成蛋白质的分离制备。这套装置的凝胶厚度不到2 mm,较小的制备电泳胶厚度提供了很好的散热效率,因而能使电泳在高电压下连续进行,从而提高分辨率,并减少分离制备的时间。

图 2 Lim等设计的制备电泳装置原理示意图Fig. 2 Schematic diagram of the preparative electrophoresis apparatus designed by Lim et al
此后出现了商品化的圆盘形制备型电泳仪。2006年,Zerefos等[16]利用BioRad公司的制备电泳仪(Preparative LDS-PAGE PrepCell)处理了人尿样本,分离制备了80个尿蛋白馏分,并采用1D SDS-PAGE (one dimensional sodium dodecyl sulfate-polyacrylamide gel electrophoresis)和2-DE (two dimensional gel electrophoresis)与MALDI-MS (matrix assisted laser desorption ionization-mass spectrometry)联用分析方法对收集的馏分进行表征。结果表明,制备电泳可显著提高后续2-DE的分辨率,并有助于低相对分子质量和低丰度的蛋白质的质谱检出。Fountoulakis等[17]利用同样的装置对小鼠肝脏蛋白质进行了预分离。上样量为50 mg蛋白质提取液,收集了80个馏分,每个馏分为10 mL,经超滤后每个馏分减少为0.2 mL,回收的蛋白质总量约为12 mg。将收集到的各个馏分与原样本的2-DE分析结果对比,发现经过预分离的馏分在2-DE凝胶中的蛋白质点的强度与数量显著多于原样本。质谱分析结果表明,有5个低丰度蛋白质首次被鉴定。
李彧娜等[18]将非变性制备电泳用于微孢根霉的华根霉变种中两个葡萄糖淀粉酶同工酶的制备,考察了电泳缓冲系统、凝胶浓度和凝胶长度对分离制备效果的影响。使用Ornstein-Davis[11,19]系统分离同工酶,用0.02 mol/L pH 6.2的乙酸钠-乙酸缓冲液洗脱,在长6 cm的7%非变性凝胶中,对两个性质十分相近的同工酶进行了有效的分离制备。
圆盘形制备电泳技术相较于其他制备方法,最主要的优势在于分辨率高。但其缺点是制备时间长,通常需要十几个小时才能达到满意的分离和制备,同时装置对冷却的要求非常高。这是由于圆盘形制备电泳装置多用于克级蛋白质的纯化,所采用的分离介质(通常是凝胶)的截面积较大,而截面积越大,介质中心与边缘的温差就越大,从而可能导致分离物条带异常。此外,圆盘形制备电泳通常需要通过缓冲液带出并收集不同馏分,使得馏分数量多且每个馏分中样品浓度低,经常会出现同一样品会被收集至多个馏分中,不同样品也有可能被收集到同一馏分中(如遇到电迁移性质相近的样品),这都不利于后续的实验。目前,随着生物技术的发展,最初用于纯化蛋白质或者核酸的制备电泳装置已逐渐被操作更方便、自动化程度更高、分离纯化效果更好的高效液相色谱所代替。
2 制备型电色谱装置及应用
制备型电色谱与制备型电泳原理类似,主要区别在于电色谱是在液相色谱系统中加入电场,依据生物大分子的亲水性或疏水性以及质荷比性质的差异进行分离[20]。
在电色谱装置中,影响最终分离效果的因素很多,如色谱柱填料、离子强度、电场强度、离子交换能力、用于冷却的附件以及装置大小等。电色谱装置在实验过程中会产生大量的热量和气泡,影响离子的迁移行为,因此散热、驱除气泡和减少条带扩散是设计电色谱装置时需要考虑的难题之一。同样,在对电色谱中各种分子迁移建模时,也需要考虑很多重要因素诸如共离子迁移、补偿离子迁移、热效应、电渗流以及对流因素等[21,22]。
最早研究制备型电色谱的是Porath等[23],利用纤维素粉末作为分离介质,填充在长约150 cm、直径约5 cm的玻璃管中,在通电的情况下以此制备柱分离了氨基酸及相关物质。还使用此制备柱进行了区带电泳实验,以85 mA的电流电泳45 h,成功分离制备了半胱氨酸、天冬氨酸、谷氨酸和亮氨酸,这几种氨基酸的制备量各为100 μmol。随后,又以85 mA的电流电泳41 h分离制备以上4种氨基酸各2.25 mmol。
1993年,Rudge等[21]设计了如图3所示的一套新的制备电色谱系统并建立了数学模型,分析了溶质在电色谱内迁移的规律。使用尼龙膜将电极附近的缓冲液和通过电泳柱的缓冲液分隔开,使电极产生的气泡不会干扰电流,而由电泳柱流出的大分子样品则被尼龙膜相隔而不会进入电极室,便于在线收集。

图 3 Rudge等设计的制备型电色谱装置原理示意图Fig. 3 Schematic diagram of the preparative electrochromatography apparatus designed by Rudge et al
Cole等[24]于1997年设计了改进的制备型电色谱装置,将电极配件进行了优化,使电色谱装置中的电场更接近于匀强电场,装置底部的半透膜阻止了电极液与色谱柱洗脱液的混合,同时也使电极处产生的气泡和其他电解产物不会干扰生物大分子的制备。Tellez等[25]研究了商品化的排阻色谱和酶改性排阻色谱作为电色谱装置在蛋白质制备方面的差异,并通过对葡聚糖排阻色谱和琼脂糖排阻色谱酶改性的水化处理,实现了对β乳白蛋白的高效分离制备,还成功制备了乳清中的四种主要蛋白质。
Rhodes等[26]设计了更为复杂的自由流制备电泳和色谱相结合的装置。蛋白质样品通过液相色谱系统的低压泵系统加入到柱内。这套装置的优点在于分离柱的直径适中,既避免了因制备柱直径过大导致色谱柱内剧烈的热对流对样品分离的影响,又克服了因制备柱直径过小导致的制备通量太小的缺点。此外,该装置还配置有压力探测器,用于监测柱上的压力。当柱上压力为零时,柱内电渗流会自动补充色谱泵的流量,不会产生样品的侧向扩散。
此外,冯蕾等[27]还考察了制备型电色谱分离小分子生物物质的可行性及影响因素。其使用的电色谱更像是凝胶电泳,因为在色谱柱内填充的是排阻凝胶。以pH 4.6的乙酸钠-乙酸缓冲溶液为流动相,考察分离介质、电场方向、电场大小和断电时间对单磷酸腺苷酸(AMP)和二磷酸腺苷酸(ADP)混合物分离度和样品回收率的影响。结果显示具有很大孔径的排阻凝胶色谱有利于样品的分离。电泳方向与流动相流动方向一致时,电场越大,分离度越好,但回收率越低;电泳方向与流动相流动方向相反时,通电时间不能过长,且分离度差,但回收率高。在样品到达电极前停止通电,可以将AMP与ADP分离,且可减少电解对样品的破坏。以上结果表明建立的制备电色谱系统可用于离子型小分子生物物质的分离制备。
3 制备型等电聚焦装置及应用
等电聚焦(isoelectric focusing, IEF)技术是一种利用具有pH梯度的支持介质分离等电点(pI)不同的蛋白质的电泳技术。每种蛋白质都有与之对应的等电点,当蛋白质所处环境的pH值与pI值相等时,蛋白质分子呈电中性,不会在电场中迁移。在电泳介质中放入载体两性电解质,当通入直流电时,两性电解质会形成一个由正极到负极逐渐增加的pH梯度,处于这个电场和pH梯度中的蛋白质会迁移至与其pI值相等的pH值处并停止在此位置,从而使pI值不同的蛋白质相互分离。等电聚焦电泳是十分出色的分析量级的技术,但是在蛋白质制备方面却需要克服很多困难[28]。
Ivory[28]对基于等电聚焦的制备型等电聚焦的发展进行了详细评述,总结了等电聚焦尤其是制备型等电聚焦存在的内在缺陷。首先,许多被分离物质在它们的等电点时溶解度非常小;其次,整个样品几乎不可能通过这种方法被完全聚焦,要么会在等电点处降解(如核酸),要么没有一个真正意义上的等电点;最后,与色谱技术类似,等电聚焦是批量处理技术,很难成为大批量连续制备技术。
最早的制备型等电聚焦被称作“循环等电聚焦”(recycling isoelectric focusing, RIEF),在该装置中,采用孔径为10~25 μm的尼龙网将等电聚焦区间分为10~20个隔间,其间填充有1%~2%的两性电解质和待聚焦蛋白质,通过一个微型蠕动泵和聚焦电压进行蛋白质的聚焦。在此基础上,最大的装置改进是加入了外部制冷装置,这使得高压聚焦得以实现。在此之后有了诸如BioRad公司的Rotofor、Rainin公司的RF3和MinipHor等商品化的制备型等电聚焦仪。黄峙等[29]以纯藻蓝蛋白为材料,采用Rotofor系统进行液相等电聚焦纯化纯藻蓝蛋白的α、β亚基。上样量为25 mg的纯藻蓝蛋白经过两次液相等电聚焦,分别得到5.1 mgβ亚基和4.7 mgα亚基,其pI值分别为4.20和4.85,总回收率为39.2%,光谱检测表明其活性基本不变。可见基于溶液聚焦的装置用于蛋白质分离制备是可行的。
Ivory等[30]还介绍了动态电场梯度聚焦(dynamic field gradient focusing, DFGF)。这种方法是在等电聚焦的轴向施加一个梯度电场,并在电场强度的反方向施加一个压力,这个压力由输液泵提供,带动缓冲液流动。被分离的蛋白质会因自身所带电荷不同而在不同位置达到受力平衡,从而被分离和制备。Ivory等利用此技术对7 mg的牛血清白蛋白和7 mg的血红蛋白进行了分离,两个蛋白质在凝胶的9 cm处和19 cm处聚焦,分离度为2.64±0.503,整个过程需要15 h。
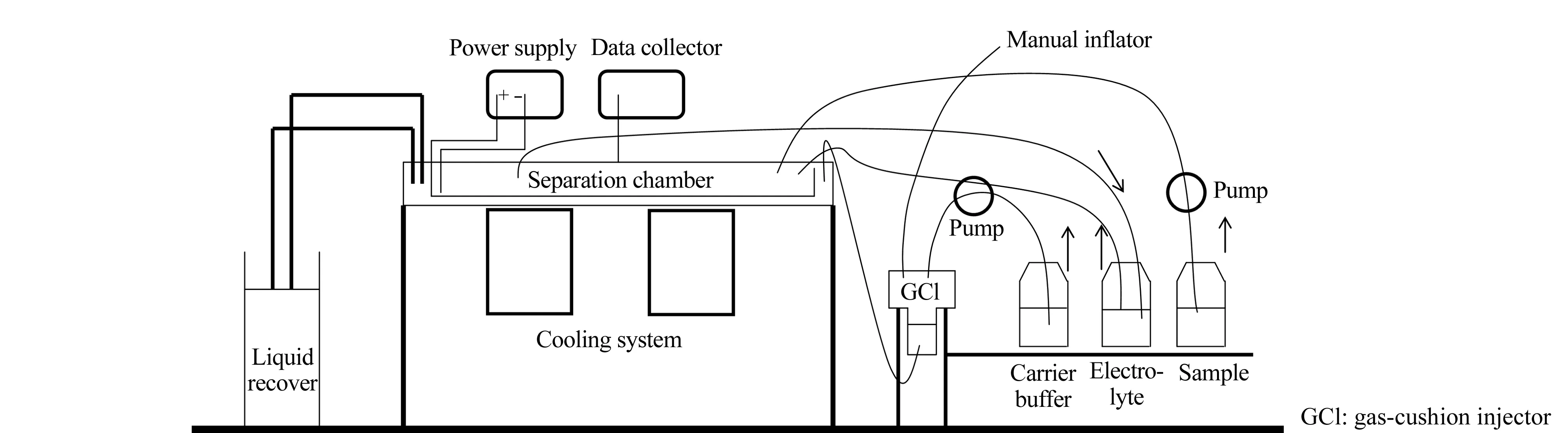
图 5 Yan等设计的自由流电泳装置原理示意图Fig. 5 Schematic diagram of the free flow electrophoresis apparatus designed by Yan et al

图 4 Zilberstein等设计的制备型聚焦电泳原理示意图Fig. 4 Schematic diagram of the preparative electric focusing apparatus designed by Zilberstein et al
Zilberstein等[31,32]利用SDS-PAGE原理和等电聚焦原理,提出一种新型的“假聚焦”制备电泳,其原理如图4所示。这种制备电泳将整个电泳区间沿负极到正极的方向分为多个隔间,每两个隔间之间用中性的琼脂糖凝胶膜隔开,隔间内充满浓度依次升高的正电荷聚合物缓冲液。当带有负电荷的SDS-蛋白质由负极向正极迁移时,在某一隔间内,正负电荷会相互中和,使原来带负电的蛋白质变为中性,不再向正极迁移,从而停留在此隔间内。这种制备电泳方法从原理上与等电聚焦非常相似,但并不是真正意义上的等电聚焦,因此被称作“假聚焦”制备电泳。Zilberstein等[31,32]据此制作了新型的液相介质的制备电泳装置,利用这个装置分离并制备了多个标准蛋白质。还研究了在这种“假聚焦”的实验条件下,大分子的迁移距离与相对分子质量之间的关系,优化了此实验条件下的参数。
Vykydalová等[33]基于近平滑念珠菌细胞表面性质的不同,利用高效液相色谱结合溶液等电聚焦对近平滑念珠菌生物膜阳性和生物膜阴性的两种形式进行了分离制备,其结果表明利用这种方法可以作为临床的快速鉴定方法。
4 自由流电泳装置及应用
基于电迁移的制备型电泳方法还有无载体电泳,如自由流电泳(free flow electrophoresis, FFE)[2]。自由流电泳是半制备型分离技术,具有可连续分离、多种模式分离、无固体支持介质和分离条件温和等优势,特别适合用于生物材料的分离纯化和制备[34]。FFE初期由Barrolier等[35]和Hannig[36]分别于1958年和1961年提出;此后,自由流电泳被广泛应用于细胞和细胞器的分离[37],而20世纪90年代末生物技术的飞速发展使得自由流电泳被用于蛋白质、核酸等生物大分子的分离[38,39]。
Yan等[40]设计了一套新型的自由流电泳装置,原理如图5所示。此套装置的优势在于组装简单、快速,有良好的散热能力。该装置仅需3 min即可完成组装,比常规自由流电泳装置(4 h)快80倍;常规装置需要至少2 h才可将装置中的气泡排空,而该装置仅需5 s,大大节约了时间。装置的散热性能良好,即使在63 V/cm的高场强下,装置仍然能进行长达8 h的连续工作,可将藻青蛋白、马心肌红蛋白和细胞色素C分离。
Shen等[41]介绍了一种基于蛋白质质荷比不同,利用自由流电泳分离和制备目标蛋白质的新方法。在不同的pH值下分离了细胞色素C、马心肌红蛋白和牛血清白蛋白3种蛋白质并利用CLC Protein Workbench软件对分离进行了预测,多组分离数据均与预测值相符。并对电泳缓冲液进行了优化,使分辨率得到了提高。为了评价此新方法,将从猪心中粗提的细胞色素C利用自由流电泳进行了提纯,最终得到了纯度为96.9%、活性为98.3%的细胞色素C,表明这种方法可用于蛋白质的非变性提纯以及下游的分析。
Eichacker等[42]利用新型的区带电泳-自由流电泳系统分离了拟南芥中的类囊体膜蛋白提取物。在自由流电泳中以1 600 V电压和85 mA电流分离并制备了300 μg的膜蛋白提取物,使用非变性聚丙烯酰胺凝胶电泳对分离制备的各个组分进行了验证,表明自由流电泳系统的分离制备达到了预期的目的。
近年来,随着质谱和其他方法成为蛋白质组学中主流的分析方法,快速、连续、非变性且无固相介质污染的自由流电泳在制备电泳领域发挥着日益重要的作用,自由流电泳装置在不断翻新,其应用范围也在不断扩大[39]。
5 微量制备型电迁移装置及应用
传统的制备型电迁移装置的制备量级均为毫克级,部分中等量级的制备电泳或电色谱,其制备量级也在数百微克级[12-14]。这种制备量级适合对某种目标蛋白质进行纯化或者工业级制备,然而现代生物学实验中,多数样品总量无法达到此量级。近10年来,随着蛋白质组学研究的深入,越来越多的痕量调控蛋白质在蛋白质组学中受到广泛关注,而微量级制备电泳也因其高分辨率及微量样本的制备能力受到越来越多的关注。而微量级的制备势必要求仪器的高回收率,但以上的分离制备方法中,都是通过缓冲液进行蛋白质样品的回收,在后续的处理过程中还会因脱盐或脱SDS等操作步骤损失样品。因此如何进行高效的微量蛋白质回收是微量级制备电泳的一个难题[43]。

图 6 Gelfree 8100微量蛋白质制备系统原理示意图Fig. 6 Schematic diagram of Gelfree 8100 Fractionation System
2009年,英国Expedeon公司推出了一套新型的微量蛋白质制备系统——多通道凝胶洗脱液相组分截留电泳(Gelfree 8100 Fractionation System),其原理如图6所示。该系统使用凝胶洗脱液相馏分截留电泳技术(gel-eluted liquid fraction entrapment electrophoresis, GELFREE),即基于蛋白质相对分子质量大小的不同,把相对分子质量在3.5~500 kDa的蛋白质分离制备成不同组别,使用移液器在液相中回收蛋白质。该系统能在较短时间内同时处理8个样品。该方法相对于其他传统分离制备方法具有上样量小、重现性好、分辨率高、回收率高、分离速度快和操作简单的优点,可提高蛋白质鉴定结果的可信度。
Witkowski[44]利用此套系统将200 μg的牛肝匀浆混合物分离成了12个组分,每个组分取4%的量重新在SDS-PAGE中上样并银染,得到了牛肝匀浆蛋白质组分中3.5~150 kDa大小的蛋白质按照相对分子质量大小依次分布的凝胶染色图。表明制备级的凝胶电泳的分离度接近分析型凝胶电泳的分辨率。
Yarmola等[45]还利用LabIntelligence生产的HPGE-1000A荧光制备电泳仪对10 μg的绿色荧光合成蛋白rGFPuv和10 μg的R-藻红蛋白进行了分离制备,并对收集到的蛋白质进行MALDI-TOF (matrix assisted laser desorption ionization-time of flight)质谱分析。HPGE-1000A制备型电泳仪可对所分离的蛋白质进行荧光分析,通过洗脱收集到被检测的荧光蛋白质。但由于标记有荧光的蛋白质与原蛋白质的相对分子质量存在一定差异,故其质谱信息通常不一致,需要通过蛋白质洗脱时调整洗脱程序解决这一问题,最终在质谱的线性模式中成功检测到了洗脱的蛋白质。
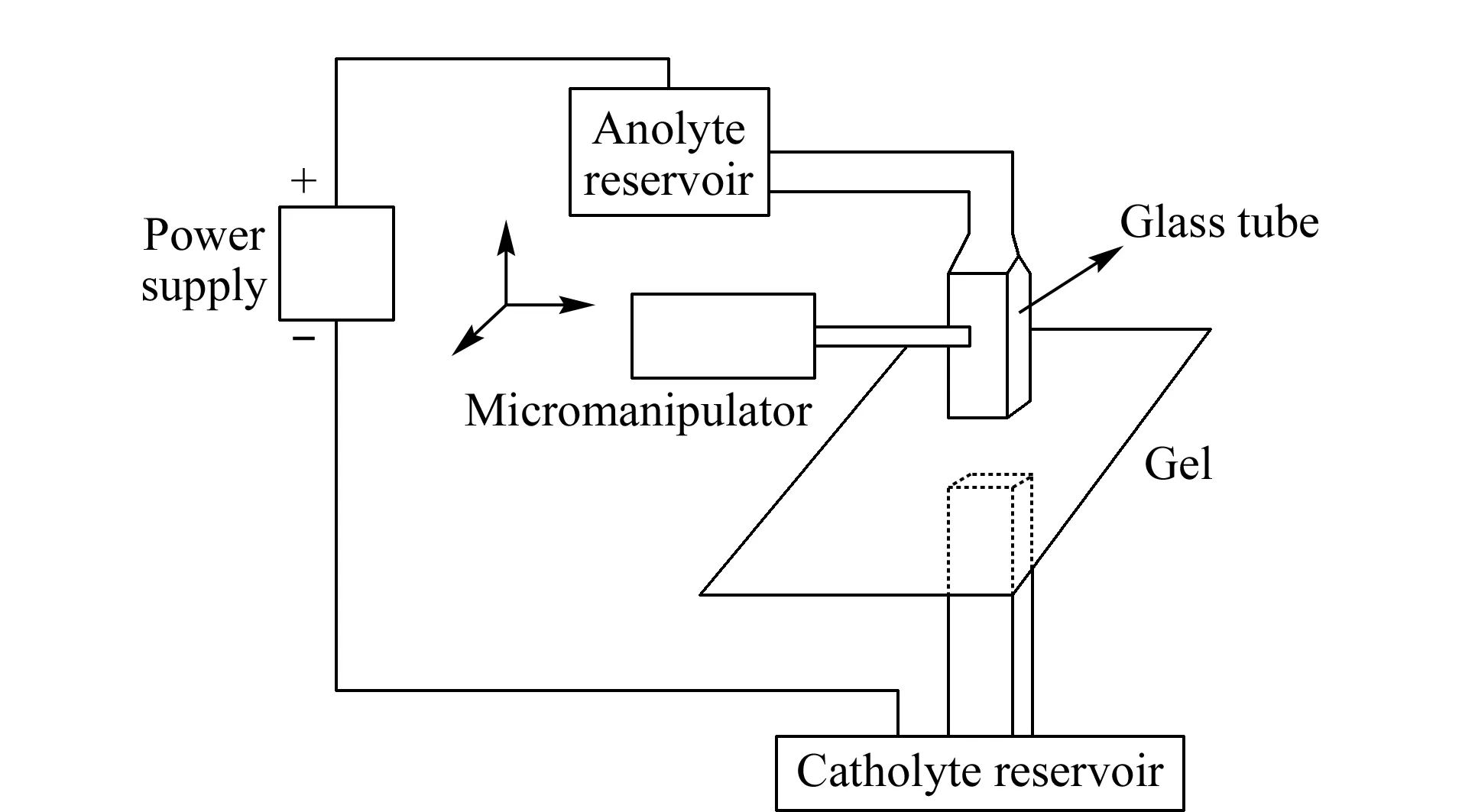
图 7 微量级制备型电洗脱装置原理示意图Fig. 7 Schematic diagram of a microscale preparative electroelution apparatus
2001年,一种新型的微量级制备型直接电洗脱装置的应用在Proteomics[46]和Electrophoresis[47]上发表。之所以称这种电洗脱装置为“直接”电洗脱装置,是因为它不同于蛋白质的1D或者2D分离,不需要将凝胶进行切割之后再提取其中的蛋白质。其原理如图7所示,该装置正、负极端均装有截面为矩形的中空管状悬臂,材料为玻璃,截面尺寸为4 mm×1 mm,两悬臂分别与正、负极缓冲液槽相连,继而与正、负电极相连,使用时,凝胶放在滤纸上,通过控制方位的装置将正、负悬臂分别移动至条带的上下方,通电以进行收集。凝胶中的蛋白质被收集到垂直且与凝胶胶面紧密接触的连接有正极的玻璃管中。
Buzás等[46]详细讨论了直接电洗脱与凝胶切分之后再进行蛋白质回收在蛋白质层次与肽段层次的回收率的差异。直接电洗脱的速度快、回收率高,可避免凝胶中成分的污染,回收完整的蛋白质,可在酶切之前利用质谱对蛋白质的均一性进行检测,唯一的不足之处是蛋白质相对于其酶切肽段溶解度较小。对SDS-PAGE分离的2.5 μg牛血清白蛋白进行了浓缩以及MALDI-TOF质谱分析,在线性模式下发现其MH+和MH2+的质谱信号响应与标准蛋白质,相对分子质量相差300 Da,这可能是由于电泳和电洗脱过程中蛋白质结合了小分子物质所致。
Radko等[48]在荧光检测、回收率、等电聚焦以及质谱检测方面考察了这种制备型直接电洗脱装置。使用相对分子质量为14~120 kDa的6种标准蛋白质混合物,经SDS-PAGE分离,用SYPRO-red染色后进行直接电洗脱,可以使80%以上的胶内蛋白质在1~12 min内完成洗脱(洗脱电压为1 000 V)。为了除去回收液中的盐及SDS,使蛋白质可直接进行IEF分离或质谱分析,对被回收物进行了3次超滤离心,剩余蛋白质质量约为离心前的25%~33%。在质谱分析中,回收的2 pmol胰蛋白酶抑制剂和牛血清白蛋白的信噪比约为6,这与0.2 pmol胰蛋白酶抑制剂和牛血清白蛋白标准蛋白质的信噪比相当。同时回收蛋白质的质量数约比标准蛋白质高0.1%~0.6%,回收的牛血清白蛋白和卵白蛋白与其各自的标准品的相对分子质量均存在较明显的差异,而回收的碳酸酐酶与其标准品的相对分子质量的差异则小于0.1%,几乎可以忽略。由于牛血清白蛋白和卵白蛋白均含有半胱氨酸,碳酸酐酶不含半胱氨酸,因此推断出由于电泳的前处理中将蛋白质还原,使得蛋白质中形成了半胱氨酸-丙烯酰胺和半胱氨酸-β-巯基乙醇的结构,增加了蛋白质的相对分子质量,同时SDS也可能存在部分残留(+260 Da)。经过超滤的蛋白质也可进行溶液酶切和质谱分析,如回收的卵白蛋白的酶切产物在m/z1 000~2 500 之间的肽段质量数均与其理论值相近。文献中的微量级制备型电洗脱装置在仅有25%~33%的回收量的情况下,仍然可顺利进行下游的IEF和质谱分析,为后续的研究奠定了基础。
相对之前的制备技术,微量级制备电迁移技术已经具有了快速、分辨率高、回收率高和成本低的优点。最快的微量级制备电泳通常仅需要约2 h就可完成蛋白质分离制备的全过程,且其回收率大都在80%以上,保证了生物体内具有重要调控功能的低丰度蛋白质的高灵敏检出。而微量级制备电迁移技术也存在一些需要克服的缺点,如装置自动化程度还比较低、某些商业化产品重现性差等。同时电迁移技术还有一些内在的缺点,比如蛋白质在最常用的SDS-PAGE上样前都需要进行变性、还原、结合SDS的过程,在这一过程中蛋白质的性质和质量都发生了变化。虽然一些文献给出了除盐和除SDS的方法,但回收的蛋白质还是在质谱分析时与标准蛋白质的相对分子质量有差异,也对制备电泳的下游应用有不利的影响。
6 结语
制备型电迁移技术在生物科学研究和生物产业中有着广泛的应用前景。在复杂蛋白质样品的分离制备方面,制备型电迁移技术比使用最先进的高效液相色谱技术更具优势,微量级制备型电泳和制备型电洗脱技术不仅能提供高分辨率的快速分离,也能提供高回收率的快速洗脱,将会发挥越来越重要的作用。制备型电迁移装置在某种程度上开始变得更加实用。一方面,自动化程度越来越高的制备型电泳仪在市面上出现,通常这些仪器都有预置的分离介质,在使用时,只需要加入样品、设置程序,即可完成目标蛋白质的制备。另一方面,许多设计巧妙、成本低的仪器使得分离制备不需要耗费太多的资金也能获得复杂程度显著降低的蛋白质样品。随着生物质谱技术的发展,例如高精度和高分辨率质谱的出现,整体蛋白质的质谱分析越来越受到重视,因此,整体蛋白质的分离制备渐渐被研究人员所重视。相信在未来的研究中,将会出现更多的制备型电迁移装置和技术,以满足蛋白质科学深入研究的需要。
[1] Rabilloud T. Proteomics, 2002, 2(11): 3
[2] Tulp A, Désirée Verwoerd, Neefjes J. J Chromatogr B, 1999, 722(1/2): 141
[3] Gorg A, Weiss W M. Proteomics, 2004, 4(12): 3665
[4] Imai K, Koshiyama A, Nakata K. Biomed Chromatogr, 2011, 25(1/2): 59
[5] Haleem I, Timothy V. Biotechniques, 2008, 44(5): 697
[6] Tang J, Gao M, Deng C, et al. J Chromatogr B, 2008, 866(1/2): 123
[7] Maizel J V. Ann N Y Acad Sci, 1964, 121: 382
[9] Shen Q Y, Guo C G, Jian Y, et al. J Chromatogr A, 2015, 1397: 73
[10] Petrov A, Wu T, Puglisi E V, et al. Methods Enzymol, 2013, 530: 315
[11] Ornstein L. Ann N Y Acad Sci, 1964, 121: 321
[12] Lewis U J, Cheever E V, Seavey B K. Anal Biochem, 1968, 24(1): 162
[13] Akaiwa S. Electrophoresis, 1982, 3: 321
[14] Carpenter H C, Skerritt J H, Wrigley C W, et al. Electrophoresis, 1986, 7: 221
[15] Lim Y P, Hixson D C. US Patent, 5284559. 1994-02-08
[16] Zerefos P G, Vougas K, Dimitraki P, et al. Proteomics, 2006, 6(15): 4346
[17] Fountoulakis M, Juranville J F, Tsangaris G, et al. Amino Acids, 2004, 26(1): 27
[18] Li Y N, Shi G Y, Wang W, et al. Food and Fermentation Industries (李彧娜, 石贵阳, 王武, 等. 食品与发酵工业), 2010, 265(1): 1
[19] Davis B J. Ann N Y Acad Sci, 1964, 121: 404
[20] Jungbauer A. J Chromatogr A, 1993, 639: 3
[21] Rudge S R, Basak S K, Ladisch M R. AIChE J, 1993, 39: 797
[22] Keim C, Ladisch M. Biotechnol Bioeng, 2000, 70: 72
[23] Porath J. Biochim Biophys Acta, 1956, 22: 151
[24] Cole K D, Cabezas H. J Chromatogr A, 1997, 760: 259
[25] Tellez C M, Cole K D. Electrophoresis, 2000, 21: 1001
[26] Rhodes P H, Snyder R S. US Patent, 6004443. 1999-12-21
[27] Feng L, Zhao F S. Chemistry and Bioengineering (冯蕾, 赵凤生. 化学与生物工程), 2009(4): 50
[28] Ivory C F. Sep Sci Technol, 2000, 35(11): 1777
[29] Huang Z, Yang F, Zheng W J, et al. Chemical Journal of Chinese Universities (黄峙, 杨芳, 郑文杰, 等. 高等学校化学学报), 2006, 27(6): 1051
[30] Tracy N I, Ivory C F. Electrophoresis, 2008, 29: 2820
[31] Zilberstein G, Korol L, Righetti P G, et al. Anal Chem, 2007, 79(22): 8624
[32] Zilberstein G, Korol L, Antonioli P, et al. Anal Chem, 2006, 79(3): 821
[33] Vykydalová M, Horká M, Ružicka F, et al. Anal Chim Acta, 2014, 812: 243
[34] Qu F, Han B, Deng Y L, et al. Chinese Journal of Chromatography (屈锋, 韩彬, 邓玉林, 等. 色谱), 2008, 26(3): 274
[35] Barrolier V J, Watzke E, Gibian H. Z Naturforschung, 1958, 13B: 754
[36] Hannig K. Z Anal Chem, 1961, 181: 244
[37] Hannig K. Electrophoresis, 1982, 3: 235
[38] Ludmila K, Bocek P. Electrophoresis, 1998, 19: 1064
[39] Robert W, Gerhard W, Petra W, et al. Proteomics, 2014, 14(4/5): 629
[40] Yan J, Guo C G, Liu X P, et al. J Chromatogr A, 2013, 1321: 119
[41] Shen Q Y, Guo C G, Jian Y, et al. J Chromatogr A, 2015, 1397: 73
[42] Eichacker L A, Weber G, Sukop-Köppel U, et al. Methods Molecular Biology, 2015, 1295: 415
[43] Shoji M, Kato M, Hashizume S. J Chromatogr A, 1995, 698: 145
[44] Witkowski C. J Vis Exp, 2009, 34: 1412
[45] Yarmola E, Chrambach A, Nguyen V Q, et al. Electrophoresis, 1999, 20: 445
[46] Buzás Z, Chang H, Vieira N E, et al. Proteomics, 2001, 1(5): 691
[47] Chang H, Yergey A L, Chrambach A. Electrophoresis, 2001, 22: 394
[48] Radko S P, Chen H T, Zakharov S F, et al. Electrophoresis, 2002, 23: 1954
Recent advances in preparative electromigration techniques for proteins
HAO Feiran, FU Bin, ZHANG Yangjun*, QIAN Xiaohong*
(StateKeyLaboratoryofProteomics,BeijingProteomeResearchCenter,BeijingInstituteofRadiationMedicine,Beijing102206,China)
Preparative electromigration techniques are a category of separation and preparation techniques based on differential electromigration principle. These techniques are widely applied in biomacromolecule and proteome researches. Related techniques mainly include preparative electrophoresis, preparative electrochromatography, preparative isoelectric focusing and free flow electrophoresis and so on. We review each kind of the preparative electromigration techniques on its apparatus designs, applications, advantages and disadvantages in detail. Microscale preparative electrophoresis is a hot spot in recent years. Its high resolution, high recovery and high efficiency make it a more prominent role in the biological sample analysis. In this review, we focus on some advances in microscale preparative electrophoresis and also give an outlook on preparative electromigration techniques in the future.
preparative electromigration technique; preparative electrophoresis; preparative electrochromatography; preparative isoelectric focusing; free flow electrophoresis; microscale preparative electrophoresis; proteins; review
10.3724/SP.J.1123.2015.09010
国家重大科学计划项目(2012CB910603);国家高技术研究发展规划项目(2012AA020202);国家重大科学仪器设备开发专项项目(2012YQ12004407,2011YQ030139,2011YQ06008408,2013YQ14040506);国家自然科学基金项目(21275519,20735005,31100591).
2015-09-14
O658
A
1000-8713(2015)12-1226-08
* 通讯联系人. Tel:(010)80727777-1142,E-mail:13683167093@163.com(张养军);13911734119@163.com(钱小红).
