4种纳米羟磷灰石复合材料对粪肠球菌抗菌性能的初步研究
2015-03-24刘奕周荣静吴红崑
刘奕 周荣静 吴红崑
1.四川省医学科学院·四川省人民医院口腔科,成都 610072;2.聊城市人民医院口腔科,聊城 252000;3.口腔疾病研究国家重点实验室 华西口腔医院特需门诊(四川大学),成都 610041
牙髓根尖周病是最常见的口腔疾病,严重影响人类的口腔和全身健康。根管治疗术是目前治疗牙髓根尖周病最有效的方法,但临床研究显示,即使经过完善的根管治疗,患牙仍存在4%~15%的失败率[1],而进行根管再处理的成功率仅为66%~74%[2]。粪肠球菌以生物膜的形式定植于根管系统[3],是导致根管治疗再感染的主要微生物之一,是目前评价根管治疗过程中各种感染清除措施有效性最常采用的目标菌种。研究[4-5]发现,临床常用的根管消毒剂氢氧化钙在体内外环境中对粪肠球菌无明显抑制作用。目前临床上尚未找到一种对粪肠球菌安全有效的根管消毒药物。
纳米羟磷灰石复合材料作为一种新型无机材料,安全无毒,生物相容性好,广泛用于医疗各领域。银、钇、铈等金属离子的加入,更赋予材料一定的抑菌性能。目前,纳米复合抗菌材料多应用于种植体表面涂层、骨修复、充填修复等领域,也有部分学者曾研究这类材料的防龋功能,但对其在根管治疗领域的应用研究还比较少见。特别是对难治性牙髓根尖周病变中的常见菌——粪肠球菌影响的研究还罕见报道。本课题通过比较4种纳米羟磷灰石复合材料对粪肠球菌的影响,拟筛选一种对粪肠球菌有高效抑制作用的根管消毒药物,为无机纳米材料在根管治疗领域的应用提供理论依据。
1 材料和方法
1.1 材料
载银纳米羟磷灰石水溶胶(Ag/nHA)、载钇纳米羟磷灰石水溶胶(Yi/nHA)、载铈纳米羟磷灰石水溶胶(Ce/nHA)、纳米羟磷灰石水溶胶(nHA)(四川大学纳米生物材料研究中心);粪肠球菌(ATCC29212)由四川大学口腔疾病研究国家重点实验室提供。
光学显微镜(Nikon公司,日本),隔水式电热恒温培养箱(上海跃进医疗器械厂),高速离心机(上海安亭科学仪器厂),ProtoCOL SR全自动抑菌环测量仪(Synbiosis公司,英国),Microstation全自动微生物鉴定仪(Biolog公司,美国)。
1.2 方法
1.2.1 实验材料溶液的配制 采用透射电镜(transmission electron microscope,TEM)观察各组复合纳米微晶的形貌和尺寸,纳米微晶晶化好,形貌均为纳米级针状微晶。分别取复合纳米羟磷灰石水溶胶(Ag/nHA、Yi/nHA、Ce/nHA、nHA)3 000 r·min-1离心2 min,去上清液。无菌去离子水超声振荡下分散,配制成浓度为320 g·L-1的纳米微晶溶胶贮存液备用。
1.2.2 粪肠球菌菌悬液的配制 取粪肠球菌的牛奶保存液50 μL,接种于普通琼脂(BA)固体培养基上,恒温培养箱37 ℃培养24 h进行细菌复苏。挑取部分菌落革兰染色后,光学显微镜下观察菌落的形态,镜检无污染,涂片检查证实为纯培养后进行传代培养,备用。
无菌接种环挑取经鉴定的纯培养单个粪肠球菌菌落置于含2 mL BA液体培养基的康氏管中进行24 h增菌,用磷酸盐缓冲液(phosphate buffered saline,PBS)配制成浓度为1×107、1×104、1×103CFU·mL-1的粪肠球菌菌悬液备用。
1.2.3 琼脂扩散实验 用微量加样枪吸取浓度为1×107CFU·mL-1的粪肠球菌菌悬液50 μL,滴加于直径为90 mm的BA琼脂平皿上,无菌玻棒涂抹均匀。每个平皿平均划分5个加样区,加样区分别加20 μL浓度为320 g·L-1的实验材料溶胶,生理盐水滤纸片为空白对照。室温放置1 h后,100%湿度、37 ℃有氧条件下,恒温培养箱内培养24 h。ProtoCOL SR全自动抑菌环测量仪测量不同实验材料对粪肠球菌的抑菌环直径大小。每种实验材料均设置5个平行对照组,分别记录20 μL实验材料溶胶在BA平皿上的直径、抑菌环的直径,并且观测不同实验材料的抑菌环范围。
1.2.4 最小抑菌浓度(minimum inhibitory concentration,MIC)的测定 含实验材料琼脂平皿的配制:采用对倍系列稀释法,用无菌去离子水将实验材料贮存液对倍稀释成系列浓度的实验材料液:32.0、16.0、8.0、4.0、2.0、1.0、0.5 g·L-1。分别取上述不同浓度的实验材料液2 mL,加18 mL温度为48~50 ℃的BA琼脂混合均匀后铺板,配制成含系列浓度实验材料溶胶的琼脂平皿:32.0、16.0、8.0、4.0、2.0、1.0、0.5 g·L-1。每种材料相应浓度各3个平皿,以普通琼脂平皿为空白对照。
采用琼脂稀释法,用微量加样枪分别吸取浓度为1×104CFU·mL-1、1×103CFU·mL-1的粪肠球菌菌悬液5 μL,点种于含系列浓度实验材料溶胶的琼脂平皿表面。两种浓度的菌悬液各点种3个点种点,一个平皿上共6个点种点。恒温培养箱37 ℃有氧条件下培养24 h,计数菌落数。
1.3 统计学分析
采用SPSS 13.0软件对不同实验材料对两种实验浓度粪肠球菌的抗菌活性进行统计学比较分析。
2 结果
2.1 琼脂扩散法结果
琼脂扩散实验表明,Ag/nHA、Yi/nHA、Ce/nHA、nHA、空白对照点种直径分别为(5.75±0.38)、(5.89±0.48)、(5.95±0.33)、(6.04±0.38)、(6.05±0.06)mm,不同实验材料点种直径间差异无统计学意义(F=0.545,P>0.05)。不同实验材料的抑菌环直径大小有可比性。与空白对照相比,Ag/nHA周围有明显的抑菌环,抑菌环直径为(8.17±0.70)mm,抑菌范围为(2.42±0.44)mm。而Yi/nHA、Ce/nHA、nHA均未表现出抑制粪肠球菌的作用(图1)。
2.2 琼脂稀释法结果
琼脂稀释实验显示,Ag/nHA对粪肠球菌的MIC为1.0 g·L-1。而Ce/nHA、Yi/nHA、nHA对粪肠球菌的MIC>32.0 g·L-1,在测试浓度范围内均未表现出抑制粪肠球菌的作用(表1、图2)。粪肠球菌菌悬液浓度对实验材料抗菌活性的评价无明显影响,1×103CFU·mL-1和1×104CFU·mL-1两种浓度菌悬液实验组间无统计学差异(表1)。
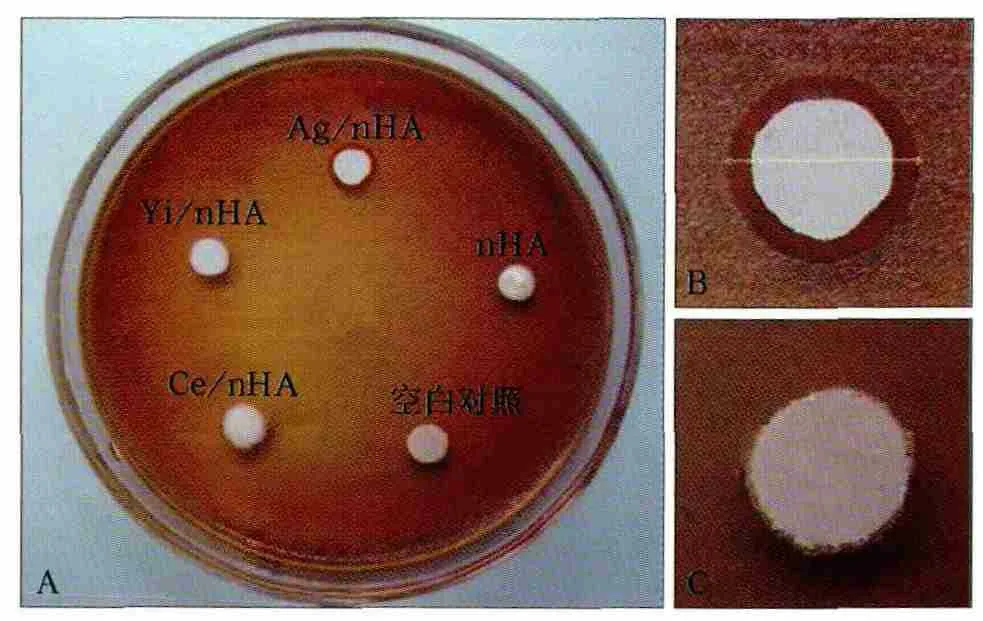
图1 不同纳米羟磷灰石复合材料对粪肠球菌的影响Fig 1 Effects of different nano hydroxyapatite composite material on Enterococcus faecalis
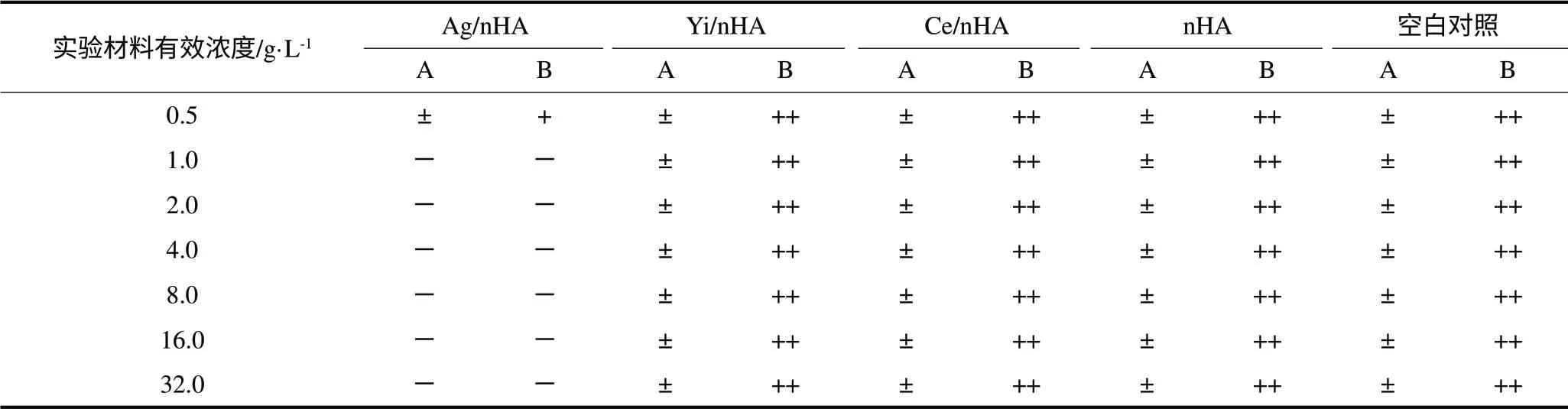
表1 细菌浓度对实验材料抗菌活性的影响Tab 1 Effect of bacterial concentration on the experiment materials
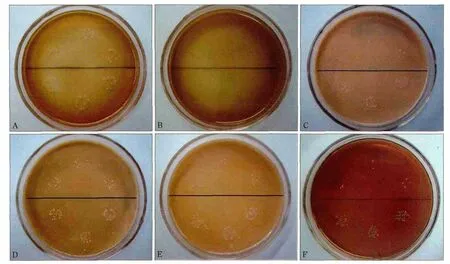
图2 含不同实验材料琼脂平皿上粪肠球菌的生长情况Fig 2 The growth of Enterococcus faecalis on different agar containing experimental materials
3 讨论
粪肠球菌为兼性厌氧的条件致病菌,多定居在人类和动物的胃肠和泌尿生殖器官,也可定居在人类口腔[6],可在多种口腔感染中检出。粪肠球菌可单独或与链球菌、中间普雷沃菌、具核梭杆菌、牙龈卟啉单胞菌等细菌混合感染根管[7-8]。以往研究[9-11]发现未经治疗的感染根管内粪肠球菌的检出率为24%~42%;在慢性根尖周炎患牙根管中粪肠球菌的检出率为60%,而在根管治疗后再感染的病例中检出率则高达76%;在根管治疗失败的病例中,粪肠球菌的检出率为77%。甚至有实验研究[12]表明,在已充填根管内粪肠球菌的阳性率高达80%。就诊次数大于10次的13例根管治疗病例中,12例感染根管内均可以检测到粪肠球菌的存在[13]。粪肠球菌对机械预备及多种杀菌药物具有广泛的抵抗力[14],并且可在组织液环境中粘接于牙本质胶原、侵入牙本质小管造成再感染,是难治性根尖周炎和根管治疗后再感染的主要病原菌之一[15],是评价根管治疗过程中各种感染清除措施有效性最常采用的目标菌种。因此,本实验选用粪肠球菌标准株作为实验菌种。
复合纳米羟磷灰石无机抗菌材料,具有纳米材料和复合材料的双重特性,具备耐高温、抗菌谱广、长效、安全、无二次污染等特点,逐渐成为抗菌材料领域的研究热点,但对该类材料在根管治疗领域的应用研究还比较少见。本课题选用的Ag/nHA、Ce/nHA、Yi/nHA、nHA是由四川大学纳米生物材料研究中心采用溶胶-凝胶法原位制备的纳米羟磷灰石复合材料,本身具有抗菌作用的金属元素与具有较大表面能的纳米羟磷灰石结合,显示出独特的生物活性。研究[16]表明,纳米羟磷灰石对金黄色葡萄球菌有明显和连续的抗菌性能;Ag/nHA对牙龈卟啉单胞菌、具核梭杆菌、消化链球菌等多种口腔常见菌具有较强的抑制作用[17];且适宜浓度的Ag/nHA对人牙龈成纤维细胞的生长繁殖无明显抑制作用,生物相容性良好[14];Yi/nHA对变异链球菌、黏性放线菌和牙龈卟啉单胞菌等口腔感染性疾病的主要致病菌有抑制作用[18];经溶胶-凝胶-超临界点干燥法合成的Ce/nHA由Ce3+替代羟磷灰石结构中的Ca2+,具有较高的溶解度,通过Ce3+的释放来发挥对大肠埃希菌、乳杆菌的抑菌作用[19]。但关于此类材料对感染根管内的常见菌粪肠球菌影响的研究,国内外均尚未见报道。因此,本实验选用四川大学纳米生物材料研究中心提供的4种纳米复合材料,通过体外评价其对粪肠球菌标准游离株的影响,拟筛选出一种对粪肠球菌有高效抑制作用的无机抗菌材料,并为该材料在根管治疗领域的应用奠定实验基础。
药物敏感实验是根据致病菌对不同抗菌药物敏感性的差异来测定抗菌药物抑制或杀灭细菌能力的一种实验方法,常用的有琼脂扩散实验和琼脂稀释实验。琼脂扩散实验通过观察实验材料周围抑菌环直径的大小,初步评价不同实验材料的抑菌性能。为了避免实验材料扩散性因素的影响,本实验将制备好的琼脂平皿放置在室温条件下1 h,并贮存于37 ℃、100%湿度的恒温培养箱中24 h,以便于材料扩散。使用ProtoCOL SR全自动抑菌环测量仪测量抑菌环直径大小,在一定程度上避免了人工测量引起的误差,具有一定的实用性。
本研究的琼脂扩散实验和琼脂稀释实验结果均表明,Ag/nHA对粪肠球菌有较好的抑制作用,其MIC为1.0 g·L-1;而其Ce/nHA、Yi/nHA和nHA在测试浓度范围内均未表现出抑制粪肠球菌的作用。以往研究[20]发现银离子本身具有较强的抗菌活性,可通过分裂细菌细胞膜、干扰细菌呼吸链、抑制细菌DNA合成等多重杀菌机制,对银离子耐受的细菌很少,也难通过变异产生耐药性。此外,银离子的抗菌时效很长,并能抑制多源性细菌聚集。有学者[21]认为纳米银的作用方式与Ag离子相似,纳米银颗粒直径极小(10~100 nm),它具备独特的小尺寸效应和表面效应,可以令其轻易地进入病原体内,迅速与细菌中的巯基结合,降低细菌合成酶的活性,从而达到杀灭细菌的目的。纳米银的Ag+还能破坏微生物的电子传输系统、呼吸系统和营养传输系统[22]。纳米羟磷灰石作为吸附剂大大改善了材料对细菌的吸附能力,使Ag/nHA达到良好的杀菌作用。国内学者[23]研究发现,激光共聚焦显微镜下见随着0.1%纳米银溶液处理牙本质表面时间的延长,粪肠球菌生物膜平均厚度逐渐减少,至24 h生物膜内无活菌。本课题组也在进一步研究Ag/nHA对体外牙根管内粪肠球菌生物膜的影响及其作用机制。Ag/nHA有望成为一种新型的根管治疗药物,使再感染根管患牙达到良好的治疗效果,但其最佳临床应用方法及其剂型有待进一步深入研究。
[1]Smith CS,Setchell DJ,Harty FJ.Factors influencing the success of conventional root canal therapy-a f ive-year retrospective study[J].Int Endod J,1993,26(6):321-333.
[2]Molander A,Reit C,Dahlén G,et al.Microbiological status of root-f illed teeth with apical periodontitis[J].Int Endod J,1998,31(1):1-7.
[3]Svensäter G,Bergenholtz G.Biof ilms in endodontic infections[J].Endod Top,2004,9(1):27-36.
[4]Nakajo K,Iwami Y,Komori R,et al.The resistance to acidic and alkaline environments of endodontic pathogenEnterococcus faecalis[J].Int Con Seri,2005,1284:191-192.
[5]Almyroudi A,Mackenzie D,McHugh S,et al.The effectiveness of various disinfectants used as endodontic intracanal medications:anin vitrostudy[J].J Endod,2002,28(3):163-167.
[6]Siqueira JF Jr,Rôças IN,Souto R,et al.Actinomyces species,streptococci,andEnterococcus faecalisin primary root canal infections[J].J Endod,2002,28(3):168-172.
[7]Peciuliene V,Reynaud AH,Balciuniene I,et al.Isolation of yeasts and enteric bacteria in root-f illed teeth with chronic apical periodontitis[J].Int Endod J,2001,34(6):429-434.
[8]Peciuliene V,Balciuniene I,Eriksen HM,et al.Isolation ofEnterococcus faecalisin previously root-f illed canals in a Lithuanian population[J].J Endod,2000,26(10):593-595.
[9]Gomes BP,Pinheiro ET,Sousa EL,et al.Enterococcus faecalisin dental root canals detected by culture and by polymerase chain reaction analysis[J].Oral Surg Oral Med Oral Pathol Oral Radiol Endod,2006,102(2):247-253.
[10]Foschi F,Cavrini F,Montebugnoli L,et al.Detection of bacteria in endodontic samples by polymerase chain reaction assays and association with def ined clinical signs in Italian patients[J].Oral Microbiol Immunol,2005,20(5):289-295.
[11]Siqueira JF Jr,Rôças IN.Polymerase chain reaction-based analysis of microorganisms associated with failed endodontic treatment[J].Oral Surg Oral Med Oral Pathol Oral Radiol Endod,2004,97(1):85-94.
[12]Zoletti GO,Siqueira JF Jr,Santos KR.Identification ofEnterococcus faecalisin root-f illed teeth with or without periradicular lesions by culture-dependent and-independent approaches[J].J Endod,2006,32(8):722-726.
[13]Siren EK,Haapasalo MP,Ranta K,et al.Microbiological findings and clinical treatment procedures in endodontic cases selected for microbiological investigation[J].Int Endod J,1997,30(2):91-95.
[14]Kishen A,George S,Kumar R.Enterococcus faecalis-mediated biomineralized biof ilm formation on root canal dentinein vitro[J].J Biomed Mater Res A,2006,77(2):406-415.
[15]Kaushik N,Rehani U,Agarwal A,et al.Antimicrobial eff icacy of endodontic irrigants againstEnterococcus faecalisandEscherichia coli:Anin vitrostudy[J].Int J Clin Pediatr Dent,2013,6(3):178-182.
[16]Yu J,Chu X,Cai Y,et al.Preparation and characterization of antimicrobial nano-hydroxyapatite composites[J].Mater Sci Eng C Mater Biol Appl,2014,37:54-59.
[17]Liao J,Mo AC,Wu HK,et al.Antibacterial activity of silverhydroxyapatite/titania nanoparticles on oral bacteria[J].Key engineering materials,2007,330/332:299-302.
[18]莫安春,吴红崑,陈治清,等.钇/羟基磷灰石纳米微晶对口腔细菌生长繁殖的影响[J].口腔医学研究,2003,19(6):454-456.
[19]Lin Y,Yang Z,Cheng J.Preparation,characterization and antibacterial property of cerium substituted hydroxyapatite nanoparticles[J].J Rara Earths,2007,25(4):452-456.
[20]Gristina AG,Costerton JW.Bacterial adherence and the glycocalyx and their role in musculoskeletal infection[J].Orthop Clin North Am,1984,15(3):517-535.
[21]黄云超,张尔,石应康.生物材料细菌黏附的研究进展[J].国外医学生物医学工程分册,1999,22(3):148-153.
[22]廖娟,费伟,郭俊,等.载银抗菌纯钛表面的制备及其抗菌性能的检测[J].华西口腔医学杂志,2014,32(3):303-305.
[23]庄沛林,高燕,凌均棨,等.纳米银对牙本质表面粪肠球菌生物膜的杀菌作用[J].中华口腔医学研究杂志:电子版,2011,5(5):463-469.
