鹿生茸区骨膜不同部位生茸潜力的研究进展
2015-03-24邵帅郭倩倩齐晓妍李春义
邵帅,郭倩倩,齐晓妍,李春义
(中国农业科学院特产研究所特种动物分子生物学省部共建国家重点实验室,长春 130112)
鹿茸是与人参齐名的珍贵传统中药,在中国已经应用了2000多年,但鹿茸还可以作为哺乳动物生物医学模型却鲜为人知。鹿茸是雄性鹿的副性征(驯鹿除外),可以作为研究性激素如何控制附属器官生长发育的模型[1];鹿茸是一个骨质性器官,在60d左右的时间可长成近10kg的骨组织,是研究哺乳动物骨质生长发育的模型[2];鹿茸在生长期最快可延长2cm/d,是公认的哺乳动物生长最快的组织,比癌变组织还要快很多倍,但鹿茸组织井然有序,因此是研究哺乳动物组织快速生长不发生癌变的模型[3];作为哺乳动物的附属器官,鹿茸每年可周期性地脱落和完全再生,这在哺乳动物中绝无仅有,是研究哺乳动物器官在失去后如何再生的模型[4,5]。本文参考最新相关报道,综述了鹿茸再生与生茸区骨膜不同部位的生茸潜力。
1 鹿茸再生
1.1 鹿茸再生过程
鹿茸是哺乳动物中唯一可以完全再生的附属器官,每年都可以周期性地再生。鹿茸的脱落和完全再生是在鹿头部永久性的骨桩即角柄上进行的[6,7]。当鹿将要进入青春期时角柄开始萌发,每年春天,骨化了的鹿茸即鹿角由角柄上脱落,触发了鹿茸的生长发育周期。鹿角脱落后,角柄顶端留下的伤口在几天之内完全愈合,而且几乎不留伤疤。愈合伤口的皮肤不同于角柄皮肤,有光泽且毛发稀疏,这种皮肤被称为茸皮。随后,鹿茸在茸皮的包裹下快速生长,同时还不断由主干分出枝杈。鹿茸的第1个分枝位于眼眉的上方,被称为眉枝;第2分枝被称为冰枝,然后第3枝等。到了秋天,鹿进入配种期,鹿体内雄激素水平急剧上升,生长的鹿茸开始骨化,切断供应鹿茸的血管和神经,最后茸皮干枯、脱落,鹿茸变成了鹿角。到了第2年春天,鹿角就从活组织角柄上脱落,从而触发新一轮的鹿茸再生周期。鹿茸的生长发育就这样年复一年地重复着[8,9]。
1.2 鹿茸再生组织学
1.2.1鹿茸角柄骨膜研究表明,鹿茸的再生有赖于角柄骨膜的存在,是角柄骨膜细胞为再生的鹿茸提供了组织细胞基础。每年大约有300万个角柄骨膜细胞参与每次鹿茸的再生[8,10],完全剔除或在某一特定时间段内完全剔除角柄骨膜组织之后角柄不能再生鹿茸[11],物理性隔离皮肤与骨膜组织之后形成无皮肤的茸,并且其骨质部分已经长出了类似二杠茸的结构,说明角柄骨膜对鹿茸再生是必要的。Li等[11]在鹿茸再生之前,将角柄骨膜与角柄皮肤之间插入了一层隔离膜,发现依然能够再生出鹿茸,并且再生的鹿茸没有皮肤包裹,说明两者分开后角柄皮肤不参与鹿茸再生过程,确定了鹿茸再生基于角柄骨膜细胞。
进一步地研究发现,角柄骨膜细胞是由生茸区骨膜分化而来。进入青春期的雄鹿,由于雄激素水平的变化,刺激生茸区骨膜细胞增殖分化,最终形成角柄,角柄生长完成后初角茸随即紧接着生长,鹿茸进入发生与再生过程。
1.2.2鹿茸生茸区骨膜生茸区骨膜(Anterogenic periosteum,AP)是一片覆盖额骨上未来生茸区的骨膜,生茸区骨膜的存在部位、大小以及取材方法见图1。利用LacZ基因对生茸区骨膜细胞进行遗传标记发现,构成角柄与鹿茸内部的所有细胞类型均来自于生茸区骨膜细胞,由其增生分化而来。生茸区骨膜是一种暂时性的组织,当第1次生茸完成后就再也分辨不出,在其原来的位置上则由一个永久性骨桩即角柄所代替,以后每年周期性地鹿茸再生都在角柄上进行[12]。因此,鹿茸的再生是基于角柄骨膜,而鹿茸最初的发生是基于生茸区骨膜。

A.AP箭头指示生茸区骨膜的存在部位;B.梅花鹿生茸区骨膜的大小;C.生茸区骨膜分成内外两部分;D.生茸区骨膜的皮下移植,移植到前额部位
A.AP arrows point to the position of anterogenic periosteum(AP);B.Size of anterogenic periosteum(AP);C.APwere divided into two parts;D.The subcutaneous transplantation of AP
图1生茸区骨膜的存在部位及其取材移植方法
Fig.1ThelocationandsamplingmethodofAP
2 鹿茸生茸区骨膜生茸潜力
鹿茸的发生是基于生茸区骨膜的存在。在角柄发生前,如果剔除生茸区骨膜,失去骨膜的生茸区将不能发起鹿茸的生长;如果将剔除的骨膜移植到鹿体的除背部、鼻子和尾部外的其他任意部位,就能诱导异位鹿茸的发生(图2A)。这些异位鹿茸与原位鹿茸一样也经历着正常的鹿茸生长周期。这些研究说明,角柄与鹿茸发生的关键信息储存于生茸区骨膜细胞中。但异位生长的鹿茸在移植当年只生成不分杈的单枝而没有种的特异性,因此,鹿茸的形态是否由生茸区骨膜本身所控制呢?
1983年,Bubenik[13]提出鹿茸的形状是由鹿大脑中枢的特定部位所控制的观点,他将这一假定的部位称为“鹿茸生长中心”。Goss等[14]报道,鹿茸的生茸潜力主要集中在后侧区域,通过组织切除和移植法发现,如果将生茸区骨膜分成前(图2B)、后(图2D)、内(图2C)、外(图2E)4个区,则前区骨膜控制鹿茸的眉枝发生;内区骨膜控制其他分枝的发生;后区和外区骨膜则仅参与鹿茸的生长,不涉及鹿茸的分枝[15]。这些发现说明控制鹿茸形状的信息储存于生茸区骨膜,而不是Bubenik所提出的“鹿茸生长中心”。鹿生茸区骨膜生茸潜力的这一研究为研究鹿茸的形态发生奠定了基础,并且为器官发生形态调控的研究找到了一个很好的研究模型。
生茸区骨膜细胞鉴定结果发现,这些细胞有惊人的自我更新能力,表达一些胚胎干细胞的关键标记物(包括Oct4、Nanog和SOX2),并在离体情况下能被诱导分化成多种体细胞[8]。因此,这些细胞被称为鹿茸干细胞。将具有干细胞特性的对鹿茸发生有重要作用的生茸区骨膜干细胞(APCs)称为鹿茸发生干细胞(SCAG);对鹿茸再生有重要作用的角柄骨膜干细胞(PPCs)称为鹿茸再生干细胞(SCAR)。鹿茸干细胞的发现,为研究鹿茸生物学特性和揭示鹿茸完全再生机制开辟了一条新的通路。
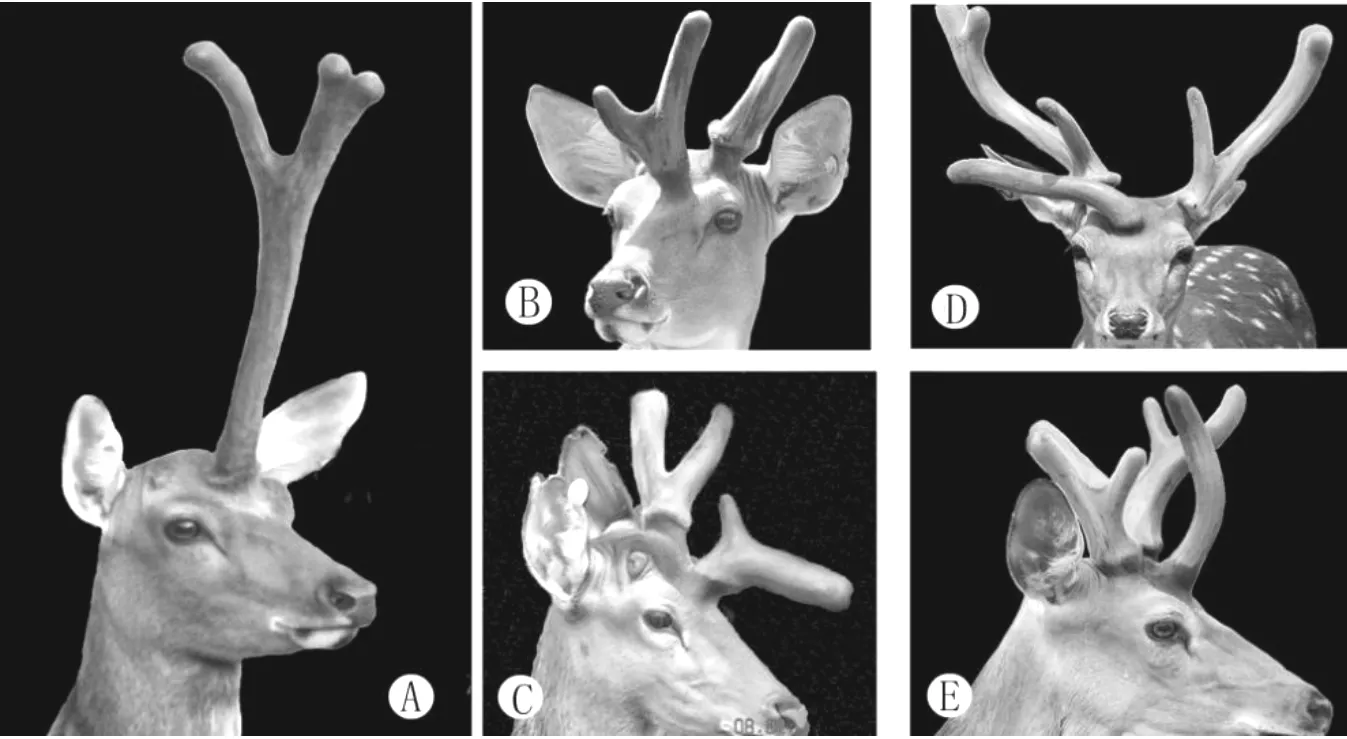
A.AP移植到前额部位,诱导形成一个正常大小的鹿茸;B.AP前半部移植到前额部位,形成具有眉枝的鹿茸;C.AP内半部移植到前额,具有分枝的鹿茸;D、E.AP后半部和外半部移植到前额,只能形成不分枝的鹿茸。
A.The transplantation of AP into the forehead has induced a normal antler;B.The transplantation of the first half of AP into the forehead has induced a antler with brow;C.The transplantation of the inside half of AP into the forehead has induced a antler with branch;D,E.The transplantation of the outside and last half of AP into the forehead has induced a antler without branch
图2鹿茸不同部位的生茸潜力
Fig.2Theanterogenicpotentialofdeerantler
3 展望
近年来,随着生物医学与再生医学的迅猛发展,组织器官再生已成为可能,这也将是未来再生医学的主流技术。自然界中已经存在的再生生物模型如水螅、蝾螈[16~18]等均是低等生物,与人类机制还相差甚远。鹿茸作为哺乳动物中唯一能够再生的附属器官,如果能揭示鹿茸的再生机制,将对再生医学产生极大的帮助。
[1]Suttie JM,Fennessy P F,Lapwood KR,et al.Role of steroids in antler growth of red deer stags[J].J Exp Zool,1995,271(2):120-130.
[2]Kierdorf U,Stoffels E,StoffelsD,et al.Histological studies of bone formation during pedicle restoration and early antler regeneration in roe deer and fallow deer[J].Anat Rec,2003,273A(2):741-751.
[3]Goss RJ.Induction of deer antlers by transplanted periosteum.Ⅰ.Graft size and shape[J].J Exp Zool,1985,235(3):359-373.
[4]Li C,Zhao H P,Liu Z,et al.Deer antler-A novel model for studying organ regeneration in mammals[J].Int J Biochem Cell Biol,2014,56C:111-122.
[5]Li C.Deer antler regeneration:a stem cell-based epimorphic process[J].Birth Defects Res C Embryo Today,2013,96(1):51-62.
[6]Li C,Suttie JM,Clark DE.Morphological observation of antler regeneration in red deer(Cervus elaphus)[J].J Morphol,2004.262(3):731-740.
[7]Li C,Suttie J.Morphogenetic aspects of deer antler development[J].Front Biosci(Elite Ed),2012,(4):1836-1842.
[8]Li C,Yang F,Sheppard A.Adult stem cells and mammalian epimorphic regeneration-insights from studying annual renewal of deer antlers[J].Curr Stem Cell Res Ther,2009,4(3):237-251.
[9]Kierdorf U,Kierdorf H,Szuwart T.Deer antler regeneration:cells,concepts,and controversies[J].J Morphol,2007,268(8):726-738.
[10]Li C.Histogenetic aspects of deer antler development[J].Front Biosci(Elite Ed),2013,(5):479-489.
[11]Li C,Yang F,Li G,et al.Antler regeneration:a dependent process of stem tissue primed via interaction with its enveloping skin[J].J Exp Zool A Ecol Genet Physiol,2007,307(2):95-105.
[12]Li C,Suttie JM.Deer antlerogenic periosteum:a piece of postnatally retained embryonic tissue[J].Anat Embryol(Berl),2001,204(5):375-388.
[13]Bubenik GA.Endocrine regulation of the antler cycle[J].Caesar Kleberg Wildl,1983,(1):73-107.
[14]Goss RJ,Powel RS.Induction of deer antlers by transplanted periosteum.Ⅰ.Graft size and shape[J].J Exp Zool,1985,235(3):359-373.
[15]Gao Z,Yang F,McMahon C,et al.Mapping the morphogenetic potential of antler fields through deleting and transplanting subregions of antlerogenic periosteum in sika deer(Cervus nippon)[J].J Anat,2012,220(2):131-143.
[16]Nye HL,Cameron JA,Chernoff EA,et al.Regeneration of the urodele limb:a review[J].Dev Dyn,2003,226(2):280-294.
[17]McGann CJ,Odelberg SJ,Keating MT.Mammalian myotube dedifferentiation induced by newt regeneration extract[J].Proc Natl Acad Sci USA,2001,98(24):13699-13704.
[18]Stocum DL,Cameron JA.Looking proximally and distally:100 years of limb regeneration and beyond[J].Dev Dyn,2011,240(5):943-968.
