苍山黑龙溪捕食线虫真菌的生物多样性
2015-03-23梅雄娥周福仙苏鸿雁
梅雄娥,周福仙,代 琦,魏 芳,苏鸿雁
(大理学院农学与生物科学学院,云南大理 671003)
捕食线虫真菌是以营养菌丝特化形成的三维菌网、黏性球、收缩环、非收缩环、黏性分枝、黏性菌丝等〔1〕捕食器官来捕食线虫的一类真菌。迄今为止,据国际权威数据库MycoBank 记载〔2〕,全世界已报道的食线虫真菌有347 种,其中捕食线虫真菌不到100种〔3〕。捕食线虫真菌在世界范围内广泛分布于各种生态环境中,包括土壤、动物粪便、腐木、腐叶、地衣、植物根系等多种基质〔4〕。
动植物寄生线虫病是一种普遍存在的病害,给农业和畜牧业带来巨大的经济损失〔5〕。目前对线虫的防治主要依靠化学杀虫剂,长期使用杀虫剂除了造成药剂残留、破坏生态环境等弊端外,也使线虫的抗药性增强〔6〕。利用捕食线虫真菌来进行生物防治具有不污染环境、药效持久、不易产生抗药性等优点。为了筛选适合不同环境的生防菌株,国内外学者进行了一系列捕食线虫真菌的研究〔7-9〕,对陆地环境和水环境中捕食线虫真菌的研究已有一些报道〔10-11〕,对水环境中的腐叶〔12〕、底泥等〔13-15〕也有一些研究报道。但对沉水腐木上的捕食线虫真菌的调查还未见报道,本实验拟对大理苍山黑龙溪中沉水腐木及溪边土壤中捕食线虫真菌资源进行调查,并比较捕食线虫真菌在不同基质中的出现频率,了解捕食线虫真菌在不同基质上的分布情况和多样性特征,为今后分离不同地区、不同基质的生防菌株提供菌种资源。
1 材料和方法
1.1 样品采集地点云南大理苍山(99°54′30″~100°12′12″E,25°33′30″~25°59′48″N),有十九峰〔16〕,每两峰之间都有一条溪水奔泻而下,流入洱海,黑龙溪位于苍山南部的玉局峰和马龙峰之间,溪水长流不息,上游溪水清澈,下游由于受人类活动的影响,水质相对较差。
1.2 样品采集与培养2014 年6~7 月份在大理苍山黑龙溪溪水里随机采集沉水腐木和溪边土壤样品各100 份,用密封袋保存带回实验室并对每份样品编号。溪边土壤采用常规撒土法培养〔17〕,落水腐木样品采用张仕颖等〔12〕培养腐叶的方法培养。
1.3 捕食线虫真菌的分离、鉴定培养两周后对每个样品镜检,采用单孢分离法,在无菌条件下将观察到的捕食线虫真菌转接到直径为60 mm 的CMA平板上,在培养基中间挖一个1 cm×1 cm 的小室,25 ℃恒温培养。培养1~2周待平板上长满菌丝时,在小室内加入诱饵线虫〔18〕,培养12~24 h 后进行镜检,观察捕器的产生情况。根据孢子着生方式、分生孢子及孢子梗形态大小、厚垣孢子形态及捕器等特征采用Li Yan 等〔19〕分类系统对捕食线虫真菌进行形态学鉴定。
1.4 数据统计及分析记录物种检出率(Occurrence Frequency,OF)。OF=含有某一种菌种的样品数/所有的样品数×100%。统计物种丰富度,采用Sorensen 相似性指数(S')评价不同样点的群落相似性。S'取值0 和1,1 表示2 个样点的真菌群落完全相似,0 表示2 个样点的真菌群落不相似。采用Shannon-Weiner 指数(H')和Simpson 指数(D)评价捕食线虫真菌的多样性。Shannon-Weiner 指数越高,群落的复杂程度越高;Simpson 指数越高,群落所含物种越丰富。计算群落相似性指数、物种多样性指数和优势度指数所用公式如下:
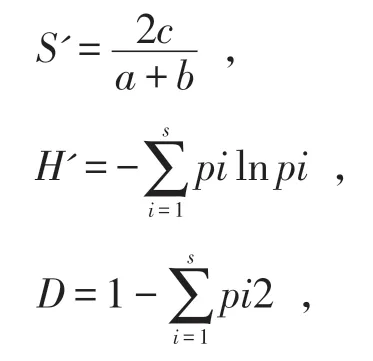
其中,a为采样点 A 的物种数,b为采样点 B 的物种数,c为2个采样点相同的物种数。pi=Ni/N,Ni为第i种的数量;N为所有种的数量;pi为第i种所占百分数,S为采样点的物种总数。
2 结果
2.1 样品中捕食线虫真菌的分离鉴定结果从溪边土壤中分离到捕食线虫真菌3属16种,优势种为Arthrobotrys oligospora(26%)和A.musiformis(20%)。从沉水腐木中分离到3属11种,优势种为A.longiphorum(13%)和Dactylellina ellipsosporum(10%)。统计结果见表1。
2.2 两种基质上捕食线虫真菌多样性比较溪边土壤中的检出率为79%,沉水腐木上的检出率为53%,两种基质中都是产三维菌网的占优势,溪边土壤的物种丰富度(16)大于沉水腐木的物种丰富度(11)。见表2。

表1 样品中捕食线虫真菌的检出率
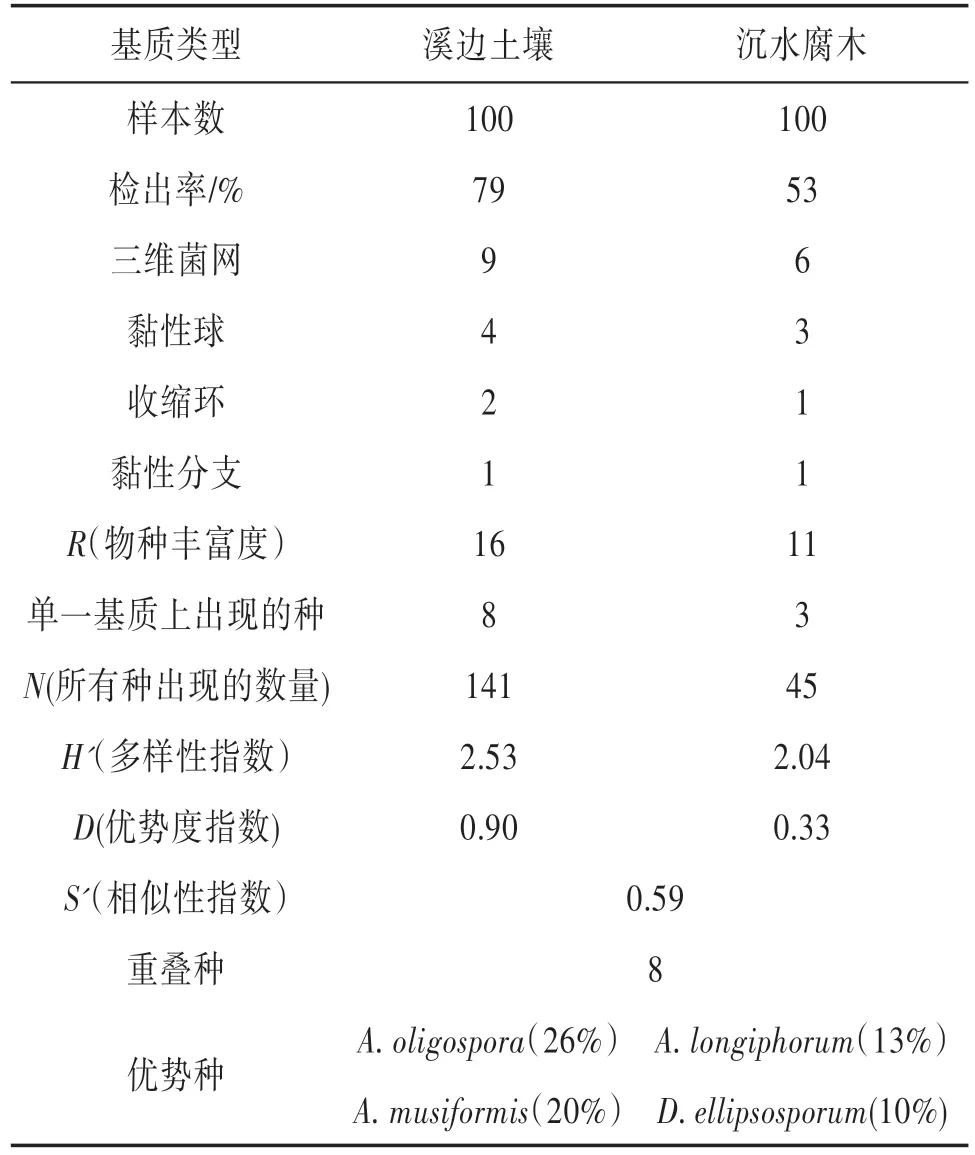
表2 两种基质上捕食线虫真菌多样性的比较
3 讨论
3.1 两种基质上捕食线虫真菌分离鉴定结果比较本次实验以大理苍山黑龙溪里随机采集的沉水腐木和溪边土壤作为研究材料,土壤中分离出的捕食线虫真菌优势种为A.oligospora(26%)和A.musiformis(20%)。沉水腐木中分离出的优势种为A.longiphorum(13%)和D.ellipsosporum(10%)。出现这种差异性的原因可能有以下几个方面:①与真菌在不同的基质上的定殖能力有关〔12〕;②与腐木在水里浸泡的时间长短有关。树木或其他植物含有大量的有机物质,这些有机物质不容易降解,所以这些材料要成为真菌居住的环境需要很长的一段时间〔20〕。Fryar等〔21〕的研究也表明,只有沉水树木达6个月后其上的真菌才能真正的成为真菌群落。
3.2 不同基质上捕食线虫真菌的物种多样性指数和群落相似性的比较不同基质中捕食线虫真菌的物种丰富度和多样性指数统计分析显示:溪边土壤的物种丰富度(16)高于沉水腐木的物种丰富度(11),溪边土壤的物种多样性指数(2.53)较沉水腐木(2.04)的高,说明土壤中的捕食线虫真菌资源更丰富。两种基质上都是产三维菌网的种类占优势,Supermarket 等〔22〕和Su等〔23〕,在调查陆地土壤样品和动物粪便样品中的捕食线虫真菌也得到过类似的结果,他们认为产黏性菌网的捕食线虫真菌需要的营养较少,并且这些真菌生长的快,其腐生能力较强,所以产黏性菌网的捕食线虫真菌占优势。相似性指数为0.59,说明两种基质上的物种有一定的相似性(群落相似性为0.00 为完全不相似,0.70以上为大体相似)〔24〕。两种基质上都出现的种有A.ongiphorum,A.elegans,A.endermata,A.vermicola,D.ellipsosporum,D.drechsleri,Drechslerella dactyloides,Shearer〔25〕提出水生真菌起源于陆地,2006年 Vijaykrishna 等〔26〕基于 18rDNA 和贝叶斯分子钟的研究也证明了水生真菌起源于陆地,因此土壤和腐木上捕食线虫真菌群落有一定的相似性,但由于基质和生境不同而形成了不同的种群结构。由于此次采集样品数量较少,为了得到更具有说服力的数据还有待进一步扩大采样范围和采样数量做进一步的调查和比较,使实验数据更具系统性和代表性。
〔1〕张克勤,莫明和. 中国真菌志第33 卷:节丛孢及相关属〔M〕.北京:中国科学技术出版社,2006:1-20.
〔2〕李娟,张克勤. 食线虫微生物防控病原线虫的研究〔J〕.中国生物防治学报,2013,29(4):481-489.
〔3〕Zhang K Q,Hyde K D.Nematode-trapping fungi〔M〕.Berlin:Springer,2014:6-14.
〔4〕Duddington C L.The ecology of predacious fungi.Ι Preliminary survey〔J〕.Trans Brit Mycol Soc,1951,34:322-331.
〔5〕Sasser J N,Freekmade W.A world perspective on nematology:the role of society〔C〕// In:Vistas on Nema tology(Veech JA&Dickerson DW eds.).Hy at sville:Society of Nematologists,1987:1-6.
〔6〕喻子牛. 微生物农药及其产业化〔M〕. 北京:科学出版社,2000:16-27.
〔7〕张金莲.广西捕食线虫真菌分类及分子分析〔D〕.南宁:广西大学,2005:2-28.
〔8〕王伟.中国部分地区捕食线虫真菌的研究〔D〕.哈尔滨:东北林业大学,2011:3-35.
〔9〕Hao Y E,Mo M H,Su H Y,et al.Ecology diversity of aquatic nematode-trapping hyphomycetes in southwest of China〔J〕.Aquatic Microbial Ecology,2005,40:175-181.
〔10〕Peach M. Aquatic predacious fungi〔J〕. Transactions of the British Mycological Society,1950,33:148-153.
〔11〕章靖,莫明和,邓敬石,等.云南西部地区的捕食线虫真菌〔J〕.云南大学学报:自然科学版,2005,27(1):71-76.
〔12〕张仕颖,郝玉娥,张克勤.云南及贵州部分地区淡水生捕食线虫真菌多样性研究〔J〕.云南大学学报:自然科学版,2007,29(2):199-207.
〔13〕杨晓燕,刘立盘. 洱海捕食线虫真菌生物多样性研究〔J〕.安徽农业科学,2011,39(23):14183-14184.
〔14〕杨晓燕,苏鸿雁,叶远邦.程海捕食线虫真菌资源的调查〔J〕.大理学院学报,2008,7(12):19-21.
〔15〕郝玉娥,张铭洋,谭胜全,等.水生捕食线虫真菌季节性分布及多样性研究〔J〕.南华大学学报:自然科学版,2012,26(1):87-92.
〔16〕大理白族自治州苍山保护管理局.苍山志〔M〕.昆明:云南民族出版社,2008:3-10.
〔17〕Duddington C L.Notes on the technique of handling predacious fungi〔J〕.Trans Brit Mycology,1955,38:97-103.
〔18〕高仁恒,刘杏忠.一种诱导和观察捕食线虫真菌捕食器官的简易方法〔J〕.真菌学报,1996,159(4):304-305.
〔19〕Li Y,Hyde K D,Jeewon R,et al.Phylogenetics and evolution of nematode-trapping fungi(Orbiliales) estimated from nuclear and protein coding genes〔J〕. Mycologia,2005,97(5):1034-1046.
〔20〕Cai L,Zhang K Q,Mckenzie E H C,et al.Freshwater fungi from bamboo and wood submerged in the Liput River in the Philippines〔J〕.Fungal Diversity,2003,13:1-12.
〔21〕Fryar S C,Davies J,Booth W,et al.Succession of fungi on dead and live wood in brackish water in Brnnei〔J〕.Mycologia,2004,96:219-225.
〔22〕Supermarket L,Back A,Poisson H B. Population dynamics of nematophagbous fungi and nematodes in an arable soil;vertigoa land seasonal fluctuation〔J〕.Soil Biochemistry,1996,28:1005-1014.
〔23〕Su H Y,Hao Y E,Mo M H,et al.The ecology of nematodetrapping hyphomycetes in cattle dung from three plate auvasty〔J〕. Veterinary Parapsychology,2006,144:293-298.
〔24〕艾训儒,马友平.洪家河流域植物群落相似性与聚类分析〔J〕.湖北民族学院学报,2006,24(4):339-342.
〔25〕Shearer C A. The freshwater ascomycetes〔J〕. Nova Hedwigia,1993,56(1-2):1-33.
〔26〕Vijaykrishna D,Jeewn R,Hyde K D.Molecular taxonomy,origins and evolution of freshwater ascomycetes〔J〕. Fungal Diversity,2006,23:351-390.
