淀粉酶产色链霉菌1628发酵培养基及发酵条件的优化
2015-03-23李丹婷袁小枫申屠旭萍俞晓平
李丹婷,袁小枫,申屠旭萍,俞晓平
(中国计量学院 生命科学学院,浙江省生物计量及检验检疫技术重点实验室,浙江 杭州 310018)
淀粉酶产色链霉菌1628发酵培养基及发酵条件的优化
李丹婷,袁小枫,申屠旭萍,俞晓平
(中国计量学院 生命科学学院,浙江省生物计量及检验检疫技术重点实验室,浙江 杭州 310018)
淀粉酶产色链霉菌1628(Streptomycesdiastatochromogenes)是一株具有广阔应用前景的生防菌株,其合成的主要活性物质为核苷类抗生素——丰加霉素.为了提高淀粉酶产色链霉菌的发酵水平,本研究采用单因素和正交实验设计,对菌株1628的发酵培养基和发酵条件进行了优化,优化后的最佳培养基配方为:可溶性淀粉1.5%、黄豆粉5%、FeSO40.1%、CaCO30.5%、NH4NO30.3%、KH2PO40.3%,最适初始pH7.0.在供试的发酵条件内,装液量60 mL/250 mL,发酵温度28 ℃,摇床转速180 r/min,发酵时间为92 h.活性物质丰加霉素的产量最高156.17 mg·L-1,比优化前提高了3.3倍.
淀粉酶产色链霉菌;发酵优化;丰加霉素;单因素;正交设计
Optimization of medium and fermentation conditions ofStreptomycesdiastatochromogenes
微生物发酵效价受多种因素影响,如菌种自身的性能、培养基及培养条件等[1-3].因此,有了优良的菌种之后,有必要研究生产菌株的最佳发酵条件,使生产菌株处于最佳的产物合成环境,进而取得高产的效果.本项目组从浙江临安天目山采集的土壤中分离筛选到一株具有生防作用的放线菌菌株——淀粉酶产色链霉菌1628(Streptomycesdiastatochromogenes)[4].进一步研究发现,该菌株能合成核苷类抗生素丰加霉素[5].丰加霉素对常见的植物病原真菌有较强的抑制作用,对黄瓜立枯病有较好的保护和治疗作用[6].野生型菌株往往产素水平较低,为了达到用于生产的目的,必须通过各种技术和方法来提高菌株的生产能力.采用优化发酵培养基以及发酵条件的方法来提高活性物质的产量是最基础的,且效果明显.本文针对生防菌株1628,研究了培养基和发酵条件对该菌株次级代谢产物中活性物质合成的影响.
1 材料与方法
1.1 菌种
淀粉酶产色链霉菌(S.diastatochromogenes)和供试病原菌黄瓜立枯丝核菌(Fusariumoxysporum)由浙江省生物计量及检验检疫技术重点实验室保存.
1.2 仪器
高效液相色谱仪(Varian Prostar-240,Varian公司),超纯水系统(Millipore,美国),AS分析天平(RADWAG,波兰),全温震荡培养箱(太仓市实验设备厂),生物安全柜(美国Thermo Fisher公司).
1.3 培养基
PDA培养基:马铃薯200 g,葡萄糖20 g,琼脂20 g,水1 L.
发酵基本培养基:葡萄糖4%,黄豆饼粉2.5%,KH2PO40.5%,CaCO30.6%.
1.4 方法
1.4.1 淀粉酶产色链霉菌液体发酵实验
采用摇瓶发酵法.在250 mL三角瓶中装60 mL液体发酵培养基,28 ℃,180 r/min培养.
1.4.2 单因素优化实验
1.4.2.1 淀粉酶产色链霉菌液体发酵培养基的优化
以发酵基本培养基为参照,将其中的葡萄糖(碳源)依次替换为麦芽糖、蔗糖、α-乳糖、甘油、淀粉(质量分数为4%),或者将其中的黄豆饼粉(氮源)依次替换为牛肉膏、玉米浆、蛋白胨、酵母膏(质量分数为2.5%),或者依次加入选择的受试无机离子Fe2+、Na+、Zn2+、K+、Mg2+,以不加离子为空白对照.挑取淀粉酶产色链霉菌1628孢子液接种到液体培养基中,每处理设三个重复,28 ℃,180 r/min下培养96 h后,每个处理的发酵液经3层灭菌纱布过滤后在11 000 r/min下离心10 min,0.22 μm膜过滤,滤液用于抑菌试验和HPLC测定.
1.4.2.2 淀粉酶产色链霉菌液体发酵培养条件的优化
1)初始pH值对活性物质合成的影响:分别考察初始pH 6.0、6.5、7.0、7.5、8.0下发酵产物对供试病原菌抑制率的大小.
2)装液量对活性物质合成的影响:在250 mL三角瓶中装液量分别为30 mL、50 mL、70 mL、90 mL、120 mL、150 mL.
3)发酵温度对活性物质合成的影响:在确定了最佳碳源、氮源、无机离子、初始pH值以及装液量后,将发酵温度分别设为24 ℃、26 ℃、28 ℃、30 ℃、32 ℃.
4)发酵时间对活性物质合成的影响:在优化培养基和最适pH及最佳温度下,发酵72 h后每隔12 h取一次样,即分别于接种培养68 h、80 h、92 h、104 h、116 h后取发酵液测定抑菌活性,每个处理三次重复.
1.4.3 正交优化实验
根据单因素优化实验结果选出利于活性物质产生的7个因素(淀粉、黄豆粉、FeSO4、初始pH、发酵时间、温度、装液量),每个因素设置3个水平,选用L18(37)正交表进行正交试验(表1),分别配置不同的培养基进行液体发酵.终止培养后,将发酵液过滤后进行HPLC测定.每个实验点做3个重复,以丰加霉素质量浓度的平均值作为活性物质生产水平的结果,并对结果进行直观分析和方差分析,确定优化培养基.
1.4.4 发酵液活性物质的测定方法
1.4.4.1 抑菌活性的测定
采用抑制菌丝生长速率法[7].淀粉酶产色链霉菌1628发酵液的滤液稀释10倍后取1 mL于无菌培养皿内,与9 mL冷却至50 ℃的PDA培养基迅速混匀,凝固后在每个培养基平面上放置1个供试菌的菌饼(直径为4 mm),菌饼接于培养皿中央(培养皿直径为9 cm),置28 ℃下培养,以无菌水为对照,重复3次.采用十字交叉法测定菌落直径,按照以下公式计算抑菌率:菌丝生长抑制率(%)=[(对照菌落直径-处理菌落直径)/(对照菌落直径-4)]×100%
1.4.4.2 高效液相色谱法分析
色谱条件:色谱柱为SHIMADZU C18RP柱(150 mm×4.0 mm,5 μm);检测器为光电二极管检测器;流动相A为甲醇、B为水.梯度洗脱程序:0~15 min 5%~37% A;15~30 min 37%~100% A;30~40 min 100%~5% A;流速1 mL·min-1;检测波长为279 nm,进样量5 μL,柱温30 ℃[8].
1.4.5 优化结果的验证
采用优化后的培养基以及培养条件对淀粉酶产色链霉菌1628进行液体发酵,HPLC检测并验证发酵液中丰加霉素含量.
2 结果与分析
2.1 单因素优化实验结果的分析
为了确定适合活性物质产生的营养因素和培养条件,利用单因素优化试验考察各种营养因素及不同培养条件下对发酵液抗菌活性的影响,结果见图1~7.从图1可见,麦芽糖、淀粉和甘油都是有利于淀粉酶产色链霉菌1628产生抗菌活性物质的碳源,但从经济角度考虑,淀粉是最适的选择.从图2可见,在5种氮源中,黄豆粉是淀粉酶产色链霉菌1628的最佳发酵氮源.从图3可见,添加了Fe2+的发酵液抑制黄瓜立枯丝核菌的效果最好.图4~6表明,淀粉酶产色链霉菌1628液体发酵的最适pH为6.0,最佳发酵温度为28 ℃,摇瓶发酵装液量为70 mL/250 mL.由图7可知,92 h之后发酵液抑菌效果几乎相近.因此确定淀粉、黄豆粉、FeSO4、初始pH、发酵时间、温度、装液量这7个因素作为正交实验的分析对象.

图1 碳源对抑菌活性物质合成的影响Figure 1 Effect of carbon source on biosynthesis of antifungal metabolites

图2 氮源对抑菌活性物质合成的影响Figure 2 Effect of nitrogen source on biosynthesis of antifungal metabolites

图3 无机离子对抑菌活性物质合成的影响Figure 3 Effect of inorganic ion on biosynthesis of antifungal metabolites
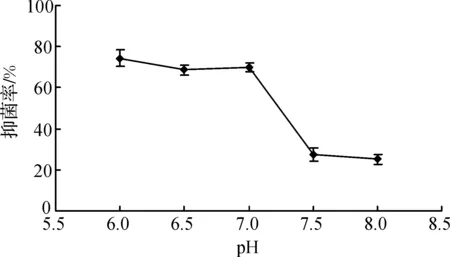
图4 初始pH值对抑菌活性物质合成的影响Figure 4 Effect of pH on biosynthesis of antifungal metabolites
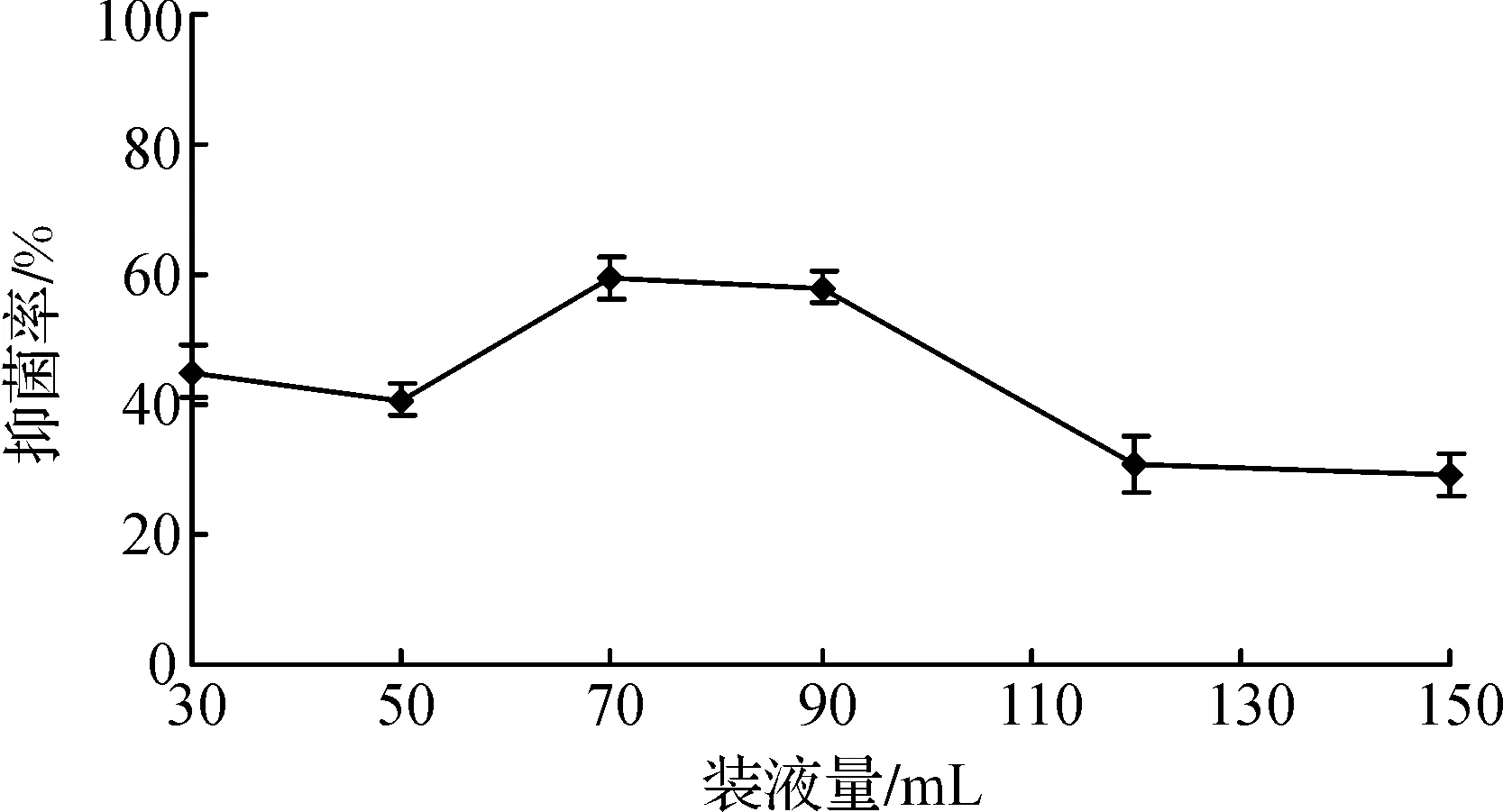
图5 装液量对抑菌活性物质合成的影响Figure 5 Effect of capacity on biosynthesis of antifungal metabolites

图6 发酵温度对抑菌活性物质合成的影响Figure 6 Effect of temperature on biosynthesis of antifungal metabolites

图7 发酵进程曲线Figure 7 Progress curve of fermentation
2.2 正交试验优化结果的分析
通过单因素优化实验,确定有利于淀粉酶产色链霉菌1628产生抗菌物质的7个因素为淀粉、黄豆粉、FeSO4、初始pH、发酵时间、温度、装液量,进行了7因素3水平的正交优化实验,实验结果见表2.将实验结果进行直观分析(表2)和方差分析(表3)后发现,淀粉、黄豆粉对抑菌活性物质合成的影响显著(p<0.05);在P=0.1水平上,温度和装液量对发酵的影响显著,FeSO4、初始pH、发酵时间对发酵液的影响不大,而发酵时间的影响最小.综合分析得到,淀粉酶产色链霉菌1628液体发酵的最佳水平为A1B2C1D2E2F2G2,确定优化培养基为:可溶性淀粉1.5%,黄豆粉5%,FeSO40.1%,CaCO30.5%,NH4NO30.3%,KH2PO40.3%.优化的培养条件为:在装液量为60 mL/250 mL时,初始pH 7.0,发酵温度28 ℃,发酵时间为92 h.

表2 培养基优化采用的L18(37)正交表的安排以及直观分析结果

(续表2)

表3 正交优化实验的方差分析
2.3 优化实验结果的验证
采用基础培养基和基础发酵条件,以及正交优化培养基和优化发酵条件培养淀粉酶产色链霉菌1628,培养92 h后取样检测活性物质丰加霉素的含量.优化后的发酵液中丰加霉素的质量浓度为156.17 mg·L-1,比优化前的47.96 mg·L-1提高了3.3倍.因此,采用优化后的培养基和发酵条件能大大提高淀粉酶产色链霉菌1628合成丰加霉素.
3 讨 论
发酵法生产微生物次级代谢产物除了受菌种自身特性决定外,培养基的组成、发酵条件等对活性物质的产量也有非常重要的影响.不同菌株能够利用的碳源、氮源不同,同种菌株对不同的碳源、氮源的利用效率也不同[3,9].本文对淀粉酶产色链霉菌1628的发酵培养基和发酵条件进行了优化,通过单因素优化实验,考察各营养因素和发酵条件对发酵液抑菌活性物质合成的影响,然后对培养基组分及发酵条件进行正交实验,从经济角度考虑,确定了菌株1628的优化培养基:可溶性淀粉1.5%,黄豆粉5%,FeSO40.1%,CaCO30.5%,NH4NO30.3%,KH2PO40.3%.优化发酵条件:最适初始pH7.0,装液量60 mL/250 mL,发酵温度28 ℃,摇床转速180 r/min,发酵时间为92 h.这为该菌株进一步开发利用提供数据基础.
正交设计是从多因素试验的全部水平组合中挑选部分有代表性的水平组合进行试验,通过对这部分实验结果的分析了解全面试验的情况,找出最优水平组合.L18(37)经常被用来优化微生物发酵的营养因素及其发酵条件,选择合适的营养因素和发酵条件进行正交优化实验,能够提高微生物产生活性代谢产物的能力.通过实验验证,发现应用优化后的培养基及其发酵条件获得的发酵液,其抑菌活性物质是应用基础条件的3.3倍,证明了应用正交实验来优化培养基和发酵条件是一种有效的方法.
在进一步研究淀粉酶产色链霉菌1628活性物质的过程中发现,初步判断该菌至少还可合成6种四烯大环内酯类抗生素(HPLC检测有四烯大环内酯类抗生素紫外特征吸收峰).多烯大环内酯抗生素对真菌抑制活性强,是一类目前应用中最不容易产生抗药性的抗真菌抗生素[10].后续的研究中我们将通过柱层析分离纯化获得四烯大环内酯类抗生素纯品,并明确其结构.
[1] 赵晓燕,吴晓青,赵忠娟,等.菌株TLB15发酵培养基的优化及其发酵液的杀虫活性[J].福建农业学报,2014,29:669-672. ZHAO Xiaoyan, WU Xiaoqing, ZHAO Zhongjuan, et al. Optimum fermentation medium for insecticidal active substances from strain TLB 15[J]. Fujian Journal of Agricultural Sciences,2014,29:669-672.
[2] 赵淑莉,任飞娥,刘金亮,等.玉米大斑病生防放线菌的筛选鉴定及发酵条件优化[J].微生物学报,2012,52(10):1228-1236. ZHAO Shuli, REN Feie, LIU Jinliang, et al. Screening, identification and optimization of fermentation conditions of an antagonistic actinomycetes strain toSetosphaeriaturcica[J]. Acta Microbiologica Sinica,2012,52(10):1228-1236.
[3] 夏觅真,蒋颂,罗薇薇,等.土壤放线菌FX05发酵培养基及发酵条件的优化[J].微生物学杂志,2009,29(4):49-52. XIA Mizhen, JIANG Song, LUO Weiwei, et al. Optimization of medium and fermentation conditions for soil actinomyces strain FX05[J]. Journal of Microbiology,2009,29(4):49-52.
[4] 申屠旭萍,于冰,边亚琳,等.拮抗链霉菌B28的分类鉴定及其生防作用研究[J].植物病理学报,2012,42(1):105-109. SHENTU Xuping, YU Bing, BIAN Yalin, et al. Biocontrol effect and taxonomy of antagonisticStreptomycesstrain B28[J]. Acta Phytopathologica Sinica,2012,42(1):105-109.
[5] 于冰,申屠旭萍,俞晓平.丰加霉素对黄瓜立枯丝核菌的拮抗作用[J].中国生物防治,2011,27(3):373-377. YU Bing, SHENTU Xuping, YU Xiaoping. Antifungal activity of toyocamycin onRhizoctoniasolaniKühn[J]. Chinese Journal of Biological Control,2011,27:373-377.
[6] NISHIMURA N, KATO A, MAEBA I. Synthesis of pyrrolo[2,1-f][1,2,4]triazine C-nucleosides. Isosteres of sangivamycin, tubercidin, and toyocamycin[J]. Carbohydrate Research,2001,331:77-82.
[7] 冯俊涛,石勇强,张兴.56种植物抑菌活性筛选试验[J].西北农林科技大学学报,2001,29(2):65-68. FENG Juntao, SHI Yongqiang, ZHANG Xing. Screening studies on fungistasis of 56 plant extracts[J]. Journal of Northwest Sci-Tech University of Agriculture and Forestry,2001,29(2):65-68.
[8] 申屠旭萍,于冰,李丹婷,等.HPLC法测定发酵液中丰加霉素的研究[J].中国计量学院学报,2013,24(3):215-218. SHENTU Xuping, YU Bing, LI Danting, et al. Identification and quantification of toyocamycin in fermentation broth by HPLC[J]. Journal of China University of Metrology,2013,24(3):215-218.
[9] 刘杨,王勇,康静芹,等.拮抗农业致病菌放线菌G5发酵条件的优化[J].湖北农业科学,2014,53(7):1634-1636. LIU Yang, WANG Yong, KANG Jingqin, et al. Optimization of fermentation condition for actinomycetes G5[J]. Hubei Agricultural Sciences,2014,53(7):1634-1636.
[10] VILAR V, BOTELHO C, BOAVENTURA R. Equilibrium and kinetic modeling of Cd biosorption by algae Gelidium and agar extraction algal waste[J]. Water Research,2006,40(2):291-302.
LI Danting, YUAN Xiaofeng, SHENTU Xuping, YU Xiaoping
(College of Life Sciences, China Jiliang University, Zhejiang Provincial Key Laboratory of
Biometrology and Inspection and Quarantine, Hangzhou 310018, China)
Streptomycesdiastatochromogenes1628 has broad applications in biocontrol field and mainy biosynthesized uncleosides antibiotics—toyocamycin. In order to improve the toyocamycin production, single-factor experiments and orthogonal tests were designed to optimize the fermentation medium and conditions forStreptomycesdiastatochromogenes1628. The optimum fermentation medium was soluble starch 1.5%, soybean meal 5%, FeSO40.1%, CaCO30.5%, NH4NO30.3%, and KH2PO40.3%. The optimum cultural conditions were initial pH7.0, capacity 60 mL/250 mL, temperature 28 ℃, 180 r·min-1for 92 h. Under optimized conditions, the output of toyocamycin is 3.3 times higher than that of the control.
Streptomycesdiastatochromogenes; fermentation condition optimization; toyocamycin; single-factor; orthogonal test

1004-1540(2015)01-0099-06
10.3969/j.issn.1004-1540.2015.01.018
2014-11-05 《中国计量学院学报》网址:zgjl.cbpt.cnki.net
国家自然科学基金资助项目(No.31401793),浙江省自然科学基金资助项目(No.LY12C14012),浙江省公益技术研究项目(No.2010C32063,2013C32008),杭州市科技计划项目(No.20120232B17).

R917
A
