东南景天耐镉相关基因SaFer的克隆与功能初步分析
2015-03-23韩小娇刘明英乔桂荣姜彦成卓仁英
赵 婷,韩小娇, 刘明英,乔桂荣, 蒋 晶, 姜彦成, 卓仁英
东南景天耐镉相关基因SaFer的克隆与功能初步分析
赵 婷1,2,3,韩小娇2,3, 刘明英2,3,乔桂荣2,3, 蒋 晶2,3, 姜彦成1, 卓仁英2,3
(1.新疆大学 生命科学与技术学院,新疆 乌鲁木齐830046;2.中国林业科学研究院 亚热带林业研究所,浙江富阳311400;3.中国林业科学研究院林木遗传育种国家重点实验室,北京100091)
铁蛋白(ferritin)是一种专门存储铁的重要胁迫相关蛋白,参与镉离子吸收的调控。从构建的东南景天Sedum alfredii cDNA文库中筛选出东南景天Ferritin基因cDNA全长,命名为SaFer,编码序列为1 117 bp,开放阅读框为759 bp,编码252个氨基酸。以东南景天基因组DNA为模板分离到SaFer基因组序列,长度为1 702 bp,含有7个内含子。氨基酸序列同源性分析表明:SaFer与苹果Malus domestica Ferritin亲缘关系最近,同源性高达76%。实时荧光定量聚合酶链式反应(qRT-PCR)分析发现:根系中SaFer基因在镉胁迫12 h后表达显著上调。镉胁迫实验显示,转基因拟南芥Arabidopsis thaliana比野生型有更高的耐镉胁迫能力。SaFer基因的分离及其初步功能验证为研究东南景天耐镉机制和林木耐镉转基因育种提供了理论依据。图9表1参23
植物学;东南景天;铁蛋白(ferritin);镉胁迫;表达分析
随着中国工业化的迅速发展,土壤重金属污染已严重影响了食品安全。如何治理土壤重金属污染已成为国内外的研究热点。利用超积累植物清除重金属污染即植物修复技术以其潜在的高效、廉价和环境友好性而获得了广泛关注[1]。重金属超积累植物是指其地上部积累的重金属离子大于100 mg·kg-1,同时植物的地上部重金属含量与根系重金属含量的比值大于1的植物[2-3]。到目前为止,世界各地已经发现的超积累植物共400多种,主要是镍(Ni)超积累植物,而镉超积累植物比较少见。目前公认的镉超积累植物有遏蓝菜Thlaspi caerulescens,鼠耳芥Arabidopsis halleri和东南景天Sedum alfredii[4-9]。矿山型东南景天是在浙江省衢州市废弃的铅、锌矿区发现的一种锌(Zn2+)/镉(Cd2+)超积累植物[10]。矿山型东南景天是经过自然进化的镉超积累植物,查清东南景天重金属超积累的分子机制对林木耐镉新品种培育具有重要意义。铁蛋白在植物体内作为一种重要的胁迫反应蛋白参与外界环境胁迫反应。当植物受到寒冷、干旱、重金属离子等环境胁迫时体内都发现有铁蛋白的存在[11]。铁蛋白可以储存铁原子,减少铁介导的自由基反应,从而提高植物的抗胁迫能力[12]。铁蛋白通过芬顿反应螯合细胞内的铁,从而保护植物细胞免受因各种环境胁迫而导致的细胞氧化性损伤[13]。此外,铁蛋白还可以储存部分重金属离子,如Cu2+和Zn2+等,通过调节铁离子浓度来调控代谢所需的金属离子含量,从而抵御环境胁迫,因此,植物铁蛋白在缓解重金属的毒害方面也可能具有一定的作用[14]。目前,尚无东南景天Ferritin基因方面的研究。本研究是从中国林业科学研究院林木遗传育种国家重点实验室(本实验室)前期构建的东南景天cDNA文库中分离克隆出1个Ferritin基因cDNA,并分析了镉胁迫条件下东南景天根部中该基因的表达变化,及转基因拟南芥Arabidopsis thaliana在镉胁迫下的生理变化,为深入研究东南景天Ferritin基因如何参与镉胁迫反应机制及其在林木耐镉转基因育种中应用奠定基础。
1 材料与方法
1.1 植物材料、菌株和载体
哥伦比亚生态型拟南芥Col-0,东南景天,大肠埃希菌Escherichia coli DH5α,Bl21 DE Star,根癌农杆菌Agrobacterium tumefaciens EHA105,植物表达载体pBI121均由本实验室保存;pGEM-T Easy载体购自美国Promega公司。
1.2 酶和主要试剂
LA Taq高保真聚合酶、rTaq DNA聚合酶和限制性内切酶Sfi I购自宝生物工程(大连)有限公司,T4 DNA连接酶购自美国Promega公司,核糖核酸(RNA)提取使用总RNA纯化试剂盒(NORGEN,加拿大),反转录试剂盒Prime ScriptTMRT reagent Kit和荧光定量试剂盒SYBR Prime ScriptTMRT-PCR Kit均购自Takara公司(Takara,中国大连),DNA凝胶回收试剂盒购自AXYGEN公司(AXYGEN,中国上海),NANODROP2000分光光度计、ABI 7300实时定量聚合酶链式反应(PCR)仪、TaKaRa梯度PCR仪、高速冷冻离心机5804R分别购自美国Thermo公司、美国Applied Biosystems公司、日本TaKaRa公司和德国Eppendorf公司,DNA测序和引物合成由生工生物工程 (上海)股份有限公司完成(表1)。
1.3 东南景天SaFer基因组序列克隆及同源性分析
从本实验室前期构建的东南景天cDNA文库中筛选出Ferritin基因cDNA全长,利用十六烷基三甲基溴化铵(CTAB)法提取东南景天基因组DNA[15]。根据Ferritin基因序列设计特异性引物:ORF-F和ORF-R,以东南景天基因组DNA为模板,PCR反应程序:95℃预变性10min;95℃变性30 s, 56℃退火30 s,72℃延伸1 min,共30个循环;最后72℃延伸10 min。经体积分数为1%琼脂糖凝胶电泳后回收目的片段,连接T-easy载体,转化大肠埃希菌DH5α,筛选阳性菌落送至生工生物工程(上海)股份有限公司测序。

表1 引物名称及对应序列Table 1 Name and sequence of primers
将获得的氨基酸序列与美国国家生物技术信息中心(NCBI)数据库中的蛋白质序列进行局部序列比对基本检索工具(BLAST)比对,分析该基因与其他物种基因的同源性,用MEGA 4.0软件进行多序列比对并构建系统进化树。
1.4 东南景天根部SaFer基因镉胁迫后表达分析
用400 μmol·L-1的氯化镉(CdCl2)胁迫东南景天无性系植株,胁迫时间分别为0,0.5,6,12,24,48,72和96 h。按照NORGEN的RNA提取试剂盒说明,分别提取东南景天根部总RNA,用NanoDrop 2000分光光度计测定浓度,并用体积分数为1%的琼脂糖电泳分析完整性。使用Prime ScriptTMRT reagent Kit反转录合成第1链。反转录体系为2.0 μL 5×primeScript Buffer,500 ng总RNA,0.5 μL Oligo dT Primer,0.5 μL Random 6 mers,0.5 μL primeScript RTase,用RNase无核糖核酸酶水补足至10.0 μL。反应程序为:37℃/30 min,85℃/5 s,将合成后的cDNA稀释10倍,用于实时荧光定量PCR。
根据cDNA全长序列设计实时荧光定量PCR引物:Fer-RTF和Fer-RTR。参照试剂盒SYBR Prime-ScriptTMRT-PCR Kit说明书,以东南景天微管蛋白基因beta-Tubulin(TUB)为内参:TUB-RTF和TUBRTR。反应在ABI 7300实时定量PCR仪上进行,反应体系为:cDNA模板2.0 μL,2×SYBR Premix Ex TaqTM10.0 μL,特异引物(10 μmol·L-1)0.4 μL,50×ROX Reference Dye 0.4 μL,用水补足20.0 μL。PCR扩增条件为:95℃30 s预变性后,95℃变性5 s,60℃复性31 s,共40个循环。每个试样平行做4次反应,重复试验2次。数据分析采用ΔΔCT法计算相对定量,目标基因相对定量=2-ΔΔCT[16]。
1.5 拟南芥的转化和筛选
参考杨靓等[17]的方法对载体pBI 121进行改造引入Sfi I酶切位点获得目的载体pBI121G,利用 sfi 1限制性内切酶对SaFer基因片段和改造后的表达载体pBI121G进行酶切,将相应的目的片段连接后的植物表达载体命名为pBI121G-SaFer,并电激转化根癌农杆菌EHA105,利用花序浸染法转化拟南芥,筛选阳性转基因植株。通过PCR和实时荧光定量聚合酶链式反应(qRT-PCR)检测分析转基因拟南芥的表达模式。
1.6 SaFer转基因拟南芥的检测
分别利用SaFer特异引物PCR和RT-PCR相结合筛选转基因拟南芥阳性植株。拟南芥幼苗移栽于营养土22 d后,根据RNA提取试剂盒说明书分别提取野生型和PCR阳性株系拟南芥叶片总RNA,按照Takara逆转录试剂盒说明书对提取得到的总RNA反转录,并将合成的cDNA稀释10倍,用于荧光定量PCR分析。
设计东南景天Ferritin基因荧光定量PCR引物:Fer-RTF和Fer-RTR,以拟南芥Actin为内参基因:AtActin-RTF和AtActin-RTR(表1),反应在ABI 7300实时定量PCR仪上进行。
1.7 转基因拟南芥的耐镉性试验
1.7.1 种子萌发试验 为了分析不同浓度镉离子胁迫对拟南芥种子发芽率的影响,将收获的转基因拟南芥T3代种子和野生型拟南芥种子经体积分数为75%的乙醇消毒后,挑选均匀饱满的种子各20粒,播种在含不同氯化镉浓度(0,0.5,1.0,1.5,2.0,2.5,3.0,3.5,4.0,5.0,6.0 mmol·L-1)的1/2MS的固体培养基上,4℃处理2 d,之后置于23℃,16 h光照/8 h黑暗条件下培养。以胚根突破种皮0.5 mm为萌发标准,每天观察种子萌发情况,统计萌发数。随后选择氯化镉浓度为1.5 mmol·L-1和2.0 mmol·L-1,处理方法同上,每天统计萌发数,分析处理后第7天统计发芽率[18],发芽率=(供试种子的发芽数/供试种子)×100%。
1.7.2 镉胁迫条件生理试验 转基因拟南芥种子的处理方法同上,在培养基中培养12 d后,移栽至营养土中培养40 d,用含2 mmol·L-1氯化镉的Hoagland浸泡转基因拟南芥和野生型拟南芥,以未经处理的转基因拟南芥和野生型拟南芥为对照,测定处理1,3,6 d后拟南芥叶片的生理指标:超氧化物歧化酶(SOD)活性采用四氮唑蓝(NBT)光还原法测定[19];质膜相对透性用DDS-11A型电导率仪测定[20]。
2 结果与分析
2.1 东南景天SaFer基因cDNA及DNA序列分析
对从东南景天cDNA文库中筛选出的铁蛋白基因序列进行生物信息学分析,确认其为全长cDNA序列,将其命名为SaFer(登录号为KF850427),cDNA长为1 117 bp,含有1个759 bp的开放读码框,5′UTR长73 bp,3′UTR长285 bp,编码252个氨基酸。根据SaFer基因cDNA序列设计特异性引物,以东南景天基因组DNA为模板分离到了SaFer基因组序列,长为1 702 bp(登录号为KF850428)。序列比对发现,东南景天SaFer基因含有7个内含子,长度与位置分别为104 bp(376~479 bp),67 bp(564~ 630 bp),80 bp(692~771 bp),446 bp(860~1 305 bp),99 bp(1 368~1 466 bp),81 bp(1 533~ 1 613 bp)和66 bp(1 686~1 751 bp)(图1)。将东南景天SaFer与部分植物蛋白质序列进行比对与亲缘关系分析发现(图2),SaFer与苹果Malus domestica的同源性最高(76%),而与拟南芥的同源性最低(65%)。

图1 SaFer基因组结构Figure 1 Gene structure of SaFer

图2 SaFer与其他植物Ferritin的进化关系Figure 2 Phylogenetic tree besed on Ferritin of Sedum alfredii and other species
2.2 SaFer基因在东南景天根部的表达分析
将提取的根部总RNA经反转录后利用qRT-PCR分析SaFer基因的表达情况。从图3可以看出SaFer基因在东南景天胁迫12 h时表达量最高,为对照的8.5倍,24 h急剧下降至对照的2.0倍,之后随着胁迫时间的增加,表达量缓慢上升。
2.3 转基因植株的鉴定
提取转基因阳性植株和野生型拟南芥叶片的DNA,以SaFer基因的特异引物进行PCR反应,PCR产物电泳结果如图4所示,转基因阳性植株可以扩增出约750 bp的目的条带,而野生型拟南芥没有PCR产物(WT),选择其中2个转基因阳性株系命名为A1-1和A1-2。
提取拟南芥转基因阳性植株以及野生型植株的总RNA,反转录后利用qRT-PCR分析目的基因SaFer的表达情况,从图5可以看出东南景天SaFer基因在转基因拟南芥中的表达量远远高于野生型拟南芥,而在野生型拟南芥中未检测到其表达。
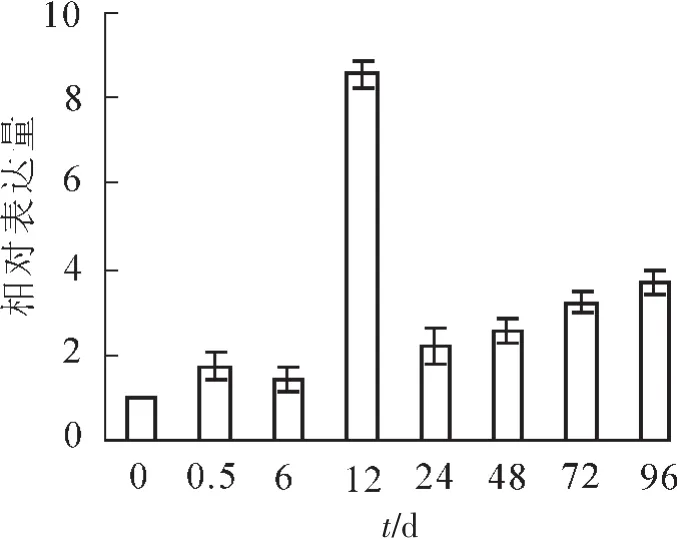
图3 不同胁迫时间SaFer基因的表达分析Figure 3 Expression levels of SaFer at different stress times
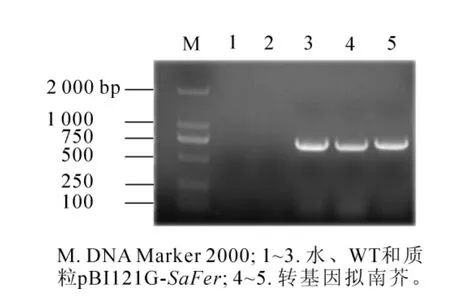
图4 转基因拟南芥的PCR检测Figure 4 PCR analysis of transgenic Arabdopsis thaliana
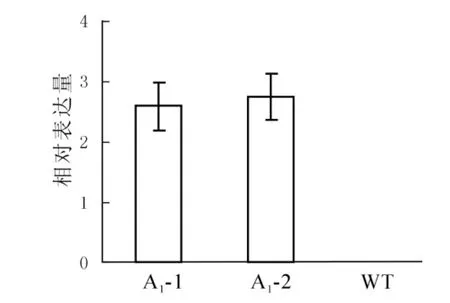
图5 转基因拟南芥的表达分析Figure 5 Expression levels of transgenic Arabidopsis thaliana
2.4 转基因拟南芥的镉抗性试验
2.4.1 拟南芥种子的萌发试验 为了解镉离子(Cd2+)胁迫对拟南芥种子萌发的影响,需要确定合适的镉处理浓度。实验用不同浓度氯化镉处理转基因拟南芥种子和野生型拟南芥种子,观察其萌发的情况。如图6所示,Cd2+处理抑制拟南芥种子萌发,且不同浓度的Cd2+对拟南芥种子萌发率的抑制作用差异显著。在Cd2+浓度为0.5 mmol·L-1时拟南芥种子的萌发率与对照差别不大,随着Cd2+浓度的增加萌发率下降,到2.0 mmol·L-1明显下降,说明拟南芥种子对1.5和2.0 mmol·L-1的Cd2+浓度比较敏感,并且转基因种子萌发率均高于野生型。胁迫条件下种子发芽率可以反应转基因植株的抗逆性。从图7可见:处理前,野生型和转基因拟南芥A1-1和A1-2的种子发芽率差异不显著,而当Cd2+浓度为1.5和2.0 mmol·L-1时,野生型种子的萌发率分别是18%和11%,而转基因株系平均发芽率分别为79%和67%,显著高于野生型(P<0.005)。
2.4.2 生理指标的测定 超氧化物歧化酶(SOD)是一种清除超氧阴离子自由基的酶。镉胁迫会引起活性氧在植物中过量积累。从图8可以看出:野生型拟南芥和转基因拟南芥在无胁迫处理时SOD酶活性基本一致,野生型拟南芥的SOD活性为405.2×16.67 nkat·g-1,转基因拟南芥SOD活性平均为421.3× 16.67 nkat·g-1,胁迫处理1,3,6 d后,所有植株的SOD活性均上升,野生型拟南芥中的SOD活性分别上升至483.7,522.8和561.5×16.67 nkat·g-1,分别比处理前上升了19.4%,29%和38.6%,而转基因拟南芥中SOD酶的活性则上升至565,608.7和666.2×16.67 nkat·g-1,同比上升了34.2%,44.6% 和58.2%。虽然两者的SOD活性镉胁迫后都呈增加的趋势,但转基因拟南芥的SOD活性增加幅度明显高于野生型拟南芥,说明SaFer基因表达提高了转基因拟南芥铁离子螯合能力,增加SOD活性来清除过氧化物的伤害,进而提高植物对镉胁迫的耐受能力。当植物受到逆境影响时,细胞膜遭到破坏,膜透性增大,从而使细胞内的电解质外渗,导致电导率增大,膜透性变化的程度可以反应植物抗逆性的强弱。如图9所示:在未处理情况下野生型拟南芥电导率为0.086 S·m-1,转基因拟南芥电导率为0.088 S·m-1,两者基本相似。胁迫1,3,6 d后,野生型拟南芥叶片电导率分别上升至0.116,0.183和0.245 S·m-1,比处理前分别上升了35.2%,112.9%和185.2%,转基因拟南芥电导率分别上升至0.01,0.12和0.171 S· m-1,同比分别上升了13.9%,37.9%和94.5%。野生型拟南芥的叶片电导率增加幅度大于转基因拟南芥。这表明镉胁迫对转基因拟南芥叶片的伤害低于野生型拟南芥,从而说明SaFer基因表达增强了转基因拟南芥对镉胁迫的抗性。
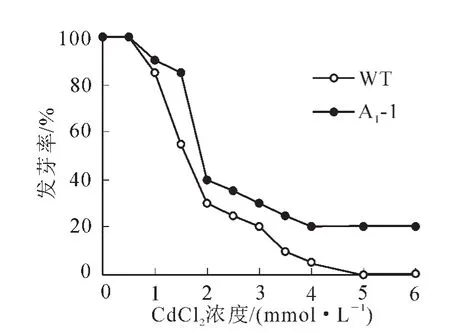
图6 不同浓度镉离子(Cd2+)胁迫下转基因与野生型拟南芥种子发芽率Figure 6 Germination rate of transgenic and wild type Arabidopsis thliana seeds under the stress of different concentrations Cd2+
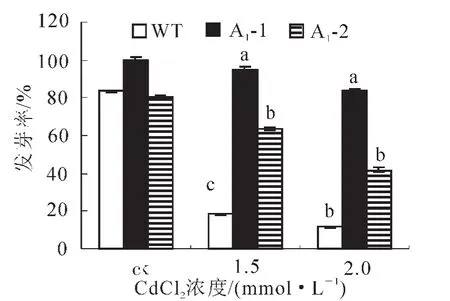
图7 不同浓度镉离子(Cd2+)胁迫下转基因与野生型拟南芥种子发芽率Figure 7 Germination of transgenic and wild type Arabidopsis thliana seeds under the stress of Cd2+
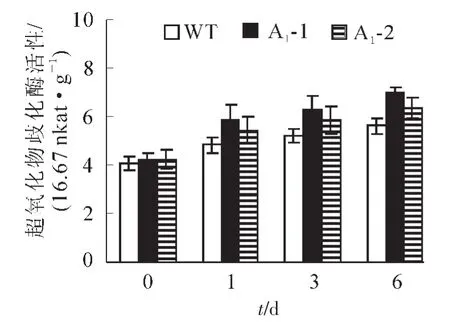
图8 胁迫前后不同拟南芥株系叶片SOD变化Figure 8 SOD activity in Arabidopsis thliana leaf under Cd2+stress
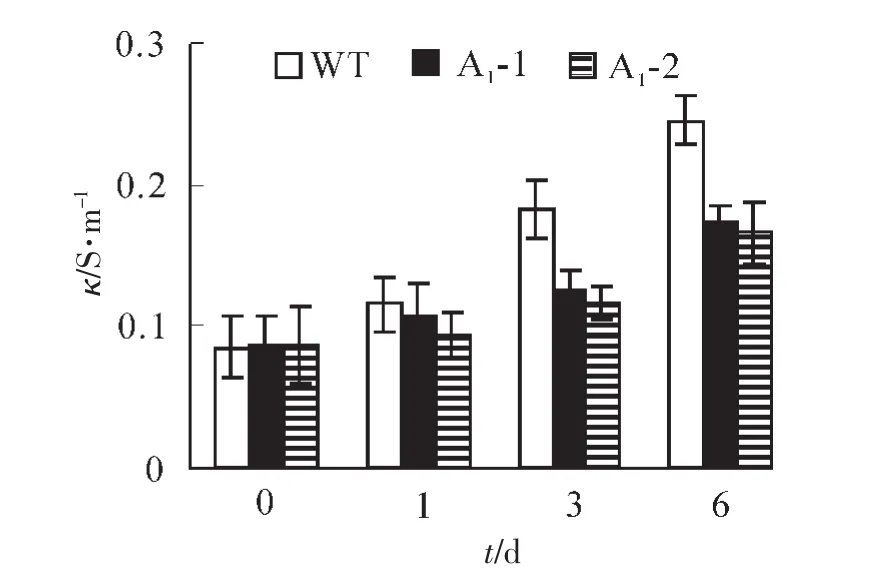
图9 胁迫前后不同拟南芥株系叶片电导率的变化Figure 9 Conductivity in Arabidopsis thliana leaf under Cd2+stress
3 讨论
随着社会工业化的迅猛发展,含有重金属的污染物大量排放,严重污染生态环境和农田土壤,导致重金属离子从土壤和水体中进入植物体内,影响了植物的生长发育和产量,并通过食物链进入人体,危害健康,如何高效、绿色清除重金属污染已经成为国内外关注的热点问题。本研究以超积累植物东南景天耐镉相关基因SaFer为研究对象,通过生物信息学、荧光定量PCR以及转基因技术等方面初步分析了SaFer基因功能,为解析SaFer基因在东南景天镉超积累过程中的作用奠定基础。
目前在水稻Oryza sativa,苹果和萝卜Raphanus sativus等植物的研究中都发现Ferritin基因的表达能够提高转基因植物对重金属的耐受性[21]。本实验室利用拟南芥花序侵染法将SaFer基因转到拟南芥中,通过PCR和qRT-PCR证实了该基因已经整合到拟南芥基因组中并能在拟南芥中正常表达。qRT-PCR结果显示:镉胁迫处理后,根部中SaFer基因在镉胁迫12 h后表达量显著上调,为对照的8.5倍,24 h急剧下降至对照的2倍,后随胁迫时间延长表达量缓慢上升,推测该基因为中后期响应基因。将转基因株系和野生型拟南芥种子播种在含有不同镉离子(Cd2+)浓度处理的培养基中进行胁迫处理,分析发现SaFer基因可以提高转基因拟南芥的耐镉能力。Goto等[22]推测可能是因为铁蛋白不仅能结合植物体内游离的铁离子,而且能很容易地结合其他重金属离子,抵御氧化胁迫的引起的伤害。镉胁迫对拟南芥种子的萌发影响较大,随着镉离子(Cd2+)浓度升高,种子发芽率降低,但转基因拟南芥均高于野生型,并且当镉离子(Cd2+)浓度大于1.5 mmol·L-1时,萌发率明显下降。选择1.5 mmol·L-1和2.0 mmol·L-1的镉离子(Cd2+)浓度处理转基因和野生型拟南芥种子发芽率,结果显示:转基因拟南芥种子的发芽率明显高于野生型,达到显著性差异,说明转SaFer基因拟南芥种子具有较高的耐镉胁迫能力。环境胁迫会使植物体内积累过量的超氧负离子和过氧化物,这些物质会破坏细胞膜结构,损伤细胞,胁迫处理后转基因植株的生理生化变化能反应植株抗逆能力的强弱。用2.0 mmol·L-1氯化镉胁迫转基因和野生型拟南芥,初步测定拟南芥的生理生化指标,分析结果表明:随着胁迫时间的延长,镉对拟南芥的伤害越严重。转基因和野生型拟南芥的超氧化物歧化酶(SOD)活性均随胁迫时间的延长而增大,但转基因株系的增长幅度均高于野生型;叶片电导率也随胁迫时间的延长而增大,但野生型的上升幅度明显高于转基因。说明转基因拟南芥能更多地清除过氧化物的伤害,抵御镉离子对细胞膜的破坏,从而维持细胞膜结构的完整性,比野生型拟南芥有更高的镉耐受性,这与秦天才等[23]的分析表现出类似的结果。
[1] WATANABE M E.Phytoremeditation on the brink of Commercialization[J].Environ Sci Technol,1997,31(4):182 -186.
[2] BAKER A J M,REEVES R D,HAJAR A S M.Heavy metal accumulation and tolerance in British populations of the metallophyte Thlaspi caerulescens J.&C.Presl(Brassicaceae)[J].New Phytol,1994,127(1):61-68.
[3] SHEN Zhenguo,ZHAO F J,McGRATH S P.Uptake and transport of zinc in the hyperaccumula tor Thlaspi caerulescens and the non-hyperaccumulator Thlaspi ochroleucum[J].Plant Cell Environ,1997,20(7):898-906.
[4] LASAT M,BAKER A J M,KOCHIAN L V.Physiological characterization of root Zn2+absorption and translocation to shoots in Zn hyperaccumulator and nonaccumulator species of Thlaspi[J].Plant Physiol,1996,112(4):1715-1722.
[5] LASAT M M,BAKER A J M,KOCHIAN L V.Altered Zn compartmentation in the root symplasm and stimulated Zn absorption into the leaf as mechanisms involved in Zn hyperaccumulation in Thlaspi caerulescens[J].Plant Physiol, 1998,118(3):875-883.
[6] BERT V,MACNAIR M R,DELAGUERIE P,et al.Zinc tolerance and accumulation in metallicolous and nonmetallicolous populations of Arabidopsis halleri(Brassicaceae)[J].New Phytol,2000,146(2):225-233.
[7] BERT V,BONNIN I,SAUMITOU-LAPRADE P,et al.Do Arabidopsis halleri from nonmetallicolous populations accumulate zinc and cadmium more effectively than those from metallicolous populations?[J].New Phytol,2002,155 (1):47-57.
[8] YANG Xiao’e,LONG Xinxian,NI Wuzhong,et al.Sedum alfredii H.:a new Zn hyperaccumulating plant first found in China[J].Chin Sci Bull,2002,47(19):1003-1006.
[9] YANG Xiaoe,LONG Xinxian,YE Haibo,et al.Cadmium tolerance and hyperaccumulation in a new Znhyperaccumulating plant specie(Sedum alfredii Hance)[J].Plant Soil,2004,259(1):181-189.
[10] LONG Xinxian,YANG Xiaoe,YE Zhengqian,et al.Differences of uptake and accumulation in four species of Sedum [J].Acta Bot Sin,2002,44(2):152-157.
[11] 徐晓晖,郭泽建,程志强,等.铁蛋白基因的水稻转化及其功能初步分析[J].浙江大学学报:农业与生命科学版,2003,29(1):49-54. XU Xiaohui,GUO Zejian,CHENG Zhiqiang,et al.Analysis of rice transformation and the function of Ferritin gene [J].J Zhejiang Univ Agric Life Sci,2003,29(1):49-54.
[12] BRIAT J F.Roles of ferritin in plants[J].J Plant Nutr,1996,19(8/9):1331-1342.
[13] DEÁK M,HORVÁTH G,DAVLETOVA S,et al.Plants ectopically expressing the iron binding protein,ferritin,are tolerant to oxidative damage and Pathogens[J].Nat Biotechnol,1999,17(2):192-196.
[14] THEIL E C,Ferritin:structure,gene regulation,and cellular function in animals,plants,and microoganisms[J]. Annu Rev Biochem,1987,56:289-315.
[15] 王关林,方红筠.植物基因工程[M].2版.北京:科学出版社,2002:744.
[16] LIVAK K J.SCHMITTGEN T D.Analysis of relative gene expression data using real-time quantitative PCR and the 2(-Delta Delta C(T))method[J].Methods,2001,25(4):402-408.
[17] 杨靓,纪巍,朱延明.渗透胁迫相关基因高通量筛选技术体系的建立[J].中国生物工程杂志,2008,28(6):60-64. YANG Liang,JI Wei,ZHU Yanming.Establishment of genes related to osmotic stress technique of high throughput screening system[J].China Biotechnol,2008,28(6):60-64.
[18] 何俊瑜,任艳芳,任明见,等.镉对不同小麦品种种子萌发的影响[J].中国农学通报,2009,25(10):235-240. HE Junyu,REN Yanfang,REN Mingjian,et al.Effects of cadmium on seed germination of different wheat varieties [J].Chin Agric Sci Bull,2009,25(10):235-240.
[19] GIANNOPOLITIS C N,RIES S K.Superoxide dismutases(Ⅰ)Occurrence in higher plants [J].Plant Physiol,1977, 59(2):309-314.
[20] FAN Lu,ZHENG Suqing,WANG Xumin.Antisense suppression of phospholipase D alpha retards abscisic acid-ethylene-promoted senescence of postharvest Arabidopsis leaves[J].Plant Cell Online,1997,9(12):2183-2196.
[21] 贺晓燕.萝卜镉胁迫响应相关基因克隆及其表达分析[D].南京:南京农业大学,2011. HE Xiaoyan.Radish Cd Stress Response Related Gene Cloning and Expression Analysis[D].Nanjing:Nanjing Agricultural University,2011.
[22] GOTO F,YOSHIHARA T,SHIGEMOTO N,et al.Iron fortification of rice seed by the soybean ferritin gene[J].Nat Biotechnol,1999,17(3):282-286.
[23] 秦天才,阮捷,王腊娇.镉对植物光合作用的影响[J].环境科学与技术,2000(增刊):33-44. QIN Tiancai,RUAN Jie,WANG Lajiao.Effects of cadmium on plant photosynthesis[J].Environ Sci Technol,2000 (supp):33-44.
Isolation and expression of a cadmium-resistant gene(SaFer)from Sedum alfredii
ZHAO Ting1,2,3,HAN Xiaojiao2,3,LIU Mingying2,3,QIAO Guirong2,3,JIANG Jing2,3, JIANG Yancheng1,ZHUO Renying2,3
(1.Department of Biology and Technology,Xinjiang University,Urumqi 830046,Xinjiang,China;2.The Research Institute of Subtropical Forestry,Chinese Academy of Forestry,Fuyang 311400,Zhejiang,China;3.State Key Laboratory of Tree Genetics and Breeding,Chinese Academy of Forestry,Beijing 100091,China)
Abiotic stress was a Serious problem that affect plants growth and products.In plants,ferritin is a special iron storage protein closely related to stress.A cDNA from the Sedum alfredii cDNA library,designated as SaFer,was isolated and analyzed by homologous analysis and by Real-Time Reverse Transcription-PCR (qRT-PCR).Then,cadmium-stress experiments were conducted to compare transgenic Arabidopsis thaliana overexpressed SaFer to a wild type.Results showed that SaFer cDNA was 1 117 bp long with an opening reading frame (ORF)of 759 bp.The ORF of SaFer encoded a polypeptide of 252 amino acids with a calculated molecular weight of about 27.8 kDa,and the homologous analysis showed that it was most closely related to ferritin of Malus domestica with 76%identities.The length of the genomic sequence of SaFer was 1 702 bp and contained 7 introns.Expression profiles in roots were analyzed by qRT-PCR and the results showed that the transcription level of SaFer was enhanced after 12 h cadmium stress.Transgenic Arabidopsis thaliana overexpressing SaFer displayed much higher Cd tolerance than the wild type which was further supported by physio-logical indexes such as SOD activity and electric conductivity.The results showed that SaFer could provide a glimpse into S.alfredii cadmium-tolerance and could contribute to the breeding of cadmium-tolerant plants. [Ch,9 fig.1 tab.23 ref.]
botany;Sedum alfredii;ferritin;cadmium stress;expression change
S718.3;Q943.2
A
2095-0756(2015)01-0025-08
浙 江 农 林 大 学 学 报,2015,32(1):25-32
Journal of Zhejiang A&F University
10.11833/j.issn.2095-0756.2015.01.004
2014-03-01;
2014-04-14
国家自然科学基金资助项目(31200465);国家高技术研究发展计划(“863”计划)项目(2013AA102701-3)
赵婷,从事植物分子生物学研究,E-mail:1458373105@qq.com。通信作者:卓仁英,研究员,博士,从事植物抗逆分子生物学研究,E-mail:zhuory@gmail.com;姜彦成,副教授,从事分子生物学研究。E-mail:xjzkjyc@xju.edu.cn
