山核桃MADS-like基因的克隆与分析
2015-03-23侯传明郑雅文王正加徐英武
侯传明,郑雅文,王正加,徐英武
山核桃MADS-like基因的克隆与分析
侯传明,郑雅文,王正加,徐英武
(浙江农林大学 亚热带森林培育国家重点实验室培育基地,浙江 临安 311300)
MADS-box基因在植物花发育的整个阶段起到了极为关键的作用。根据山核桃 Carya cathayensis雌花芽454测序得到的基因片段,采用cDNA末端快速扩增(RACE)技术,获得了1条CcMADS-like基因。序列分析结果表明:CcMADS-like开放阅读框(ORF)长度为609 bp,编码202个氨基酸,具有典型的MADS-box结构域,包括高度保守的MADS盒和K区以及I区、C区。CcMADS-like与拟南芥Arabidopsis thaliana,金鱼草Antirrhinum majus,美洲黑杨Populus deltoides,欧洲大叶杨Populus trichocarpa等的同源基因所编码的蛋白质同源性分别达到48%,65%,69%,71%。山核桃不同组织实时荧光定量聚合酶链式反应(qRT-PCR)结果表明:CcMADS-like基因在花芽中表达量远远高于其他组织,暗示该基因极有可能参与山核桃成花发育。酵母单杂交实验表明,CcMADS-like蛋白具有转录激活活性。图5表1参25
经济林学;花发育;山核桃;MADS-box;基因克隆;qRT-PCR;酵母单杂交实验
开花是高等植物由营养生长向生殖生长的一个重要生理转变过程,既受外界环境因素的影响,又受内在基因的调控,其中 MADS-box基因在花的发育过程中起着重要的作用。MADS由酿酒酵母Saccharomyces cerevisiae的MCM1,拟南芥Arabidopsis thaliana的AGAMOUS,金鱼草Antirrhinum majus 的DEFICIENS和人类Homo sapiens的SRF等4种蛋白因子的首写字母构成[1]。MADS基因有2个主要谱系:TypeⅠ型和TypeⅡ型。大多数植物序列和动物的MEF2型基因共同形成Ⅱ型谱系[2]。植物中的MADS-box基因具有相似的内含子和外显子结构,MADS转录因子主要由MADS盒、K盒、I区、C末端等4个部分组成[3-4]。MADS-box基因所编码的蛋白为MADS-box转录因子,以二聚体化的形式通过其保守结构域与特定的DNA序列相结合来调控下游基因的表达[5-6]。MADS基因几乎参与植物成花的所有途径[7],形成复杂的网络控制植物成花,其调控成花机制有著名的ABC模型[8-9],随着矮牵牛 Petunia hybrida FBP7和FBP11基因[10]和拟南芥SEP3基因[11]的克隆鉴定,最终得到植物花形态建成的新模型:四分子模型[12]。该模型认为,同源或异源MADS转录因子形成四聚蛋白调控复合体,四聚体结合在目标基因启动子区调节基因开闭,进而调控花发育[13]。构成四聚体的2个二聚体单位(同源二聚体或者异源二聚体)特异地结合在DNA相邻的CArG-box(5′-CC[A/T]6GG-3′)上[14],通过C末端结合形成四聚体,致使DNA分子弯曲靠近,然后通过激活或抑制靶基因表达进而调控花器官发育。山核桃Carya cathayensis,雌雄同株,雌雄花器官发生发育的时间和部位不同,具有单性花成花时空表达特异性[15-16]。本研究在山核桃雌花芽转录组454测序鉴定出114个可能的成花基因基础上[16],首次克隆得到了山核桃相关MADS基因,并进行基本生物信息学分析,采用荧光定量聚合酶链式反应(qRT-PCR)研究它在不同组织的表达差异,采用酵母单杂交方法验证其转录因子的功能,为进一步阐明该基因在山核桃成花的过程和机制奠定一定的理论基础。
1 材料与方法
1.1 植物材料
实验所用材料为浙江省临安市板桥镇罗塘村,海拔50~200 m的西南—西北向阳山坡上正常生长发育的野生山核桃植株。山核桃雌花芽从3月初开始分化到4月完成授粉;雄花芽在5-6月发育,然后进入休眠期[17]。故分别采集3-4月的雌花芽和5-6月的雄花芽以及同期根、茎、叶、营养芽,所取样品马上用液氮保存,回实验室放置-80℃冰箱备用。
1.2 RNA提取检测和cDNA合成
将采集的山核桃雌雄花芽样品混合,采用改良的十六烷基三甲基溴化铵+核糖核酸(RNA)裂解液(CTAB+Trizol)法提取总核糖核酸(RNA),以10.0 g·kg-1琼脂糖凝胶对各样品的RNA进行电泳和NanoDrop-1000测吸光度值相结合,检测样品RNA的质量。根据cDNA Synthesis Kit(Takara)说明书以已检测过的总RNA为模板合成cDNA的第1条链,进而合成cDNA。
1.3 CcMADS-like基因克隆
根据山核桃3月初到7月初不同阶段的雌花芽混合样454测序[16]所获得的基因片段,在美国国家生物技术信息中心(NCBI)序列同源比对后设计cDNA末端快速扩增技术(RACE)引物,3′RACE第1轮引物为3GSP1,第2轮引物为3GSP2;5′RACE第1轮引物为5GSP1,第2轮引物为5GSP2(表1)。依照5′-Full RACE Kit with TAP和3′-Full RACE Core Set with PrimeScript RTase(Takara)分别进行3′RACE和5′RACE。根据RACE结果设计开放阅读框(ORF)引物F1和R1(表1),由生工生物工程(上海)股份有限公司合成。以山核桃雌雄花芽混合样cDNA为模板,聚合酶链式反应(PCR)扩增目的条带;10.0 g·kg-1琼脂糖凝胶电泳,DNA Gel Extraction Kit(生工生物)回收目的片段,连接到pMD-19T Sample Vector (TaKaRa)上,42℃热激法转化大肠埃希菌Escherichia coli DH5α,蓝白斑筛选,挑取阳性单克隆,摇菌过夜,Plasmid Mini-Preps Kit(生工生物)提取质粒,酶切鉴定的阳性样品送到中国上海生工生物工程服务有限公司测序。
1.4 CcMADS-like基因序列分析
测序结果在NCBI网站上进行BLAST比对,用DNAMAN软件进行序列氨基酸编辑和多序列比对,结合MEGA5.2软件采用Neighbor-Joining(NJ)分析方法构建系统进化树。
1.5 qRT-PCR分析
分别以山核桃根、茎、叶、营养芽、混合花芽提取的总RNA反转录的cDNA为模板,应用ABI-7500定量PCR(real-time PCR)仪对CcMADS-like在根、茎、叶、营养芽、花芽等不同组织的表达进行定量分析,每种组织模板进行3次生物学重复实验。所用引物为RT1和RT2。以本课题组设计的山核桃Actin基因为内参,内参引物序列为:Actin1和Actin2(表1)。
1.6 CcMADS-like转录激活活性验证
设计引物(表1),PCR扩增获得CcMADS-like的全长ORF,TINY2[18]CDS全长。BamHⅠ/ EcoRⅠ酶切凝胶电泳后回收,连接入克隆入酵母表达载体pGBKT7(GAL4-BD)(Clotech),热激转化入大肠埃希菌DH5α中,阳性单克隆经双酶切及测序确定序列正确性。以LiAc高效转化法制备酵母感受态AH109,采用PEG3350/DMSO法将pGBKT7-X转化入现制感受态。梯度稀释后涂布于-Trp/SD单缺培养基,28℃培养2~3 d至菌落d=2~3 mm,挑取阳性单克隆反复冷热处理破壁后,进行菌落PCR检测。其中pGBKT7为阴性对照,pGBKT7-TINY2为阳性对照。检测得到的阳性单克隆点滴法5.0 μL于含有X-α-Gal(clotech)的SD/-Trp培养基上,28℃培养观察。

表1 实验所用引物Table 1 Primer sequences used in experiment
2 结果与分析
2.1 CcMADS-like基因克隆和序列分析
根据山核桃花芽454测序得到的基因片段设计RACE引物,以混合花芽的cDNA为模板3′RACE扩增得到了650 bp的片段,5′RACE扩增得到了350 bp的片段,将5′RACE和3′RACE获得的序列进行拼接,结果表明:该基因ORF长度为609 bp,含有TAA终止密码子,编码202个氨基酸(图1)。经过 Blastp比对分析表明,该蛋白具有典型的MADS-box结构域,M区与MEF2-like蛋白高度一致,以此确定该基因属于TypeⅡ MADS家族基因,是MIKC型MADS蛋白(图1)。多序列比对发现M区(编码58个氨基酸)具有高度的保守性,K区(编码87个氨基酸)也有较高的保守性(图2),与欧洲大叶杨Populus trichocarpa XP_002321711.1,美洲黑杨Populus deltoids ABV23568.1, 金鱼 草 Antirrhinum majus CAC44080.1, 拟南芥 Arabidopsis thaliana NP_182090.1同源蛋白的一致性(identity)分别为71%,69%,65%,48%。在NCBI查找已经鉴定的其他物种同源序列,经ClustalX比对后,用MEGA5.2构建系统发育树(图3)。结果显示:CcMADS-like与欧洲大叶杨Populus trichocarpa XP_002321711.1和美洲黑杨Populus deltoids ABV23568.1关系最近,与芥菜Brassica juncea AFM77893.1和欧洲油菜Brassica napus AFH41826.1关系较远。

图1 CcMADS-like序列和功能结构分析Figure 1 Nucleotide sequence and function structural domain analysis of CcMADS-like

图2 CcMADS-like和其他物种MADS蛋白氨基酸序列间的同源性比对Figure 2 Alignment of amino acid sequence of MADS genes from different plants
2.2 CcMADS-like在不同组织中的表达分析
CcMADS-like不同组织qRT-PCR结果显示:CcMADS-like在根和茎中几乎没有检测到表达;在叶、营养芽、花芽中均有表达,但表达量存在较大差异;在花芽中的表达量远远大于其他组织(图4)。
2.3 CcMADS-like转录激活功能分析
转化有重组质粒pGBKT7-TINY2,pGBKT7-CcMADS-like,pGBKT7的酵母AH109在单缺板上生长良好,单克隆的菌落PCR检测也表明重组质粒成功转化入酵母菌株(图5)。在含有X-α-Gal的选择培养基上,3种转化菌株均有良好单菌落生长;pGBKT7-CcMADS-like和pGBKT7-TINY的酵母菌落呈明显蓝色;pGBKT7的酵母菌落没有蓝色表现(图5)。这说明CcMADS-like的确具有转录激活活性。

图3 基于MADS基因氨基酸序列构建的系统进化树分析Figure 3 Phylogenetic analysis based on the amino acid sequence of MADS-box genes
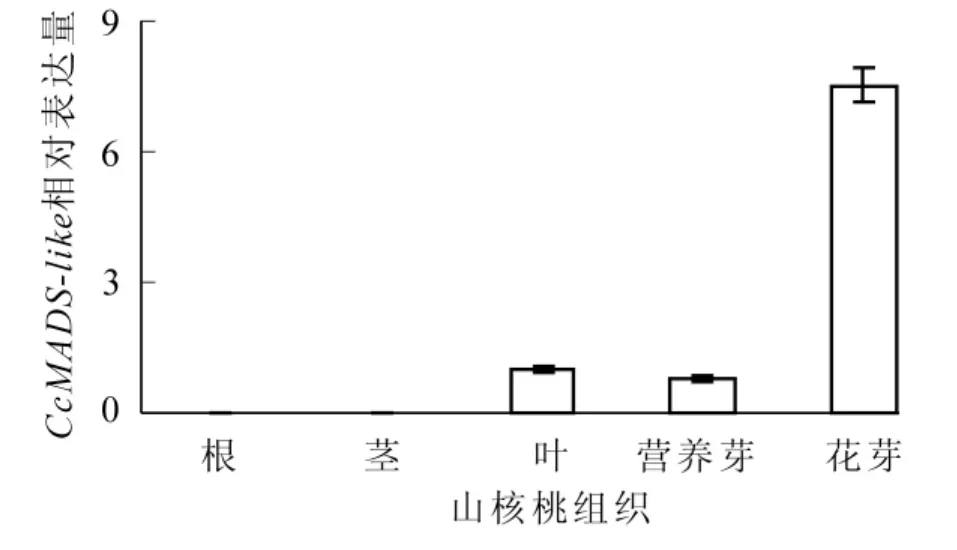
图4 CcMADS-like在不同组织中的表达分析Figure 4 Relative expression of CcMADS-like in the root,stem, leaf,vegetative budsand floralbuds ofCarya cathayensis

图5 CcMADS-like转录激活功能分析Figure 5 PCR test and yeast one-hybrid assay of CcMADS-like
3 讨论
MADS-box基因家族广泛参与植物成花的各种途径和不同时期,是植物成花的主要内因。其编码的蛋白,即MADS转录因子,以二聚化的形式通过其保守结构域与特定的DNA序列相结合来调控基因的表达。作为转录因子,MADS蛋白的结构具备转录因子的普遍特性,即含有DNA结合结构域和激活结构域。典型的MIKC型MADS-box主要由MADS盒、K盒、I区、C末端等4个部分组成。MADS盒是DNA结合单元[19];K盒是植物MADS转录因子的特征序列,也是发生二聚体化的结构基元[20];I区帮助二聚体的转录因子与DNA结合形成复合体;C末端是富含疏水残基的非保守区域。本实验克隆得到的CcMADS-like的M区与MEF2-like蛋白高度一致(图1),故确定为植物TypeⅡ型MADS家族成员,因为植物TypeⅠMADS蛋白的M区与ARG80/SRF-like高度相似,且植物TypeⅠMADS蛋白的K区保守性较差,序列变化多样[21-22]。实验所得CcMADS-like基因具有典型的TypeⅡ型MIKC结构分区[2],多序列比对表明其具有高度保守的MADS盒和保守性较高的K区,这与其转录因子结合DNA和行使转录作用的功能相互佐证。同时也证明了M区和K区在MADS-box基因家族进化过程中保持着极高的稳定性,是MADS转录因子功能的重要执行结构。进化树分析表明,CcMADS-like与金鱼草Antirrhinum majus DEFH7和葡萄Vitis vinifera MADS6距离较近,而距离最近的美洲黑杨也疑似属于DEFH7家族[23],因此初步断定实验得到的CcMADS-like属于DEFH7基因亚家族成员。研究表明:DEFH7基因家族根据进化分析属于TM8家族[2,24]。然而,目前对TM8家族的功能所知甚少,拟南芥中尚未发现TM8家族成员,也没有功能缺陷植株表型的描述。现在可以确定的是TM8家族属于植物MIKC型MADS-box基因;葡萄中表达水平检测表明,TM8成员在成花过程中发挥重要功能[25]。MADS-box基因广泛参与植物的整个生命活动过程,尤其是植物成花过程。实时定量PCR在根、茎中未检测到明显CcMADS-box表达,但在叶、叶芽、花芽中检测到表达,尤其在花芽中表达含量比其他组织高约7~10倍,表现出明显的组织特异性,暗示着CcMADS-like与花器官发育有着密切联系,但具体功能机理则可能需要对该基因在花芽发育的不同阶段和不同花器官表达量来确定。转录激活活性是转录因子的重要功能特征。以酵母单杂交实验对山核桃CcMADS-like转录激活活性进行验证,结果表明:CcMADS-like可以有效地激活酵母菌株中的下游报告基因,说明CcMADS-like与其他MADS蛋白一样,确实具有转录激活功能。当然,要揭示CcMADS-like在山核桃成花过程中的功能机制,还有待于转基因等方面的进一步功能验证。
[1] SOMMER H,BELTRAN J P,HUIJSER P,et al.Deficiens,a homeotic gene involved in the control of flower morphogenesis in Antirrhinum majus:the protein shows homology to transcription factors[J].EMBO J,1990,9(3):605-613.
[2] BECKER A,THER茁EN G.The major clades of MADS-box genes and their role in the development and evolution of flowering plants[J].Mol Phylogenet Evol,2003,29(3):464-489.
[3] 周佳平,林新春,徐英武.拟南芥SEPALLATA3蛋白质原核表达与纯化[J].浙江农林大学学报,2014,31 (1):14-18. ZHOU Jiaping,LIN Xinchun,XU Yingwu.Arabidopsis thaliana SEPALLATA3 protein in a prokaryotic system[J].J Zhejiang A&F Univ,2014,31(1):14-18.
[4] 朱龙飞,徐英武,林新春.绿竹花发育相关基因BoAP3的克隆与分析[J].浙江农林大学学报,2013,30(6):839-842. ZHU Longfei,XU Yingwu,LIN Xinchun.Cloning and analysis of flowering-related gene,BoAP3,in Bambusa oldhamii [J].J Zhejiang A&F Univ,2013,30(6):839-842.
[5] EGEA-CORTINES M,SAEDLER H,OMMER H.Ternary complex formation between the MADS-box proteins SQUAMOSA,DEFICIENS and GLOBOSA is involved in the control of floral architecture in Antirrhinum majus[J]. EMBO J,1999,18(19):5370-5379.
[6] HONMA T,GOTO K.Complexes of MADS-box proteins are sufficient to convert leaves into floral organs[J].Nature, 2001,409(6819):525-529.
[7] KOORNNEEF M,ALONSO-BLANCO C,PEETERS A J M,et al.Genetic control of flowering time in Arabidopsis [J].Annu Rev Plant Physiol Plant Mol Biol,1998,49(1):345-370.
[8] WEIGEL D,MEYEROWITZ E M.The ABCs of floral homeotic genes[J].Cell,1994,78(2):203-209.
[9] MA Hong,PAMPHILIS C.The ABCs of floral evolution[J].Cell,2000,101(1):5-8.
[10] COLOMBO L,FRANKEN J,KOETJE E,et al.The petunia MADS box gene FBP11 determines ovule identity[J]. Plant Cell,1995,7(11):1859-1868.
[11] PELAZ S,DITTA G S,BAUMANN E,et al.B and C floral organ identity functions require SEPALLATA MADS-box genes[J].Nature,2000,405(6783):200-203.
[12] THEI茁EN G,SAEDLER H.Plant biology:floral quartets[J].Nature,2001,409(6819):469-471.
[13] THEI茁EN G.Development of floral organ identity:stories from the MADS house[J].Curr Opin Plant Biol,2001,4 (1):75-85.
[14] TREISMAN R.Inside the MADS box[J].Nature,1995,376(6540):468-469.
[15] WANG Zhengjia,HUANG Jianqin,HUANG Youjun,et al.Cloning and characterization of a homologue of the FLORICAULA/LEAFY gene in hickory(Carya cathayensis Sarg.)[J].Plant Mol Biol Rep,2012,30(3):794-805.
[16] HUANG Youjun,LIU Lili,HUANG Jianqin,et al.Use of transcriptome sequencing to understand the pistillate flowering in hickory(Carya cathayensis Sarg.)[J].BMC Genom,2013,14(1):691.doi:10.1186/1471-2164-14-691.
[17] 杨希宏,黄有军,黄坚钦,等.山核桃FLC同源基因鉴定与表达分析[J].浙江农林大学学报,2013,30(1):1-8. YANG Xihong,HUANG Youjun,HUANG Jianqin,et al.Identification and expression of FLOWERING LOCUS Chomologous genes in Carya cathayensis[J].J Zhejiang A&F Univ,2013,30(1):1-8.
[18] WEI Gang,PAN Yi,LEI Juan,et al.Molecular cloning,phylogenetic analysis,expressional profiling and in vitro studies of TINY2 from Arabidopsis thaliana[J].J Biochem Mol Biol,2005,38(4):440-446.
[19] SHORE P,SHARROCKS A D.The MADS-box family of transcription factors[J].Eur J Biochem,1995,229(1):1-13.
[20] KRIZEK B A,MEYEROWITZ E M.Mapping the protein regions responsible for the functional specificities of the Arabidopsis MADS domain organ-identity proteins[J].Proc Nat Acad Sci USA,1996,93(9):4063-4070.
[21] THEI茁EN G,KIM J T,SAEDLER H.Classification and phylogeny of the MADS-box multigene family suggest defined roles of MADS-box gene subfamilies in the morphological evolution of eukaryotes[J].J Mol Evol,1996,43(5): 484-516.
[22] KAUFMANN K,MELZER R,THEI茁EN G.MIKC-type MADS-domain proteins:structural modularity,protein interactions and network evolution in land plants[J].Gene,2005,347(2):183-198.
[23] 周祥明.美洲黑杨雄性花芽cDNA文库构建及花发育相关基因的克隆与鉴定[D].北京:北京林业大学,2007. ZHOU Xiangming.Construction of cDNA Library and Identification of Genes Involved in Floral Development in Male Floral Buds of Populus deltoids[D].Beijing:Beijing Forestry University,2007.
[24] HEIJMANS K,MOREL P,VANDENBUSSCHE M.MADS-box genes and floral development:the dark side[J].J Expl Bot,2012,63(15):5397-5404.
[25] DIAZ-RIQUELME J,LIJAVETZKY D,MARTINER-ZAPATER J M,et al.Genome-wide analysis of MIKC-type MADS.box genes in grapevine[J].Plant Physiol,2009,149(1):354-369.
第5届中国森林保护学术大会暨林业有害生物绿色防控国际研讨会召开
2014年10月28日至30日,由中国林学会主办的第5届中国森林保护学术大会暨林业有害生物绿色防控国际研讨会在浙江农林大学召开。来自全国各地从事森林保护科研、教学、管理和生产的专家学者300余人参加会议。
本届大会围绕会议主题:森林健康——林业有害生物绿色防控,对中国森林健康所面临的挑战和绿色防控等进行了广泛的讨论与学术交流。会议设国际研讨会、4个分段大会和青年学术沙龙等进行交流研讨。学术报告聚焦林业有害生物流行与生态控制,林业有害生物监测、预警及检疫,生物农药与绿色防控,林业有害生物基础理论等研究,全面反映了近年来中国森林保护学科研究的最新成果。
会议期间,举行了中国林学会森林病理学会分会理事会议。南京林业大学副校长叶建仁当选为分会理事会主任委员,浙江农林大学副校长张立钦当选为副主任委员。此次大会还为青年学者搭建了学术交流平台。大会评选出优秀学术报告14篇,其中一等奖2篇,二等奖4篇,三等奖8篇。
下届中国森林保护学术大会将由中南林业科技大学承办。
周湘
Cloning and analysis of a MADS-like gene in Carya cathayensis
HOU Chuanming,ZHENG Yawen,WANG Zhengjia,XU Yingwu
(The Nurturing Station for the State Key Laboratory of Subtropical Silviculture,Zhejiang A&F University,Lin’an 311300,Zhejiang,China)
MADS-box family genes play key roles in all phases of floral development.Based on a partial fragment acquired from 454 sequencing of Carya cathayensis (hickory)floral buds,a full-length of a MADS-like gene was obtained by rapid amplification of cDNA ends (RACE).Afterwards,a quantitative real-time (qRT)polymerase chain reaction (PCR)analysis,an amino acid sequence alignment,and a yeast one-hybrid assay were performed.Results of the sequence analysis revealed the open reading frame (ORF)of the Cc-MADS-like gene was 609 bp in length and encoded a protein of 202 aa.The protein presented typical characteristic of MADS-box family genes and contained MADS domain,I,K,and C,with the MADS domain was considerably conserved.The amino acid sequence alignment showed that the putative protein CcMADS-like gene had an identity to homologies of Arabidopsis thaliana (48%),Antirrhinum majus (65%),Populus deltoides(69%),and Populus trichocarpa(71%).The qRT-PCR analysis revealed that the expression level of CcMADS-like gene in flower buds was much higher than in other tissues.The yeast one-hybrid showed that the CcMADS-like gene had an activation activity as a transcription factor.Overall,the qRT-PCR analysis suggested that CcMADS-like gene possibly participated in floral development of hickory.[Ch,5 fig.1 tab.25 ref.]
cash forestry;floral development;Carya cathayensis;MADS-box;gene clone;qRT-PCR;yeast onehybrid
S664.1;S722.3
A
2095-0756(2015)01-0033-07
浙 江 农 林 大 学 学 报,2015,32(1):33-39
Journal of Zhejiang A&F University
10.11833/j.issn.2095-0756.2015.01.005
2014-03-10;
2014-04-20
国家高技术研究发展计划(“863”计划)项目(2013AA102605);国家重点基础研究发展计划(“973”计划)项目(2011CB111500);国家自然科学基金资助项目(31170637);浙江农林大学科研发展基金资助项目(2010FR072)
侯传明,从事植物分子生物学研究。E-mail:houchm0927@163.com。通信作者:徐英武,教授,博士,博士生导师,从事蛋白和药物结构生物学等研究。E-mail:yxu@zafu.edu.cn
