木腐真菌的鉴定及对不同木材的腐朽能力
2015-03-23骆静怡傅威锐潘程远
骆静怡,傅威锐,潘程远
木腐真菌的鉴定及对不同木材的腐朽能力
骆静怡,傅威锐,潘程远
(浙江农林大学 农业与食品科学学院,浙江 临安311300)
木腐真菌是一类木质纤维素的自然分解者,在生态系统的物质循环中发挥着重要角色。利用真菌子实体、菌落、菌丝体和分生孢子形态,结合内转录间隔区(ITS)和26S rDNA D1/D2区域序列,对环境中采集到的木腐真菌进行鉴定,并对分离鉴定到的真菌进行木质素酶和纤维素酶活性分析,以及木材侵染腐朽能力研究。通过鉴定,共分离得到 5种木腐真菌,分别是尖孢镰刀菌 Fusarium oxysporum,毛栓孔菌 Trametes hirsuta,层生镰刀菌Fusarium proliferatum,裂褶菌Schizophyllum commune和血红密孔菌Pycnoporus sanguineus。酶活分析表明:5种真菌均表现出较高的漆酶和锰过氧化物酶活性,但纤维素酶活性则普遍较低或不存在。利用质量损失法分析5种真菌对6种不同木材样品的生物降解能力,12周腐朽实验结果表明:毛栓孔菌的木材腐朽能力较强,造成对橡木Quercus mongolica最高的69.16%的质量损失率,而尖孢镰刀菌、层生镰刀菌和裂褶菌等的木材腐朽能力较弱,造成木材质量损失率普遍低于3.00%,血红密孔菌对不同木材的腐朽能力差异较大,可造成41.37%的橡木质量损失率,而对柚木Tectona grandis仅有2.20%。通过分析酶活性和木材腐朽结果可以得出,真菌木质纤维素酶活力和其木材腐朽能力不存在相关性,即较高的酶活力并不代表其具有较强的木材腐朽能力。图5表2参36
木材科学与技术;木腐真菌;鉴定;木质素酶;纤维素酶;木材腐朽
木腐真菌,即木材腐朽真菌,是一类能降解木质纤维素的生物体,作为生态系统中的分解者,在物质循环方面有着极为重要的作用。在中国,目前已分离鉴定到1 200余种木腐真菌[1-4]。按分类学地位,木腐真菌主要属于担子菌亚门 Basidiomycotina非褶菌目 Polyporales子囊菌门 Ascomycota盘菌纲Discomycetes和半知菌类的部分真菌[5]。从木材腐朽类型来看,木腐真菌可分为白腐真菌、褐腐真菌和软腐真菌,其中,白腐真菌为最主要的木材腐朽菌,约占已知种类的90%[6]。木腐真菌对木材的腐朽,源于其能分泌木质素酶和纤维素酶,将木材细胞壁中的木质纤维素降解成低分子的物质,并摄取这些物质作为养分和能源,供其生长和繁殖。不同种类的木腐真菌,其所分泌酶的种类和活性有所不同。黄孢原毛平革菌Phanerochaete chrysosporium作为一种白腐真菌,其体内具备降解木质纤维素所有的相关基因[7],但最被人们熟知的是其体内高活性的木质素过氧化物酶和锰过氧化物酶[8]。同样作为木质纤维素降解体系中研究较多的云芝栓孔菌Trametes versicolor,其分泌的木质纤维素酶主要是漆酶和锰过氧化物酶[9-10]。正因为不同木腐真菌具有不同的酶系及活力,使得它们对木材的侵染和分解能力各不相同[11-12]。木腐真菌作为自然界的分解者发挥着巨大的作用,但是对于木材的使用,却造成了巨大的经济损失。本研究将对原木中采集的木腐真菌进行分离鉴定,测定各种菌种木质素酶(包括漆酶、锰过氧化物酶和木质素过氧化物酶)和纤维素酶(包括内切葡聚糖酶、外切葡聚糖酶和β-葡萄糖苷酶)的活性,同时比较菌种对 6种家居常用木材柚木 Tectona grandis,橡木 Quercus mongolica,菠萝格 Intsia bijuga,杉木Cunninghamia lanceolata,花旗松Pseudotsuga menziesii和马尾松Pinus massoniana等的腐朽能力,分析木腐真菌木质纤维素酶酶活与其木材侵染能力的关系,为扩展木腐真菌种质资源、木材保护以及今后木腐真菌的利用提供有用信息。
1 材料与方法
1.1 菌种采集、分离与保存
2012年12月12日,在浙江省临安市马溪木材厂采集木腐真菌子实体,分别装于1.5 mL离心管中,并拍照记录。通过组织分离法,在马铃薯葡萄糖琼脂(PDA)培养基中分离得到5个菌株,编号为MX1,MX2,MX3,MX4和MX5,并保存于浙江农林大学植物保护学科微生物实验室。
1.2 菌种鉴定
1.2.1 菌种形态与显微观察 挑取PDA上培养的真菌菌丝制作临时载玻片,灭菌水作为介质,在10× 40倍显微镜下观察菌丝、分生孢子及厚壁孢子的形态,用DS-Ri1数码相机(Nikon)进行显微拍照。MX1菌株的显微结构为PDA上培养30 d的菌丝体,MX2,MX3,MX4和MX5菌株的显微结构为PDA上培养8 d的菌丝体。
1.2.2 菌种内转录间隔区(ITS)及D1/D2序列分析 分别挑取PDA上培养8 d的MX1,MX2,MX3,MX4和MX5菌丝体,用EZ-10 Spin Column Fungal DNA Isolation Kit(生工生物)提取其基因组DNA,以提取的DNA为模板,用Fungi Identification PCR Kit(TaKaRa)试剂盒聚合酶链式反应(PCR)扩增菌丝体基因内转录间隔区(ITS)序列和26S rDNA D1/D2区域序列。PCR反应产物经琼脂糖凝胶电泳分离后,用AxyPrep DNA Gel Extraction Kit(Axygen)回收目的条带,对回收的DNA片段进行测序。
1.3 粗酶液制备
刮取在PDA上培养14 d后的木腐真菌菌丝,加蒸馏水研磨,将研磨液离心(1 000 r·min-1,10 min,4℃)得到的上清液作为粗酶液。该粗酶液用于测定木质素酶和纤维素酶的活力。
1.4 粗酶液总蛋白质质量分数测定
取上述各种真菌粗酶液用于总蛋白质质量分数测定。运用Bradford原理,使用蛋白质定量检测试剂盒(生工生物)进行蛋白测定。
1.5 木质素酶活力测定
1.5.1 漆酶 用ABTS(Sigma)的氧化来表示漆酶的活性。其1.0 mL反应体系为:900滋L 0.5 mmol·L-12, 2-联氮-二(3-乙基-苯并噻唑-6-磺酸)二铵盐(ABTS)和0.1 mol·L-1醋酸钠缓冲液(pH 5.0),加入100滋L粗酶液,启动反应,测定反应3 min内420 nm处吸光度的变化[13]。以1 min转化1滋mol ABTS所需的酶量来表示1个酶活力单位(滋mol·min-1)。
1.5.2 锰过氧化物酶 在锰和过氧化氢存在下氧化2,6-二甲氧基苯酚(DMP,Sigma)来表示锰过氧化物酶的活性。其1.0 mL反应体系中含100.0 mmol·L-1酒石酸钠缓冲液(pH 4.5),1.0 mmol·L-1DMP,1.0 mmol·L-1硫酸锰和0.1 mmol·L-1过氧化氢,在加入100滋L粗酶液后启动反应体系,测定3 min内469 nm处吸光度的变化[14]。以1 min转化1滋mol DMP所需的酶量来表示1个酶活力单位(滋mol·min-1)。
1.5.3 木质素过氧化物酶 在过氧化氢存在下氧化藜芦醇(Sigma)来表示木质素过氧化物酶的活性。其1.0 mL反应体系中含10.0 mmol·L-1酒石酸钠缓冲液 (pH 3.0),2.0 mmol·L-1藜芦醇和0.4 mmol·L-1过氧化氢,在加入100滋L粗酶液后启动反应体系,测定3 min内310 nm处吸光度的变化[14]。以1 min转化1滋mol藜芦醇所需的酶量来表示1个酶活力单位(滋mol·min-1)。
1.6 纤维素酶活力测定
1.6.1 内切葡聚糖酶 以羧甲基纤维素(CMC,Sigma)为底物,反应产生的还原糖来表示内切葡聚糖酶的活性。在50.0 mmol·L-1醋酸钠缓冲液(pH 5.0)配制成的900滋L 1%(w·v-1)羟甲基纤维素(CMC)溶液中加入100滋L粗酶液,于32℃反应30 min,然后在CMC溶液中加入等体积(1.0 mL)的3,5-二硝基水杨酸(DNS试剂),于100℃水浴10 min,再于4℃下保持15 min,最后恢复室温,测定540 nm下的吸光度[15]。用1 min所产生1滋g还原糖的量来表示1个酶活力单位(滋g·min-1)。
1.6.2 外切葡聚糖酶 以4-nitrophenyl β-D-cellobioside(pNPC,Sigma)氧化成对硝基酚的能力来表示外切葡聚糖酶的活性。在900滋L含10.0 mmol·L-1pNPC和100.0 mmol·L-1醋酸钠缓冲液(pH 5.0)中加入100 滋L粗酶液,于50℃水浴反应15 min,测定415 nm处的吸光度[16-17]。用1 min产生1滋mol对硝基酚来表示1个酶活力单位(滋mol·min-1)。
1.6.3 β-葡萄糖苷酶 以4-nitrophenyl-β-D-glucopyranoside(pNPG,Sigma)氧化成对硝基酚的能力来表示β-葡萄糖苷酶的活性。在900滋L含10.0 mmol·L-1pNPG和100.0 mmol·L-1醋酸钠缓冲液(pH 5.0)中加入100滋L粗酶液,于50℃水浴反应15 min,测定415 nm处的吸光度[17]。以1 min产生1滋mol对硝基酚所需的酶量来表示1个酶活力单位(滋mol·min-1)。
1.7 木材侵染能力测定
在无菌条件下,将上述分离得到的5种木腐真菌分别接种到9 cm的PDA平板培养皿中,接种后置于25℃培养箱中培养8 d,使菌种长满平板或基本长满平板。
从临安市马溪木材厂取得未经处理的柚木、橡木、菠萝格、杉木、花旗松和马尾松等的边材加工成18 mm×18 mm×3 mm大小样品,并给每块木材样品编号,放入温度为103℃烘箱中烘干6 h,每块木材样品用电子天平称量(精确到0.001 g)。然后将木材样品包好在高压灭菌锅中灭菌(120℃,20 min)。在无菌条件下,将木块置于长满菌丝的平板培养基内,放木材样品1块·培养基-1,重复3次·样品-1,然后将培养皿放入25℃恒温培养箱中,12周后,取出附带菌丝体的木块,除去表面的菌丝,放入103℃烘箱中烘干6 h,称量。计算木材样品受菌侵染后的质量损失百分率,以百分数计算表示。计算公式为:试样质量损失百分率(%)=(W1-W2)÷W1×100%。其中:W1为木块样品试验前的干质量,W2为木块样品试验后的干质量。
1.8 数据分析
木质纤维素酶在5种木腐真菌中的活性差异以及5种木腐真菌对木材侵染能力的差异运用方差进行分析(Newman-Keuls),其显著水平α=0.05。数据分析所使用的分析软件为SPSS 16.0(SPSS Inc)。
2 结果与分析
2.1 菌种鉴定
2.1.1 MX1菌株 MX1菌株腐生在杨树储木上,图1A为采集地储木上菌株子实体(箭头所指),易与物剥离,灰白色,平伏,贴生。图1B为该菌从子实体上分离纯化后,在25℃下培养8 d的菌落,菌丝起初为白色,随着培养天数的增加,扩散性色素积累,变为红色至暗红色。显微结构观察到2种分生孢子,大孢子(图1C实心箭头)和小孢子(图1C空心箭头)。大孢子细长,镰刀形,有3个隔,大小约为20.0 μm×1.5~2.5 μm;小孢子形态多样,有卵形、肾形、圆柱形,大小约为2.5~5.0 μm×1.0~1.5 μm。测序结果发现:MX1菌株ITS序列和26S D1/D2区域序列长度分别为544 bp和606 bp(GenBank登录号分别为KF513162和KF513167),经美国国家生物技术信息中心(NCBI)快速局域序列对位排列算法(BLAST)比对后发现MX1菌株ITS序列与已知尖孢镰刀菌Fusarium oxysporum ITS序列(GenBank登录号JF776163)完全一致;MX1菌株D1/D2序列与已知尖孢镰刀菌D1/D2序列(GenBank登录号KF181210)完全一致。尖孢镰刀菌可以产生大孢子、小孢子和厚壁孢子等3种无性分生孢子,大孢子为两头尖,大小20~30 μm的镰刀状,小孢子为椭圆形,而厚壁孢子一般在黑暗或逆境中才会出现[18]。综合MX1菌株的子实体、分生孢子种类和形态、ITS序列和26S D1/D2序列比对结果,可以确定MX1菌株为尖孢镰刀菌。
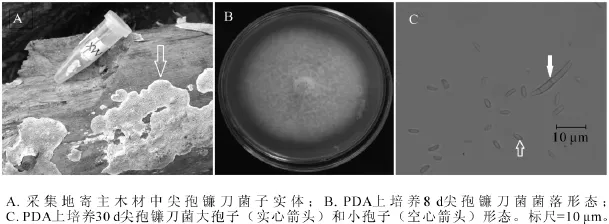
图1 尖孢镰刀菌(MX1)形态学特征Figure 1 Morphological characteristics of Fusarium oxysporum
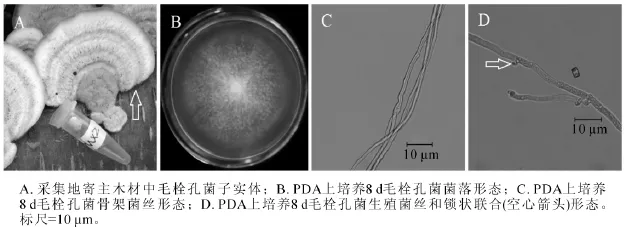
图2 毛栓孔菌(MX2)形态学特征Figure 2 Morphological characteristics of Trametes hirsuta
2.1.2 MX2菌株 MX2号菌株腐生在泡桐木原木上,图2A为采集地原木上菌株子实体(箭头所指),无柄盖形,菌盖扁平,表面白色中带浅棕黄色,半圆形或扇形,被厚绒毛,有明显同心环带。目前,木腐真菌的鉴定大多以子实体形态来进行判定,该菌株的子实体形态与毛栓孔菌子实体形态极为相似[19]。图2B为该菌在25℃下培养8 d的菌落,菌丝白色,不产生扩散性色素,有严重腐烂臭味。随着培养天数增加,菌丝越来越茂盛,越长越厚,几十天之后,可形成团块状实心菌丝球,并且菌丝体易从培养基上撕落。显微结构观察到2种菌丝形态,图2C中菌丝不分枝,细长,图2D中菌丝具有锁状联合(图2D箭头)。从显微结构的2种菌丝形态,可以推测MX4号是担子菌门的真菌。图2C中不分枝的菌丝为骨架菌丝,图2D中具有锁状联合的菌丝为生殖菌丝。测序结果发现,MX2菌株ITS序列和26S D1/D2区域序列长度分别为628 bp和645 bp(GenBank登录号分别为KF513163和KF513168),经NCBI BLAST比对后发现MX2菌株ITS序列与已知毛栓孔菌Trametes hirsuta ITS序列(GenBank登录号AB733170)相似度达到99%;MX2菌株D1/D2序列与已知毛栓孔菌D1/D2序列(GenBank登录号AB733343)完全一致。综合MX2菌株子实体、菌落形态、菌丝显微结构、ITS序列和26S D1/D2序列比对结果,可以确定MX2菌株为毛栓孔菌。
2.1.3 MX3菌株 MX3号菌株腐生在松木上,图3A为采集地原木上该菌株子实体(图3A箭头所指的白色物质),白色,平伏,贴生。图3B为该菌在25℃下培养8 d的菌落,菌丝白色,生长茂盛,无腐烂臭味,培养10 d左右,培养基底部可见黄色或红紫色扩散性色素。显微结构观察到2种孢子,分生孢子和厚壁孢子。分生孢子卵形至椭圆形(图3C实心箭头),大小为2.0~5.0 μm×0.5~1.5 μm,并且产孢量大;厚壁孢子卵圆形(图3C空心箭头),有分隔,大小为8.0~9.0 μm×1.5~4.0 μm。测序结果发现:MX3菌株 ITS序列和 26S D1/D2区域序列长度分别为 558 bp和 606 bp(GenBank登录号分别为KF513164和KF513169),经NCBI BLAST比对后发现MX3菌株ITS序列与已知层生镰刀菌Fusarium proliferatum ITS序列(GenBank登录号HQ380763)完全一致;MX3菌株D1/D2序列与已知层生镰刀菌D1/D2序列(GenBank登录号HQ382533)完全一致。该菌株菌落中心红紫色色素以及小分生孢子形态与层生镰刀菌的菌落及小孢子描述相似[20]。综合MX3菌株子实体、菌落形态、分生孢子种类和形态、ITS序列和26S D1/D2序列比对结果,可以确定MX3菌株为层生镰刀菌。
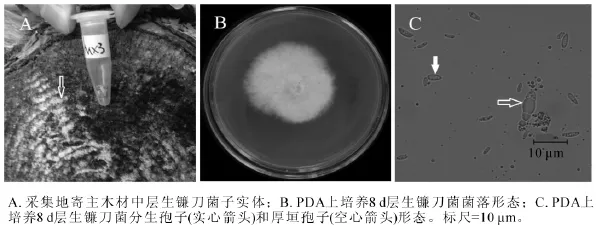
图3 层生镰刀菌(MX3)形态学特征Figure 3 Morphological characteristics of Fusarium proliferatum
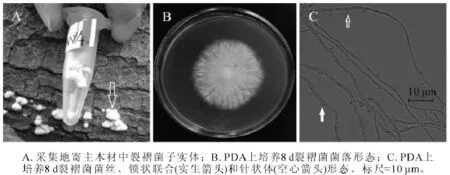
图4 裂褶菌(MX4)形态学特征Figure 4 Morphological characteristics of Schizophyllum commune
2.1.4 MX4菌株 MX4菌株腐生在杨树原木上。图4A为采集地原木上菌株子实体(箭头所指),菌盖扇形,菌肉白色,此形态与裂褶菌子实体相似[19]。图4B为该菌在25℃下培养8 d的菌落,菌丝白色,生长茂盛,不易衰老,有腐烂臭味。随着培养天数增加,菌丝不断连接与分化,2~3个月后能在培养基上形成黄色、表面裂褶的蘑菇。该菌菌丝显微结构具有锁状联合(图4C实心箭头),且沿着菌丝两侧长有针状体(图4C空心箭头)。从显微结构的锁状联合特征,可以推测MX4号是担子菌门的真菌,图4C中具有锁状联合的菌丝为生殖菌丝。生殖菌丝的锁状联合以及针状突是裂褶菌菌丝的典型结构[21],该菌株菌丝均具有这2种形态,可以初步判定其为裂褶菌。测序结果进一步发现,MX4菌株ITS序列和26S D1/D2区域序列长度分别为636 bp和645 bp(GenBank登录号分别为KF513165和KF513170),经NCBI BLAST比对后发现MX4菌株ITS序列与已知裂褶菌Schizophyllum commune ITS序列(GenBank登录号JX848644)完全一致;MX4菌株D1/D2序列与已知裂褶菌 D1/D2序列(GenBank登录号AB428351)完全一致。综合MX4菌株子实体、菌落形态、菌丝显微结构、ITS序列和26S D1/D2序列比对结果,可以确定MX4菌株为裂褶菌。
2.1.5 MX5菌株 MX5菌株腐生在松木上。图5A为采集地原木上该菌株子实体(箭头所指),菌盖扇形扁平,菌肉红色,此形态与血红密孔菌子实体形态极为相近[19]。图5B为该菌在25℃培养8 d的菌落,将培养基上白色物质刮下,在显微结构下观察,发现只有大量孢子,并没有菌丝。该菌株菌丝分布在培养基内部,培养基表面无菌丝。图5C为分生孢子,圆柱形或椭圆形,大小为1.5~2.5 μm×0.5~1.0 μm。测序结果发现,MX5菌株ITS序列和26S D1/D2区域序列长度分别为636 bp和645 bp(GenBank登录号分别为KF513166和KF513171),经NCBI BLAST比对后发现MX5菌株ITS序列与已知血红密孔菌Pycnoporus sanguineus ITS序列(GenBank登录号HQ891297)完全一致;MX5菌株D1/D2序列与已知血红密孔菌 D1/D2序列(GenBank登录号HM595619)完全一致。综合MX5菌株子实体、菌落形态、分生孢子形态、ITS序列和26S D1/D2序列比对结果,可以确定MX5菌株为血红密孔菌。
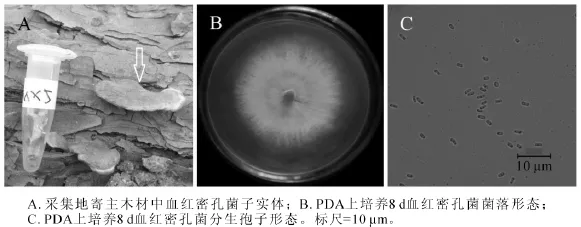
图5 血红密孔菌(MX5)形态学特征Figure 5 Morphological characteristics of Pycnoporus sanguineus
2.2 木腐真菌木质纤维素酶活性
由表1可以看出:5种木腐真菌木质纤维素酶活性存在较大差异,其中,木质素酶活性普遍高于纤维素酶活性。漆酶和锰过氧化物酶在5种真菌中均有表达,其中,漆酶在尖孢镰刀菌和层生镰刀菌中活性最高,分别达到501.19和295.73 μmol·min-1·g-1;锰过氧化物酶在层生镰刀菌和血红密孔菌中活性最高,分别达到247.11和241.39 μmol·min-1·g-1;木质素过氧化物酶仅在裂褶菌中有少量活性,而在其余4种真菌均未检测到活性(表1)。内切葡聚糖酶分别在毛栓孔菌、层生镰刀菌和裂褶菌中检测到活性,其中在毛栓孔菌中活性最高,达到100.38 μg·min-1·g-1;外切葡聚糖酶仅在毛栓孔菌和层生镰刀菌中有较低活性,而在其余3种真菌中未检测到活性;β-葡萄糖苷酶除了在尖孢镰刀菌中未检测到活性外,其余四种真菌均有活性(表1)。总体而言,毛栓孔菌、层生镰刀菌、裂褶菌和血红密孔菌均表现出木质素酶和纤维素酶活性,而尖孢镰刀菌仅呈现出木质素酶活性。
2.3 木材侵染能力分析
从木材样品真菌侵染前后质量损失率可以进一步得出(表2),毛栓孔菌对6种木材造成的质量损失均显著高于其他4种木腐真菌,其中除了对菠萝格造成2.21%质量损失外,对其他5种木材样品均造成20.00%以上的质量损失;血红密孔菌对菠萝格的侵染能力类似于毛栓孔菌,对橡木和杉木的侵染能力仅次于毛栓孔菌,但显著强于其他3种真菌,造成的质量损失率分别达到41.37%和14.08%;尖孢镰刀菌、层生镰刀菌和裂褶菌对6种木材样品的侵染能力显著弱于毛栓孔菌,其造成的木材质量损失率普遍低于3%。
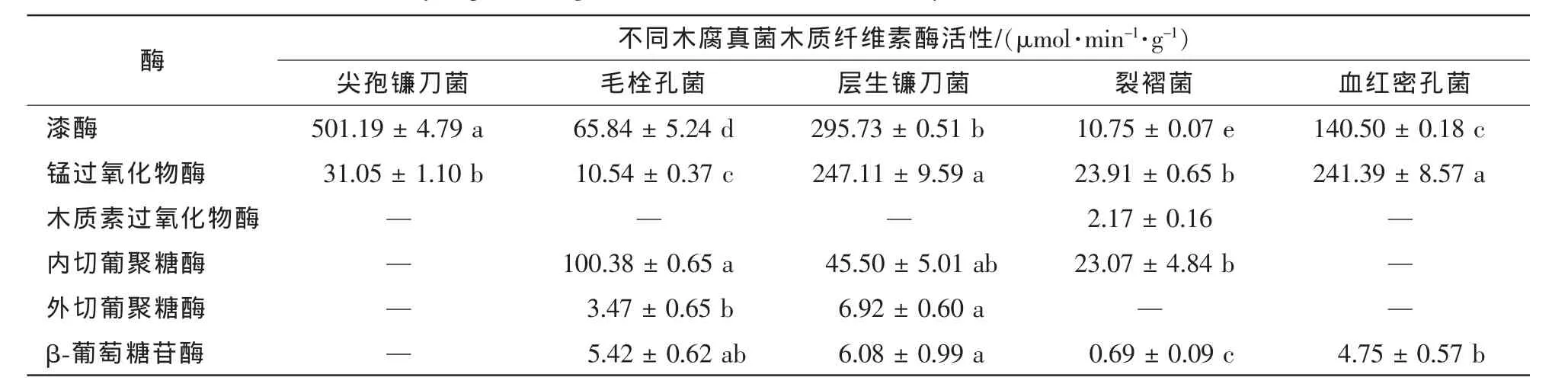
表1 PDA培养14 d后5种木腐真菌木质纤维素酶活性Table 1 Lignocellulolytic activities of Fusarium oxysporum,Trametes hirsute,Fusarium proliferatum,Schizophyllum commune and Pycnoporus sanguineus on PDA after fourteen days
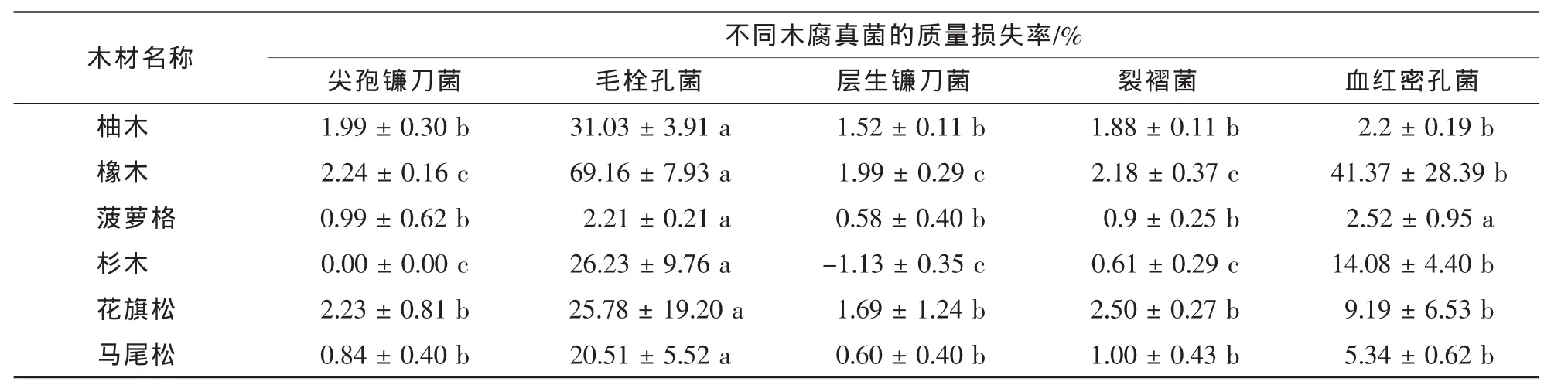
表2 木腐真菌侵染12周后不同木材的质量损失率Table 2 Weight losses of Tectona grandis,Quercus mongolica,Intsia biujga,Cunninghamia lanceolata,Pseudotsuga menziesii and Pinus massoniana after twelve weeks of wood-rotting fungus exposure
3 讨论
通过真菌子实体、菌落、菌丝体和分生孢子形态,结合ITS及26s rDNA D1/D2序列,本研究共鉴定出5种真菌,其中3种属于担子菌门非褶菌目,分别是毛栓孔菌、裂褶菌和血红密孔菌;2种属于子囊菌门镰刀菌属,分别是尖孢镰刀菌和层生镰刀菌。毛栓孔菌是最常见的一种木材腐朽菌,能腐生在阔叶树和针叶树原木上,造成木材白色腐朽[1]。裂褶菌是分布较广的一种木材腐朽菌,能腐生在阔叶树储木上,造成木材白色腐朽[19]。血红密孔菌能腐生在多种阔叶树储木上,造成木材白色腐朽[6]。层生镰刀菌是粮食作物中常见的病原菌(特别是玉米Zea mays),能产生一系列的真菌毒素,影响粮食生产与安全[22],但也有研究表明:该菌种是引起中国杨树Populus湿心材的一种病原真菌[23],其具备木质素降解能力[24]。尖孢镰刀菌广泛存在于土壤中,可侵染植物的一种兼性寄生真菌,能对许多寄主植物造成病害[25]。本研究中的尖孢镰刀菌虽是从MX1菌株分离所得,但从子实体外观形态推测,该菌应该只是与子实体菌株共生的一种真菌。
毛栓孔菌普遍用于木质素的降解研究,其体内具备高活性的漆酶,锰过氧化物酶和木质素过氧化物酶[26],但也有研究表明,毛栓孔菌体内具备一定的纤维素酶[27]。本研究中分离到的毛栓孔菌具备木质素和纤维素降解相关的酶(除了木质素过氧化物酶),虽然该菌木质纤维素酶活性在5种真菌中不突出,但其对不同木材的侵染腐朽能力显著强于其余4种真菌,说明该菌适应能力强,能腐朽不同化学成分和结构的木材,能在多种木材上生长。
血红密孔菌是一种被广泛用于产漆酶及其应用研究的真菌[28-30]。本研究中分离到的血红密孔菌也同样表现出较高的漆酶活性,同时也检测到锰过氧化物酶和β-葡萄糖苷酶的活性。血红密孔菌对不同木材具备不同的白色腐朽能力。Pointing等[31]通过12周的木材腐朽实验表明,血红密孔菌能分别造成山毛榉Fagus sylvatica和樟子松Pinus sylvestris 34.9%和19.1%的质量损失。本研究也同样发现血红密孔菌对不同木材表现出较强的选择性侵染腐朽能力,其中对橡木的侵染能力最强,造成质量损失率达到41.37%,而对柚木的侵染能力较弱,只造成2.20%的质量损失。
裂褶菌作为一种白腐真菌,具备降解木材细胞壁中木质纤维素的能力[32]。Asgher等[33]研究发现,S. commune IBL-06具备木质素降解所需的漆酶、锰过氧化物酶和木质素过氧化物酶,其中锰过氧化物酶活性最高,其次是漆酶。本研究中,锰过氧化物酶、漆酶和木质素过氧化物酶在裂褶菌体内表现出相似的活性。然而,通过基因组测序发现,裂褶菌虽然具有丰富的纤维素酶基因和漆酶编码基因,但不存在锰过氧化物酶和木质素过氧化物酶编码基因,木质素的降解可能主要依靠漆酶或纤维二糖脱氢酶的作用[34]。虽然裂褶菌具有降解木质纤维素相关的酶,但其活性普遍不高,相应地,其对木材的侵染腐朽能力也不强,造成木材质量损失率为0.61%~2.50%。
层生镰刀菌因能在玉米中分泌伏马菌素而成名[35],但对木材腐烂能力的研究则较少。本研究中,层生镰刀菌虽然具备较高活性的木质纤维素酶活性,但其对不同木材的侵染能力普遍较弱,造成木材质量损失率<2.00%。尖孢镰刀菌虽然是一种传统的植物病原物,但其体内具有木质素降解的相关酶[36]。本研究也表明,尖孢镰刀菌菌丝体具有漆酶和锰过氧化物酶的活性,但不存在纤维素酶活性,其对木材的侵染腐朽能力也不强。
通常认为,木质纤维素酶活性高的菌株,相应的降解木质素和纤维素的能力也较强。但从本研究木腐真菌的木质纤维素酶活力及其木材腐朽能力的研究中可以发现,木腐真菌表现出的酶活性和对木材的降解能力不能完全对应,较高的木质纤维素酶活力并不代表其具有较强的木材腐朽能力,如层生镰刀菌;较低的木质纤维素酶活力也不意味着其木材腐朽能力较弱,如毛栓孔菌。可以看出,真菌木质纤维素酶的活性和其木材腐朽能力关系复杂,真菌对木材的腐朽是个复杂的过程,不能仅凭借某些酶的活性而断言其腐朽能力。
4 结论
木腐真菌既是自然界中木质纤维素的主要分解者,也是影响木材使用寿命的主要因素。本研究通过对木腐真菌鉴定及其体内木质纤维素酶系研究,分析其对6种木材的侵染能力,得出如下结论:①利用真菌形态学以及分子生物学方法鉴定出5种木腐真菌,分别为尖孢镰刀菌、毛栓孔菌、层生镰刀菌、裂褶菌和血红密孔菌。②5种木腐真菌体内表现出不同的木质纤维素酶种类和活性,其中层生镰刀菌、毛栓孔菌、裂褶菌和血红密孔菌具备1种或多种木质素酶和纤维素酶,而尖孢镰刀菌仅能分泌木质素酶。③毛栓孔菌对木材的侵染能力最强,其造成不同木材的质量损失率均在20.00%以上(除菠萝格2.21%外),血红密孔菌对不同木材的侵染能力有所差异,其中能造成较高的41.37%橡木质量损失率,也能造成较低的2.20%柚木质量损失率,其余3种真菌对不同木材的侵染能力均不强,造成的质量损失率菌都低于3.00%。④木腐真菌木质纤维素酶与其木材侵染能力不存在正相关,即具有较高或较为丰富木质纤维素酶的木腐真菌不能认定其具有较强的木材侵染能力,反之亦然。
[1] 戴玉成,徐梅卿,杨忠,等.中国储木及建筑木材腐朽菌[J].林业科学研究,2008,21(1):49-54. DAI Yucheng,XU Meiqing,YANG Zhong,et al.Wood-decaying fungi on timber or wooden constructions in China [J].For Res,21(1):49-54.
[2] 戴玉成.中国多孔菌名录[J].菌物学报,2009,28(3):315-327. DAI Yucheng.A checklist of polypores in China[J].Mycosystema,2009,28(3):315-327.
[3] DAI Yucheng.A revised checklist of corticioid and hydnoid fungi in China for 2010[J].Mycoscience,2011,52(1): 69-79.
[4] DAI Yucheng.Polypore diversity in China with an annotated checklist of Chinese polypores[J].Mycoscience,2012,53(1):49-80.
[5] 魏玉莲,戴玉成.木材腐朽菌在森林生态系统中的功能[J].应用生态学报,2004,15(10):1935-1938. WEI Yulian,DAI Yucheng.Ecological function of wood-inhabiting fungi in forest ecosystem [J].Chin J Appl Ecol, 2004,15(10):1935-1938.
[6] 戴玉成.中国储木及建筑木材腐朽菌图志[M].北京:科学出版社,2009:1-214.
[7] MARTINEZ D,LARRONDO L F,PUTNAM N,et al.Genome sequence of the lignocellulose degrading fungus Phanerochaete chrysosporium strain RP78[J].Nat Biotechnol,2004,22(6):695-700.
[8] GOLD M H,ALIC M.Molecular biology of the lignin-degrading basidiomycete Phanerochaete chrysosporium[J]. Microbiol Rev,1993,57(3):-622.
[9] PAICE M G,REID I D,BOURBONNAIS R,et al.Manganese peroxidase,produced by Trametes versicolor during pulp bleaching,demethylates and delignifies kraft pulp[J].Appl Environ Microbiol,1993,59(1):260-265.
[10] PAZARLIOGLU N K,SARIISIK M,TELEFONCU A.Laccase:production by Trametes versicolor and application to denim washing[J].Proc Biochem,2005,40(5):1673-1678.
[11] MACHUCA A,FERRAZ A.Hydrolytic and oxidative enzymes produced by white-and brown-rot fungi during Eucalyptus grandis decay in solid medium[J].Enzyme Microbial Technol,2001,29(6/7):386-391.
[12] FERRAZ A,CÓRDOVA A M,MACHUCA A.Wood biodegradation and enzyme production by Ceriporiopsis subvermispora during solid-state fermentation of Eucalyptus grandis[J].Enzyme&Microbial Technol,2003,32 (1):59-65.
[13] 燕红,苏俊,于彩莲,等.高效木质素降解菌株的分离筛选[J].浙江大学学报:农业与生命科学版,2011,37 (3):259-262. YAN Hong,SU Jun,YU Cailian,et al.Isolation and screening of fungal strains with high ligninolytic enzyme activities[J].J Zhejiang Univ Agric&Life Sci,2011,37(3):259-262.
[14] HEINFLING A,MARTÍNEZ M J,MARTÍNEZ A T,et al.Transformation of industrial dyes by manganese peroxidases from Bjerkandera adusta and Pleurotus eryngii in a manganese-independent reaction[J].Appl Environ Microbiol, 1998,64(8):2788-2793.
[15] ZHOU Jin,WANG Yonghong,CHU Ju,et al.Identification and purification of the main components of cellulases from a mutant strain of Trichoderma viride T 100-14[J].Bioresour Technol,2008,99(15):6826-6833.
[16] GAO Le,WANG Fenghui,GAO Feng,et al.Purification and characterization of a novel cellobiohydrolase (PdCel6A) from Penicillium decumbens JU-A10 for bioethanol production[J].Bioresour Technol,2011,102(17): 8339-8342.
[17] JOO A R,JEYA M,LEE K M,et al.Production and characterization of β-1,4-glucosidase from a strain of Penicillium pinophilum[J].Proc Biochem,2010,45(6):851-858.
[18] OHARA T,TSUGE T.FoSTUA,encoding a basic helix-loop-helix protein,differentially regulates development of three kinds of asexual spores,macroconidia,microconidia,and chlamydospores,in the fungal plant pathogen Fusarium oxysporum[J].Eukaryotic Cell,2004,13(10):1412-1422.
[19] 曾祥谓,崔宝凯,徐梅卿,等.中国储木及建筑木材腐朽菌[J].林业科学研究,2008,21(6):783-791. ZENG Xiangwei,CUI Baokai,XU Meiqing,et al.Wood-decaying fungi on timber or wooden constructions in China [J].For Res,2008,21(6):783-791.
[20] CHENG Zhongshan,TANG Wencheng,SU Zhijian,et al.Identification of mangrove endophytic fungus 1403 (Fusarium proliferatum) based on morphological and molecular evidence[J].J For Res,2008,19(3):219-224.
[21] ERDMANN S,FREIHORST D,RAUDASKOSKI M,et al.Transcriptome and functional analysis of mating in the basidiomycete Schizophyllum commune[J].Eukaryotic Cell,2012,11(5):571-589.
[22] BACON C W,NELSON P E.Fumonisin production in corn by toxigenic strains of Fusarium moniliforme and Fusarium proliferatum[J].J Food Prot,1994,57(6):514-521.
[23] 晁龙军,曾大鹏,孙福在,等.引起杨树湿心材的一种病原真菌——Fusarium proliferatum(Matsushima)Nirenberg[J].林业科学,1998,34(5):69-73. CHAO Longjun,ZENG Dapeng,SUN Fuzai,et al.Fusarium proliferatum(Matsushima)Nirenberg:a pathogen causing wetwood in poplar trees[J].Sci Silv Sin,1998,34(5):69-73.
[24] REGALADO V,RODRÍGUEZ A,PERESTELO F,et al.Lignin degradation and modification by the soil-inhabiting fungus Fusarium proliferatum[J].Appl Environ Microbiol,1997,63(9):3716-3718.
[25] 刘波,黄俊生,肖荣凤.尖孢镰刀菌生物学及其生物防治[M].北京:科学出版社,2013:1-109.
[26] VARES T,HATAKKA A.Lignin-degrading activity and ligninolytic enzymes of different white-rot fungi:effects of manganese and malonate[J].Can J Bot,1997,75(1):61-71.
[27] RANA S,TIWARI R,ARORA A,et al.Prospecting Parthenium sp.pretreated with Trametes hirsuta,as a potential bioethanol feedstock[J].Biocatal Agric Biotechnol,2013,2(2):152-158.
[28] POINTING S B,JONES E B G,VRIJMOED L L P.Optimization of laccase production by Pycnoporus sanguineus in submerged liquid culture[J].Mycologia,2000,92(1):139-144.
[29] LU Lei,ZHAO Min,ZHANG Beibei,et al.Purification and characterization of laccase from Pycnoporus sanguineus and decolorization of an anthraquinone dye by the enzyme[J].Appl Microbiol Biotechnol,2007,74(6):1232-1239.
[30] LU Chunxia,WANG Haiyun,LUO Yuanming,et al.An efficient system for pre-delignification of gramineous biofuel feedstock in vitro:application of a laccase from Pycnoporus sanguineus H275[J].Proc Biochem,2010,45(7):1141 -1147.
[31] POINTING S B,PARUNGAO M M,HYDE K D.Production of wood-decay enzymes,mass loss and lignin solubilization in wood by tropical Xylariaceae[J].Mycol Res,2003,107(2):231-235.
[32] SCHMIDT O,LIESE W.Variability of wood degrading enzymes of Schizophyllum commune[J].Holzforschung,1980, 34(2):67-72.
[33] ASGHER M,KAUSAR S,BHATTI H N,et al.Optimization of medium for decolorization of solar golden yellow R direct textile dye by Schizophyllum commune IBL-06[J].Int Biodeterioration&Biodegradation,2008,61(2):189-193.
[34] OHM R A,JONG J F,LUGONES L G,et al.Genome sequence of the model mushroom Schizophyllum commune[J]. Nat Biotechnol,2010,28(9):957-963.
[35] ROSS P F,NELSON P E,RICHARD J L,et al.Production of fumonisins by Fusarium moniliforme and Fusarium proliferatum isolates associated with equine leukoencephalomalacia and a pulmonary edema syndrome in swine[J]. Appl Environ Microbiol,1990,56(10):3225-3226.
[36] MÖNKEMANN H,HÖLKER U,HÖLKER M.Components of the ligninolytic system of Fusarium oxysporum and Trichoderma atroviride[J].Fuel Proc Technol,1997,52(1/3):73-77.
Identification of wood-rotting fungi and their decay capability in six wood species
LUO Jingyi,FU Weirui,PAN Chengyuan
(School of Agricultural and Food Science,Zhejiang A&F University,Lin’an 311300,Zhejiang,China)
Wood-rotting fungi,one of the lignocellulose decomposers in nature,play an important role in the material cycle of the ecosystem.In order to clarify the relationship between wood decay capability of fungi and their lignocellulases activity,five kinds of wood-rotting fungi were identified in this study (namely Fusarium oxysporum,Trametes hirsuta,Fusarium proliferatum,Schizophyllum commune,and Pycnoporus sanguineus),based on morphological characteristics of sporophore,colony,mycelium,and conidium,and combined with sequences of internal transcribed spacer (ITS)and 26S rDNA D1/D2.Also,lignases and cellulases activities were determined from the wood-rotting fungi.Biodegradation capability of the fungi to six different species of wood,including oak (Quercus mongolica),teak (Tectona grandis),merbau (Intsia biujga),Chinese fir (Cunninghamia lanceolata),Douglas fir (Pseudotsuga menziesii)and masson pine (Pinus massoniana),was evaluated through wood mass losses of pre-and post-treatments.Results showed that for all five species of fungi,laccase and manganese peroxidase exhibited higher activities than cellulases.After 12 weeks of the decay experiment,T.hirsuta caused the most decay with oak (mass loss of 69.16%).F.oxysporum,F. proliferatum,and S.commune caused less than 3.00%mass loss with all six species of wood;whereas P.sanguineus caused 41.37%mass loss with oak but only 2.20%mass loss with teak.When comparing wood decay capability of fungi and lignocellulases activity,higher lignases and cellulases activity of the fungus did not mean it had higher decay capability on the wood.[Ch,5 fig.2 tab.36 ref.]
wood science and technology;wood-rotting fungi;identification;lignases;cellulases;wood decay
S782.33
A
2095-0756(2015)01-0001-10
浙 江 农 林 大 学 学 报,2015,32(1):1-10
Journal of Zhejiang A&F University
10.11833/j.issn.2095-0756.2015.01.001
2014-02-17;
2014-05-07
国家自然科学基金资助项目(31301923);浙江农林大学大学生创新创业基金资助项目(201201012)
骆静怡,从事木腐真菌研究。E-mail:123973358@qq.com。通信作者:潘程远,副教授,博士,从事木材抗虫防腐研究。E-mail:cypan@zafu.edu.cn
