生物体内甜菜碱脂的研究进展
2015-03-22徐继林周成旭严小军
翁 倩, 徐继林, 周成旭, 严小军
(宁波大学 应用海洋生物技术教育部重点实验室, 浙江 宁波 315211)
生物体内甜菜碱脂的研究进展
翁 倩, 徐继林, 周成旭, 严小军
(宁波大学 应用海洋生物技术教育部重点实验室, 浙江 宁波 315211)
甜菜碱脂是一类极性膜脂,自然界中发现的有3类,分布于不同类别的生物中,其中最广泛分布于藻类以及部分低等植物中,有着多种功能,最主要的作用是作为膜脂参与生物的生命活动,对光合作用、植物抗逆以及藻类生物燃料的开发具有重要意义。不同生物体中的甜菜碱脂类别、含量以及分布均有差异,对甜菜碱脂的结构、化学鉴定、细胞内定位、理化性质、生物合成及其分子生物学机理等多方面进行综述,并指出目前研究中仍需解决的问题、可以拓展的方向,以便于对甜菜碱脂进行更为深入地研究。
甜菜碱脂;DGTS;DGTA;DGCC
甜菜碱脂(Betaine Lipid,BL)是一类复杂的甘油脂,也是自然界中主要的极性甘油脂之一。甜菜碱脂主要存在于藻类、苔藓植物、真菌和一些简单的原生动物和光合细菌中,虽然在被子植物中很少发现,但是在一些产孢子植物中被检测到,如蕨类和部分有节植物门的种类。甜菜碱脂分子成电中性,含有带负电荷的羧基和带正电荷的三甲基氨基,在中性pH时是两性离子,生理pH下分子带负电荷。海藻中已经发现的甜菜碱脂有3类,分别是1, 2-二酰基甘油-O-4′-(N,N,N-三甲基)高丝氨酸[1, 2-diacylglyceryl-O-4′-(N,N,N-trimethyl) homoserine, DGTS]、1, 2-二酰基甘油-O-2′-(N,N,N-三甲基)-β-丙氨酸[1, 2-diacylglyceryl-O-2′-(N,N,N-trimethyl)-β-alanine, DGTA]以及1, 2-二酰基甘油-3-O-(羧羟甲基)胆碱[1, 2-diacylglyceryl-3-O-(N-hydroxymethyl) choline, DGCC],见图1。这3类脂在海藻中的分布较广泛,其中,DGTS在自然界中最常见,分类学研究表明,它可能是甜菜碱脂类演化过程中形成的第一类脂[1-2]。
1 甜菜碱脂的结构
3类甜菜碱脂有类似的结构,它们均由二酰基甘油与甜菜碱形成。甜菜碱脂含有一个极性基团,该基团通过一个醚键连接在甘油部分的sn-3位上,脂肪酸在sn-1和sn-2上进行酯化。没有磷或糖基团。其中,甜菜碱部分的主链均含有3个碳,3类脂的不同点是羧基分布于3个不同的碳原子上。DGCC的羧羟甲基使甜菜碱部分的主边上插入了一个氧;DGTS可以看成石莼氨酸甜菜碱经酯化反应得到的产物;DGTA是β-丙氨酸甜菜碱经α-羟甲基与二酰甘油基连接得到的产物。甜菜碱脂的结构与磷脂酰胆碱(phospahtidylcholine, PC)这种甘油酯比较相似[1-2]。
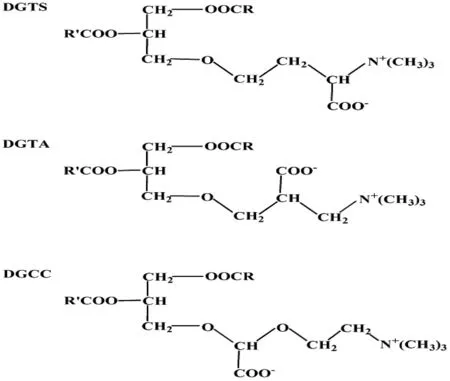
图1 甜菜碱脂的结构
在大部分藻类的DGTS中,甘油部分的sn-1位上的脂肪酸以饱和脂肪酸为主(主要是14:0和16:0),而在sn-2位上,C18不饱和脂肪酸是主要的脂肪酸〔主要为18:2(n-6)和18:3(n-3)〕[3]。然而,海洋藻类在这两个位置上却可以含有高比例的多不饱和脂肪酸〔例如20:5(n-3)〕[3]。
甜菜碱脂的结构和甘油磷脂酰胆碱的结构中存在明显的相似,尽管前者的相变温度比相同脂肪酸组成成分的磷脂酰胆碱的稍高一点,但是这两种脂与水混合后,其物理相行为大体相似。有一些证据表明某些生物体(并不是所有)的膜中的甜菜碱脂和磷脂酰胆碱的存在有着反比关系,这也说明了它们至少某种程度上是可以相互替代[3]。例如,甜菜碱脂可以在缺少磷的情况下进行积累[4]。
2 甜菜碱脂的检测
甜菜碱脂可以从藻细胞或植物材料中提取,传统检测和分析的方法有二维薄层色谱法[5]。将甜菜碱脂从另一个脂或其它类型脂中分离出来使用的溶剂体系经过了多次发展和改善。由于一定条件下DGTA在酸性溶液中易脱氨,所以不建议使用酸性试剂。二维薄层色谱法对甜菜碱脂的典型分离有过很多报道[6]。在鉴定DGTS或将DGTS和其他两类甜菜碱脂区分开来的研究中,曾普遍用过的方法是化学染色法。DGTS中存在着季胺基团,能与Dradendorff试剂发生反应,因此常用该试剂来染色甜菜碱脂,从而区分DGTS和其它甜菜碱脂。Dradendorff试剂能与DGTS反应,也能与PC反应。但DGTS与Dradendorff试剂反应后,斑点会呈现桔黄色,继续喷洒试剂时颜色加深,而PC染色后,斑点最初显浅黄色,但继续喷洒试剂颜色不变。甜菜碱脂不被磷脂染色试剂染色。DGTS极性低于DGTA,DGTS比DGTA含更短更少的饱和脂肪酸。DGTA的标准品一般通过制备分离得到,该标准品也使用于DGTS和DGCC的定量,这是因为这3种甜菜碱脂享有一样的季胺基团,类似于PC的结构特征,季胺基团是正离子模式下电子出现残留的地方,而且DGTS和DGTA是结构异构体。
可以通过核磁波谱(NMR)方法更准确鉴定甜菜碱脂,其中1H-NMR和13C-NMR在建立这些脂的结构中均很有用。三甲基氨的信号主要出现在1H-NMR的3.3 ppm以及13C-NMR的54 ppm处[3]。C4骨架的信号从甘油和脂酰基的信号中明显分离,因此有利于鉴定甜菜碱脂[3]。
随着其他学科及仪器的发展,甜菜碱脂分析检测的方法不断改进。红外吸收光谱法以及质谱法[7]也可用于确认甜菜碱脂的结构中,现在人们越来越多使用色谱质谱以及不同技术相结合的方法进行脂类的分析鉴定[8-9],这样省时方便且更准确。Kind等[10]采用LC-QTOF、GC-MS方法定性测定藻类分泌物中的化合物,通过与质谱数据库匹配以及保留时间的筛选,将这些化合物一一鉴定列出,其中包含多种DGTS。Haigh等[11]结合质谱以及核磁的方法,特征性描述了小球藻Chlorellaminutissima中DGTS的结构特征,并且发现DGTS与MGDG水平呈负相关,DGTS水平随着时间变化显示明显的波动。Popendorf等[12]利用高效液相色谱-电喷雾电离-三重四极杆质谱(HPLC-ESI-TQMS)方法定量测定浮游群落的极性甘油脂,包括3类甜菜碱脂,方法省时有效,市场无售的甜菜碱脂标准品则用制备HPLC方法自制获得。
3 甜菜碱脂在细胞内定位
甜菜碱脂是生物膜的组成成分,存在于多个地方,例如在蕨类植物荷叶铁线蕨中的单倍体(配子体)和二倍体(孢子)组织中均有报道[13]。在孢子体中,叶柄和蕨叶复叶羽片中的DGTS含量相近,其中羽片是高度分化的主要光合器官。也有报道衣藻的叶绿体、类囊体膜以及核膜中含有DGTS。这些研究结果不代表叶绿体是DGTS积累的主要位点,事实上,杜氏盐藻的分离质膜含高浓度的DGTS。衣藻细胞中的高浓度DGTS只能解释为DGTS是叶绿体外的膜的主要脂成分[14],DGTA的细胞内定位报道相对少些。
4 甜菜碱脂的理化性质
PC和DGTS丰度的明显相互作用表明DGTS和PS的物理和化学特性相似,有时它们在细胞内的作用可以互相替换。通过差示扫描量热法和荧光去极化法测定了DGTS的水性分散体从凝胶态到液晶态转变的临界温度(Tm)[6],结果发现DGTS和PC热相变情况相似,DGTS的Tm比PC的Tm高6℃。由于DGTA纯化时不太稳定,因此其热力学特性不清楚,该方面的研究有待加强。
5 甜菜碱脂的生物合成
甜菜碱脂生物合成的报道结果相似[15],Eichenberger和Gribi[16]研究了缺磷酸盐的紫细菌类球红细菌(Rhodobactersphaeroides)DGTS的生物合成,该研究发现生物合成过程中有两个必不可少的酶体系。第一个酶体系转移S-酰苷甲硫氨酸的3-氨基-3羧丙基为1, 2-二酰基-sn-甘油的3-羟基,以便形成中间产物二酰基甘油丝氨酸。第二个酶体系以3个连续步骤从S-腺苷甲硫氨酸转移甲基以形成最后的产物DGTS。藻类试验的结果显示,甜菜碱脂参与到脂肪酸从细胞质到叶绿体的转移,并且它们在加工和重新分配为其他脂类前,可能是从头合成的脂肪酸的主要受体。
体外DGTS的形成实验表明高丝氨酸和甲基基团的前体均为S-酰苷-L-甲硫氨酸。DGTS的形成与内质网相关,并不是在质体上。通过与高级植物PC以及磷脂酰乙醇胺的生物合成进行类比,微粒体活性可能与内质网有关[17]。
5.1 DGTS极性头部的来源
研究甜菜碱脂生物合成,极性头部以及甘油和羟氨基酸连接形成的机制是关注的重点。虽然高丝氨酸可能是DGTS极性头部的前体之一,但是外源性添加高丝氨酸却不能影响衣藻DGTS的极性头部的光合标记[18]。然而,L-甲硫氨酸却能有效降低光合作用的14CO2到DGTS的转移,表明甲硫氨酸是DGTS极性头部的前体。事实上放射性标记L-甲硫氨酸已被特一性转移入DGTS的极性头部,C-1,C-3,C-4以及甲硫氨酸的S-甲基碳都被整合到DGTS的极性头部[18],这些研究均表明甲硫氨酸在DGTS的生物合成中起着“双重”的作用,其中,甲硫氨酸的C4骨架是DGTS极性头部的C4骨架的前体,甲硫氨酸的S-甲基基团是DGTS的N-甲基基团的前体。现在还不太清楚形成一个DGTS分子需要多少甲硫氨酸分子,当甲硫氨酸的第一个甲基通过分子内迁移移向氨基时,三分子的甲硫氨酸可能会形成一个DGTS分子。甲硫氨酸是否是3个甲基的唯一来源也是未知的,DGTS的醚键连接的形成机制的研究一直没有很大进展,DGTS合成的体外体系的建立将有利于阐述该机制。
5.2 DGTS到DGTA的转化
由于DGTA是由其它脂类合成的,所以DGTA在体外标记试验中没有明显标记,DGTS有可能是DGTA的前体。用棕鞭藻属细胞的脉冲标记[3,4-14C]甲硫氨酸试验可以研究DGTS与DGTA的前体与产物关系,将双标记DGTS(3H标记甘油部分,14C标记极性部分)外加入到棕鞭藻属细胞中,可以直接证明DGTS到DGTA的转化[15]。隐藻的[甲基-14C]甲硫氨酸或[3,4-14C]甲硫氨酸脉冲标记试验[19]也可以证明DGTS与DGTA的前体与产物的关系,而DGTS到DGTA的转变机制的研究还有待进一步深入。由于C-1(羧基碳)在转变过程中不守恒,因此羧基基团到邻位碳的迁移的可能性就被排除,羧基基团必须从DGTS中去除,再将另一个羧基基团引入到邻位碳原子中[3],而后者羧基基团的给予者仍需鉴定。
5.3 酰基的修饰
DGTS的酰基基团可以被外加入的脂肪酸快速标记。Schlapfer和Eichenberger[20]在衣藻中试验发现,整合到DGTS的标记油酸去饱和后成为亚油酸(双键在C-5,6,C-9,10,和C-12,13的C18酸)以及亚油酸的异构体,去饱和的基质则是DGTS自身。
DGTA的脂肪酸成分似乎通过酰基交换进行修饰,通过对DGTS和DGTA的脂肪酸成分比较发现,脂酰基在DGTS转变到DGTA的过程中或转变过后被替换[15]。光合同化的碳整合到DGTA的酰基中的速度比较快,整合到DGTA的极性头部的速度要慢些,这个结果也很好地支持了之前的假说[19]。甘油部分的C-1和C-2的脂肪酸显然是交换的,但是酰基交换中涉及的酶研究仍需深入。
6 DGTS合成的分子生物学
分子生物学研究选取原核生物作为研究材料,原核生物结构、代谢以及很多体系比真核生物简单,有利于研究的开展。光合紫细菌和根瘤菌中的DGTS合成的发现,为DGTS的研究开创了新局面。
生物在生长过程中会遇到一定的生理逆境,如缺乏氮和磷时,高等植物和细菌会产生相应的调节机制来应对这种逆境胁迫。根瘤菌在缺磷的条件下能合成DGTS,但是phoB突变体在低磷和高磷的条件下均无法合成DGTS。Geiger等[7]研究苜蓿根瘤菌中的调节基因phoB介导膜脂DGTS的磷酸盐压力调控合成发现,通过激活参与磷酸盐以及其他磷化合物的转运和同化的基因,细菌在缺少营养盐时作出反应。一些土壤细菌产生其它的节省磷的机制。磷酸盐受限的条件下,它们用不含磷的脂来取代膜磷脂。结果在低磷酸盐浓度时,自由生存的微共生细菌根瘤菌(苜蓿)根瘤菌膜脂形式改变。生长过程中磷酸盐受限制时,硫脂、鸟氨酸脂和从头合成的DGTS增加。根瘤菌phoCDET突变体,缺乏磷酸盐的吸收,在低或高培养基磷酸盐浓度下自发合成DGTS,这表明磷源转运到细胞质的减少会引起诱导DGTS生物合成的反应。在低或高磷酸盐浓度下,根瘤菌phoU或phoB变异体不能形成DGTS。然而,phoU或phoB变异体均补充phoB-表达质粒后,两者在磷酸盐受限时都能回复DGTS形成的能力,该现象表明,phoU与phoB两个基因中,膜脂DGTS的生物合成只需要完整的phoB。DGTS的鉴定也可以借鉴使用该研究中使用的质谱鉴定方法。该研究[7]表明缺磷时DGTS合成的调控基因是phoB,而调控的活性形式则为磷酸化phoB表达蛋白phoB。
光合紫细菌在缺磷时能合成DGTS,Klug和Benning[21]用化学诱变法筛选出两个DGTS的突变体,其在低磷水平时也无法合成DGTS,之后利用基因恢复以及插入失活的方法探索出btaA和btaB这两个基因是导致突变的基因,由此还提出了DGTS合成过程中的btaA和btaB功能假说。
Riekhof等[22]用生物信息学的方法鉴定了衣藻基因组中的编码蛋白BTA1Cr,由于它的序列类似于Rhodobactersphaeroides的DGTS生物合成所需的两个蛋白BtaARs和BtaBRs,所以研究者预测它就是衣藻中DGTS生物合成的有效蛋白。BTA1Cr编码的功能蛋白作用类似于直系同源中细菌蛋白质,而BTA1Cr的异源性单独表达导致了Escherichiacoli.中的DGTS的积累。此外,该蛋白还作为衣藻中纯化脂滴的第二大主要蛋白。由此Khozin-Goldberg和Cohen[23]提出假设,认为DGTS在脂滴形成过程中的作用或许类似于PC在其它生物体油体形成时的功能,由于DGTS与PC的性质相似,它可以取代衣藻质体外膜的PC,所以一定程度上该假设是存在的。随着研究的深入,Riekhof等[24]结合生物信息学分析,再次证实细菌和衣藻中编码DGTS生物合成酶的基因是bta1。最新研究[4]进一步发现植物和动物病原体的真菌基因组同样编码其DGTS生物合成的酶促机构,在磷限制时,真菌也会合成DGTS。在真菌缺磷调节子的调控下,DGTS的生物合成仅与bta1 编码的DGTS合成酶相关,由NUC-1/Pho4p转录因子介导。通过酿酒酵母脂质代谢的合理再造(该酿酒酵母的PC被DGTS完全取代),表明膜生物合成和细胞器组装的基本过程是可行的,并且能保证工程菌株的正常生长。
7 甜菜碱脂的研究意义
Armada等[25]结合HPLC/ESI-TOF-MS方法研究PseudoisochrysisparadoxaVLP和DiacronemavlkianumVLP两种微藻中极性脂的组成,对藻中的甜菜碱脂和脂肪酸差异进行重点比较分析。该研究有助于了解微藻重要类别的脂成分与分类学的复杂关系,使用脂肪酸和完整极性脂作为营养标记也有益于进一步准确认识初级生产者在食物网中的作用。甜菜碱脂可以作为一种生物标记物[25]。甜菜碱脂与微藻的生长和耐盐性有关[26],DGTS的含量测定有助于了解生长或耐盐的机制,进而有益于培养出更多的所需微藻[27]。此外,通过了解脂代谢的变化差异,可以认识取样区域的环境特征以及控制生物分布的环境因子,比如少量的基于磷酸盐的完整极性脂可以反映出该区域磷酸盐限制[28],将脂研究与生态学研究结合起来,增加了环境研究的指标和方法。
Banskota等[29]从微绿球藻Nannochloropsisgranulata中分离了6种甜菜碱脂,这些脂具有剂量依赖的NO抑制活性,抑制RAW264.7巨噬细胞的脂多糖诱导的NO生成。进一步研究表明这些甜菜碱脂通过下调诱导NO合成酶的表达,抑制巨噬细胞中NO的产生,这个发现指出该脂或许可以开发成为一种抗炎剂。这是DGTS有抗炎活性的首次报道。试验通过半制备型HPLC分离制得6种甜菜碱脂,结合UV、MS、1H和13C NMR进行分析鉴定。该研究还报道了DGTS抑制NO生成的效果与脂肪酸相关,结合了EPA或是结合了EPA和二十四烯酸的DGTS比其他DGTS拥有更好的NO活性,这意味着增加脂肪酸侧链的不饱和度可能会增强NO抑制活性。作用机制与DGTS对巨噬细胞中诱导NO合成酶的表达作用相关。在LPS刺激的RAW264.7巨噬细胞中,DGTS可以下调iNOS蛋白质水平,因此甜菜碱脂抑制NO生成的机制可以解释为,通过下调iNOS表达实现抑制作用,而不是仅仅通过与脂肪酸的不饱和键反应来实现。该研究首次提出甜菜碱脂将作为潜在的抗炎剂来源,为医药、保健品以及功能食品产业的产品开发提供了新的思路。
8 展望
甜菜碱脂的研究,可以结合体内能量转变的研究[30],也可以延伸到与其他脂的代谢转变关系研究中[31]。Poulson-Ellestad等[32]研究海洋浮游群落竞争作用时发现,硅藻的能量代谢发生变化且细胞的保护机制受阻,包括细胞膜的成分改变,这与Riekhof等[24]报道的甜菜碱脂合成与膜磷脂的降解有关是相符的。Roche和Leblond[33]研究Chlorarachniophytes中的甜菜碱脂,通过质谱方法来阐述了甜菜碱脂和其他脂的结构以及结构变化的机理,通过结构的分析以及物理化学性质的阐释,推测了甜菜碱脂与其他脂存在的关系,并指出未来的研究工作可以深入到以前没有涉及的属的甜菜碱脂的研究。内质网上甜菜碱脂的不同脂组成与内质网上存在的各延伸酶及去饱和酶的酶活性有关,了解相关基因组信息就可以完全破译甜菜碱脂合成的机理。Leblond等[9]指出未来的研究可以关注甜菜碱脂与半乳糖脂合成的关系,这包括甜菜碱脂及半乳糖脂合成涉及的基因的鉴定,也包括测定半乳糖脂合成酶的酶作用物的特异性的差异。只要确定了基因,就可以破译出半乳糖脂以及甜菜碱脂生物合成的脂基因质体系谱,从而进行比较。
[1]Dembitsky V M. Betaine ether-linked glycerolipids: chemistry and biology. [J]. Prog Lipid Res, 1996, 35: 1-51.
[2]Kunzler K, Eichenberger W. Betaine lipids and zwitterionic phospholipids in plants and fungi[J]. Phytochem, 1997, 46: 883-892.
[3]Sato N. Betaine lipids. [J]. Bot Mag Tokyo, 1992, 105: 185-197.
[4]Riekhof W R, Naik S, Bertrand H, et al. Phosphate starvation in fungi induces the replacement of phosphatidylcholine with the phosphorus-free betaine lipid diacylglyceryl-N,N,N-trimethylhomoserine [J]. Eukaryotic Cell, 2014, 13: 749-757.
[5]冯福应. 海洋小球藻Chlorellasp. 甘油脂及脂肪酸、光合色素特征的研究. [D]. 北京:中国科学院研究生院(植物研究所), 2003.
[6]Sato N, Murata N. Transition of lipid phase in aqueous dispersions of diacylglyceryltrimethylhomoserine. [J]. Biochim Biophys Acta, 1991, 1082: 108-111.
[7]Geiger O, Rohrs V, Weissenmayer B, et al. The regulator genephoBmediates phosphate stress-controlled synthesis of the membrane lipid diacylglyceryl-N,N,N-trimethylhomoserine inRhizobium(Sinorhizobium)meliloti[J]. Mol Microbiol, 1999, 32: 63-73.
[8]Manninen P, Laakso P, Kallio H. Separation of gamma and alpha linolenic acid containing triacylglycerols to capillary supercritical fluid chromatography[J]. Lipids, 1995, 30: 665-671.
[9]Leblond J D, Dahmen A S, Dodson V J, et al. Characterization of the betaine lipids, diacylglyceryl-N,N,N-trimethylhomoserine (DGTS) and diaclyglycerylhydroxymethyl-N,N,N-trimethyl-β-alanine (DGTA), in brown- and green-pigmented raphidophytes. [J]. Algolog Studies, 2013, 142: 17-28.
[10]Kind T, Meissen J K, Yang D, et al. Qualitative analysis of algal secretions with multiple mass spectrometric platforms[J]. J of Chromat A, 2012, 1244: 139-147.
[11]Haigh W G, Yoder T F, Ericson L, et al. The characterisation and cyclic production of a highly unsaturated homoserine lipid inChlorellaminutissima[J]. Biochim et Biophysi Acta, 1996, 1299: 183-190.
[12]Popendorf K J, Fredricks H F, Van Mooy B A S. Molecular ion-independent quantification of polar glycerolipid classes in marine plankton using triple quadrupole MS [J]. Lipids, 2013, 48: 185-195.
[13]Heinzelmann S M, Bale N J, Hopmans E C, et al. Critical assessment of glyco-and phospholipid separation by using silica chromatography. [J]. Appl Environ Microbiol, 2014, 80: 360-365.
[14]Mendiola-Morgenthaler L, Eichenberger W, Boschetti A. Isolation of chloroplast envelopes fromChlamydomonas. Lipid and polypeptide composition. [J]. Plant Sci, 1985, 41: 97-104.
[15]Vogel G, Eichenberger W. Betaine lipids in lower plants. Biosynthesis of DGTS and DGTA inOchromonasdanica(Chrysophyceae) and the possible role of DGTS in lipid metabolism[J]. Plant Cell Physiol, 1992, 33: 427-436.
[16]Eichenberger W, Gribi C. Lipids ofPavlovalutheri: cellular site and metabolic role of DGCC[J]. Phytochem, 1997, 45: 1561-1567.
[17]Moore T S, Du Z, Chen Z. Membrane lipid biosynthesis inChlamydomonasreinhardtii. In vitro biosynthesis of diacylglyceryltrimethylhomoserine[J]. Plant Phys, 2001, 125: 423-429.
[18]Sato N. Dual role of methionine in the biosynthesis of diacylglyceryltrimethylhomoserine inChlamydomonasreinhardtii[J]. Plant Physiol, 1988, 86: 931-934.
[19]Sato N. Lipid inCryptomonasCR-1. Ⅱ. Biosynthesis of betaine lipids and galactolipids[J]. Plant Cell Physiol, 1991, 32: 845-851.
[20]Schlapfer P, Eichenberger W. Evidence for the involvement of diacylglyceryl(N,N,N-trimethyl)homoserine in the desaturation of oleic and linoleic acids inChlamydomonasreinhardi(Chlorophyceae)[J]. Plant Sci Lett, 1983, 32: 243-252.
[21]Klug R M, Benning C. Two enzymes of diacylglyceryl-O-4′-(N,N,N-trimethyl) homoserine biosynthesis are encoded bybtaAandbtaBin the purple bacteriumRhizobiummeliloti[J]. Proc Natl Acad Sci, 2001, 98(10): 5910-5915.
[22]Riekhof W R, Andre C, Benning C. Two enzymes, BtaA and BtaB, are sufficient for betaine lipid biosynthesis in bacteria[J]. Arch Biochem Biophys, 2005, 441: 96-105.
[23]Khozin-Goldberg I, Cohen Z. Unraveling algal lipid metabolism: recent advances in gene identification[J]. Biochimie, 2011, 93: 91-100.
[24]Riekhof W R, Sears B B, Benning C. Annotation of genes involved in glycerolipid biosynthesis inChlamydomonasreinhardtii: discovery of the betaine lipid synthase BTA1Cr[J]. Eukaryotic Cell, 2005, 4: 242-252.
[25]Armada I, Hachero-Cruzado I, Mazuelos N, et al. Differences in betaine lipids and fatty acids betweenPseudoisochrysisparadoxaVLP andDiacronemavlkianumVLP isolates (Haptophyta)[J]. Phytochem, 2013, 95: 224-233.
[26]Laloknam S, Tanaka K, Buaboocha T, et al. Halotolerant cyanobacteriumAphanothecehalophyticacontains a betaine transporter actine at alkaline pH and high salinity[J]. Appl Environ Microbiol, 2006, 72: 6018-6026.
[27]Nakanishi K, Deuchi K. Culture of a high-chlorophyll-producing and halotolerantChlorellavulgaris[J]. J Biosci Bioeng, 2014, 117: 617-619.
[28]Rossel P E, Elvert M, Ramette A, et al. Factors controlling the distribution of anaerobic methanotrophic communities in marine environments: evidence from intact polar membrane lipids[J]. Geochi et Cosmochi Acta, 2011, 75: 164-184.
[29]Banskota A H, Stefanova R, Sperker S, et al. New diacylglyceryltrimethylhomoserines from the marine microalgaNannochloropsisgranulataand their nitric oxide inhibitory activity[J]. J Appl Phycol, 2013, 25: 1513-1521.
[30]Obata T, Fernie A R, Nunes-Nesi A. The central carbon and energy metabolism of marine diatoms[J]. Metabolites, 2013, 3: 325-346.
[31]Liu B, Benning C. Lipid metabolism in microalgae distinguishes itself[J]. Plant Biotech, 2013, 24: 300-309.
[32]Poulson-Ellestad K L, Jones C M, Roy J, et al. Metabolomics and proteomics reveal impacts of chemically mediated competition on marine plankton. Proceedings of the National Academy of the Sciences of the United States of America, 2014, doi: 10.1073/pnas.1402130111.
[33]Roche S A, Leblond J D. Betaine lipids in chlorarachniophytes[J]. Phycological Res, 2010, 58: 298-305.
Progress in betaine lipid research
WENG Qian, XU Ji-lin, ZHOU Cheng-xu, YAN Xiao-jun
(Key Laboratory of Applied Marine Biotechnology Ministry of Education, Ningbo University, Ningbo 315211, China)
Betaine lipids, as one type of polar membrane lipids, have a total of three types in nature. They are distributed in various organisms, especially in algae and some of the lower plants, with a variety functions participating in biological activity as membrane lipids and playing an important role in photosynthesis, plant stress resistance and the development of algae biofuel. In addition, the type, content and distribution of betaine lipids depend on organisms. This paper described the structure, chemical identification, intracellular localization, physicochemical properties, biosynthesis and molecular biology of betaine lipids, meanwhile points out outstanding problems and further development in present study that aims to make an intensive study of betaine lipids.
betaine lipid; DGTS; DGTA; DGCC
2014-08-15;
2014-09-17
国家自然科学基金(31172448); 教育部博士点基金优先发展领域项目(20133305130001); 宁波市科技攻关项目(2013C10014,2014C10005); 浙江省公益性项目(2014C32081); 浙江海洋技术创新团队项目(2012R10029); 宁波市海洋藻类技术创新团队项目(2011B81007)
翁倩,从事微型藻类生化研究,E-mail: wengqian1989@163.com;
徐继林,研究员,主要研究方向为海洋微藻生物化学研究,E-mail: xujilin@nbu.edu.cn。
R151.1
A
2095-1736(2015)02-0087-05
doi∶10.3969/j.issn.2095-1736.2015.02.087
