曼氏无针乌贼墨汁黑色素的提取工艺研究
2015-03-22周月越王春琳母昌考李荣华宋微微
周月越, 王春琳, 母昌考, 李荣华, 宋微微
(宁波大学海洋学院 应用海洋生物技术教育部重点实验室, 浙江 宁波 315211)
曼氏无针乌贼墨汁黑色素的提取工艺研究
周月越, 王春琳, 母昌考, 李荣华, 宋微微
(宁波大学海洋学院 应用海洋生物技术教育部重点实验室, 浙江 宁波 315211)
曼氏无针乌贼墨汁的主要成分是黑色素、蛋白质及灰分。使用酶解法去除杂质,获得高纯度墨汁黑色素。通过对碱性蛋白酶、中性蛋白酶、酸性蛋白酶、胃蛋白酶、木瓜蛋白酶、胰蛋白酶的水解效果进行比较,挑选出水解效果最好的蛋白酶。通过单因素实验,比较不同pH值、温度、加酶量、水解时间,对黑色素提取的影响。在单因素实验的基础上,通过正交试验优化黑色素的提取工艺。实验结果表明,高纯度的黑色素可以用1.5%碱性蛋白酶在温度为50℃,pH值10.5和底物浓度为2%的条件下酶解4 h获得。
曼氏无针乌贼;黑色素;酶解法;提取工艺
自然界中的黑色素包括褐色素和真黑色素两大类,褐色素是由苯并噻嗪和苯并噻唑形成的聚合物,真黑色素是由两种基本结构单元(5,6-二羟基吲哚和5,6-二羟基-2-吲哚羧酸)形成的多聚物[1]。天然黑色素具有许多特殊的生物活性,黑色素具有抗紫外辐射作用[2-4], DNA光保护作用[5-6],黑色素还具有抗脂质过氧化、清除超氧化物自由基、螯合金属离子的能力[7-11]。天然黑色素具有特殊的生物活性且健康安全,已在美黑化妆品、天然染发剂、食品添加剂方面有一定应用。此外,黑色素还在医药及仿生材料领域得到一定的应用。由于黑色素具有抗辐射的作用,黑色素覆盖的纳米颗粒用来保护癌症放疗中的骨髓细胞[12],黑色素还被制成纳米药物载体,用于肠道炎症的治疗[13],黑色素还与TiO2合成纳米仿生材料[14]。为进一步开发黑色素产品使之获得更好的应用,获得高纯度的天然黑色显得十分重要。
曼氏无针乌贼(Sepiellamaindroni,Rochebrune)俗称墨斗鱼、墨鱼,属于软体动物门、头足纲、十腕目、乌贼科,是中国近海广布性种[15]。曼氏无针乌贼墨汁为海产品加工过程中的废弃物,中医中把它作为一种止血剂使用[16],它的墨汁约为总体重的1.28%[17],是开发保健黑色素产品的价廉质高的原料。曼氏无针乌贼墨汁黑色素(the melanin ofSepiellamaindroniink ,MSMI)属于真黑色素,它与少量蛋白及金属离子结合形成黑色不溶于水的球状小颗粒[18-19],故要获得高纯度的MSMI,主要是要去掉蛋白质和灰分。提取和制备方法的不同对MSMI的结构和生物活性会造成不同的影响,本实验采取的酶解法能较好去除蛋白质,保持黑色素颗粒的完整性,对于研究黑色素的生物活性来说,是一种比较理想的方法[20-22]。
1 材料与方法
1.1 材料
曼氏无针乌贼从福建省霞浦县菜市场购得,胴长在9.2~15.7 cm之间,平均胴长10.9 cm,体重范围97.0~231.7 g,平均体重133.7 g。
1.2 试剂与仪器
中性蛋白酶、酸性蛋白酶、胃蛋白酶、木瓜蛋白酶、胰蛋白酶(solarbio),Biofuge Primo R台式离心机(Thermo),UV-2201 型紫外可见分光光度计(Shimadzu),Free Zone 4.5 台式冷冻干燥机( Labconco)。
1.3 试验方法
1.3.1 MSMI粗品的制备
取曼氏无针乌贼墨囊80只,挤压冲洗墨囊获得墨汁,3层纱布过滤防止破碎组织混入,8000 r/min离心10 min后,上清液移除,沉淀冷冻干燥,获得MSMI粗品。
1.3.2 测定MSMI的紫外-可见吸收光谱
在6 mL 2% NaOH溶液中加入黑色素粉末0.4 mg,磁力搅拌使之完全溶解,进行紫外-可见光谱分析,确定MSMI的特征吸收波长。待测波长范围为190~790 nm,采样间隔0.5 nm,观察特征吸收峰。
1.3.3 酶制剂的筛选
以MSMI粗品为原料,底物浓度2%(w/v),用2%(质量比)碱性蛋白酶,中性蛋白酶、酸性蛋白酶、胃蛋白酶、木瓜蛋白酶、胰蛋白酶酶,在各自最适宜温度和pH下水解8 h,6000 r/min离心10 min,去上清液,离心6次。冷冻干燥后,溶于2%的NaOH溶液。比较黑色素碱性溶液在特征吸收峰处的吸光值大小,从而判断出哪种蛋白酶提取效果最好。
1.3.4 单因素实验和正交实验
通过单因素实验,比较加酶量、水解时间、pH值、反应温度对MSMI提取的影响。在单因素实验的基础上进行4因素3水平的正交实验,实验按L9(34)正交表设计,进一步优化MSMI的提取工艺参数。
1.3.5 数据分析
分析MSMI紫外-可见光谱图,找到MSMI的特征吸收峰。由于吸光值与物质的量的浓度成正比,MSMI浓度越高,相应的吸光值也大,故特征峰处的吸光值可以作为衡量MSMI含量的相对指标。
正交试验用极差分析法进行数据分析。计算Ki和ki(i=1,2,3), K1为水平1的3次指标值之和,K2为水平2的3次指标值之和,K3为水平3的3次指标值之和,ki=Ki/3。计算极差R,R=kimax-kimin。根据极差R的大小,得到因素的主次顺序,R越大,表示该因素的水平变化对实验的影响越大,因此在实验中这个因素就越重要,反之,R越小,这个因素就越不重要。最后根据因素的主次顺序选出最优的水平组合。
2 结果
2.1 MSMI的紫外可见光谱分析
对MSMI进行紫外-可见光谱扫描(如图1所示),发现在222.5 nm处有一个特征吸收峰,在可见光区域的吸光度随着波长的变长而逐渐变小,这与已经报道出的黑色素紫外可见光谱类似。宋茹等[23]用酶解法制备的鱿鱼黑色素在220 nm 附近有特征吸收峰,而可见光区域的吸光度随着波长的变长而逐渐降低。李兴旺等[24]采用酸解法制备的鱿鱼墨黑色素在可见光区域也未见明显吸收峰,在紫外光区域(200~400 nm)存在2个吸收峰,其中一个强吸收峰约在215 nm 处。李晓等[29]用酶解法制备的金乌贼墨黑色素在紫外光区域( 190~ 400 nm )和可见光区域中,各存在一个明显吸收峰( 206和557 nm ),其中在约206 nm处有较大吸收,与本实验结果接近。由于吸光值与物质的量的浓度成正比,MSMI浓度越高,相应的吸光值也大,故本实验以MSMI在222.5 nm的吸光值作为判断MSMI含量的相对指标。
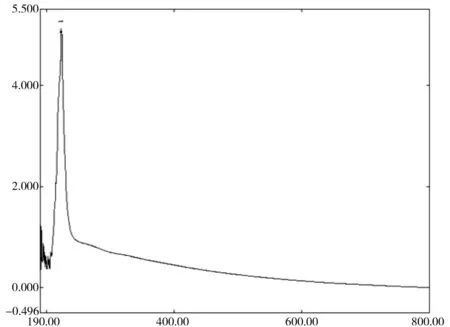
图1 MSMI的紫外-可见光谱图
2.2 选择提取MSMI所用蛋白酶
以MSMI粗品为原料,将6种蛋白酶即碱性蛋白酶、中性蛋白酶、酸性蛋白酶、胃蛋白酶、木瓜蛋白酶、胰蛋白酶的水解效果进行比较(如表1)。各种蛋白酶水解后,比较它们在222.5 nm处的吸光值(如图2所示),碱性蛋白酶相比其他5种酶的吸光值明显较高,故可将碱性蛋白酶选作提取MSMI的水解酶。

图2 各种蛋白酶对MSMI吸光值的影响
1—胰蛋白酶; 2—胃蛋白酶; 3—木瓜蛋白酶; 4—中性蛋白酶; 5—酸性蛋白酶; 6—碱性蛋白酶。
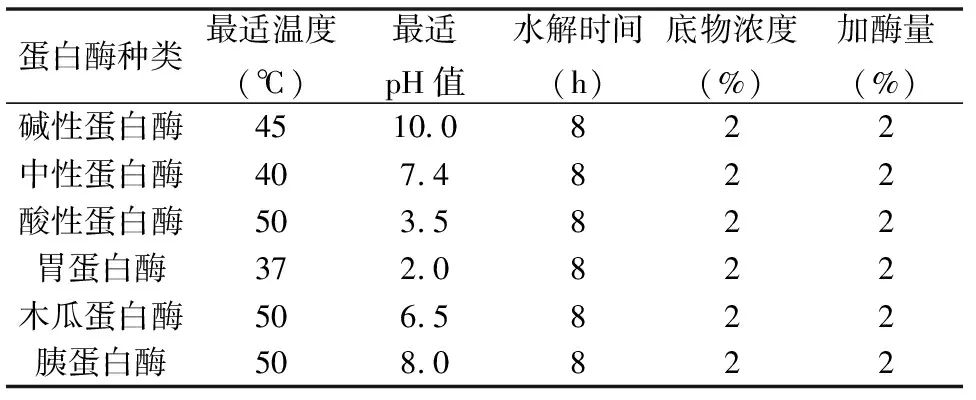
表1 各蛋白酶的酶解条件
2.3 MSMI 提取的单因素实验
2.3.1 pH值对MSMI提取的影响
在温度为45℃,加酶量2%,水解时间8 h,选择不同pH值8.0、8.5、9.0、9.5、10.0、10.5和11.0进行试验,探讨pH值对MSMI提取的影响(如图3),根据图3可知pH值在8.0到10.0之间,MSMI的吸光值随着pH值的增加而增加,当pH值达10.0时,MSMI的吸光值达到最大,pH值继续变大,吸光值随着下降。
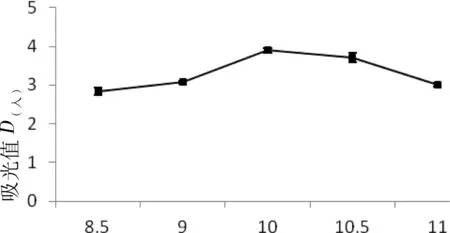
图3 pH值对MSMI吸光值的影响
2.3.2 反应温度对MSMI提取的影响
在pH值为10.0,加酶量2%,水解时间8 h,选择不同温度35℃、40℃、45℃、50℃和55℃进行试验,探讨温度对MSMI提取的影响(如图4),根据图4可知温度在35℃到50℃之间,随着温度的增加MSMI的吸光值也增加,在温度为50℃时,MSMI的吸光值达到最大值,随着温度的继续增高,MSMI的吸光值反而下降。
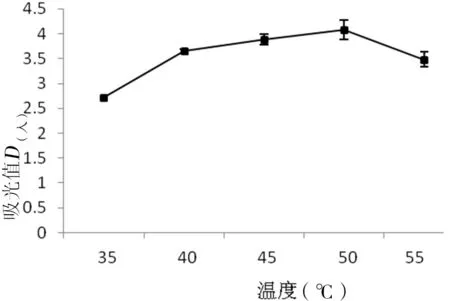
图4 温度对MSMI吸光值的影响
2.3.3 水解时间对MSMI提取的影响
在温度为45℃,pH值为10.0,加酶量2%,水解时间分别为2 h、4 h、6 h和8 h进行试验,探讨水解时间对MSMI提取的影响(如图5),根据图5可知4 h内,MSMI的吸光值随着时间的增加而增加,在4 h及大于4 h以后,吸光值几乎不变。

图5 反应时间对MSMI吸光值的影响
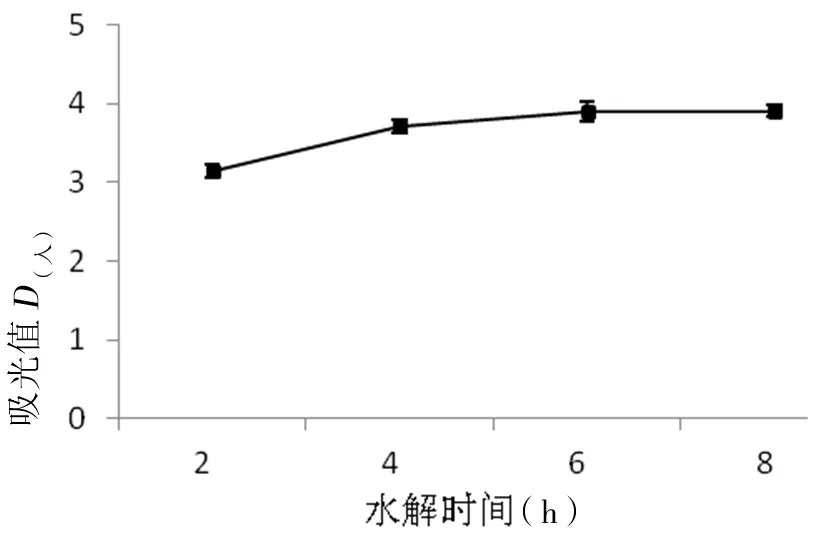
图6 酶用量对MSMI吸光值的影响
2.3.4 加酶量对MSMI提取的影响
在温度为45℃,pH值为10.0,水解时间8 h的条件下,用酶量分别为0.5%、1%、2%和3%进行试验,探讨加酶量对酶解过程的影响(如图6),根据图6可知加酶量在0.5%到1%之间MSMI的吸光值逐渐上升,当加酶量大于等于1%时,吸光值几乎不变。
2.4 正交实验
在单因素实验的基础上,对碱性蛋白酶水解进行正交实验(如表2),以进一步优化MSMI的提取工艺。比较4个因素(A:温度;B:pH值;C:加酶量;D:酶解时间)的极差,结果为RA>RB>RC>RD,说明因素A即水解温度,对MSMI提取的影响最大,其次是pH值、加酶量及酶解时间。由正交实验结果可知,MSMI提取效果最好的组合为A3B3C2D1,即1.5 %的碱性蛋白酶在温度为50℃、pH值10.5条件下水解4 h后MSMI提取效果最好,吸光值达到4.2672。
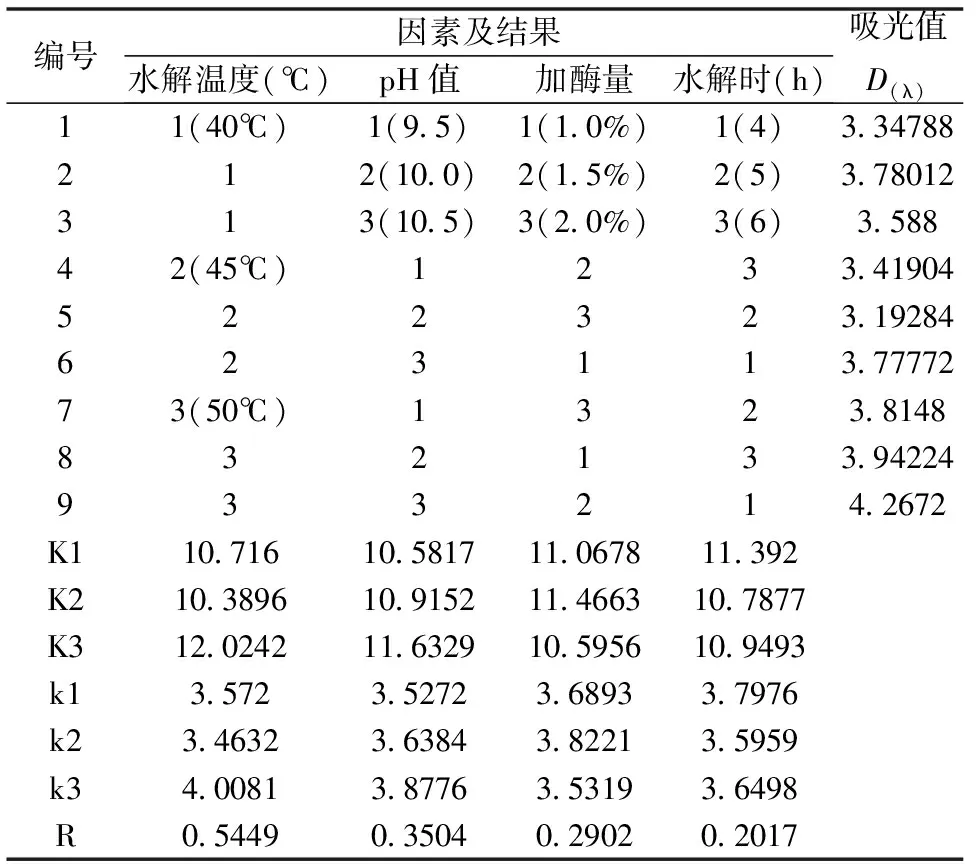
表2 L9(34)正交实验设计与结果
将未经蛋白酶水解制得的MSMI与最佳提取条件下提取的MSMI进行对比,进行验证实验,结果如表3所示。由表3可知,与未经蛋白酶水解制得的MSMI相比,最佳工艺条件下提取的MSMI在222.5 nm处的吸光值明显提高。

表3 提取工艺条件验证
3 讨论
目前提取黑色素的方法分为3种:高速离心法、酸解法及酶解法。Liu等[25]用高速离心法的方法从乌贼墨中提取了黑色素,此法操作简单且能较好保持黑色素原有的结构和生物活性,但与之结合的蛋白不能完全去除。Magarelli等[26]利用酸解法提取黑色素,得到的黑色素纯度高且去除了结合蛋白及大部分的金属离子,但酸解法可使真黑色素脱羧基,所以酸解法对于提取有生物活性的黑色素来说并不是一个特别好的方法[27]。Birbeck等[28]用木瓜蛋白酶从头发中提取了黑色素,李和生[29-30]等用酶解法从金乌贼的墨汁中提取了高纯度的黑色素并对其生物活性进行研究,发现乌贼墨对大肠杆菌具有很好的防紫外线作用,并能很好抑制大鼠自发性脂质过氧化。李欣[31]等通过双酶水解法提取乌骨鸡的黑色素,它能够使D-半乳糖衰老模型小鼠血和肝脏中GSH-Px 活力显著升高,MDA 水平显著降低,说明黑色素在体内具有显著的抗氧化作用。总的来说,我们选取的酶解法能较好去除蛋白质,保持黑色素颗粒的完整性,对于研究黑色素的生物活性来说,是一种比较理想的方法。
本文研究了酶解法提取曼氏无针乌贼墨汁黑色素,高纯度的黑色素可以用1.5%碱性蛋白酶在温度为50℃,pH值为10.5和底物浓度为2%的条件下酶解4 h获得,它为曼氏无针乌贼黑色素资源的开发利用提供参考。
[1]Ito S. A Chemist's View of Melanogenesis[J]. Pigment Cell Research, 2003, 16(3):230-236.
[2]Brenner M, Hearing V J. The protective role of melanin against UV damage in human skin[J]. Photochemistry and Photobiology, 2008, 84(3):539-549.
[3]Huang S, Pan Y, Gan D, et al. Antioxidant activities and UV-protective properties of melanin from the berry ofCinnamo-mumburmanniiandOsmanthusfragrans[J]. Medicinal Chemistr-y Research, 2011, 20(4):475-481.
[4]王哲鹏,邓学梅,王安如. 乌鸡黑色素对果蝇的紫外辐射保护作用[J]. 中国农业大学学报, 2007, 26(1): 17-21.
[5]宁 华. 工程菌所产黑色素对DNA光保护作用的研究[J]. 培训与研究(湖北教育学院学报), 2000, 17(2): 53-54.
[6]宁 华. 工程菌所产黑色素对生物大分子光保护作用的研究[J]. 华中师范大学学报:自然科学版, 2001, 35(1): 85-88.
[7]Tu Y G, Sun Y Z, Tian Y G, et al. Physicochemical characterisation and antioxidant activity of melanin from the muscles of Taihe black-bone silky fowl (Gallus gallus domesticus Brisson)[J]. Food Chemistry, 2009, 114(4):1345-1350.
[8]Lin L C, Chen W T. The study of antioxidant effects in melanins extracted from various tissues of animals[J]. LIN AND CHEN, 2005, 18(2):277-281.
[9]Ye M, Wang Y, Guo G Y, et al. Physicochemical characteristics and antioxidant activity of arginine-modified melanin from Lachnum YM-346[J]. Food Chemistry, 2012, 135(4):2490-2497.
[10]Panzella L, Gentile G, Derrico G, et al. Atypical structural and pi-electron features of a melanin polymer that lead to superior free-radical-scavenging properties[J]. Angew Chem Int Ed Engl, 2013, 52(48):12684-12687.
[11]Swalwell H, Latimer J, Haywood R M, et al. Investigating the role of melanin in UVA/UVB and hydrogen peroxide-induced cellular and mitochondrial ROS production and mitochondrial DNA damage in human melanoma cells[J]. Free Radical Biology and Medicine, 2012, 52(3):626-634.
[12]Schweitzer A D, Revskaya E, Chu P, et al. Melanin-covered nanoparticles for protection of bone marrow during radiation therapy of cancer[J]. International Journal of Radiation Oncology Biology Physics, 2010, 78(5):1494-1502.
[13]Araújo M, Viveiros R, Correia T R, et al. Natural melanin: a potential pH-responsive drug release device[J]. International Journal of Pharmaceutics, 2014, 469(1):140-145.
[14]Pezzella A, Capelli L, Costantini A, et al. Towards the development of a novel bioinspired functional material: Synthesis and characterization of hybrid TiO2/DHICA-melanin nanoparticles[J]. Materials Science and Engineering, 2013, 33(1):347-355.
[15]王春琳,樊晓旭,余红卫,等. 曼氏无针乌贼墨囊组织学及墨汁形成的超微结构[J]. 动物学报, 2008,54(2): 366-372.
[16]Zhang W, Sun Y L, Chen D H. Effects of chitin and sepia ink hybrid hemostatic sponge on the blood parameters of mice[J]. Mar Drugs, 2014, 12(4):269-281.
[17]杜铁平,周培根. 乌贼墨研究概况[J]. 食品研究与开发, 2002, 23(6): 16-18.
[18]王荣,孙道元,孟昭竑.关于乌贼墨的化学组成[J]. 动物学杂志, 1975, 02(3): 46-47.
[19]Shen C, Xie J, Xu X. The components of cuttlefish (Sepie-lla maindroni de Rochebruns) oil[J]. Food Chemistry, 2007, 102(1):210-214.
[20]宋 茹,祝 颖,俞群娣. 酶解法制备的鱿鱼墨黑色素鉴定及理化性质[J]. 浙江海洋学院学报:自然科学版, 2009,28(1): 95-98.
[21]雷 敏. 鱿鱼墨黑色素及黑色素铁生物活性的研究[D].青岛:中国海洋大学, 2008.
[22]蔡华珍,胥孝俊. 酶法与酸法提取的乌鸡黑色素的性能比较[J]. 食品与发酵工业, 2007,33(4): 65-68.
[23]宋 茹,李厚宝,邓尚贵.鱿鱼墨黑色素酶解法提取工艺优化及其紫外、红外光谱特征分析[J],食品科学, 2011, 32(18):63-67.
[24]李兴旺,王 糙,蒋霞云.从鱿鱼墨中精制黑色素[J],上海水产大学学报,200l,10(3):252-256.
[25]Liu Y, Simon J D. The effect of preparation procedures on the morphology of melanin from the ink sac ofSepiaofficinalis[J]. Pigment Cell Research, 2003, 16(1):72-80.
[26]Mario M, Químico, Paolo P. Purification, characterization and analysis of sepia melanin fromcommercial sepia ink (Sepia Officinalis)[J]. Revista CES Medicina Veterinaria Zootecnia, 2010, 5(2): 18-28.
[27]Liu Y, Kempf V R, Brian N J, et al. Comparison of the structural and physical properties of human hair eumelanin following enzymatic or acid/base extraction[J]. Pigment Cell Research, 2003, 16(4):355-365.
[28]Birbeck M S, Mercer E H, Barnicot N A. The structure and formation of pigment granules in human hair[J]. Experimental Cell Research, 1956, 10(2):505-514.
[29]李 晓,李和生. 酶法提取金乌贼墨汁中黑色素的工艺条件研究[J]. 天然产物研究与开发, 2010, 22(1): 159-162+166.
[30]李和生, 李 晓, 董亚辉,等. 乌贼墨黑色素的超微结构及抗氧化活性研究[J]. 中国食品学报, 2012, 30(10):62-66.
[31]李 欣,田颖刚,谢明勇,等. 乌骨鸡黑色素的提取分离及抗氧化活性研究[J]. 食品科学, 2009, 30(18):117-120.
Research on the extraction method of the melanin fromSepiellamaindroniink
ZHOU Yue-yue, WANG Chun-lin, MU Chang-kao, LI Rong-hua, SONG Wei-wei
(Key Laboratory of Applied Marine Biotechnology, Ministry of Education,School of Marine Science, Ningbo University, Ningbo 315211, China)
The main component ofSepiellamaindroniink is melanin, protein and ash. Highly purified melanin was extracted by enzyme decomposition method. On the basic of analyzing and comparing 6 proteases, including alcalase, dispase, acid proteinase, pepsin, papain and trypsin, the protease with the best hydrolytic result was picked out. By single-factor experiments, the effects of pH, temperature, time and enzyme concentration on the hydrolysis were studied. On that basis, orthogonal design was used to optimize the extractive craft. The experimental results showed that highly purified melanin can be obtained under the condition that 1.5% alcalase was added for 4 h in the condition of 50℃, pH10.5 and substrate concentration of 2%.
Sepiellamaindroni; melanin; enzymolysis; extraction process
2014-08-06;
2014-09-08
国家自然科学基金项目(41206114,41176124);浙江省自然科学基金项目(LQ12C19002);浙江省自然科学基金重点项目(Z3110482);教育部博士点基金资助(20103305110003)
周月越,硕士研究生,E-mail:zhouyueyue2012@126.com;
宋微微,讲师,研究方向为曼氏无针乌贼养殖及其副产品开发,E-mail:songweiwei@nbu.edu.cn。
TS254.9
A
2095-1736(2015)01-0028-05
doi∶10.3969/j.issn.2095-1736.2015.02.028
