蔗糖对紫色土豆微型薯形成及花青素含量的影响
2015-03-22杨瑞娟龚一富杭雨晴王何瑜
杨瑞娟, 龚一富, 郭 伦, 杭雨晴, 王何瑜
(宁波大学海洋学院, 浙江 宁波 315211)
蔗糖对紫色土豆微型薯形成及花青素含量的影响
杨瑞娟, 龚一富, 郭 伦, 杭雨晴, 王何瑜
(宁波大学海洋学院, 浙江 宁波 315211)
为深入探讨蔗糖在植物花青素生物合成过程中的调节作用,以紫色土豆为材料,分析不同蔗糖浓度对紫色土豆外植体生长、花青素含量、微型薯形成以及花青素生物合成相关基因表达的影响。结果表明,紫色土豆外植体在蔗糖浓度为15 g/L时生长情况最好,平均长度最长,平均重量最重,但高浓度蔗糖对外植体生长起抑制作用;蔗糖能促进紫色土豆花青素含量的积累及微型薯的形成,随着蔗糖浓度的增加,花青素含量随之增加,紫色土豆花青素含量在蔗糖浓度为120 g/L时最高,为5.11 mg/g FW,是对照组的8.89倍;蔗糖浓度为60 g/L时,微型薯重量最重,为0.34 g,结实率最高,达到22.50%。RT-PCR结果显示,蔗糖能促进StF3′5′H、StUFGT以及StDFR的表达,蔗糖通过调控此类花青素合成相关基因的表达影响紫色土豆花青素含量。
花青素;蔗糖;微型薯;紫色土豆;基因表达
紫色土豆(Solariumtuberoosum)原产南美洲,是集药用与保健作用为一体的土豆新品种。微型薯是在紫色土豆脱毒试管苗之后生产种薯的新形式,由于微型薯具有体积小、产量高、不易染菌等优点,已被广泛用于种质保存[1]、脱毒苗生产以及基因转移受体中。经色素分离和鉴定结果表明,紫色土豆主要成分为花青素。花青素属黄酮类化合物,具有很强的抗氧化性,有清除氧自由基、抗炎和抗癌等作用[2-4]。近年来,紫色土豆作为一种营养价值高、保健作用强的食物广受关注。
花青素生物合成受到外界因素的调控,前人研究表明,干旱、低温、强光[5]、压力[6]、低氮[7]、芸苔素[8]、赤霉素、蔗糖[9]等均能影响植物花青素生物合成。其中,外源性蔗糖能够显著影响植物花青素的生物合成。利用多种糖类处理花椰菜后发现,蔗糖对花青素含量影响最大,且蔗糖能够促进花椰菜花青素生物合成相关基因的表达[10]。研究表明,蔗糖通过多途径影响植物花青素的生物合成。首先,作为能源物质,蔗糖是植物生长发育和花青素生物合成的保证。在草莓果实发育过程中,外源蔗糖处理可加速果实成熟[11]。苹果的生长发育和着色也需要蔗糖参与[12]。其次,蔗糖是花青素生物合成的前体物质。高浓度蔗糖有利于花青素的积累,在花青素生物合成过程中,蔗糖可能是代谢过程的前体物质和提高基因表达的一个信号分子[13]。第三,蔗糖作为信号转导过程中初级信使因子参与调节植物生命周期中许多重要进程[14],例如,蔗糖能够通过调节细胞内Ca2+和蛋白激酶/磷酸酶这些信号转换器参与植物花青素生物合成[15]。
前人已有关于外源性糖对花青素生物合成及相关基因表达影响的研究,然而,对于蔗糖对紫色土豆花青素的影响机理国内外还未见报道。地上植物如番茄、草莓等在无光照条件下不能着色,而紫色土豆果实在完全遮光条件下仍然能够积累花青素并呈现紫色,可见紫色土豆花青素生物合成调控机制与其他物种有所区别。类黄酮3′5′羟基化酶(F3′5′H)是生成蓝色花色素苷的关键酶,二氢黄酮醇-4-还原酶(DFR)特异催化二氢黄酮醇还原为无色花青素,是花青素显色的决定性酶,UDP-葡萄糖:黄酮类3-O-葡萄糖基转运酶(UFGT)能够使无色不稳定花青素转化为有色稳定的花色素苷。研究蔗糖对此类酶基因表达的影响有助于深入探究完全遮光条件下植物花青素积累的机制。目前,植物花青素合成相关基因的表达、信号转导及调控的机制研究主要集中在花的部位,对于块茎等地下部位的花青素积累机制却鲜有报道。研究植物地下部分花青素合成机制将填补此类研究的空白并为花青素生物合成机理研究提供参考。因此,本实验通过研究蔗糖对紫色土豆花青素积累及其生物合成相关基因表达的影响,为深入探讨植物地下部分花青素积累提供参考,同时也为紫色土豆在医药、卫生领域的发展提供了理论依据。
1 材料与方法
1.1 植物材料与处理
紫色土豆试管苗由宁波大学海洋学院植物组织培养室提供。剪取无菌苗的茎段,接种于MS培养基中继代繁殖,培养温度为(25±1)℃,光照强度为2000 μmol/m2·s,每天光照16 h。培养30 d 后,获得紫色土豆品种无菌试管苗供实验用。
蔗糖对基因诱导表达实验中,把不同浓度蔗糖处理12 h的试管苗作为实验材料。提取2~3 cm长、茎秆略带紫红色的试管苗为材料,在液氮条件下将0.5 g紫色土豆材料研磨成粉末,抽提好的RNA加入RNA酶抑制剂于-70 ℃保存。
1.2 紫色土豆微型薯培养
本实验以紫色土豆为材料,设置4个蔗糖浓度梯度,分别为15 g/L、30 g/L、60 g/L和120 g/L,每个浓度设3个重复,每个重复接种10 瓶,每瓶接种4个外植体,每个重复共40个外植体。不加蔗糖处理的一组为对照组,培养30 d后,用吸水纸吸干微型薯表面水份,在电子天平上称取鲜重和微型薯的重量,记录并计算微型薯的结薯率。
1.3 花青素含量的测定
将含有花青素的紫色土豆外植体剪成0.5 cm左右长短,再用滤纸进行水份吸干。随机取样,在电子分析天平上分别准确称量紫色土豆外植体的新鲜重量,每次称取量在0.1 g±10%,置于试管中。在试管中加入0.3 mL的1%酸性(1% HCl)乙醇,用镊子进行外植体的组织破碎,再加0.7 mL 1%酸性(1% HCl)乙醇定量。所有的试管用封口膜扎紧以防挥发,20℃下在THZ-C恒温振荡器上以95 r/min的速度进行培养18 h,肉眼观察组织完全变白。室温条件下将培养后的组织21500 r/min离心3 min。精密量取离心后上清液0.5 mL与2.5 mL的1%酸性乙醇混合后,将混合液加到1 cm厚比色皿中, 1%酸性(1%HCl)乙醇溶液为空白对照,用722可见分光光度计分别在530 nm波长和657 nm波长下测定花青素的吸光度。每个样品重复测量3次,取平均值。
计算公式:Q=(D530 nm-0.25D657 nm)×M-1。
其中Q为花青素的含量,单位为mg/g FW;D530 nm为花青素在530 nm的吸光度;D657 nm为花青素在657 nm的吸光度;M为花青素的样品质量,单位为g。
1.4 紫色土豆花青素相关基因表达分析
提取不同蔗糖浓度处理的紫色土豆试管苗RNA并检查其浓度。按照TaKaRa公司DNase I 的操作程序,在37 ℃下温浴30 min去除RNA样品中的DNA。每份0.5 μg的RNA样品用于 RT-PCR分析, RT-PCR按照one-step RT-PCR Kit (TaKaRa, Japan) 的操作程序进行。反应中所使用的引物分别为stf3′5′h-F和stf3′5′h-R、stdfr-F和stdfr-R、stufgt-F和stufgt-R(表1),PCR程序:50℃反转30 min;94℃预变性 2 min ; 94℃变性 45 s,60℃ 退火45 s,72℃延伸 2 min,28个循环;72℃延伸10 min;4℃保存。RT-PCR的内参是土豆actin,等量的RNA作为模板,所使用的特异引物是actin-F和actin-R(表1),产物在含溴化乙锭的1%的琼脂糖凝胶上电泳分离检测。

表1 实验所用的 PCR引物
2 结果与分析
2.1 不同浓度蔗糖对紫色土豆外植体生长的影响
研究不同浓度蔗糖对紫色土豆外植体生长的影响,实验结果表明(表2),随着蔗糖浓度的增加,紫色土豆外植体的长度与重量呈先上升后下降的趋势,在蔗糖浓度15 g/L时,紫色土豆外植体的长度达到最大值,为2.99 cm,外植体重量也达到最大值,为0.02 g。蔗糖浓度为120 g/L时,外植体长度和重量均低于对照组,说明高浓度蔗糖能够抑制外植体的生长。方差分析表明不同浓度蔗糖对外植体生长长度与重量有显著影响。
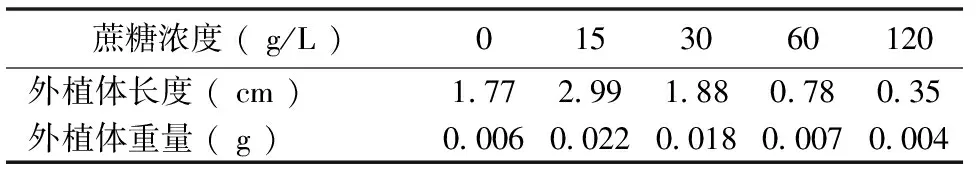
表2 不同浓度蔗糖处理后外植体生长情况
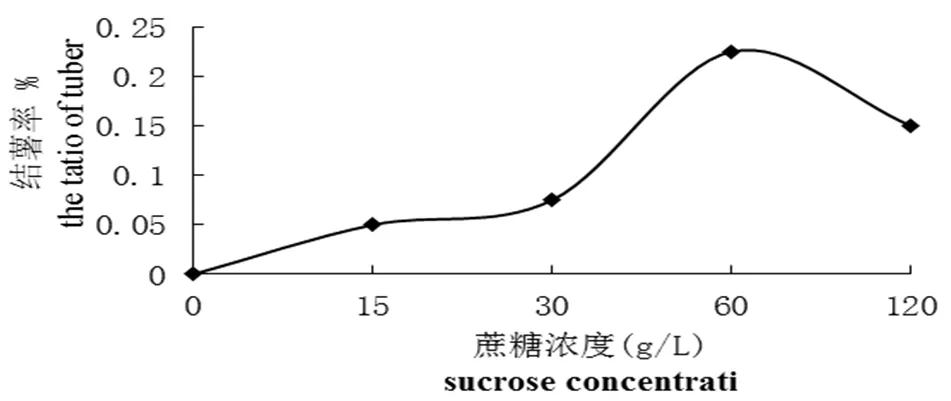
图1 蔗糖浓度对紫色土豆结薯率的影响
Fig 1 The effect of different concentrations of sucrose on the ratio of tuber formation
2.2 不同浓度蔗糖对紫色土豆微型薯形成的影响
研究不同浓度蔗糖对紫色土豆微型薯生长的影响,实验结果表明(图1和图2),在一定蔗糖浓度范围内,紫色土豆结薯率和微型薯重量与蔗糖浓度成正相关。在蔗糖浓度为60 g/L 时结薯率最高,为22.50%,此浓度下微型薯总重量也最重,为0.34 g。对照组中,微型薯结薯率为零,可以看出蔗糖是微型薯形成和生长的必要因素。
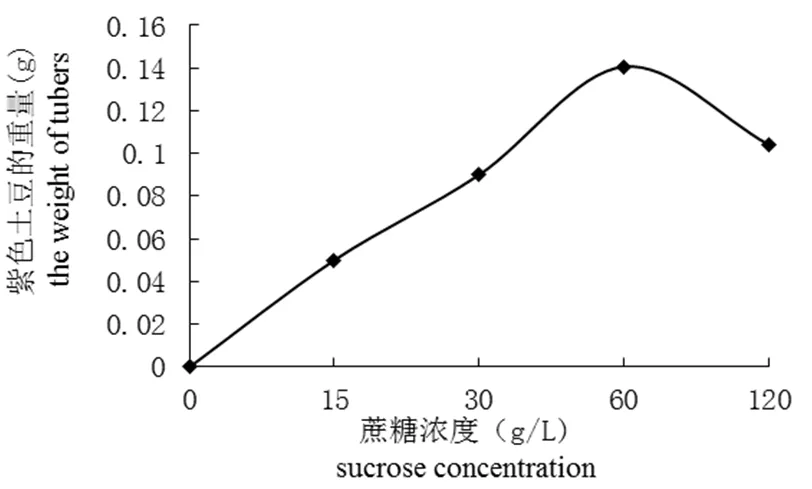
图2 不同浓度蔗糖处理下微型薯的重量
2.3 不同浓度蔗糖对紫色土豆花青素含量的影响
研究不同蔗糖浓度对紫色土豆花青素的影响,实验结果表明(图3 a),随着蔗糖浓度的增加,紫色土豆外植体花青素的含量呈增长趋势。花青素含量在蔗糖浓度为120 g/L时达到最大值,为5.11 mg/g FW,是对照组的8.89倍(对照组花青素含量为0.58 mg/g FW)。方差分析表明,不同浓度蔗糖对紫色土豆花青素含量有高度显著影响。
2.4 不同浓度蔗糖对紫色土豆花青素生物合成相关基因的影响
使用RT-PCR分析StF3′5′H、StDFR以及StUFGT在不同浓度蔗糖处理后在试管苗中的表达情况,结果表明,3个基因的表达均受蔗糖这一因素的诱导。不同浓度蔗糖处理紫色土豆12 h以后,StF3′5′H的表达量随蔗糖浓度的增加而明显增强,StF3′5′H的表达在蔗糖浓度为15 g/L和30 g/L时已有明显的增强;当蔗糖浓度为60 g/L和120 g/L时,StF3′5′H的表达量达到最高,远远大于对照组(图3 b)。StDFR的表达量同样随蔗糖浓度的增加而明显增强,当蔗糖浓度为15 g/L时,StDFR的表达已经有较明显的增强;蔗糖浓度为60 g/L时,StDFR的表达量达到最高;当蔗糖浓度120 g/L时,StDFR的表达量虽比蔗糖60 g/L时略微下降,但仍然远远高于对照组(图3 b)。StUFGT的表达量在不同浓度蔗糖处理试管苗12 h后有明显增强,当蔗糖浓度为15 g/L时,StUFGT的表达无明显增强,与对照组几乎相同;当蔗糖浓度为30 g/L时,StUFGT的表达才有较明显的增强;StUFGT的表达量在蔗糖浓度为60 g/L时达到最高;StUFGT的表达量在蔗糖浓度为120 g/L时略有下降,但仍然明显高于对照组(图3b)。
将不同蔗糖浓度下紫色土豆花青素的含量与此浓度下花青素相关基因的表达情况比较后发现(图3),花青素含量以及StF3′5′H、StDFR和StUFGT的表达均与蔗糖浓度呈正相关。当蔗糖浓度为60 g/L时3个基因表达最强,而花青素含量在蔗糖浓度为120 g/L时达到最高。其中的原因可能是蔗糖浓度为120 g/L时,合成途径中的其他关键酶基因表达继续增强,例如StCHS表达量在蔗糖浓度为120 g/L时显著增强。
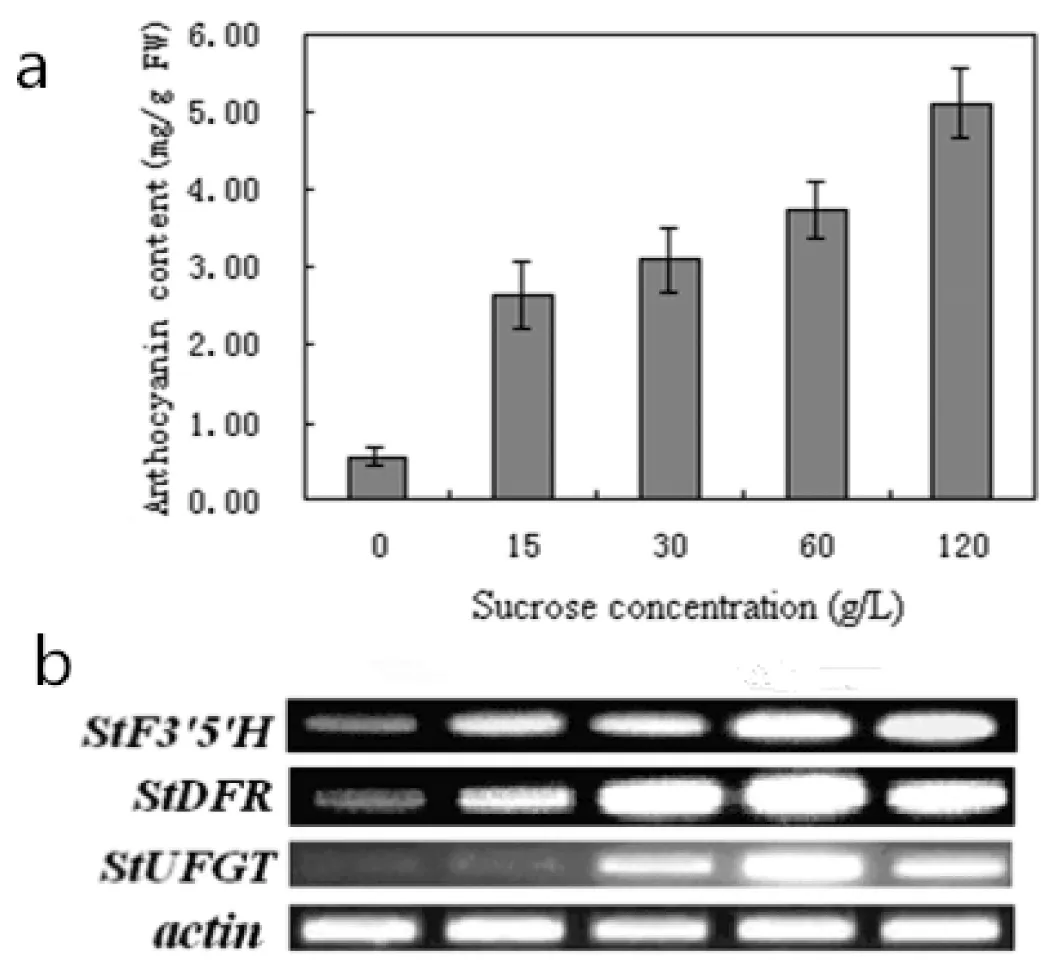
图3 不同蔗糖浓度处理下花青素积累(a)与花青素相关基因表达(b)的关系
3 讨论
蔗糖是影响淮山薯(DioscoreafordiiPrain et Burkill.)珠芽诱导率和平均珠芽数的主导因子[16],高浓度蔗糖可诱导块茎膨大过程中的关键酶——淀粉合成酶的表达。本研究发现,未经蔗糖处理的紫色土豆无微型薯生成,说明淀粉合成酶在无蔗糖情况下未表达或表达较弱,进而阻断了块茎膨大进程。外植体在浓度为15 g/L 时长势最好,高浓度(60 g/L及以上)蔗糖反而抑制外植体生长,但此浓度下微型薯的生长情况最好,一方面考虑营养较多提供微型薯的生长,造成外植体生长弱小;另一方面,高浓度蔗糖自身对外植体生长有抑制作用[17],这与前人研究蔗糖对拟南芥(Arabidopsisthaliana)的影响结果一致[18]。因此在紫色土豆生长过程中,应根据需求的不同,选择不同蔗糖浓度进行培养。
蔗糖诱导植物花青素的积累及其合成途径中相关基因的表达,拟南芥(Arabidopsisthaliana)、矮牵牛(RosahybridaL.)、花椰菜(Brassicaoleracea)等植物花青素生物合成及相关基因表达均受蔗糖调节[19-20]。早期研究结果表明,蔗糖作为前体物质参与植物花青素生物合成;后来,科学家发现蔗糖能够通过提高植物的渗透胁迫能力为花青素生物合成提供动力,蔗糖能够增强拟南芥中花青素色素基因PAP1的表达,进而提高花青素含量,并增强拟南芥的盐胁迫能力[21];植物花青素的生物合成还受蔗糖特异信号通路调控,而外源性蔗糖能够激活蔗糖特异信号通路进而影响花青素生物合成[22]。本研究结果表明,随着蔗糖浓度的增加,花青素含量及合成相关基因表达量逐渐增加,且不同蔗糖浓度对花青素含量的影响与其合成相关基因表达情况基本一致。外源性蔗糖显著诱导StF3′5′H、StDFR和StUFGT的表达,使花青素合成过程中的关键酶高度表达,进而增加紫色土豆花青素含量,说明蔗糖能够通过诱导紫色土豆花青素合成相关酶基因的表达从而调节花青素代谢途径影响花青素的积累。不同种类的可溶性糖对植物花青素生物合成影响不同,其中,蔗糖能够明显提高花青素生物合成,说明培养基中C/N比也是花青素生物合成的影响因素[23]。蔗糖对植物花青素生物合成机理可能通过一些未知的途径进行调控,需要进一步探索。蔗糖是光合产物由叶片或源组织到库组织的主要运输形式[24],紫色土豆地下部分花青素生物合成可能通过运送到块茎的蔗糖诱导合成。本实验研究蔗糖对紫色土豆花青素的生物合成机理,为植物花青素合成代谢调控网络的提供参考。地下部分植物花青素生物合成涉及到复杂的代谢网络,有待于进一步研究。花青素生物合成是类黄酮类物质合成途径的分支模式,后续研究可进一步分析花青素合成途径和其他途径的协调机制。
[1]王梦飞, 田宏先, 裴荣信, 等. 马铃薯腋芽快繁微型薯技术研究[J]. 中国农学通报, 2011, 27(10): 213-217.
[2]袁克星, 王海涛, 常丽新, 等. 月季花色素对运动小鼠抗氧化酶系统及乳酸含量的影响[J]. 河北师范大学学报: 自然科学版, 2011, 35(5): 515-518.
[3]Liu H, Jia W, Zhou Y. Studies on the extraction and stability of Forsythia Anthocyanin[J]. Guangdong Agricultural Sciences, 2010, 10: 054.
[4]Gomez A C, Pérez J L J, Orea A C, et al. Photoacoustic analysis of blue corn pigments in nixtamalized flours[J]. International Journal of Thermophysics, 2006, 27(4): 1274-1280.
[5]宋 明, 孙梓健, 汤青林, 等. 环境胁迫下大头芥花青素积累及其相关结构基因的表达[J]. 中国蔬菜, 2012, 6: 009.
[6]Lea U S, Slimestad R, Smedvig P, et al. Nitrogen deficiency enhances expression of specific MYB and bHLH transcription factors and accumulation of end products in the flavonoid pathway[J]. Planta, 2007, 225(5): 1245-1253.
[7]刘荣直. 光信号和 GAs 在低氮诱导的拟南芥花青素积累中的作用[D]. 兰州:兰州大学, 2013.
[8]袁利兵. 芸苔素影响细胞分裂素诱导拟南芥花青素积累的研究[D]. 长沙:湖南农业大学, 2012.
[9]胡朝阳, 周友凤, 龚一富, 等. 紫色马铃薯查尔酮合成酶基因 (CHS) 的克隆及分析[J]. 中国农业科学, 2012, 45(005): 832-839.
[10]Guo R, Yuan G, Wang Q. Sucrose enhances the accumulation of anthocyanins and glucosinolates in broccoli sprouts[J]. Food Chemistry, 2011, 129(3): 1080-1087.
[11]贾海锋. 蔗糖及茉莉酸信号在草莓果实发育中的作用及其机理分析[D]. 北京:中国农业大学, 2013.
[12]刘玉莲, 车 飞, 郭延平, 等. 苹果着色期花青苷和糖组分含量变化及关联性[J]. 食品科学, 2013, 34(17): 47-52.
[13]Weiss D. Regulation of flower pigmentation and growth: multiple signaling pathways control anthocyanin synthesis in expanding petals[J]. Physiologia Plantarum, 2000, 110(2): 152-157.
[14]Rolland F, Moore B, Sheen J. Sugar sensing and signaling in plants[J]. The Plant Cell Online, 2002, 14(1): S185-S205.
[15]Vitrac X, Larronde F, Krisa S, et al. Sugar sensing and Ca2+calmodulin requirement inVitisviniferacells producing anthocyanins[J]. Phytochemistry, 2000, 53(6): 659-665.
[16]蔡国红, 杨 泉, 李洪波, 等. 蔗糖, 多效唑, ABA, KT 对淮山薯试管珠芽诱导的影响[J]. 热带作物学报, 2010 (9): 1458-1463.
[17]Stewart J L, Maloof J N, Nemhauser J L. PIF genes mediate the effect of sucrose on seedling growth dynamics[J]. PLoS One, 2011, 6(5): e19894.
[18]Cottage A, Mott E K, Kempster J A, et al. TheArabidopsisplastid-signalling mutant gun1 (genomesuncoupled1) shows altered sensitivity to sucrose and abscisic acid and alterations in early seedling development[J]. Journal of Experimental Botany, 2010: erq186.
[19]杨少华, 王 丽, 穆 春, 等. 蔗糖调节拟南芥花青素的生物合成[J]. 中国生物化学与分子生物学报, 2011, 27(4): 364-369.
[20]Ram M, Prasad K V, Kaur C, et al. Induction of anthocyanin pigments in callus cultures ofRosahybridaL. in response to sucrose and ammonical nitrogen levels[J]. Plant Cell, Tissue and Organ Culture, 2011, 104(2): 171-179.
[21]Oh J E, Kim Y H, Kim J H, et al. Enhanced level of anthocyanin leads to increased salt tolerance in Arabidopsis PAP1-D plants upon sucrose treatment[J]. Journal of the Korean Society for Applied Biological Chemistry, 2011, 54(1): 79-88.
[22]Jeong S W, Das P K, Jeoung S C, et al. Ethylene suppression of sugar-induced anthocyanin pigmentation in Arabidopsis[J]. Plant Physiology, 2010, 154(3): 1514-1531.
[23]Ram M, Prasad K V, Kaur C, et al. Induction of anthocyanin pigments in callus cultures ofRosahybridaL. in response to sucrose and ammonical nitrogen levels[J]. Plant Cell, Tissue and Organ Culture (PCTOC), 2011, 104(2): 171-179.
[24]贾晓琳. 外源糖在心里美萝卜幼苗花青素代谢中作用初探[D]. 新乡:河南师范大学, 2013.
Effect of sucrose on minituber formation and the accumulation of anthocyanin in purple potato
YANG Rui-juan, GONG Yi-fu, GUO Lun, HANG Yu-qing, WANG He-yu
(School of Marine Sciences, Ningbo University, Ningbo 315211, China)
To illuminate the sucrose regulation of plant anthocyanin biosynthesis pathway, the effects of different sucrose concentration on the explants growth, anthocyanin accumulation, the minituber formation and the related gene expression involved in anthocyanin biosynthesis in purple potato were investigated. The results indicated that when cultured with 15 g/L sucrose, the explants have the best growth condition, the growth of explants was inhibited at high concentration of sucrose. Sucrose enhanced the contents of anthocyanin and the minituber formation in purple potato. With the increasing of sucrose concentration, anthocyanin accumulation was significantly increased. When treated with 120 g/L sucrose, the contents of anthocyanin achieved the highest value as 5.11 mg/g FW. The minitubers have a heaviest weight (0.34 g) and highest setting rate (22.50%), when treated with 60 g/L sucrose. The related genes involved in anthocyanin biosynthesis includingStF3′5′H,StDFRandStUFGTwere up-regulated by sucrose, implying that the sucrose might control the anthocyanin accumulation by regulating the genes expressions involved in anthocyanin biosynthesis.
anthocyanin; sucrose; minituber; purple potato; genes expression
2014-05-01;
2014-07-10
浙江省自然科学基金项目(LY13C020004)
龚一富,副教授,主要研究方向为植物分子生物学与基因工程,E-mail:gongyifu@163.com。
Q945
A
2095-1736(2015)01-0053-05
doi∶10.3969/j.issn.2095-1736.2015.02.053
