硒对紫云英的Hormesis效应及其生理响应研究
2015-03-22袁菊红胡绵好
张 娜, 袁菊红, 胡绵好
(1. 江西财经大学 旅游与城管管理学院, 南昌 330032;2. 江西财经大学 艺术学院, 南昌 330032)
硒对紫云英的Hormesis效应及其生理响应研究
张 娜1, 袁菊红2, 胡绵好1
(1. 江西财经大学 旅游与城管管理学院, 南昌 330032;2. 江西财经大学 艺术学院, 南昌 330032)
采用水培方法,研究硒(Se)不同浓度(0、0.2、0.5、1.0、1.5、2.0、2.5和5.0 mg/L) 胁迫下紫云英的生长特征,探讨低浓度Se对紫云英的Hormesis效应,评价Se胁迫下紫云英的生理响应。结果表明,低浓度Se (≤ 0.5 mg/L) 对紫云英根系相对伸长率、耐性指数、根系活力、叶绿素a含量、叶绿素b含量和类胡萝卜素含量均有显著的刺激效应,分别比对照增加了68.26%,9.00%,38.10%,21.6%,24.3%和66.7%;对其叶片蒸腾速率和叶片含水量也表现出一定的促进作用;Se浓度≥1.0 mg/L对紫云英的生长有明显的抑制作用。Se浓度为5.0 mg/L时,紫云英地上部Se 含量达到(73.03 ± 1.151)μg/g DW,地下部Se 含量达到(48.427±1.525)μg/g DW。Se对紫云英产生Hormesis效应的剂量范围为0.2~0.5 mg/L。结果还表明,根系MDA含量、根系相对电导率、地下部分生物量、根系耐性指数、根系活力、根系相对伸长率和地上部生物量这7项指标在评价紫云英幼苗耐Se性方面比较重要。
紫云英; 硒胁迫; Hormesis效应; 生理特性
硒(Se) 是动物和人类生命必需的营养元素之一,也是植物生长所需的一种有益元素[1],其不仅具有刺激植物生长发育和提高作物产量与品质,促进植物新陈代谢,增强植物生物抗氧化作用,还具有拮抗其它重金属的作用。Se的特殊作用及中国大部分地区缺Se的现状使得从食物中获取Se成为提高人体Se水平的重要而有效的途径[2],因此,Se在农业生产、人畜健康和环境保护中的重要性已越来越受到国内外的关注。低浓度Se可促进植株生长,提高产量及品质,但高浓度Se反而对植物造成一定的毒害作用,如低浓度Se (<3.81 mg/kg) 可使小白菜、芥菜、生菜和菠菜的株高、根长、根径、地上部和地下部生物量明显增加,而Se浓度>29.91 mg/kg 时对这些蔬菜根茎产生的毒害作用[3]。低浓度Se(≤1.0 mg/L) 处理可明显促进花椰菜、苜蓿和欧芹根的生长,但当Se处理浓度大于1.0 mg/L时,花椰菜、苜蓿和欧芹根的生长明显受到抑制[4]。这种在低浓度时对植物生长表现刺激作用,而高浓度时表现出抑制作用的现象,称为Hormesis效应,它广泛存在于各类生物、各类毒物及各类生命现象中[5]。近年来,有关土壤施Se或叶面喷施Se肥对植物富硒及其对重金属拮抗作用[6]和Se在不同蔬菜中的转运、积累等方面的研究较多[3, 7],但对低浓度Se对植物的Hormesis效应的研究较少。
紫云英 (Astragalussinicus) 是豆科黄芪属一年或越年生草本植物,是重要的冬季绿肥作物,不仅具有农用、食用、药用价值和富硒特性等[8],还具有改良土壤,提升土壤肥力,增加土壤有机质含量,减少土壤重金属含量[9],提高种植区食物链中硒含量和保护农业生产环境的作用。目前中国大多数地区种植的紫云英,主要用于绿肥生产、花卉观赏及其富硒食品的开发[8]。虽然紫云英的富硒特性[10]及其对重金属Cu、Zn和Pb的胁迫效应[11]已有报道,但有关Hormesis 效应在紫云英中出现的规律和特征却鲜见报道。因此,本研究通过水培试验,研究低浓度Se胁迫下紫云英的生长特性,观察其Hormesis效应特征和规律,探讨紫云英幼苗适应 Se 胁迫相关的生理机制,对其它牧草植物Hormesis效应研究及其整体抗逆性的提高具有理论指导意义,也为富硒紫云英在农业生态环境和预防硒缺乏促进健康等综合开发利用方面提供理论参考。
1 材料与方法
1.1 试验材料及预处理
紫云英 (Astragalussinicus) 种子购自江西省南昌市花鸟市场。试验于2013年10月在江西财经大学江西省生态环境实验中心实验室进行。挑选大小均匀饱满的紫云英种子100粒,用0.1%的HClO 溶液消毒 10 min,用水洗净,均匀播种在装有沙子的育苗盘中,浇透水,在室内条件下培养,待小苗长出第 2 片真叶时,挑选长势一致的幼苗,移入水培装置中,每盆 4束苗 (15株/束),先用自来水培养2周,待长出2~3片营养叶根长达到5 cm时,挑选长势一致的幼苗,用1/4 Hoagland 营养液预培养1周,再在1/2 Hoagland营养液中培养1周,最后在全营养液中培养2周后再更换为含不同浓度 Se 的培养液进行处理。
1.2 试验设计
添加Na2SeO3到营养液中,设置8个Se浓度梯度:0.0 (对照)、0.2、0.5、1.0、1.5、2.0、2.5和5.0 mg/L。试验在实验室内进行,水培容器放在靠近窗边的试验台上。每处理24株苗,3次重复。试验期间每天补水1次,5 d换1次营养液,所有处理溶液的 pH 值保持在6.5±0.1,处理18 d后收获并进行指标测定。
1.3 测定项目与方法
1.3.1 生理指标测定方法
分别采集各处理组所有紫云英幼苗的根和叶片,洗净后直接用于各项生理指标的测定。叶片相对含水量采用烘干称量法测定[12];叶绿素含量采用丙酮提取-紫外分光光度计法测定[12];根系活力采用 TTC法测定[13];根系中丙二醛(MDA)含量采用硫代巴比妥酸法测定[13];根系相对电导率采用电导率仪测定[14];根系脯氨酸含量采用酸性茚三酮法测定[13];用美国 Gene 公司的 LI -6400XT 光合仪测定紫云英幼苗叶片蒸腾速率。根系耐性指数 = 各处理根系长度/对照根系长度。相对根伸长率测量用直尺直接测量紫云英幼苗根系处理前后的长度,计算相对根系伸长率 (每个处理共测20条幼根重复10次)。相对根伸长率定义为:

式中,RLSet为Se处理t时间后根长;RLSe0为Se处理前根长;RLCt为对照处理t时间后根长;RLC0为对照处理前根长。
1.3.2 生物量及Se含量的测定方法
用不锈钢剪刀将紫云英的地上和地下部分分离,用自来水冲洗干净后,用去离子水冲洗多次并用滤纸吸干表面水分,用BS224S型千分之一电子天平称其鲜重后放入恒温箱中先在105℃下杀青30 min,再在75℃烘干至恒重,称其干重。部分样品研磨成粉后用HNO3-HClO4进行消化(体积比3∶1),采用紫外分光光度法测定其Se含量[15]。
1.4 数据处理
所有数据均为3次重复的平均值,采用Origin8.5和DPSv14.50软件进行数据统计分析及作图,采用最小显著差异法(LSD)进行差异显著性检验,表中数据为平均数 ± 标准误差;用变量的相关矩阵提取公因子,采用最大旋转法进行主成分分析。
2 结果与分析
2.1 Se处理对紫云英根系相对生长率、根系耐性指数和根系活力的影响
由表1可知,随着Se浓度的升高,紫云英幼苗根系相对伸长率、耐性指数和根系活力呈先上升后下降的趋势,且不同浓度处理间存在明显的差异。当Se浓度为0.5 mg/L时,相对伸长率、耐性指数和根系活力分别比对照增加了68.26%、9.00%和38.10%,表现出显著的促进作用;当Se浓度≥1.0 mg/L时,紫云英幼苗相对伸长率、耐性指数和根系活力均呈明显下降趋势,分别比对照下降了53.16%、30.70%和25.40%。由此可见,低浓度Se (≤0.5 mg/L) 促进了紫云英幼苗根系生长及其耐性指数和根系活力的增加,而高浓度Se (≥1.0 mg/L) 却明显抑制了紫云英幼苗根系生长,具有典型的Hormesis效应特征。

表1 不同浓度Se处理对紫云英幼苗根系相对伸长率、耐性指数及根系活力的影响
同一列中数据用 LSD检验, 不同字母表示差异显著(P<0.05);下同。

表2 不同浓度Se处理对紫云英幼苗根系相对电导率、
2.2 Se处理对紫云英根系相对电导率、MDA和脯氨酸含量的影响
由表2可知,随着Se浓度的升高,紫云英幼苗根系MDA含量、游离脯氨酸含量和相对电导率呈先上升后下降的趋势,但均比对照高。当Se浓度为1.0 mg/L时,MDA含量、相对电导率和游离脯氨酸含量分别比对照增加了47.27%、38.05%和194.05%。这说明Se胁迫加剧了紫云英幼苗根系膜脂过氧化水平,细胞质膜相对透性也随胁迫浓度的升高而增大,同时根系中积累了大量游离脯氨酸,这可能是紫云英幼苗根系对逆境胁迫的一种适应性响应。
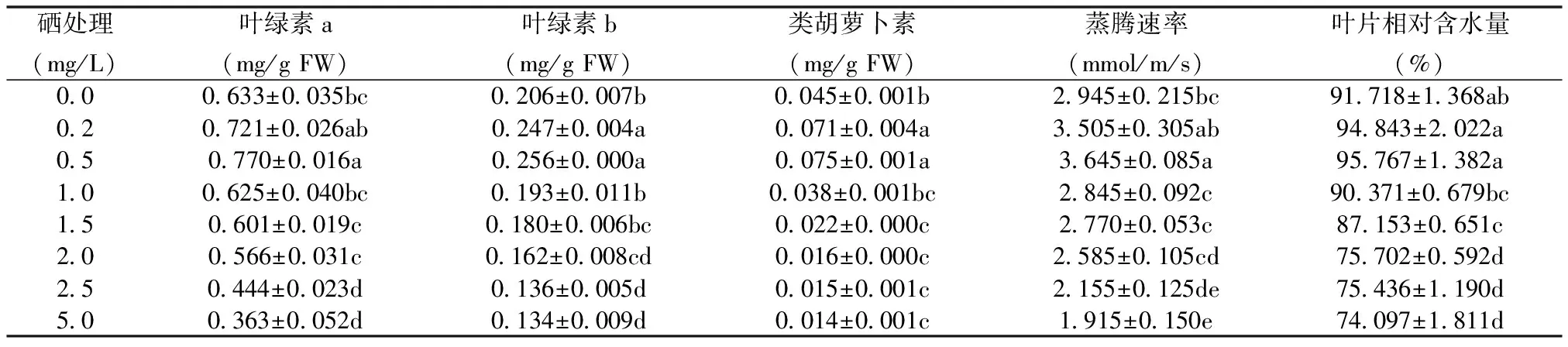
表3 不同浓度Se处理对紫云英叶片光合色素含量、蒸腾速率和叶片相对含水量的影响
2.3 Se处理对紫云英叶片光合色素含量、蒸腾速率和叶片相对含水量的影响
由表3可知,当Se浓度为0.2和0.5 mg/L时,与对照相比,叶绿素a含量分别增加了13.9%和21.6%;叶绿素b含量分别增加了19.9%和24.3%;类胡萝卜素含量分别增加了57.8%和66.7%,表明低浓度Se (≤ 0.5 mg/L) 对紫云英叶片光合色素含量表现出不同程度的促进作用;而当Se浓度 ≥ 1.0 mg/L时,叶绿素a、b和类胡萝卜素含量均显著降低,且Se浓度为5.0 mg/L时,叶绿素a、b和类胡萝卜素含量分别比对照显著减少42.7%、35.0%和68.9%。由此可见,Se对紫云英幼苗表现出低剂量促进高剂量抑制的双相剂量-反应现象,具有明显的Hormesis效应特征。由表3还可知,低浓度Se (≤0.5 mg/L) 处理的紫云英叶片蒸腾速率与对照相比呈明显上升趋势,当Se处理浓度增大至5.0 mg/L 时,紫云英幼苗叶片蒸腾速率与对照相比呈显著下降趋势。不同浓度Se处理18d后,低浓度Se (≤0.5 mg/L) 处理的紫云英幼苗叶片相对含水量呈升高趋势,但与对照相比差异不显著,表明低浓度Se(≤0.5 mg/L)处理未造成叶片水分失调,而表现出一定程度的促进作用;当Se浓度为5.0 mg/L时,叶片相对含水量显著降低(为对照的19.2%),说明高浓度Se对紫云英幼苗叶片体内的水分平衡有显著影响。
2.4 Se处理对紫云英幼苗Se积累和生物量的影响
由图1A可知,Se浓度为0.5 mg/L时,地上部和地下部干重分别比对照增加了17.2%和12.0%,表现出明显的促进作用;而Se浓度≥2.5 mg/L时,紫云英幼苗地上部和地下部干重分别比对照显著减少31.1%和52.6%。可见,低浓度Se (≤0.5 mg/L) 处理促进了紫云英幼苗的生长,而高浓度Se (≥2.5 mg/L) 处理却抑制了其生长,也具有典型的Hormesis效应特征。由图1B还可知,紫云英幼苗地上部和地下部的Se含量呈现出地上部大于地下部的分布格局,当Se浓度为5.0 mg/L时,地上部Se 含量为(73.03±1.151)μg/g DW,地下部Se含量为(48.427±1.525)μg/g DW。由此可见,高浓度Se处理的紫云英幼苗仍有很强的Se积累能力。

图1 不同浓度Se处理对紫云英幼苗Se积累和生物量的影响
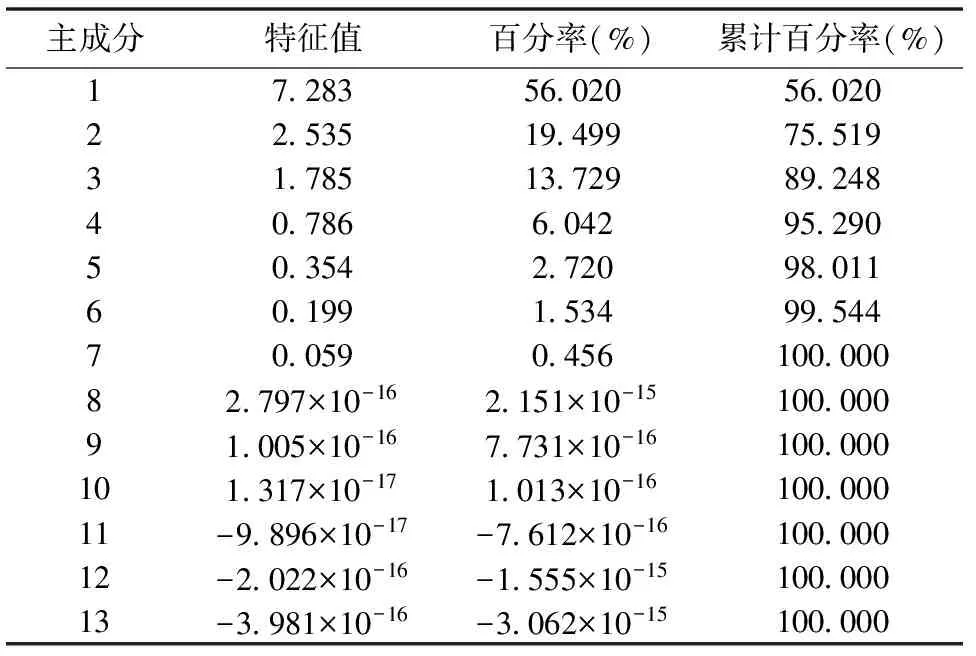
主成分特征值百分率(%)累计百分率(%)17283560205602022535194997551931785137298924840786604295290503542720980116019915349954470059045610000082797×10-162151×10-1510000091005×10-167731×10-16100000101317×10-171013×10-1610000011-9896×10-17-7612×10-1610000012-2022×10-16-1555×10-1510000013-3981×10-16-3062×10-15100000
2.5 Se胁迫效应与生理指标的关系
由表4可知,前3个主成分累积百分率为89.248%,表明前3个主成分可代表全部因子89.248%的综合信息,后10个主成分在反映紫云英对Se 胁迫的生理响应中仅为10.752%。因此,前3个主成分反映了Se 胁迫对紫云英幼苗生理特性的重要主成分。由于主成分是由13个生理指标组成,根据计算相关矩阵的特征向量,有表5可得出主成分的函数式:
Y1=0.933X1+0.953X2+0.936X3+0.657X4-0.116X5+0.451X6-0.582X7+0.469X8-0.954X9-0.966X10+0.087X11+0.815X12+0.953X13
Y1=0.185X1-0.005X2-0.236X3-0.036X4+0.964X5-0.756X6+0.598X7+0.684X8-0.194X9-0.198X10-0.036X11-0.020X12+0.199X13
Y1=-0.261X1-0.243X2-0.204X3+0.667X4-0.005X5+0.391X6+0.300X7+0.250X8-0.102X9-0.108X10+0.904X11-0.018X12-0.164X13
由以上函数式可以看出,在3个主成分方程中,第1主成分中根系MDA含量的系数最大,其次分别是根系相对电导率、地下部分干重、耐性指数、根系活力、根系相对伸长率和地上部分干重,可认为是反映这些变量的综合指标;第2主成分中叶绿素b含量的系数最大,可认为是反映叶绿素b含量的综合指标;第3主成分中根系中游离脯氨酸含量的系数最大,可以认为是反映游离脯氨酸含量的综合指标。由表6还可知,根系MDA含量、根系相对电导率、地下部分生物量、根系耐性指数、根系活力、根系相对伸长率和地上部生物量等指标具有明显的相关性。由此可见,根系MDA含量、根系相对电导率、地下部分生物量、根系耐性指数、根系活力、根系相对伸长率和地上部生物量可以作为评价紫云英幼苗耐Se性指标。

表 5 各生理指标相关矩阵
3 讨论
3.1 Se对紫云英幼苗的Homesis效应分析
目前,有关小剂量重金属、农药残留、UV-B辐射及稀土元素的兴奋效应研究已成为国际社会Hormesis研究的核心领域[5]。如低浓度Cr6+(≤0.05 mg/L)对小球藻产生刺激效应,而当Cr 浓度达到1.0 mg/L,在pH值为8时对小球藻产生了显著的抑制作用[16]。低浓度Cd(≤1.0mg/kg) 可增加小白菜干重及其叶绿素含量,当Cd浓度达到5mg/kg时,其干重和叶绿素含量明显降低;小白菜叶绿素含量也随着酸雨的加重而降低[17]。本研究结果表明,低浓度Se (≤ 0.5 mg/L) 处理对紫云英幼苗的根长、植株生物量、叶片光合色素含量、根系相对伸长率、蒸腾速率等均表现显著的刺激作用,而高浓度Se (≥ 1.0 mg/L) 处理则表现明显的抑制作用,这符合Hormesis效应的特征规律。虽然已证实了Hormesis效应是一种客观存在的剂量-反应现象[18],但由于环境中多种机制共同调节,致使毒物刺激作用机制仍需进一步研究。紫云英作为一种新的富硒植物模型,对其毒物刺激效应的潜在机制也亟待进一步探讨。
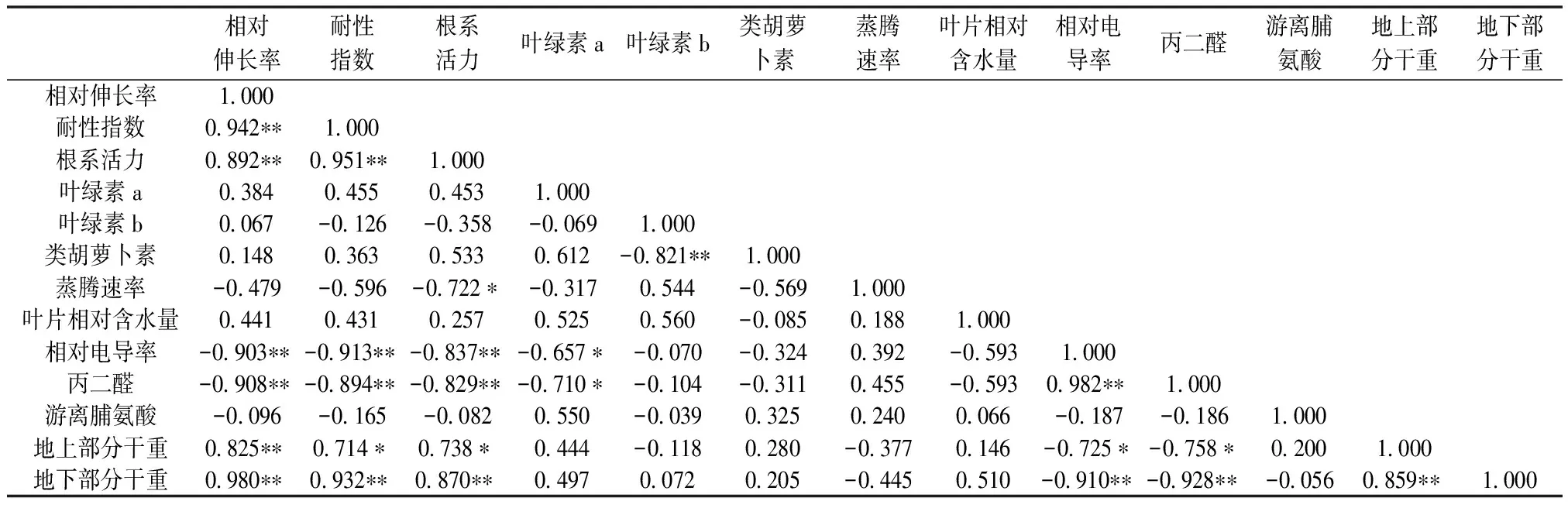
表 6 不同浓度Se处理下紫云英胁迫指标的相关性分析
“**”—在0.01水平上显著相关;“*”—在0.05水平上显著相关。
3.2 紫云英幼苗对Se不同浓度胁迫的生理响应分析
重金属胁迫下,植株将污染物通过根系再到全株各器官、组织中,在污染物达到一定浓度下植株根系就表现出不同程度的受害特征。根系长度是反映根系生长发育状况的一个指标;根系活力与根系生命活动的强弱有直接的关系,在各种逆境胁迫下能否维持较高的根系活力是植物抗逆性强弱的一种体现[19]。根系耐性指数是各处理的根系长度与对照的根系长度的比值,是用来反映植物对重金属耐性大小的重要指标[20]。本研究结果表明,紫云英幼苗根系相对伸长率、耐性指数和根系活力随着Se浓度的升高而下降,说明随Se 浓度逐渐增强,根系受Se的毒害作用加重,根系活力明显降低。该结果与徐惠风等[20]研究结果相一致。
MDA是膜脂质过氧化作用的产物,其含量的高低代表膜脂质过氧化作用的程度[21],是植物膜系统受伤害的重要指标之一。相对电导率的变化可以反映植物细胞膜的伤害程度,一定程度上也可以反应植物的抗逆能力[14]。脯氨酸是细胞内重要的渗透调节物质,具有调节细胞渗透平衡、增强细胞结构稳定性和阻止氧自由基产生的作用,它与植物体内活性氧自由基的清除以及膜脂过氧化作用的减轻有密切的关系[21]。本研究结果表明,紫云英幼苗根系MDA含量和相对电导率随着Se胁迫浓度的升高而增加,但游离脯氨酸含量则呈现先上升后下降的明显趋势,说明Se胁迫加剧了紫云英幼苗根系膜脂过氧化水平,细胞质膜透性也随之增大,且随着Se浓度的提高,游离脯氨酸抗逆性作用下降,这可能是紫云英幼苗根系对逆境胁迫的一种适应性响应。该结果与Liu等[22]人的研究结果相似。
叶绿素是含量的变化既可反映植物叶片光合作用功能的强弱,也可反映环境胁迫对植物的损害程度[23]。本研究结果表明,紫云英幼苗叶片中叶绿素a、b和类胡萝卜素含量均随Se浓度的增加呈先上升后下降的趋势。低浓度Se(≤0.5 mg/L) 处理可提高紫云英幼苗叶绿素的含量,这可能与Se对叶绿素合成过程起调节作用的、含巯基的两个酶作用有关[24];而高浓度Se (≥1.0 mg/L)处理却明显降低叶绿素的含量,这说明高浓度Se处理破坏了紫云英幼苗叶片的光合能力。类胡萝卜素是一种在植物体内普遍存在的色素,具有抑制活性氧的产生和清除活性氧的功能[25],可保护植物体免受活性氧的伤害,对保护光合器官免受有毒物质破坏起重要作用。本研究结果发现,低浓度Se (≤ 0.5mg/L) 对紫云英类胡萝卜素的刺激效应较叶绿素显著;高浓度Se (≥1.0 mg/L) 处理则使类胡萝卜素含量降低,但各处理间差异不显著,说明Se并未对类胡萝卜素的合成造成较大伤害,其所具有的生物学功能仍在发挥着作用。Seth 等[26]的实验结果也证明了这一点。蒸腾作用是植物吸收水分和转运水分的主要动力,能维持植物各部分的水分饱和,保持细胞组织的形态,促进无机盐类在植物体内的分布,且能将植物在光合作用和氧化代谢中产生的多余热能散出。本研究结果表明,低浓度Se (≤0.5 mg/L) 处理的紫云英叶片蒸腾速率和叶片相对含水量呈上升趋势,但叶片相对含水量与对照相比差异不明显,这与Lou等[27]对Cd胁迫的研究结果相似。
紫云英属豆科黄芪属作物,黄芪属大多数植物富硒能力较强[11]。本研究发现,紫云英幼苗地上部和地下部的Se含量均随着Se处理浓度的增加而增加,呈现出地上部大于地下部的分布格局。当Se浓度为5.0 mg/L时,地上部和地下部富集Se含量达到最大值,表明在高浓度Se胁迫下,紫云英仍有较强的积累能力,这为紫云英富硒产品及其富硒农畜产品的研制提供可靠的理论依据。3.3 紫云英幼苗生理响应指标与Se胁迫的相关性分析
选择评价植物Se 耐受性的方法和指标,在理论和实践中都有重要意义。主成分分析法是近年来应用植物耐受性评价指标选择较多的方法[28],如通过主成分分析表明,相对电导率、SOD活性、MDA含量、脯氨酸含量、根系相对含水量5项指标可作为黄瓜根系对Na2CO3耐性评价指标[29];根长、株高、地上鲜重、地下鲜重和根系耐性指数从一定程度上可反映植物对重金属Cu的耐性大小[30]。本研究利用主成分法对13个生理指标进行综合评价分析,认为根系MDA含量、根系相对电导率、地下部分生物量、根系耐性指数、根系活力、根系相对伸长率和地上部生物量可作为评价紫云英幼苗耐Se性指标,这为牧草耐Se性评价提供可行的数量化鉴定指标。
4 结论
1)低浓度Se处理(≤ 0.5 mg/L) 对紫云英幼苗生长有一定的刺激作用,表现出明显的毒物刺激效应,Se对紫云英产生毒物刺激效应的剂量范围为0.2~0.5 mg/L。
2)根系MDA含量、根系相对电导率、地下部分生物量、根系耐性指数、根系活力、根系相对伸长率和地上部生物量可以作为评价紫云英幼苗耐Se性指标。
[1]郭 艳, 张江萍, 刘 和. 微量元素硒在园艺植物中的生理功能研究进展[J]. 中国农学通报, 2013, 29(01): 76-79.
[2]张杨杨, 焦自高, 艾希珍, 等. 硒对植物的生理作用及富硒瓜菜研究进展[J]. 中国瓜菜, 2014, 27(1): 5-9.
[3]段曼莉, 付冬冬, 王松山, 等. 亚硒酸盐对四种蔬菜生长、吸收及转运硒的影响[J]. 环境科学学报, 2011, 31(3): 658-665.
[4]毛 晖, 王朝 辉. 硒的价态与浓度水平对6种植物种子发芽和根际生长的影响[J]. 农业环境科学学报, 2011, 30(10): 1958-1965.
[5]郭兰萍, 张小波, 杨 光, 等. Hormesis 及其在药用植物生产中的应用[J]. 中国中药杂志, 2011, 26(5): 525-529.
[6]吴之琳, 童心昭, 尹雪斌, 等. 硒提高植物拮抗重金属毒性的研究进展[J]. 粮食科技与经济, 2014, 39(2): 22-27.
[7]Ramos S J, Faquin V, Guilherme L R G. Selenium biofortification and antioxidant activity in lettuce plants fed with selenate and selenite[J]. Plant Soil and Environment, 2010, 56(12): 584-588.
[8]林新坚, 曹卫东, 吴一群, 等. 紫云英研究进展[J]. 草业科学, 2011, 28(01): 135-140.
[9]唐明灯, 艾绍英, 李盟军, 等. 紫云英对污染土壤上叶菜生长及其镉和铅含量的影响[J]. 中国环境科学,2011, 31(3): 461-465.
[10]王建红, 曹 凯, 张 贤, 等. 施用有机硒肥生产富硒紫云英嫩梢菜的可行性研究[J]. 浙江农业学报, 2011, 23(1): 141-143.
[11]倪才英, 陈英旭, 骆永明, 等. 紫云英 (AstragalussiniucusL.) 对重金属胁迫的响应[J]. 中国环境科学, 2003, 23(5): 503-508.
[12]吴际友, 李志辉, 刘 球, 等. 干旱胁迫对红椿无性系幼苗叶片相对含水量和叶绿素含量的影响[J]. 中国农学通报, 2013, 29(04): 19-22.
[13]张 萌, 张永清. 不同品种糜子幼苗根系对干旱胁迫的生物学响应[J]. 作物杂志, 2013(5): 98-103.
[14]王水良, 王 平, 王趁义. 铝胁迫对马尾松幼苗根系形态及活力的影响[J]. 生态学杂志, 2010, 29(11): 2097-2101.
[15]付 明, 卢嫣红, 姚元枝, 等. 紫外分光光度法测定藜蒿的硒含量[J]. 江苏农业科学, 2009(5): 240-241.
[16]赵 娜, 朱 琳, 冯鸣凤. 不同pH条件下Cr6+对3种藻的毒性效应[J]. 生态毒理学报, 2010, 5(5): 657-665.
[17]王星辉, 杨海君, 颜丙花, 等. 镉、酸雨和农药复合污染对小白菜产量和品质的毒性效应[J]. 湖南农业科学, 2011(1): 85-88.
[18]Jia L, He X Y, Chen W, et al. Hormesis phenomena under Cd stress in a hyperaccumulator-LonicerajaponicaThunb[J]. Ecotoxicology, 2013, 22(3): 476-485.
[19]吴恒梅, 纪 艳, 姜 成, 等. 重金属镉对丝瓜种子萌发及根系活力的影响[J]. 北方园艺, 2012(11): 38-40.
[20]徐惠风, 杨成林, 王丽妍, 等. 铅胁迫对金盏银盘的生长及其根系耐性的影响[J]. 东北林业大学学报, 2011, 39(1): 52-53, 61.
[21]王小平, 吴向华, 毛善国. 盐胁迫对九粒白根系活力及叶绿素含量与抗性生理的影响[J]. 北方园艺, 2013(10): 32-34.
[22]Liu J J, Wei Z, Li J H. Effects of copper on leaf membrane structure and root activity of maize seedling[J]. Botanical Studies, 2014, 55:47 (doi:10.1186/s40529-014-0047-5).
[23]努尔古丽·阿木提, 陆海燕, 努尔巴依·阿布都沙力克, 等. 重金属污染下芦苇叶片叶绿素含量的变化研究[J]. 北方园艺, 2012(21): 57-60.
[24]Shinmachi F, Buchner P, Stroud J L, et al. Influence of sulfur deficiency on the expression of specific sulfate transporters and the distribution of sulfur, selenium, and molybdenum in wheat[J]. Plant Physiology, 2010, 153(1): 327-336.
[25]李新扬, 徐元元, 公玲玲, 等. 茚虫威对玫瑰三节叶蜂叶绿素和类胡萝卜素含量的影响[J]. 生物安全学报, 2013, 22(4): 261-264.
[26]Seth K, Aery N C. Effect of boron on the contents of chlorophyll, carotenoid, phenol and soluble leaf protein in Mung Bean,Vignaradiate(L.) Wilczek[J]. Proc Natl Acad Sci, India, Sect B Biol Sci, 2014, 84(3): 713-719.
[27]Lou Y H, Luo H J, Hu T, et al. Toxic effects, uptake, and translocation of Cd and Pb in perennial ryegrass[J]. Ecotoxicology, 2013, 22(2): 207-214.
[28]徐心诚. 主成分分析法对番茄品种耐弱光性的综合评价[J]. 中国农学通报, 2012, 28(04): 135-140.
[29]孙涌栋, 谷永庆, 罗未蓉, 等. 黄瓜幼苗根系对 Na2CO3胁迫的适应机制研究[J]. 西南大学学报:自然科学版, 2008, 30(8): 91-95.
[30]李 影, 王友保. 4种蕨类草本植物对Cu的吸收和耐性研究[J]. 草业学报, 2010, 19(3): 191-197.
Study of selenium on hormesis effect and physiological response ofAstragalussinicus
ZHANG Na1, YUAN Ju-hong2, HU Mian-hao1
(1. School of Tourism and Urban management, Jiangxi University of Finance & Economics, Nanchang 330032;2. College of art, Jiangxi University of Finance&Economics, Nanchang 330032, China)
A hydroponic experiment was conducted to investigate the growth characteristics ofAstragalussinicusunder selenium (Se) stress (0, 0.2, 0.5, 1.0, 1.5, 2.0, 2.5 and 5.0 mg/L), to investigate the Hormesis effect of low concentration Se onA.sinicus, and to evaluate the physiological response ofA.sinicusto Se stress. The results showed that at low concentration of Se (≤ 0.5 mg/L) treatments, relative root elongation, root tolerance index, root activity, chlorophyll a contents, chlorophyll b contents, and carotenoid contents ofA.sinicusincreased significantly by 68.26%, 9.00%, 38.10%%, 21.6%, 24.3%, and 66.7%, respectively, as compared with that of the control. In addition, Se (≤ 0.5 mg/L) treatments also had a certain roleinpromotingtranspiration rate and relative water content of leaf. However, when the concentration of Se wasgreaterthanorequalto1.0 mg/L, the growth ofA.sinicuswasinhibited significantly. When the Se concentration was 5.0 mg/L, the Se contents in the shoot and root ofA.sinicusreached to (73.03±1.151)μg/g DW and (73.03±1.151)μg/g DW, respectively. The dose range of the hormesis effect of Se onA.sinicuswas0.2-0.5 mg/L. The result also showed that MDA content, relative conductivity, root biomass, root tolerance index, root activity, relative root elongation, and shoot biomass were important indicators in Se stress evaluation ofA.sinicusseedlings.
Astragalussinicus; selenium stress; hormesis effect; physiological characteristic
2014-08-13;
2014-09-08
国家自然基金资助项目(21407069, 21367013, 41001376); 国家大学生创新创业训练计划项目(201410421019)
张 娜,硕士研究生, 研究方向为环境绿色修复, E-mail:1012080797@qq.com;
胡绵好,博士后,副教授,研究方向为环境绿色修复及评价,E-mail: yankeu@gmail.com。
X171.5
A
2095-1736(2015)02-0042-06
doi∶10.3969/j.issn.2095-1736.2015.02.042
