振动训练对制动大鼠单一肌梭电生理活动的影响
2015-03-22赵雪红樊小力
赵雪红, 高 艳, 樊小力
(1. 湖北文理学院医学院, 湖北 襄阳 441053;2. 西安交通大学医学部, 西安 710061)
振动训练对制动大鼠单一肌梭电生理活动的影响
赵雪红1, 高 艳1, 樊小力2
(1. 湖北文理学院医学院, 湖北 襄阳 441053;2. 西安交通大学医学部, 西安 710061)
采用石膏固定建立后肢制动模型,用空气隔绝法记录大鼠单一肌梭的电生理活动,用振动仪给制动+振动组比目鱼肌施加高频振动,7 d后观察大鼠制动侧比目鱼肌肌梭的电生理活动变化。比目鱼肌的湿重与非制动侧相比降低了15.33%±4.76%(P<0.05);有自发放电的肌梭数量减少(P<0.05);静息放电频率降低(P<0.05)。制动期间施加高频振动组,比目鱼肌湿重减少的程度明显降低(P<0.05);自发放电的肌梭数量、肌梭的放电频率明显高于制动组(P<0.05)。制动期间的肌肉振动对制动所致肌梭电生理活动特性的改变有明显的对抗作用。
制动;肌萎缩;肌梭;电生理;肌肉振动
大量研究资料表明,肢体脱负荷条件下骨骼肌会出现明显的废用性萎缩[1]。本研究组以往的研究结果表明,肌梭的形态结构[2]、Ca2+ [3]水平和MHC表型的表达[4],在肢体脱负荷早期即出现改变,而且肌梭的传入放电活动减少,而肌梭传入冲动减少可能是废用性肌萎缩发生的始动因素之一[5]。如果能够维持肌梭的传入放电活动,势必能够延缓或对抗肌萎缩的发生和发展。
近年来肌肉振动已成为康复医学领域用来增强骨骼肌功能的一种有效手段,而高频正弦波振动的主要作用是兴奋肌梭[6-8]。但每日短时、间歇性的肌肉振动能否使这种短时的效应长久的维持,从而维持肌梭的电生理活动,还不清楚。因此,本研究拟通过观察肌肉振动对制动大鼠单一肌梭电生理活动的影响,探讨肌梭在废用性肌萎缩发生中的作用及机制,为更有效地制定对抗肌肉萎缩的措施提供研究资料。
1 材料与方法
1.1 实验动物分组
实验选用健康雌性Sprague-Dawley成年大鼠24只(体重220~250 g,由西安交通大学医学院实验动物中心提供)。将大鼠按体重配对原则随机分为:制动(immobilization, IMM)7 d组、制动+振动(Immobilization+high frequency vibration, IMM+HFV)7 d组和同步正常对照组,每组8只。所有实验动物单笼喂养,能够自由活动与进食、进水。动物室内温度保持在20℃~25℃,人为控制室内照明,保持12 h光明与黑暗交替循环。
采用改良的Booth FW方法建立大鼠后肢制动模型[9-10]。大鼠用10%水合氯醛腹腔注射麻醉(0.4 g/kg b.w),左侧后肢用石膏绷带由踝关节向上缠绕至大腿与腹股沟处,踝关节固定在跖屈位。在石膏层的外面用一层铜网保护,以防止动物咬毁石膏。
1.2 振动方法
给制动+振动组大鼠,采用本室自行研制的强肌仪施加短时、间歇式振动( 频率为100 Hz,振幅300 μm) 。振动方法:将振动仪探头置于比目鱼肌肌腹部位,振动1 min后间歇1 min,重复4 次;将探头更换部位,间歇2 min后继续振动;每个比目鱼肌选择3个振动点。每天进行4 次振动(上午8:00,中午12:00,下午4:00,晚上8:00)。
1.3 单一肌梭电生理活动的记录
动物经戊巴比妥钠腹腔注射麻醉,分离并取下比目鱼肌,迅速称其湿重。
称重后,在双目解剖显微镜下以其呈梭形膨大的赤道部和较强的折光性辨认肌梭,用分离针完整地分离出单一肌梭。肌梭标本制备好后,静息放置30~60 min后,将其移入灌流槽内,用改良的空气隔绝法记录传入放电活动(sampling frequency: 20 kHz )[11]。首先在自然长度下观察肌梭自发放电活动1000 s,随后将肌梭两端用组织胶固定于伸长位,维持5 min,计算最后1 min内肌梭的放电频率。如果拉长后肌梭无放电则放弃该次实验。
1.4 主要溶液和仪器设备
1.4.1 主要溶液(mmol/L)
10% 水合氯醛;肌梭电生理活动记录液:NaCl 138.8、 KCl 4.0、 NaHCO312.0、KH2PO41.0、MgCl21.0、CaCl22.0、葡萄糖 11.0,Glutamine 2.4、Glycine 3.2、Histidine 1.0、Glutamate 1.0[11]。持续通95%O2和5%CO2的混合气体,pH值7.4。
1.4.2 主要仪器设备
双目解剖显微镜(SMZ-10A,日本NIHON KONDEN公司);CED1401数模转换器和Spike2分析软件(Cambridge,UK);217双盐桥饱和甘汞电极(中国上海越磁公司)
1.5 统计学分析
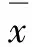
2 结果2.1 高频正弦波振动对制动大鼠比目鱼肌湿重的影响
IMM组和IMM+HFV组的非制动侧比目鱼肌湿重与正常对照组相比均无显著性差异(P=0.35和P=0.26)。因此我们将每组的非制动侧比目鱼肌湿重作为参照,衡量制动对比目鱼肌湿重的影响。
如表1所示,制动7 d后,制动侧比目鱼肌湿重与非制动侧相比明显下降(P<0.05);制动期间施加正弦波振动,制动侧比目鱼肌湿重减少的程度明显降低(P<0.05)。

表1 肌肉振动对制动大鼠比目鱼肌湿重的影响
a—Contralateral non-immobilized muscle used as control;“*”—P<0.05, compared with Controla;“#”—P<0.05,compared with IMM group.
2.2 肌肉振动对制动大鼠比目鱼肌单一肌梭电生理活动的影响
正常对照组共分离、记录了29个单一肌梭的放电活动,其中有2例无自发放电。在静息状态下,单一肌梭的自发放电频率较低,尤其是制动后,最典型的每1000 s内仅有数十个动作电位散在出现。因此我们通过1000 s内总的放电数来观察肌梭的电活动。
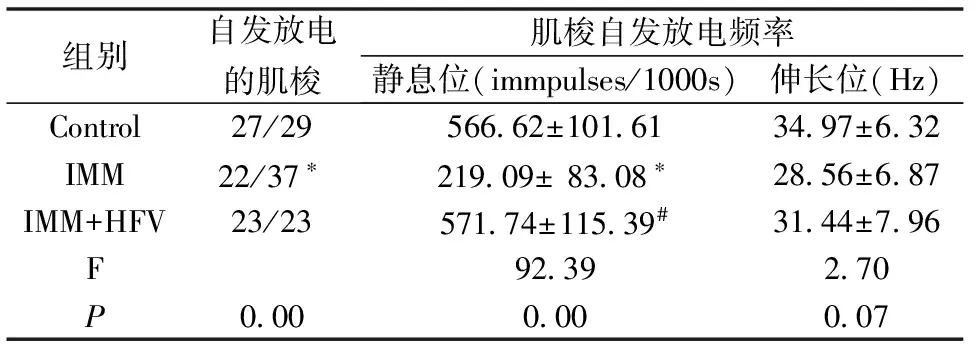
表2 正弦波振动对制动大鼠比目鱼肌单一肌梭放电活动的影响
*—P<0.05, Compared with control group;#—P<0.05,compared with IMM group.
如表2所示,制动7 d后,静息条件下,有自发放电的肌梭数量明显减少(P<0.05),肌梭的放电频率也明显降低(P<0.05)。制动期间给予正弦波振动,则能对抗肌梭电生理活动的改变(P>0.05)。
将肌梭固定于伸长位后,所有肌梭均有连续的放电出现,且IMM+HFV组和正常对照组及IMM组的放电频率无明显差别(P>0.05)。
3 讨论
如所周知,肌梭是骨骼肌内的一种牵张感受器。在体的肌梭活动受梭外肌、γ-运动神经元及高位中枢功能状态的影响[12-13]。单一肌梭排除了其他组织对它的影响,其传入放电活动主要取决于梭内肌纤维的收缩功能和感觉末梢对牵拉的敏感性。
静息位单一肌梭的自发放电活动,主要是由于梭内肌纤维的自主收缩,使赤道部的感觉末梢受牵拉引起的。无论是超微结构的改变、还是Ca2+的改变,都会影响到梭内肌纤维的收缩功能[3]。因此,制动引起的肌梭静息位自发放电活动的降低,可能是由于肌梭自身形态结构的改变,导致梭内肌纤维自主收缩活动减少引起的。伸长位肌梭放电活动主要反映的是感觉末梢对牵拉的敏感性。本研究结果提示,制动后肌梭感觉末梢对牵拉刺激的敏感性无明显改变。
高频正弦波振动兴奋肌梭的机制是直接牵拉刺激神经末稍[14-15],使肌梭传入冲动增加,引起梭外肌纤维产生反射性的收缩。由于γ-运动神经元和α-运动神经元经常处于同激活(co-activation)状态,梭外肌收缩时γ-运动神经元传出冲动也增加,梭内肌纤维两极端收缩,牵拉赤道部感觉末梢,引起肌梭的传入放电活动增加,因而就防止了废用条件下梭内肌纤维的脱负荷。本课题组以往的研究也证实,正弦波振动对后肢脱负荷引起的肌梭形态结构的改变具有明显的对抗作用[16]。本研究进一步表明,正弦波振动对制动所致肌梭电生理活动特性的改变也有明显的对抗作用;同时能够减轻制动引起的大鼠比目鱼肌湿重的降低,这与Falempin等的研究结果相一致[17]。因此我们推测,肌肉振动对废用性肌萎缩的对抗作用可能主要是改善了废用状态下肌梭形态结构,从而改善了梭内肌纤维的收缩功能,进而改善了肌梭电生理活性,增加了相关中枢的兴奋性引起的。但由于条件所限,制动条件下梭内肌纤维收缩功能的改变还没有直接的实验证据,还有待于进一步的研究。
综上所述,本研究结果表明,短期的后肢制动即可引起肌梭电生理活动的明显抑制,而制动期间短时、间歇性的肌肉振动能够明显改善制动对肌梭电生理活动的抑制。本研究为探明废用性肌萎缩的发生机制及其防治措施提供了新的思路。
[1]Kim J H, Thompson L V. Non-weight bearing-induced muscle weakness:the role of myosin quantity and quality in MHC type II fibers [J]. Am J Physiol Cell Physiol, 2014, 307(2):C190-194.
[2]Zhao X H, Fan X L, Song X A, et al. Influence of 14-day hind limb unloading on isolated muscle spindle activity in rats [J]. J Muscle Res Cell Motil, 2010, 31(3): 155-161.
[3]Zhu Y J, Fan X L, Li X H, et al. Effect of hindlimb unloading on resting intracellular calcium in intrafusal fibers and ramp-and-hold stretches evoked responsiveness of soleus muscle spindles in conscious rats [J]. Neurosci Lett,2008, 442(3): 169-173.
[4]De-Doncker L, Picquet F, Browne G B, et al. Expression of myosin heavy chain isoforms along intrafusal fibers of rat soleus muscle spindles after 14 days of hindlimb unloading [J]. J Histochem Cytochem, 2002, 50(11): 1543-1554.
[5]Ali U, Fan X L, You H J. Role of muscle spindle in weightlessness-induced amyotrophia and muscle pain [J]. Neurosci Bull, 2009, 25(5): 283-288.
[6]Imtiyaz S, Veqar Z, Shareef M Y. To compare the effect of vibration therapy and massage in prevention of delayed onset muscle soreness(DOMS)[J]. J Clin Diagn Res, 2014, 8(1): 133-136.
[7]Mettlach G, Polo-Parada L, Peca L, et al. Enhancement of neuromuscular dynamics and strength behavior using extremely low magnitude mechanical signals in mice [J].J Biomech, 2014, 47(1): 162-167.
[8]Chow D H, Leung K S, Qin L, et al. Low-magnitude high-frequency vibration (LMHFV) enhances bone remodeling in osteoporotic rat femoral fracture healing [J]. J Orthop Res, 2011, 29(5): 746-752.
[9]Booth F W, Kelso J R. Production of rat muscle atrophy by cast fixation [J]. J Appl Physiol, 1973, 34(3): 404-406.
[10]赵雪红,樊小力,宋新艾,等. 100Hz正弦波振动对制动大鼠比目鱼肌M波和H反射的影响 [J]. 浙江大学学报:医学版,2011,40(5):545-549.
[11]赵雪红,樊小力,宋新爱,等. 大鼠单一肌梭的电生理特征 [J]. 生理学报, 2011, 63(3): 281-285.
[12]Prochazka A, Ellaway P. Sensory systems in the control of movement [J]. Compr Physiol, 2012 , 2(4): 2615-2627.
[13]Fortier S, Basset F A. The effects of exercise on limb proprioceptive signals [J]. J Electromyogr Kinesiol, 2012, 22(6): 795-802.
[14]Spiliopoulou S I, Amiridis I G, Tsigganos G, et al. Side-alternating vibration training for balance and ankle muscle strength in untrained women [J]. J Athl Train, 2013, 48(5): 590-600.
[15]Tsukiboshi T, Sato H, Tanaka Y, et al. Illusion caused by vibration of muscle spindles reveals an involvement of muscle spindle inputs in regulating isometric contraction of masseter muscles [J]. J Neurophysiol, 2012, 108(9): 2524-2533.
[16]赵雪红,樊小力. 失重模拟失重条件下肌梭的改变与肌肉萎缩关系的研究进展 [J]. 生理学报, 2013, 65(1): 96-100.
[17]Falempin M, In-Albon S F. Influence of brief daily tendon vibration on rat soleus muscle in non-weight-bearing situation [J]. J Appl Physiol, 1999, 87(1): 3-9.
Effects of muscle vibration on the electrophysiological activity of isolated muscle spindles in rat following hind limb immobilization
ZHAO Xue-hong1, GAO Yan, FAN Xiao-li2
(1. Medical College, Hubei University of Arts and Science, Xiangyang 441053;2. Medical College, Xi′an Jiaotong University, Xi′an 710061, China)
To investigate the effects of muscle vibration on the electrophysiological activity of isolated muscle spindles in rat following hind limb immobilization, the limb immobilization model in rat was induced with plaster cast. The electrophysiological activities of the isolated muscle spindles were recorded by air-gap technique. The muscle vibration was applied to the immobilized soleus muscle with a home-made vibrator. Results showed that after 7 days′ immobilization, significant reduction in muscle mass (15.33%±4.76% compared with the contralateral non-immobilized muscle ) was found(P<0.05); the numbers of muscle spindles with spontaneous discharges decreased(P<0.05)and the spontaneous impulses decreased(P<0.05). With sinusodial vibration during 7 days of immobilization, the loss of muscle mass was significantly attenuated and no significant changes in electrophysiological activities of isolated muscle spindles occurred. It indicated that the muscle vibration during the immobilization could guard against the changes of muscle spindles′ electrophysiological activity induced by hind limb immobilization.
immobilization; muscular atrophy; muscle spindles; electrophysiology; muscle vibration
2014-08-27;
2014-10-06
国家自然科学基金(No.31300981);湖北省自然科学基金(2012FFC05601)
赵雪红,博士,讲师,主要研究方向为神经电生理、骨骼肌生理学,E-mail: xuehong_zhao@163.com。
R338
A
2095-1736(2015)02-0017-03
doi∶10.3969/j.issn.2095-1736.2015.02.017
