胸膜肺炎放线杆菌Δlip40回复突变株的构建及鉴定
2015-03-22胡雪鹤刘彩红
胡雪鹤, 刘彩红, 阎 浩, 祁 超
(华中师范大学 生命科学学院, 湖北省遗传与调控重点实验室, 武汉 430079)
胸膜肺炎放线杆菌Δlip40回复突变株的构建及鉴定
胡雪鹤*, 刘彩红*, 阎 浩, 祁 超**
(华中师范大学 生命科学学院, 湖北省遗传与调控重点实验室, 武汉 430079)
胸膜肺炎放线杆菌(APP)可引起猪胸膜肺炎,在一定程度上阻碍了养猪业的发展.目前,APP基因组中已得到有效鉴定的基因不足10%.为建立有效的APP功能基因研究体系,本文以前期构建的血清1型APP SLW01株外膜脂蛋白基因缺失突变株Δlip40为亲本,通过电转化法将携带有完整lip40基因的穿梭质粒pJFF-lip40导入Δlip40中,通过氯霉素抗性筛选获得回复突变株CΔlip40.对CΔlip40的生物学特性进行了初步分析发现,穿梭质粒可在APP中稳定遗传,并且APP生长能力未受穿梭质粒转入的影响.此外,SLW01和Δlip40对氯霉素高度敏感,但回复突变株CΔlip40较前两种菌株对氯霉素抗性明显增强,表明穿梭质粒pJFF224-XN抗性基因可在APP菌株中稳定表达.回复突变株CΔlip40的成功构建为分析脂蛋白Lip40致病机制提供了有效对照材料,本研究中建立的互补菌株构建系统以及APP抗性评价方法将有助于今后深入研究APP生物学特性及基因功能.
胸膜肺炎放线杆菌; 回复突变株; 构建; 鉴定
胸膜肺炎放线杆菌(Actinobacilluspleuropneumoniae,APP)是一种革兰氏阴性小球杆菌.该菌血清型较多,基于荚膜多糖抗原性,目前可将该菌划分为15个血清型[1].此外,还可以根据对烟酰胺腺嘌呤二核苷酸(Nicotinamide adenine dinucleotide,NAD)的依赖性分为非NAD-依赖的生物II型(血清型13、14),和NAD-依赖的生物I型(血清型1-12、15),所有血清型菌株都与猪致病相关.APP 可引起猪传染性胸膜肺炎(Porcine contagious pleuropneumonia,PCP),是一种接触传染性呼吸道疾病,通常表现为急性出血性、纤维素性、坏死性支气管肺炎和纤维素性胸膜炎,感染该菌后,各年龄阶段的猪都可能发病,该病给多个国家和地区的养猪业都曾造成较大的经济损失[2].该病于1957年由Pattison等[3]首次报道后,在世界范围内爆发和流行.研究表明,APP是一种多毒力因子病原菌,现已证明细菌毒素、荚膜多糖、脂多糖、粘附因子、蛋白酶、外膜蛋白以及转录调控因子等多种因子与该菌致病相关[4-7].
细菌脂蛋白(Lipoprotein,Lpp)是一类重要的功能蛋白,具有多种生理作用,如参与生物合成、维持细胞结构、物质转运等[8].Lpp在病原菌致病过程中起重要作用,除可作为黏附分子和增加病原抗逆性外,还能调节宿主免疫应答反应.另外,一些病原菌Lpp具有较好的免疫原性,是亚单位疫苗开发的靶标[9].目前,人们对于多种常见人类疾病致病菌Lpp的生物学特性有了较多认识,但对动物病原菌APP Lpp的研究则相对较少.且之前对于APP Lpp的研究多侧重于免疫原性及疫苗应用研究,人们已经克隆到一些具有良好免疫原性的脂蛋白,如TbpB[10]和多种OmlA[11-12],证实具有疫苗应用潜力,并成功开发为疫苗(PleuroStar APP, Novartis Animal Health Inc., Switzerland).
通过生物信息学方法筛选到一个外膜脂蛋白基因lip40,随后通过同源重组和负向筛选法成功构建lip40基因缺失突变株Δlip40.本研究以Δlip40为亲本菌株,通过电转化的方法将携带有完整lip40基因的E.coli-APP穿梭质粒导入lip40基因缺失突变株Δlip40中,构建回复突变株CΔlip40,并分析了该菌遗传稳定性、生长能力以及氯霉素抗性,为进一步分析Lip40的生物学功能奠定基础.
1 材料与方法
1.1 主要试剂
烟酰胺腺嘌呤二核苷酸(Nicotinamide adenine dinucleotide,NAD+)购自美国Sigma公司.各种限制性内切酶、LATaqDNA聚合酶、T4 DNA连接酶、DNA Marker及pMD18-T载体购自大连宝生物工程(大连)有限公司.DNA凝胶回收试剂盒、质粒提取试剂盒购自美国Omega Bio-Tek公司.胰蛋白大豆琼脂(Tryptic soy agar,TSA)、胰蛋白大豆肉汤(Tryptic soy broth,TSB)购自美国Difco公司.
1.2 菌株、质粒以及引物
血清1型胸膜肺炎放线杆菌SLW01为华中农业大学农业微生物学国家重点实验室贝为成教授惠赠.胸膜肺炎放线杆菌lip40基因缺失突变株Δlip40由本实验室构建并保存.大肠杆菌EscherichiacoliDH5α由本实验室保存.穿梭质粒pJFF224-XN[13]由瑞士伯尼尔大学Joachim Frey教授惠赠.
扩增lip40基因所用引物:
P1:5′-GGCTGCAGATGAAAAACATCACAAAATTTG-3′,含PstI酶切位点(见下划线);
P2:5′-TTGCGGCCGCTTACTTTTGTTGTTTTGCGC-3′,含NotI酶切位点(见下划线).
APP菌株鉴定所用引物(tonB2基因):
P3:5′-TTGGATCCGATGATTTACCCCAAGAAG-3′;
P4:5′-TTAAGCTTACCACTACCGCCTACCGC-3′.
穿梭质粒pJFF224-XN鉴定引物为:
P5:5′-GAATTTTACCCGGATTGACC-3′;
P6:5′-GCTGAAACTTTGCCATCGTA-3′.
1.3 APP基因组提取以及lip40基因扩增
取血清1型APP分离株SLW01的新鲜培养物,根据文献[14]描述的方法提取APP基因组.以基因组为模板,通过引物P1和P2扩增lip40基因.扩增条件为:94℃ 10 min;94℃ 30 s,53℃ 1 min,72℃ 2 min,共30个循环;然后72℃延伸10 min.
1.4 穿梭质粒的构建
将前述PCR产物lip40基因连接到pMD18-T载体,得到质粒pMD-lip40,经酶切鉴定正确后,以PstI/NotI双酶切,回收lip40片段并连接到经同样酶切的穿梭质粒pJFF224-XN中,得到携带外源基因的穿梭质粒pJFF-lip40.
1.5 电转化以及回复突变株的抗性筛选
大量制备质粒pJFF-lip40,用电转化将重组穿梭质粒pJFF-lip40转入基因缺失突变株Δlip40.APP电转化感受态细胞的制备参考文献[15]进行.电转化参数:电压2.5 kV,电容25 μFD,脉冲电阻800 Ω.电击后将菌液置37℃恢复培养3 h后涂布抗性平板.氯霉素抗性筛选阳性克隆时,分别设置氯霉素浓度为2.5 μg/mL,2 μg/mL,1.5 μg/mL,1 μg/mL,0.5 μg/mL.筛选具有氯霉素抗性的克隆,再用PCR加以验证.将得到的突变株命名为CΔlip40.
1.6 CΔlip40的遗传稳定性分析
将得到的回复突变株CΔlip40在不含氯霉素抗性的TSA培养基上传代10次,之后涂布到不含氯霉素的TSA平板,随机挑选10个单克隆,接种于无氯霉素的TSB培养基,经过夜培养后,用PCR鉴定,以确定CΔlip40是否发生回复.
1.7 CΔlip40的生长能力分析
将过夜培养的SLW01、Δlip40、CΔlip40分别以1∶100的比例接种到100 mL TSB培养基中(含NAD和10%小牛血清),接种后每隔1 h取样一次,测定菌液在600 nm下的吸光值(OD600),共测10 h,重复3次取平均值.比较3种菌株的生长能力.
1.8 CΔlip40的氯霉素抗性分析
为了检测SLW01、Δlip40、CΔlip40 3种菌株的氯霉素敏感性,取96孔细胞培养板,在第一列加入150 μL含NAD和10%小牛血清的TSB培养基,并将第一列氯霉素浓度设置为20 μg/mL,其后每孔加入75 μL培养基,从第一列培养基中取75 μL到第二列并进行混匀,依次类推,将氯霉素依次进行2倍稀释.将过夜培养的SLW01、Δlip40、CΔlip40分别以1∶100的比例接种到TSB培养基中(含NAD和10%小牛血清),待细菌生长至OD600值为0.4~0.5时,用培养基(含NAD和10%小牛血清)进行50倍稀释,接种于96孔细胞培养板,每孔加入75 μL稀释后的菌液于37℃摇床缓慢振荡培养.每隔1 h测定一次OD600值,共测7 h,重复3次取平均值.比较3种菌株对氯霉素的敏感性.
2 结果与分析
2.1 穿梭质粒pJFF-lip40的构建
以提取的APP基因组DNA为模板,以P1/P2为引物进行PCR扩增,得到的产物经1.0%琼脂糖凝胶电泳分析,结果如图1A所示,PCR产物大小约为900 bp,与预期大小相符(连同引物实际长度为927 bp).将PCR扩增的lip40基因克隆到pMD18-T载体中,序列分析证实无碱基误配.将扩增片段经PstI和NotI酶切并插入到穿梭质粒pJFF224-XN的T4启动子下游.构建的重组质粒命名为pJFF-lip40.经PstI和NotI双酶切后得到2条带,大小约为8 000 bp和900 bp,表明质粒构建正确(图1B).
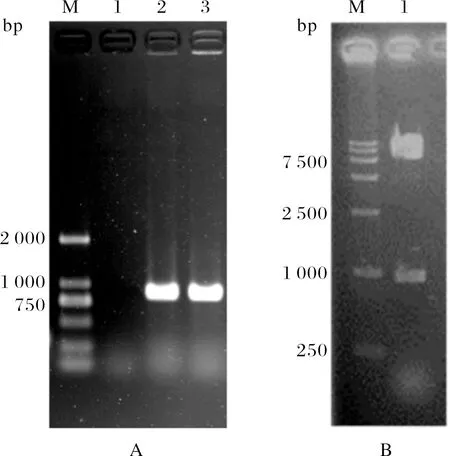
(A) M:DNA marker;1:空白对照;2、3:lip40基因的PCR扩增产物;(B) M:DNA marker;1:重组质粒pJFF-lip40双酶切(Pst I/Not I)产物.
2.2 回复突变株的筛选与初步鉴定
将穿梭质粒pJFF-lip40以电转化的方法导入血清1型lip40基因缺失突变株Δlip40中,当氯霉素浓度为1 μg/mL时,有菌落生长,随机挑取克隆转接至含氯霉素的TSB培养基,均可培养至浑浊,取培养物进行PCR验证,分别用3对引物加以验证:引物P1和P2用于扩增lip40基因;引物P3和P4用于扩增APP基因组中tonB2基因;引物P5和P6用于鉴定穿梭质粒.PCR结果(图2)均与预期相符,表明筛选的回复突变株初步证实是正确的.本次测试中随机挑选的克隆均为阳性,表明本实验体系能高效获得APP回复突变株.

M:DNA marker.1~4:引物P3/P4验证结果.5:阳性对照.6:空白对照.7~10:引物P5/P6验证结果.11:阳性对照.12:空白对照.13~16:引物P1/P2验证结果.17:阳性对照.18:空白对照.
2.3 CΔlip40的遗传稳定性
CΔlip40在不含氯霉素的TSA培养基上连续传代10次后,分别以引物P1/P2、P3/P4、P5/P6进行PCR扩增,均能扩增出特异性片段(图3),表明穿梭质粒pJFF-lip40在APP菌株CΔlip40中稳定存在,不需要额外添加氯霉素抗性选择压力.
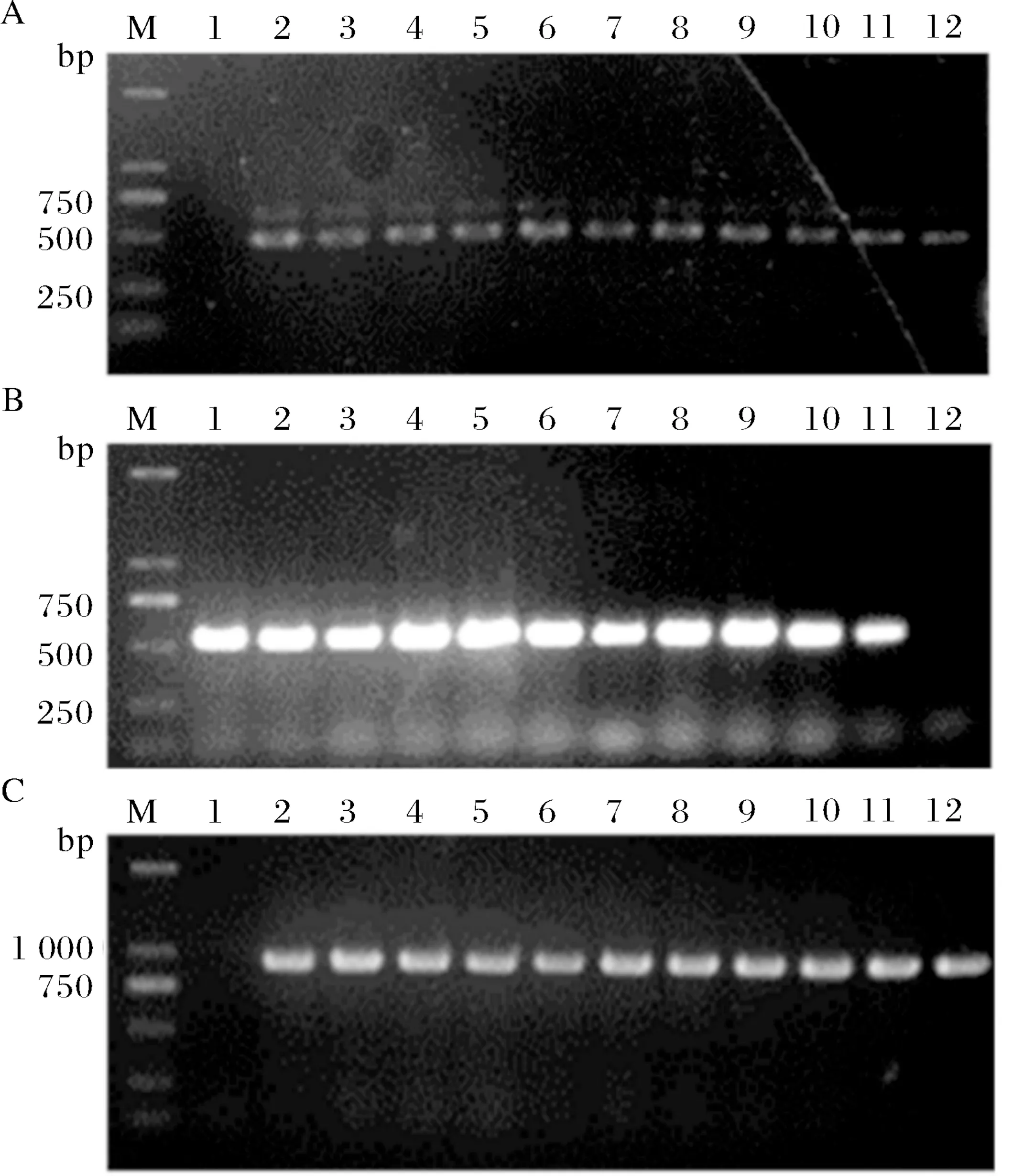
(A) M:DNA marker;1:空白对照;2:阳性对照;3~12:引物P3/P4验证CΔlip40 1~10代遗传稳定性结果;(B) M:DNA marker;1~10:引物P5/P6验证CΔlip40 1~10代遗传稳定性结果;11:阳性对照;12:空白对照;(C) M:DNA marker;1:空白对照;2:阳性对照;3~12:引物P1/P2验证CΔlip40 1~10代遗传稳定性结果.
2.4 CΔlip40体外生长能力分析
APP野生型菌株SLW01、lip40基因缺失株Δlip40以及回复突变株CΔlip40的生长曲线如图4所示.可见回复突变株和亲本菌株以及野生型菌株生长能力差别不大,表明携带穿梭质粒并没有明显影响APP的生长速度.
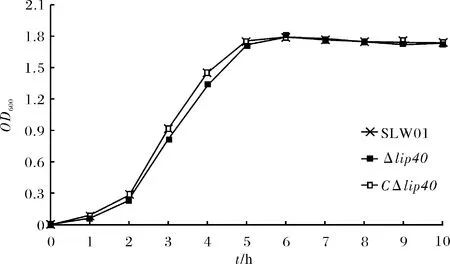
图4 SLW01、Δlip40以及CΔlip40体外生长能力分析Fig.4 Growth ability of SLW01, Δlip40 and CΔlip40 in vitro
2.5 CΔlip40氯霉素抗性分析
SLW01、Δlip40以及CΔlip40在不同氯霉素浓度下的生长曲线如图5所示.当氯霉素浓度≤0.31 μg/mL时,SLW01菌株与Δlip40菌株可以生长,但在氯霉素浓度为1.24 μg/mL时,仅回复突变株CΔlip40可以生长,可以判定穿梭质粒CAT表达盒在CΔlip40中有效表达.同时也说明在回复突变株CΔlip40抗性筛选过程中,当所选择的氯霉素抗性浓度为1 μg/mL时,能够高效获得CΔlip40阳性克隆,浓度过高(≥ 2 μg/mL),无克隆生长;而0.5 μg/mL则有较多假阳性克隆.

(A) SLW01在不同氯霉素浓度下的生长曲线;(B) Δlip40在不同氯霉素浓度下的生长曲线;(C) CΔlip40在不同氯霉素浓度下的生长曲线.
综上所述,本研究以缺失外膜脂蛋白基因lip40的缺失突变株为亲本菌株,成功将携带有完整lip40基因的穿梭质粒pJFF224-XN导入lip40基因缺失突变株中,构建得到回复突变株CΔlip40.并且通过抗性筛选、遗传稳定性分析、生长能力分析以及氯霉素抗性分析等一系列实验对该回复突变株CΔlip40的生物学特性进行了初步分析.
3 讨论
电转化法是细菌、真菌等微生物导入外源基因的常用方法之一,尤其是采用化学或自然转化法等传统转化方法遇到困难时应当首选电转化法[16].其原理是利用瞬间高压电脉冲,使细胞的表面产生膜暂时性的孔道,同时由于电击作用可促进细胞膜融合,最后在细胞膜上产生大的孔道,易于质粒DNA进入[17].
基因敲除是研究细菌基因生物学功能及致病机理的重要方法,但在病原微生物的基因功能研究中,仅通过基因突变株表型变化还不够,因为目的基因下游基因的转录起始位点可能存在于上游目的基因中,目的基因缺失后可能产生极性效应,导致其下游相邻特别是相近基因转录水平改变,因而突变株的表型变化就不止是单个基因敲除所产生,而是由几个相邻基因共同变化所致.因此,通过构建回复突变株,分析基因互补后的表型或基因功能是否恢复,可以有效验证目的基因的功能[18-19].
回复突变株常用的构建方法包括质粒法[20]以及基因原位整合法,质粒法相较于原位整合法操作更加简单、快捷,并且原位整合法一般适用于质粒在宿主菌株中不能稳定存在或者不能有效表达时[21-22].用于构建回复突变株的穿梭质粒pJFF224-XN最初由Frey构建[13],该质粒以广宿主性质粒RSF1010为基础而构建[23-25],部分研究表明该质粒能在APP中拷贝,并携带II型氯霉素乙酰转移酶基因.虽然该基因在APP中表达效率远不及大肠杆菌(≥ 25 μg/mL),但由于氯霉素在兽用领域禁用已久,许多APP分离株对氯霉素十分敏感,因此,不难获得转化子.另外,pJFF224-XN质粒当中还包含有T4噬菌体基因32的启动子区域以及转录终止信号,能驱动下游基因表达[13].David等研究表明pJFF224-XN质粒可以在APP中高效的表达ApxI以及ApxII,证实了质粒的启动子活性[26].
本研究还通过测定生长曲线的方法,比较了不同基因型APP菌株氯霉素敏感性.将对数中期APP菌株接种于不同氯霉素浓度液体培养基中,测定不同时间点的吸光值.结果表明,pJFF-lip40的表达使SLW01菌株获得了一定的氯霉素抗性(1.24 μg/mL),比不含质粒菌株高4倍.当筛选浓度为1.0 μg/mL时,随机挑选克隆均呈稳定氯霉素抗性;而当筛选浓度下降至0.5 μg/mL时,TSA平板上部分转化子,经PCR鉴定为APP,但无穿梭质粒,为假阳性克隆,但这样的克隆转接至0.5 μg/mLTSB培养基后不能生长,此结果与通过生长曲线法所得APP抗性浓度(≤ 0.31 μg/mL)符合.以上结果表明,生长曲线法可用于初步分析APP抗生素抗性.
综上所述,本实验中构建的回复突变株CΔlip40可以作为lip40基因功能研究的有效对照,本研究中所使用的回复突变株构建方法以及抗生素抗性分析法为后期深入研究APP功能基因及致病机制奠定了基础.
[1] Blackall P J, Klaasen H L, van Den B H, et al. Proposal of a new serovar ofActinobacilluspleuropneumoniae: serovar 15[J]. Vet Microbiol, 2002, 84(1/2): 47-52.
[2] Fenwick B, Henry S.Porcinepleuropneumonia[J]. J Am Vet Med Assoc, 1994, 204(9): 1334-1340.
[3] Pattison I H, Howell D G, Elliot J. A haemophilus-like organism isolated from pig lung and the associated pneumonic lesions[J]. J Comp Pathol, 1957, 67(4): 320-330.
[4] Chiers K, De Waele T, Pasmans F, et al. Virulence factors ofActinobacilluspleuropneumoniaeinvolved in colonization, persistence and induction of lesions in its porcine host[J]. Vet Res, 2010, 41(5): 65.
[5] Li L, Xu Z, Zhou Y, et al. Analysis onActinobacilluspleuropneumoniaeLuxS regulated genes reveals pleiotropic roles of LuxS/AI-2 on biofilm formation, adhesion ability and iron metabolism[J]. Microb Pathog, 2011, 50(6): 293-302.
[6] Xie F, Zhang Y, Li G, et al. The ClpP protease is required for the stress tolerance and biofilm formation inActinobacilluspleuropneumoniae[J]. PLoS One, 2013, 8(1): e53600.
[7] Zhou Y, Li L, Chen Z, et al. Adhesion protein ApfA ofActinobacilluspleuropneumoniaeis required for pathogenesis and is a potential target for vaccine development[J]. Clin Vaccine Immunol, 2013, 20(2): 287-294.
[8] Remans K, Vercammen K, Bodilis J, et al. Genomic-wide analysis and literature-based survey of lipoproteins inPseudomonasaeruginosa[J]. Microbiology, 2010, 156(Pt 9): 2597-2607.
[9] Kovacs-Simon A, Titball R W, Michell S L. Lipoproteins of bacterial pathogens[J]. Infect Immun, 2011, 79(2): 548-561.
[10] Baltes N, Hennig-Pauka I, Gerlach G F. Both transferrin binding proteins are virulence factors inActinobacilluspleuropneumoniaeserotype 7 infection[J]. FEMS Microbiol Lett, 2002, 209(2): 283-287.
[11] Rossi C C, de Araújo E F, de Queiroz M V, et al. Characterization of the omlA gene from different serotypes ofActinobacilluspleuropneumoniae: A new insight into an old approach[J]. Genet Mol Biol, 2013, 36(2): 243-251.
[12] Chen X, Xu Z, Li L, et al. Identification of conserved surface proteins as novel antigenic vaccine candidates ofActinobacilluspleuropneumoniae[J]. J Microbiol, 2012, 50(6): 978-986.
[13] Frey J. Construction of a broad host range shuttle vector for gene cloning and expression inActinobacilluspleuropneumoniaeand other Pasteurellaceae[J]. Res Microbiol, 1992, 143 (3): 263-269.
[14] Prideaux C T, Pierce L, Krywult J, et al. Protection of mice against challenge with homologous and heterologous serovars ofActinobacilluspleuropneumoniaeafter live vaccination[J]. Curr Microbiol, 1998, 37(5): 324-332.
[15] Bei W, He Q, Yan L, et al. Construction and characterisation of a live, attenuated apxIICA inactivation mutant ofActinobacilluspleuropneumoniaelacking a drug resistance marker[J]. FEMS Microbiol Lett, 2005, 243(1): 21-27.
[16] 格日勒图, 王艳霞, 包秋华, 等. 电转化方法将外源性质粒导入干酪乳杆菌的研究[J]. 中国乳品工业, 2009, 37(2): 9-13.
[17] Sabelnikov A G, Cymbalyuk E S, Gongadze G, et a1.Escherichiacolimembranes during electrotransformation: an electron microscopy study[J]. Biochim Biophys Acta, 1991, 1066(1): 21-28.
[18] 王 芳, 赵江丽, 何 湘, 等. 志贺氏菌福氏2a 301株ipaH4.5突变株的构建及生物学功能分析[J]. 微生物学通报, 2010, 37(5): 714-720.
[19] 陈振鸿, 王 丽, 张义全, 等. 副溶血弧菌基因回补实验方法的建立与应用[J]. 南方医科大学学报, 2014, 34(1): 70-74.
[20] 刘金林, 陈 砚, 胡琳琳, 等. 表达ApxIA的血清7型胸膜肺炎放线杆菌弱毒菌株的构建及特性分析[J]. 动物及兽医生物技术, 2010, 26(3): 305-310.
[21] 胡海红, 石爱琴, 胡艳华, 等. 枯草芽孢杆菌整合载体的构建及基因组的改造[J]. 浙江理工大学学报, 2010, 27(1): 134-139.
[22] 袁文杰, 陈丽杰, 孔 亮, 等. rDNA介导的菊粉酶基因整合载体构建及在K. marxianus中应用[J]. 大连理工大学学报, 2013, 53(2): 176-182.
[23] Bagdasarian M, Lurz R, Rückert B, et a1. Specific-purpose plasmid cloning vectors. II. Broad host range, high copy number, RSF1010-derived vectors, and a host-vector system for gene cloning inPseudomonas[J]. Gene, 1981, 16(1~3): 237-247.
[24] Frey J, Mudd E A, Krisch H M. A bacteriophage T4 expression cassette that functions efficiently in a wide range of gram-negative bacteria[J]. Gene, 1988, 62(2): 237-247.
[25] Gormley E P, Davies J. Transfer of plasmid RSF1010 by conjugation fromEscherichiacolitoStreptomyceslividansandMycobacteriumsmegmatis[J]. J Bacteriol, 1991, 173(21): 6705-6708.
[26] Reimer D, Frey J, Jansen R, et a1. Molecular investigation of the role of ApxI and ApxII in the virulence ofActinobacilluspleuropneumoniaeserotype 5[J]. Microb Pathog, 1995, 18(3): 197-209.
Construction and identification of complementation strain ofActinobacilluspleuropneumoniaemutant Δlip40
HU Xuehe, LIU Caihong, YAN Hao, QI Chao
(Hubei Key Laboratory of Genetic Regulation and Integrative Biology,College of Life Sciences, Central China Normal University, Wuhan 430079)
Actinobacilluspleuropneumoniaeis the etiological agent of porcine pleuropneumonia (PCP), which is associated with significant economic losses in swine industry worldwide. At present, the gene identification rate of APP genome is lower than 10%. To establish an effective research method for APP functional gene, an outer membrane lipoproteinlip40 gene deletion mutant of APP SLW01 (serovar 1), was used as parent strain, named Δlip40. A shuttle vector containing intactlip40 gene (pJFF-lip40) was introduced into Δlip40 by electroporation, and through chlorampenicol resistance selection, complementation strain CΔlip40 was constructed. The preliminary analysis of biological characteristics of CΔlip40 was done. we found The shuttle vector was stable in CΔlip40, and the growth ability of CΔlip40 was not affected by the shuttle vector. Moreover, SLW01 and Δlip40 were highly sensitive to chloramphenicol while CΔlip40 had a stronger chloramphenicol resistance than the former two, indicating the resistance gene in pJFF224-XN stably expressed in the APP. CΔlip40 provided effective material for the analysis of pathogenesis of lipoprotein Lip40. The construction method of complementary strain and APP resistance evaluation method will be helpful for further investigating the biological characteristics and gene function of APP.
Actinobacilluspleuropneumoniae; complementation strain; construct; identification
2015-01-30.
国家自然科学基金项目(20772040).
1000-1190(2015)04-0590-06
S852.61< class="emphasis_bold">文献标识码: A
A
*并列第一作者.** 通讯联系人.E-mail:qichao@mail.ccnu.edu.cn.
