托氟沙星纳米乳的制备及其急性毒性研究
2015-03-22欧阳五庆李梦云王波臻杨鸣琦
高 娴,欧阳五庆*,李梦云,刘 岳,王波臻,郑 寅,杨鸣琦*
(1.西北农林科技大学 动物医学院,杨凌 712100;2.河南科技大学 动物科技学院,洛阳 471003;3.石河子大学 动物科技学院,石河子 832003)
托氟沙星纳米乳的制备及其急性毒性研究
高 娴1,欧阳五庆1*,李梦云2,刘 岳1,王波臻3,郑 寅1,杨鸣琦1*
(1.西北农林科技大学 动物医学院,杨凌 712100;2.河南科技大学 动物科技学院,洛阳 471003;3.石河子大学 动物科技学院,石河子 832003)
拟制备托氟沙星纳米乳,并对其理化性质与急性毒性进行研究。以纳米乳的载药量、稳定性为考察指标,筛选油相、表面活性剂、助溶剂,结合伪三元相图确定纳米乳的最佳配方,制备托氟沙星纳米乳。通过透射电镜、激光粒度分析仪测定纳米乳的微观形态、粒径;用高效液相色谱仪检测药物含量,通过影响因素试验、加速试验、长期试验考察其稳定性与有效期;经小鼠灌胃试验评价其急性毒性。结果显示,托氟沙星纳米乳的最佳配方:托氟沙星1.36%、牛至油3.24%、乳酸2.60%、聚氧乙烯醚-40-氢化蓖麻油25.98%、蒸馏水66.82%。该纳米乳的乳滴呈圆球形,平均粒径为16.16 nm,稳定性良好,有效期为24个月。托氟沙星在3~100 μg·mL-1浓度范围内与对应的峰面积线性关系良好,纳米乳的平均回收率为99.33%±1.24%,相对标准偏差为1.25%,精密度较高。小鼠灌胃LD50>10 000 mg·kg-1,最大耐受剂量为39.72 g·kg-1。成功制备了托氟沙星纳米乳,为进一步开发纳米级抗菌药物提供理论依据。
托氟沙星;纳米乳;伪三元相图;质量评价;急性毒性
托氟沙星(tosufloxacin,TFLX)又名妥舒沙星、托磺沙星,是由日本富山化学工业公司综合研究所研发的一种新型、广谱、高效的氟喹诺酮类抗菌药物[1-2]。TFLX对需氧菌(革兰阳性菌、革兰阴性菌)、厌氧菌及沙眼衣原体均具有广谱抗菌作用,与已上市的同类药物相比,其对链球菌属、肠球菌属、葡萄球菌属等革兰阳性菌,淋病奈瑟菌及寄生在细胞内的沙门菌、志贺菌具有更强的抗菌作用[3-4]。该药物主要通过抑制细菌DNA回旋酶,干扰细菌DNA的正常转录与复制而发挥作用,同时也可抑制拓扑异构酶Ⅱ,干扰复制的DNA分配到子代细胞,使细菌死亡。TFLX对细菌分裂增殖的这种双重抑制作用,使其抗菌作用更强,交叉耐药性减少[5]。
TFLX主要用于治疗泌尿系统、消化系统、呼吸系统等感染,其临床疗效显著,患者不良反应轻微[6],在国外已经成为临床治疗急性细菌性感染的常用抗菌药物[7-8]。但TFLX几乎不溶于水,临床常用的剂型仅有胶囊、片剂,患者服用的依从性较低,且口服后在小肠液中的溶解性严重限制其药效的发挥[9]。
纳米乳(nanoemulsion,NE)是由水相、油相、表面活性剂、助表面活性剂、助溶剂等以适当的比例混合,自发乳化而成的分散体系,其外观澄清透明或略浑浊,热力学稳定,各向同性,乳滴粒径小于100 nm[10]。纳米乳作为一种纳米药物传递系统,可改善药物的溶解性,提高药物的生物利用度,增强药物的稳定性。
本试验针对TFLX临床应用中存在的问题,结合纳米乳给药体系的优势,制备托氟沙星纳米乳(以下简称为TFLX-NE),对其理化性质、急性毒性进行考察,以期为临床提供一种安全、高效、稳定的纳米药物。
1 材料与方法
1.1 仪器与试剂
UV2450紫外-可见分光光度仪(日本Shimadzu公司);Zetasizer Nano ZS型激光粒度分析仪(英国Malvern instrument 公司);HT7700透射电子显微镜(日本Hitachi公司);FE-20K型pH计(瑞士Mettler Toledo公司);高效液相色谱仪(日本日立公司);高效液相色谱工作站D-2000Elite(日本日立公司);250D光照培养箱(金坛市开发区吉特实验仪器厂);RM2245转轮切片机(德国Leica公司)。
托氟沙星(河南天耀科技有限公司);聚氧乙烯醚-40-氢化蓖麻油(RH-40)、聚氧乙烯醚-40-蓖麻油(EL-40)、吐温-80(Tween-80)(天津市恒兴化学试剂有限公司);乳酸(天津市天力化学试剂有限公司);牛至油(江西吉安中香天然植物有限公司);香芹酚(上海康拓化工有限公司);丁香酚(江西恒城天然香料提炼厂);肉桂油、肉桂醛(武汉远程共创科技有限公司);乙腈(天津市科密欧化学试剂有限公司)。
1.2 实验动物
健康青年昆明小白鼠70只,雌雄各半,体重20 g±2 g,购自西北农林科技大学实验动物中心。饲养温度25 ℃±2 ℃,相对湿度50%~60%,12 h光暗交替,无抗生素全价小鼠饲料饲喂,自由清洁饮水。
1.3 TFLX-NE的配方筛选与制备
1.3.1 油相的筛选 TFLX的水溶性差,根据纳米乳的制备工艺,将其溶于不同的油脂,选择溶解度较大的油脂作为油相。取过量的TFLX分别溶于香芹酚、丁香酚、肉桂油、肉桂醛、牛至油中,置于恒温摇床,25 ℃振摇48 h。吸取上清液,用紫外分光光度法测定TFLX在各油脂中的溶解度,选出适宜的油相。
1.3.2 表面活性剂的筛选 本试验将制备O/W型纳米乳,根据“乳剂中对乳化剂溶解度大的一相形成外相”和“相似者相溶”原理,选用亲水亲油平衡值(hydrophile lipophilic balance,HLB)8~18的表面活性剂[11]。选择药学试验中常用的低毒、低刺激性非离子型表面活性剂RH-40、EL-40、Tween-80。室温下,将TFLX溶于已筛选出的油相中,表面活性剂/油相分别按质量比9∶1~1∶9混合,缓慢滴加蒸馏水,并不断匀速搅拌,体系将由稀薄变黏稠,再突变为稀薄,最终成为澄清透明的液体。记录由黏稠突变为稀薄时的相变点加水量,并计算该临界体系中各成分的质量。以油相、水相、表面活性剂为三个顶点,用Origin Pro 8.0分别绘制伪三元相图,根据乳区面积大小确定表面活性剂。
1.3.3 助溶剂的筛选 TFLX在筛选出的油相中溶解度较低,不能满足临床用药要求,根据药物本身的理化性质,选择乳酸作为助溶剂。以油相、表面活性剂、蒸馏水为TFLX-NE的基质,考察不同质量分数乳酸(1.6%、2.6%、4.8%)对纳米乳形成的影响。1.3.4 TFLX-NE的制备 根据伪三元相图及纳米乳的载药量、稳定性,确定TFLX-NE的最佳配方。室温下,依配方先将TFLX加入油相,充分搅拌,再添加乳酸,不断搅拌使TFLX完全溶解,然后加入表面活性剂,搅拌均匀,最后,边搅拌边缓慢滴加蒸馏水,即可制备澄清透明的TFLX-NE。
1.4 TFLX-NE的质量评价
1.4.1 TFLX-NE的结构类型鉴别 采用染色法鉴别TFLX-NE的结构类型[12]。将水溶性染料次甲基蓝和脂溶性染料苏丹Ⅲ分别滴加到已制备的TFLX-NE中,观察两种染料的扩散速率。若蓝色的次甲基蓝扩散速率明显大于红色的苏丹Ⅲ,则该纳米乳为水包油型(O/W);反之则为油包水型(W/O);若二者扩散速率相同,则为双连续型(B.C)。
1.4.2 TFLX-NE的微观形态观察 将TFLX-NE用蒸馏水稀释5倍,滴加在覆盖有碳膜的铜网上,室温下自然干燥,在透射电子显微镜下观察纳米乳的微观形态。
1.4.3 TFLX-NE的粒径分析 将TFLX-NE用蒸馏水稀释5倍,室温下吸取稀释液至激光粒度分析仪的样品池,测定其粒径,重复3次。
1.4.4 TFLX-NE的pH测定 25 ℃下,用pH计测定TFLX-NE的pH,重复3次。
1.4.5 TFLX-NE的含量测定
1.4.5.1 选择检测波长:用0.1 mol·L-1NaOH溶液配制5 μg·mL-1TFLX对照品溶液,通过UV-2450紫外可见分光光度仪检测其紫外吸收波长,选择吸光度最大处作为检测波长。
1.4.5.2 色谱条件:Diamonsil C18色谱柱(250×4.6 mm,5 μm);柱温为室温;流动相选择0.025 mol·L-1磷酸溶液-乙腈(85∶15),三乙胺调节pH为3.0;流速1.5 mL·min-1;进样量20 μL。
1.4.5.3 方法专属性试验:配制100 μg·mL-1TFLX对照品溶液(0.1 mol·L-1NaOH溶液溶解)、含100 μg·mL-1TFLX的TFLX-NE供试品及空白纳米乳供试品,0.45 μm滤器过滤,超声脱气,依次进样测定。
1.4.5.4 建立标准曲线:将100 μg·mL-1TFLX对照品溶液用流动相稀释为50、25、12.5、6.25、3.125 μg·mL-1系列溶液,进样测定,重复3次,以TFLX浓度(C)对色谱峰面积(A)进行线性回归,建立标准曲线。
1.4.5.5 回收率试验:精确量取一定量TFLX对照品加入空白纳米乳中,流动相稀释,使其中TFLX的浓度分别为10、15、20 μg·mL-1。分别重复进样3次,测定每个样品的实际浓度。以实测浓度与标示浓度的比值,计算各样品的回收率、平均回收率及相对标准偏差(relative standarad deviation,RSD)[13]。
1.4.5.6 精密度试验:精确配制10、15、20 μg·mL-1TFLX-NE样品,分别进行日内精密度和日间精密度试验。日内精密度试验于1 d内的第1、5、10、24小时测定纳米乳中TFLX的含量,日间精密度于第1、3、5、7天测定纳米乳中TFLX的含量。
1.4.6 TFLX-NE的稳定性考察
1.4.6.1 影响因素试验
(1)高温试验:取一批TFLX-NE,开口置于西林瓶内,60 ℃下放置10 d,第5天和第10天取样,观察纳米乳的外观是否发生变化,并检测药物含量。
(2)高湿度试验:取一批TFLX-NE,开口置于西林瓶内,在25 ℃、相对湿度90%±5%条件下放置10 d,第5天和第10天取样,观察纳米乳的外观变化,并检测药物含量。
(3)强光照射试验:取一批TFLX-NE,开口置于西林瓶内,在照度为4 500 lx±500 lx的条件下放置10 d,于第5天和第10天取样,观察纳米乳的外观是否发生变化,并检测药物含量[14-15]。
1.4.6.2 加速试验:取三批TFLX-NE,密封贮存于中性硬质无色玻璃瓶内,在温度40 ℃±2 ℃、相对湿度75%±5%的条件下放置6个月,分别于第1、2、3、6个月末取样一次,观察纳米乳的外观,检测其药物含量[14,16]。
1.4.6.3 长期试验:取三批TFLX-NE,密封贮存于中性硬质无色玻璃瓶内,在温度25 ℃±2 ℃,相对湿度60%±10%的条件下放置18个月。分别于0、3、6、9、12、18个月观察纳米乳的外观,检测药物含量。将结果与0个月比较,运用Excel 2013进行统计分析,确定TFLX-NE的有效期[17]。
1.5 TFLX-NE的急性毒性试验
1.5.1 LD50测定 参照文献报道的托氟沙星LD50值[18],设计预试验探索TFLX-NE灌胃小鼠的0%和100%估计致死量(即Dmin和Dmax)。选取50只健康小鼠,雌雄各半,每组10只,随机分为5组(A~E组),试验前12 h禁食不禁水。A组为空白对照组,灌胃给予1 000 mg·kg-1生理盐水;B~E组分别灌胃给予10、100、1 000、10 000 mg·kg-1TFLX-NE。灌胃后持续观察30 min,第1、4小时再观察一次,此后每日至少观察1次,连续观察14 d,详细记录小鼠的中毒表现,毒性反应的持续时间、消失时间以及死亡时间。采用Bliss法计算TFLX-NE的LD50值。试验结束,处死试验小鼠,剖检,观察主要器官的病理变化,取其肝、十二指肠、肾,制作石蜡切片,HE染色,光学显微镜下观察各主要器官的病理变化。
1.5.2 MTD测定 取20只健康小鼠,雌雄各半,试验前12 h禁食不禁水,以最大体积(0.4 mL·10 g-1)灌胃给予TFLX-NE。给药后,前4 h持续观察,以后每天至少观察1次,连续观察14 d,详细记录小鼠的精神状况、中毒症状、死亡情况等。
试验结束,处死小鼠,剖检,观察主要器官的病理变化,取小鼠的肝、十二指肠、肾,制作石蜡切片,HE染色,光学显微镜下观察各主要器官的病理变化。
2 结 果
2.1 TFLX-NE的配方筛选与制备
2.1.1 油相的筛选 TFLX在各油脂中的溶解度如图1所示。结果显示,TFLX在牛至油中的溶解度最大,确定牛至油为油相。

图1 托氟沙星在各油脂中的溶解度Fig.1 Solubility of TFLX in various oils
2.1.2 表面活性剂的筛选 以Tween-80为表面活性剂时,无法成功制备TFLX-NE。以RH-40、EL-40为表面活性剂时,均可在一定的比例范围制备澄清透明的纳米乳;当以RH-40为表面活性剂时,形成的纳米乳区面积最大,故选择RH-40为纳米乳的表面活性剂(图2)。
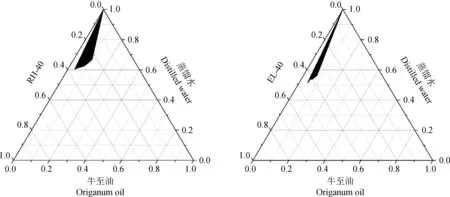
图2 表面活性剂对纳米乳体系的影响Fig.2 Effect of surfactant on the nanoemulsion system
2.1.3 助溶剂的筛选 以乳酸为助溶剂制备TFLX-NE,不同含量的乳酸对纳米乳形成的影响见表1。结果显示,加入2.6%和4.8%的乳酸,均可制备TFLX-NE,放置30 d,后者发生絮凝现象,说明制备的纳米乳不稳定。因此,制备TFLX-NE时,应加入2.6%的乳酸。
表1 不同含量乳酸对纳米乳体系的影响
Table 1 Effect of different lactic acid content on nanoemulsion system

乳酸含量/%Lacticacidcontent现象描述Symptom30d稳定性30dstability结果判定Results1.6乳白色液体Milkyliquid不稳定Unstable×2.6澄清透明液体Clearandtransparentliquid稳定,澄清透明液体Stable,clearandtransparentliquid√4.8澄清透明液体Clearandtransparentliquid不稳定,絮凝Unstable,flocculation×
×.乳酸含量不适宜;√.乳酸含量适宜
×.The lactic acid content inappropriate;√.The lactic acid content appropriate
2.1.4 TFLX-NE的制备 在尽可能减少辅料添加量的原则上,综合考虑纳米乳的载药量、稳定性等因素,将TFLX-NE各成分的比例确定为TFLX 1.36%、牛至油3.24%、RH-40 25.98%、乳酸2.60%、蒸馏水66.82%。
2.2 TFLX-NE的质量评价
2.2.1 TFLX-NE的结构类型鉴别 经染色法鉴别,在TFLX-NE中,蓝色的次甲基蓝扩散速率明显大于红色的苏丹Ⅲ,说明该纳米乳为O/W型。
2.2.2 TFLX-NE的微观形态观察 经透射电镜放大30 000倍观察,TFLX-NE的乳滴呈均匀分散的圆球形,大小均一,无黏连(图3)。

图3 托氟沙星纳米乳的电镜图片Fig.3 TEM micrograph of TFLX-NE
2.2.3 TFLX-NE的粒径分析 TFLX-NE的粒径介于6.50~28.21 nm,平均粒径为16.16 nm(图4),表明TFLX-NE为粒径分布范围较窄的多分散体系。

图4 托氟沙星纳米乳的粒径分布Fig.4 Size distribution of TFLX-NE
2.2.4 TFLX-NE的pH测定 经测定,TFLX-NE的pH为3.54±0.02。
2.2.5 TFLX-NE的含量测定 经紫外可见分光光度仪检测,TFLX在277.60和315.00 nm处有吸收峰,其中277.60 nm处为最大吸收峰,故选择277.60 nm为检测波长(图5)。由图6可知TFLX对照品的保留时间为10.88 min,空白纳米乳对TFLX-NE中TFLX含量的测定无干扰,该方法具有专属性。通过线性回归求得TFLX的标准曲线方程为A=93 326C+58 260(R2=0.999 8),表明TFLX在3~100 μg·mL-1的浓度范围内与对应峰面积的线性关系良好(图7)。表2显示TFLX-NE的平均回收率为99.33%±1.24%,RSD为1.25%,说明该方法的准确度较高。TFLX-NE日内精密度的平均RSD为0.82%,日间精密度的平均RSD为0.98%,说明该方法的稳定性良好。

图5 托氟沙星的紫外吸收光谱Fig.5 UV absorption spectra of TFLX
2.2.6 TFLX-NE的稳定性考察 当体系处于最低能级或各反应物的反应达到平衡状态时,整个体系热力学稳定。通过一系列稳定性试验,可以考察纳米乳的稳定性,避免亚稳定态纳米载药体系,筛选出纳米乳的最佳配方。将TFLX-NE置于高温、高湿度、强光照环境下,未发生分层、破乳等现象,药物含量变化均小于5%。该纳米乳在40 ℃±2 ℃,相对湿度75%±5%的条件下,密封贮存6个月,其外观无明显变化,药物含量下降为标示量的96.82%。通过长期试验测定,TFLX-NE的标示量-时间线性回归方程为y=-0.27x+99.16(r=-0.897 1),经统计分析,得出该纳米乳的有效期估算图8。当药物含量下降到标示量的90%时,标示量与95%可信区间下界线的交点对应的时间为24.40月,为保证临床用药的有效性,确定TFLX-NE在25 ℃±2 ℃、相对湿度60%±10%的条件下,有效期为24个月。各试验结果表明,TFLX-NE的稳定性良好,体系处于最低能级状态或体系中各物质间的化学反应保持在平衡状态,进一步说明该纳米乳的配方优良。

图6 药品的色谱图Fig.6 Chromatogram of drugs

图7 托氟沙星的浓度-峰面积曲线Fig.7 concentration-peak area curve of TFLX
表2 TFLX-NE回收率试验结果
Table 2 Results of recovery test of TFLX-NE

样品浓度/(μg·mL-1)Sampleconcentration实测值/(μg·mL-1)Measuredvalue回收率/%Recoveryratio平均回收率/%MeanrecoveryratioRSD/%10.009.7997.9415.0014.9699.7399.33±1.241.2520.0020.06100.32

图8 托氟沙星纳米乳的有效期估算Fig.8 Estimation image of shelf life of TFLX-NE
2.3 TFLX-NE的急性毒性试验
2.3.1 LD50测定 14 d内未发生小鼠死亡现象,小鼠被毛光滑,活动有力,天然腔无分泌物,食欲旺盛,未见明显的中毒症状,说明TFLX-NE灌胃给予小鼠的LD50>10 000 mg·kg-1。剖检可见小鼠的心、肝、脾、肺、肾、胃、肠等均无明显的病理变化。光镜下观察,用药组小鼠的肝细胞围绕中央静脉呈放射状整齐排列,核圆形,偶有双核现象,与正常对照组比较未见明显差异(图9 a、b)。用药组小鼠的十二指肠黏膜层、黏膜下层、基层、浆膜层结构完整,黏膜上皮排列整齐,杯状细胞明显,十二指肠腺发达,与正常对照组比较未见明显差异(图9 d、e)。用药组小鼠的肾单位结构完整,肾小管、集合小管上皮细胞排列整齐,管腔明显,与正常对照组比较未见明显差异(图9 g、h)。
2.3.2 MTD测定 给药后第2天小鼠自发活动减少,被毛竖立,第4天开始逐渐恢复正常,14 d内未发生死亡情况,TFLX-NE灌胃给予小鼠的MTD为0.4 mL·10 g-1,即39.72 g·kg-1。剖检可见,小鼠的心、肝、脾、肺、肾、肠等主要器官未发生明显的病理变化。光镜下观察可见,少部分肝细胞核浓缩、固染,个别有坏死崩解现象(图9 c);十二指肠形态、结构与正常对照组无明显差异(图9 f);肾中肾小管上皮细胞少量坏死,与基底膜脱离,甚至脱落至管腔内(图9 i)。
3 讨 论
本试验采用先进的纳米生物技术,制备TFLX-NE,其乳滴粒径介于6.50~28.21 nm,成功解决了TFLX难溶于水的困扰。纳米乳制备过程中,最重要的是筛选适宜的油相、表面活性剂以及各组分比例的确定。纳米乳的油相需在保证对机体无毒副作用、无刺激性且稳定的基础上,选择药物溶解度高的油脂。确定油相后,根据“相似相溶”原理,在毒性和刺激性较小的常用非离子型表面活性剂中选择与油相HLB值相同或接近的表面活性剂,再结合滴定法绘制伪三元相图,选择形成纳米乳区面积最大的表面活性剂[19]。TLX-NE制备过程中选择TFLX溶解度最高的牛至油为最佳油相,EL-40和RH-40的HLB值均接近牛至油的HLB值,但以RH-40为表面活性剂绘制的伪三元相图乳区面积大于EL-40,故选择RH-40为最佳表面活性剂。O/W型纳米乳是脂溶性药物的良好载体,它不仅可通过油相、表面活性剂提高药物的溶解度,还可加入助表面活性剂、助溶剂增溶[20]。为进一步提高TFLX的溶解度,添加乳酸(质量分数为2.6%)为助溶剂,使药物的含量达到1.36%。TFLX-NE为淡黄色澄清透明液体,乳滴呈圆球形,分布均匀无黏连。测定TFLX-NE中TFLX的含量时,为消除各种杂质的干扰,建立了专一、稳定、准确的高效液相色谱法,这与国内外学者检测TFLX含量常用的方法保持一致[21-22]。经各种稳定性试验考察,该纳米乳稳定性良好,有效期为24个月。
LD50、MTD是评价药物急性毒性的重要指标,可以为长期毒性试验、生殖毒性试验、致突变试验等提供剂量选择依据,从而确定临床用药的安全性和剂量[23]。灌胃给予小鼠TFLX-NE,其LD50值大于10 000 mg·kg-1,MTD为39.72 mg·kg-1。按照WHO外源性化学物质的急性毒性分级标准,TFLX-NE属微毒药物(≥5 000 mg·kg-1)。病理组织切片可以在细胞水平上反映受试药物对组织器官的损伤程度。用TFLX-NE进行小鼠经口毒性试验,剂量≤10 000 mg·kg-1时,药物对小鼠的肝、肾、十二指肠均无损伤;剂量提高到MTD时,药物对小鼠的肝细胞和肾小管上皮细胞有轻微损伤,对十二指肠无影响,表明TFLX-NE的安全性较高,有巨大的开发利用价值。
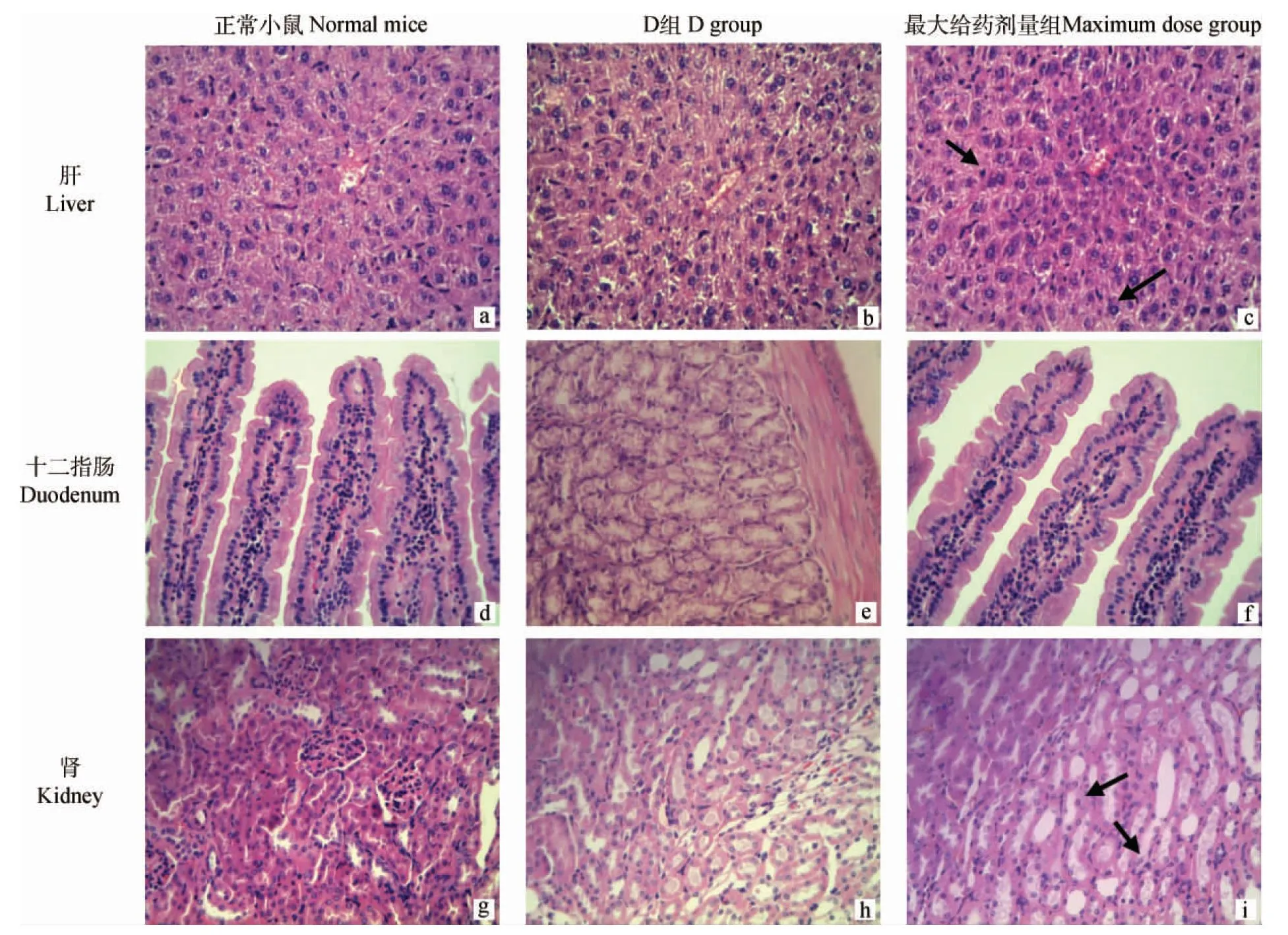
图9 灌胃给予不同剂量托氟沙星纳米乳后小鼠组织器官的病理变化(400×)Fig.9 Pathological changes in the tissues and organs of mice after oral administration with different doses of TFLX-NE(400×)
4 结 论
成功制备1.36%的托氟沙星纳米乳,外观澄清透明,平均粒径为16.16 nm,小鼠灌胃LD50>10 000 mg·kg-1,MTD为39.72 mg·kg-1。
[1] ARGUEDAS A G,AKANIRO J C,STUTMAN H R,et al.Invitroactivity of tosufloxacin,a new quinolone,against respiratory pathogens derived from cystic fibrosis sputum[J].AntimicrobAgentsChemother,1990,34(11):2223-2227.
[2] 焦红梅,张婴元.妥舒沙星[J].中国药学杂志,1996,31(4):240-242. JIAO H M,ZHANG Y Y.Tosufloxacin[J].ChinesePharmaceuticalJournal,1996,31(4):240-242.(in Chinese)
[3] NOUMI T,NISHIDA N,MINAMI S,et al.Intracellular activity of tosufloxacin(T-3262) againstSalmonellaenteritidisand ability to penetrate into tissue culture cells of human origin[J].AntimicrobAgentsChemother,1990,34(6):949-953.
[4] SEGRETI J,HIRSCH D J,HARRIS A A,et al.Invitroactivity of tosufloxacin(A-61827,T-3262) against selected genital pathogens[J].AntimicrobAgentsChemother,1990,34(6):971-973.
[5] 陈杖榴.兽医药理学[M].3版.北京:中国农业出版社,2009:271-274. CHEN Z L.Veterinary pharmacology[M].3rd edition.Beijing:China Agriculture Press,2009:271-274.(in Chinese)
[6] HOSHINO T,SATO Y,TOYONAGA Y,et al.Nationwide survey of the development of drug resistance in the pediatric field in 2007 and 2010:drug sensitivity ofHaemophilusinfluenzaein Japan(second report)[J].JInfectChemother,2013,19(3):495-503.
[7] KING A,BETHUNE L,PHILLIPS I.Theinvitroactivity of tosufloxacin,a new fluorinated quinolone,compared with that of ciprofloxacin and temafloxacin[J].JAntimicrobChemother,1991,28(5):719-725.
[8] NIKI Y.Pharmacokinetics and safety assessment of tosufloxacin tosilate[J].JInfectChemother,2002,8(1):1-18.
[9] DATE A A,NAGARSENKER M S.Design and evaluation of self-nanoemulsifying drug delivery systems(SNEDDS) for cefpodoxime proxetil[J].IntJPharm,2007,329(1-2):166-172.
[10] RAO J,MCCLEMENTS D J.Lemon oil solubilization in mixed surfactant solutions:Rationalizing microemulsion & nanoemulsion formation[J].FoodHydrocolloids,2012,26(1):268-276.
[11] 张志荣.药剂学[M].北京:高等教育出版社,2007:125-132. ZHANG Z R.Pharmaceutics[M].Beijing:Higher Education Press,2007:125-132.(in Chinese)
[12] 郭建军,欧阳五庆,李会芳,等.非泼罗尼纳米乳的制备及理化性质与安全性分析[J].畜牧兽医学报,2013,44(7):1140-1146. GUO J J,OUYANG W Q,LI H F,et al.Preparation and physical and chemical properties and security analysis of fipronil nanoemulsion[J].ActaVeterinariaetZootechnicaSinica,2013,44(7):1140-1146.(in Chinese)
[13] LI J K,HE X Y,LI M Y,et al.Chemical fingerprint and quantitative analysis for quality control of polyphenols extracted from pomegranate peel by HPLC[J].FoodChem,2015,176:7-11.
[14] 国家药典委员会.中华人民共和国药典(第二部)[M].北京:化学工业出版社,2010:176-179. Chinese Pharmacopoeia Commission.Chinese pharmacopoeia(PartⅡ)[M].Beijing:Chemical Industry Press,2010:176-179.(in Chinese)
[15] AHMAD J,MIR S R,KOHLI K.Effect of oil and co-surfactant on the formation of Solutol HS 15 based colloidal drug carrier by Box-Behnken statistical design[J].ColloidSurfA-PhysicochemEngAsp,2014,453:68-77.
[16] ANDRIOLE V T.The Quinolones[M].3rd ed.Pittsburgh:Academic Press,2000:255-284.
[17] 曹德英.药物剂型与制剂设计[M].北京:化学工业出版社,2009:84-87. CAO D Y.Pharmaceutical dosage form and preparation design[M].Beijing:Chemical Industry Press,2009:84-87.(in Chinese)
[18] GANELLIN C R,TRIGGLE D J.Dicionary of pharmacological agents(volume 2)[M].London:Chapman & Hall,1996:2389-2394.
[19] 周 莹,欧阳五庆,郑星星,等.盐酸布替萘芬纳米乳的制备及其质量评价[J].中国兽医学报,2013,33(6):892-897,504. ZHOU Y,OUYANG W Q,ZHENG X X,et al.Preparation and quality evaluation of butenafine hydrochloride nanoemulsion[J].ChineseJournalofVeterinaryScience,2013,33(6):892-897,504.(in Chinese)
[20] MALCOLMSON C,LAWRENCE M J.A comparison of the incorporation of model steroids into non-ionic micellar and microemulsion systems[J].JPharmPharmacol,1993,45(2):141-143.
[21] 朱庆玲,郝锐娟,丁 红.甲苯磺酸妥舒沙星HPLC测定方法的改进[J].北方药学,2005,2(6):13-14. ZHU Q L,HAO R J,DING H.Improvement of the assay of tosufloxacin tosylate by HPLC[J].JournalofNorthPharmacy,2005,2(6):13-14.(in Chinese)
[22] LYON D J,CHEUNQ S W,CHAN C Y,et al.Rapid HPLC assay of clinafloxacin,fleroxacin,levofloxacin,aparfloxacin and tosufloxacin[J].JAntimicrobChemother,1994,34(3):446-448.
[23] 周立国.药物毒理学[M].2版.北京:中国医药科技出版社,2011:131-147. ZHOU L G.Drug toxicology[M].2nd ed.Beijing:China Medical Science Press,2011:131-147.(in Chinese)
(编辑 白永平)
Study on the Preparation and Acute Toxicity of Tosufloxacin Nanoemulsion
GAO Xian1,OUYANG Wu-qing1*,LI Meng-yun2,LIU Yue1,WANG Bo-zhen3,ZHENG Yin1,YANG Ming-qi1*
(1.CollegeofVeterinaryMedicine,NorthwestA&FUniversity,Yangling712100,China;2.CollegeofAnimalScienceandVeterinary,HenanUniversityofScienceandTechnology,Luoyang471003,China;3.CollegeofAnimalScienceandVeterinary,ShiheziUniversity,Shihezi832003,China)
The purpose of this study was to prepare tosufloxacin nanoemulsion and to analyse its physical and chemical properties and acute toxicity.The oil phase,surfactant and solubilizer were selected according to the drug loading and stability of the nanoemulsion,the optimum formula was designed using pseudo-ternary phase diagrm,prepared tosufloxacin nanoemulsion.The configuration and particle size of tosufloxacin nanoemulsion were measured by TEM and LPSA.The drug content of tosufloxacin nanoemulsion was determined through High Performance Liquid Chromatography(HPLC).The stability and shelf life were tested by stress testing,accelerated testing and long-term testing.Its acute toxicity was evaluated by gavage testing in mice.The results showed that the optimum formula of tosufloxacin nanoemulsion was composed of tosufloxacin(1.36%),origanum oil(3.24%),lactic acid(2.60%),RH-40(25.98%),and distilled water(66.82%).The droplet shape of this nanoemulsion was spherical,with the average diameter of 16.16 nm,and its stability was good,the shelf life was 24 months.As the concentrations of tosufloxacin ranged from 3 to 100 μg·mL-1,the concentrations and peak areas showed good linear relationship;the average recovery rate and relative standard deviation of tosufloxacin nanoemulsion were 99.33%±1.24% and 1.25%,respectively;the precision of this nanoemulsion was well.The LD50of tosufloxacin nanoemulsion was greater than 10 000 mg·kg-1,the MTD of this nanoemulsion was 39.72 g·kg-1.The tosufloxacin nanoemulsion was prepared successfully,and it will provide a theoretical basis for the further development of nanoscale antimicrobial agents.
tosufloxacin;nanoemulsion;pseudo-ternary phase diagram;quality evaluation;acute toxicity
10.11843/j.issn.0366-6964.2015.11.021
2015-02-16
农业科技成果转化资金项目(2013GB2G000475)
高 娴(1989-),女,山西保德人,硕士生,主要从事动物病理学研究,E-mail:xianzi908111@163.com
*通信作者:欧阳五庆,教授,主要从事新兽药研发、纳米生物技术和细胞生物学研究,E-mail:oywq506@sina.com;杨鸣琦,教授,主要从事动物病理学研究,E-mail:xbndymq@163.com
S859.53
A
0366-6964(2015)11-2069-09
