弓形虫强免疫原性排泄分泌抗原组分的鉴定
2015-03-22张念章张德林
叶 强,王 萌,张念章,殷 宏,2,张德林,2*
(1.中国农业科学院兰州兽医研究所 家畜疫病病原学国家重点实验室 甘肃省动物寄生虫病重点实验室,兰州 730046;2.江苏省动物重要疫病与人兽共患病防控协同创新中心,扬州 225009)
弓形虫强免疫原性排泄分泌抗原组分的鉴定
叶 强1,王 萌1,张念章1,殷 宏1,2,张德林1,2*
(1.中国农业科学院兰州兽医研究所 家畜疫病病原学国家重点实验室 甘肃省动物寄生虫病重点实验室,兰州 730046;2.江苏省动物重要疫病与人兽共患病防控协同创新中心,扬州 225009)
旨在筛选弓形虫排泄分泌抗原(ESA)中具有强抗原性的蛋白质组分。通过双向电泳和免疫印迹技术,对弓形虫ESA进行分析。结果共筛选到了18个免疫显性蛋白质点,并成功对其中6个具有代表性的蛋白质点进行了质谱鉴定,显示为微线体蛋白1、微线体蛋白4、包囊基质蛋白和14-3-3蛋白,共4种。本研究进一步为弓形虫病的诊断和疫苗研究提供新的实验依据。
弓形虫;排泄分泌抗原;双向电泳;免疫印迹;质谱
刚地弓形虫是一种专性细胞内寄生虫,能感染包括人在内的几乎所有温血动物,并引发多种严重危害人和动物生命健康的疾病。据估计,全世界约有1/3的人感染,通常呈隐性感染[1],孕妇感染弓形虫会引起多种胎儿疾病[2-4]。近年来,艾滋病(AIDS)患者不断增多,并发的弓形虫脑炎成为AIDS患者死亡的主要原因之一。因此,弓形虫的防治越来越受到关注,而研制高效的弓形虫疫苗成为当前最迫切的任务之一[5]。
目前已有的大部分疫苗,包括全虫疫苗、排泄分泌抗原疫苗、核酸疫苗和基因工程疫苗等,但这些疫苗的效果并不是十分理想[5],所以开发更加安全、有效的疫苗成为弓形虫免疫预防的重要任务。弓形虫排泄分泌抗原(excreted-secreted antigen,ESA)是虫体在入侵宿主细胞及在细胞内增殖和细胞外游离过程中向血液、组织间隙、体腔液或培养上清液释放的可溶性抗原成分,主要包括微线体蛋白(microneme protein,MIC)、棒状体蛋白(rhoptry protein,ROP)和致密颗粒蛋白(dense granule protein,GRA)等。大量研究显示,弓形虫ESA及其组分具有良好的反应原性及免疫保护性,表明其具有开发新型诊断试剂及良好疫苗的潜力[6-7]。因此,深入研究ESA的蛋白成分、生化及免疫学特性,对了解弓形虫的抗原特性、致病机制、免疫保护等均具有重要价值。
我们通过双向电泳结合蛋白质免疫印迹试验,筛选与弓形虫抗原性密切相关的一些蛋白质,并通过质谱成功进行鉴定,进一步为弓形虫的诊断和疫苗及新型药物的研究提供新的实验依据。
1 材料与方法
1.1 实验动物
SPF级雌性昆明鼠,体重18~22 g,购自中国农业科学院兰州兽医研究所动物实验中心。6月龄山羊,体重25~35 kg,购自甘肃省兰州市榆中县某羊场,经弓形虫间接血凝试剂盒检测为弓形虫抗体阴性。
1.2 虫株
弓形虫GJS强毒株,由中国农业科学院兰州兽医研究所家畜寄生虫病研究室保存。
1.3 细胞系
VERO细胞系由中国农业科学院兰州兽医研究所家畜寄生虫病研究室保存。
1.4 主要试剂
线性固相pH 梯度(immobilized pH gradient,IPG)干胶条(pH 4~7,24 cm)等购自美国Bio-Rad公司,PMSF、HRP标记的抗羊二抗购自Sigma公司,PVDF膜购自美国Amersham公司,HRP-DAB底物显色试剂盒、ECL化学发光试剂盒购自美国GE公司,弓形虫间接血凝检测试剂盒购自中国农业科学院兰州兽医研究所。
1.5 弓形虫速殖子的收集
将液氮冻存的弓形虫速殖子细胞悬液(浓度为2.0×106·mL-1)取出后,迅速置于37 ℃水中溶解,腹腔注射昆明小鼠,每只0.5 mL。待其发病后,腹腔冲洗收集新鲜的弓形虫速殖子悬液,4 ℃ 100×g 离心10 min,除去腹水中的小鼠细胞和碎片,上清液再次4 ℃ 200×g 离心10 min,收集的沉淀即为弓形虫速殖子。用PBS调整速殖子到合适的浓度后,保存备用。
1.6 细胞培养与ESA收集
弓形虫的培养和ESA的获得参考T.A.Costa-Silva等[8]方法,ESA从感染弓形虫的细胞培养基中获得,方法如下:长势良好的VERO细胞在接种弓形虫之前,用PBS冲洗3次,加入新鲜的含1%胎牛血清的PRMI-1640,然后接种弓形虫GJS株2.5×106个·mL-1,37 ℃共培养12 h后,倒掉细胞培养液,用PBS冲洗3次。再加入新鲜不含血清成分的PRMI-1640,在37 ℃温箱培养约48 h后,收集含有ESA的细胞培养液,用0.22 μm的滤膜过滤后加入10 μg·mL-1的PMSF。样品低温冻干后,于-80 ℃保存。同时设未接种弓形虫的细胞培养对照试验组,培养方式和过程以及培养液中蛋白质的收集与试验组完全相同。
1.7 蛋白质样品的制备
向冻干的蛋白质粉末中加入适量的蛋白质抽提液(8 mol·L-1Urea,2% CHAPS,0.2% Bio-Lyte ampholytes,50 mmol·L-1DTT,1% IPG buffer pH 4~7)使其充分溶解。4 ℃ 10 000×g 离心15 min,收集上清液,即为粗蛋白质样品。
采用TCA/丙酮沉淀法处理样品:将粗蛋白质样品用5倍体积的预冷丙酮(含10% TCA和20 mmol·L-1DTT)-20 ℃沉淀2 h,4 ℃ 12 000×g 离心15 min,再用预冷丙酮(含20 mmol·L-1DTT)冲洗3次,自然挥干。加入适量上样缓冲液,溶解蛋白质。考马斯亮蓝法测定蛋白质样品浓度后,分装。直接用于双向电泳或-80 ℃保存。
1.8 羊弓形虫阴、阳性血清的制备
羊弓形虫阴性血清:对体重为25~35 kg的山羊颈静脉采血,1 000×g离心15 min,吸取血清,用弓形虫间接血凝检测试剂盒检测其抗体滴度,确定该山羊为弓形虫阴性后(抗体水平<1∶64),保存血清,备用。
羊弓形虫阳性血清:对体重为25~35 kg的山羊腹腔注射弓形虫速殖子5 mL,浓度为2.0×106mL-1,10 d后,再次注射相同剂量的弓形虫速殖子,如此重复5次后,颈静脉采血,1 000×g离心15 min,吸取上层血清,用弓形虫间接血凝检测试剂盒检测其抗体滴度,确定山羊弓形虫阳性血清效价(抗体水平≥1∶64),保存,备用。
1.9 蛋白质印迹(Western blotting)分析
弓形虫ESA 10 μg 经过SDS-PAGE电泳分离后,进行转膜,将胶上的蛋白质电转至PVDF膜上,用制备的羊弓形虫阴、阳性血清为抗体,HRP标记的抗羊二抗(1∶2 000)进行Western blotting分析。用HRP-DAB底物显色试剂盒进行显色。
1.10 弓形虫ESA二维电泳分析
弓形虫ESA 4 ℃融化后,加入上样缓冲液(8 mol·L-1尿素,2% CHAPS,0.2% IPG Buffer,50 mmol·L-1DTT,0.002%溴酚蓝),混匀,4 ℃10 000×g离心10 min。按上样量1 mg,总体积450 μL进行上样。采用50 V,20 ℃进行主动水化12 h,然后直接进行等电聚焦总电压时间为110 kVh。等点聚焦结束后将胶条进行两步平衡。然后将平衡后的胶条移至12%十二烷基硫酸钠-聚丙烯酰胺凝胶电泳(SDS-PAGE)凝胶(24 cm×19 cm×0.1 cm)上进行第二向电泳,二向电泳的程序:1.5 W·gel-145 min,15 W·gel-1直到溴酚蓝跑到底,约4 h 30 min 。
选取2014年3月至2017年3月在本院接受治疗的结肠癌患者103例,将患者随机分为两组:实验组51例(完整结肠系膜切除术),对照组52例(传统根治术)。
1.11 凝胶染色和蛋白质印迹(Western blotting)分析
将上述两块凝胶中的一块进行考马斯亮蓝染色过夜,然后脱色至蛋白质点清晰可见、背景颜色较浅为止,用UMAX PowerLook 1100透射扫描仪获取图像并保存。另一块进行转膜,将胶上的蛋白质电转至PVDF膜上,用制备的弓形虫羊阴性、阳性血清为抗体,HRP标记的抗羊二抗进行Western blotting分析,最后使用ECL化学发光试剂盒将PVDF膜进行胶片曝光显影定影,流水冲洗后干燥并照相保存。
1.12 免疫反应性蛋白的质谱鉴定
将发生免疫反应的蛋白质点从凝胶上切取下来,用超纯水漂洗两次后,加入脱色液(25 mmol·L-1NH4HCO3、50%乙腈的水溶液),脱色30 min。吸出脱色液,加入脱水液Ⅰ(50%的乙腈溶液),脱水30 min,吸出脱水液Ⅰ,加入脱水液Ⅱ(100%的乙腈),脱水30 min,吸出脱水液Ⅱ,加入20 μL酶解工作液(含0.02 μg·μL-1胰蛋白酶的酶解覆盖液),吸胀30 min,加入10 μL酶解覆盖液(25 mmol·L-1NH4HCO3、10%乙腈的水溶液),37 ℃水浴酶解过夜,酶解后上清转移至另一新离心管中,加入50 μL蛋白质萃取液于剩下的胶中,37 ℃温浴30 min,5 000×g离心5 min,合并上清,冻干后待做质谱。将干粉重新溶解于5 μL含0.1%TFA的溶液中,然后按照1∶1的比例与含50% ACN和含1% TFA的α-氰基-4-羟基肉桂酸饱和溶液混合,取1 μL样品进行质谱点靶鉴定。
质谱鉴定后,在数据库T.gondii6.2中搜索,搜索参数如下:酶为胰蛋白酶;允许最大漏切位点为1;固定修饰为Carbamidomethyl(C);可变修饰为Oxidation(M);MS tolerance为0.005%;MS/MS tolerance为0.5 u;Protein score C.I.%大于95%为鉴定成功。
2 结 果
2.1 SDS-PAGE-WB
对收集到的蛋白质样品进行SDS-PAGE电泳免疫印迹试验(图1),弓形虫ESA与羊弓形虫阳性血清反应结果中,共有8个阳性条带(如图1),分别出现在约15、20、26、36、38、54、62和130 ku,其中在36 ku附近的阳性条带信号最强,而ESA与羊弓形虫阴性血清反应没有条带出现(图1),对照组健康VERO细胞培养液中收集的蛋白质与羊弓形虫阳性血清作用,未出现阳性反应条带(图1)。
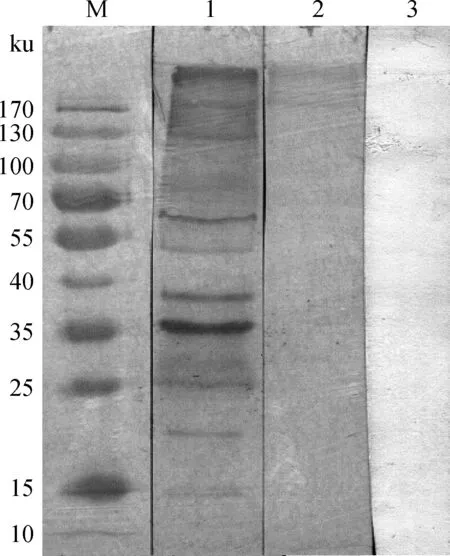
M.蛋白质相对分子质量标准;1.弓形虫ESA蛋白与羊弓形虫阳性血清反应结果;2.VERO细胞培养上清液与羊弓形虫阳性血清反应结果;3.弓形虫ESA蛋白与羊弓形虫阴性血清反应结果M.Protein molecular weight marker;1.The reaction of the T.gondii excreted-secreted antigen and positive serum of T.gondii in goat;2.The reaction of the cell supernatant of VERO and positive serum of T.gondii in goat;3.The reaction of the T.gondii ESA and negative serum of T.gondii in goat图1 免疫血清与抗原免疫印迹反应Fig.1 Reactivity of anti-Toxoplasma gondii sera with antigens in Western blotting
2.2 弓形虫ESA的双向电泳图谱
2.3 2-DE-WB和质谱分析
f托氟沙星纳米乳的制备及其急性毒性研究结果显示共检测到了18个阳性蛋白质点(图3)。选择了其中的6个斑点进行质谱分析,并成功对这6个蛋白质点进行鉴定,结果显示它们属于4种特定蛋白质,包括微线体蛋白1(microneme protein 1,MIC1)、 微线体蛋白4(microneme protein 4,MIC4)、包囊基质蛋白(cyst matrix protein)、14-3-3蛋白(14-3-3 protein)(表1)。

图2 弓形虫双向电泳图谱Fig.2 2-DE image of Toxoplasma gondii-infected excreted-secreted antigen

图3 弓形虫ESA免疫印迹得到的阳性蛋白质点Fig.3 Positive protein spots of Toxoplasma gondii excreted-secreted antigen identified by the Western blotting
表1 质谱鉴定的阳性蛋白质点
Table 1 Protein from excreted-secreted antigen ofToxoplasmagondiiidentified by mass spectrometry

位点号SpotNo.蛋白质登录号AccessionNo.蛋白质名称Proteinname分值Proteinscore蛋白质相对分子质量ProteinMW等电点PI覆盖度Coverage1gi|211967270|micronemeprotein4,MIC4123651475.06172gi|211963364|cystmatrixprotein,putative234494644.89193gi|211963364|cystmatrixprotein,putative255494644.89234gi|211966195|micronemeprotein1,MIC1110496255.15205gi|237832223|14⁃3⁃3protein,putative75373795.05136gi|237832223|14⁃3⁃3protein,putative81373795.0527
3 讨 论
弓形虫ESA在弓形虫入侵宿主细胞和细胞内存活过程中,都起到关键作用,组分较为复杂。ESA具有良好的反应原性及免疫保护性,多种弓形虫免疫效果良好的蛋白质,如GRA6[9]蛋白等,都是其重要的组成成分。本文利用从感染弓形虫的VERO细胞培养基上清收集的弓形虫ESA进行免疫反应原性检测,以筛选具有免疫原性的弓形虫排泄分泌抗原。SDS-PAGE-WB结果共检测到了8个阳性条带,与已报道的相关研究结果相一致[10-11],并且对照组试验中没有出现阳性反应条带。其中36 ku附近的阳性条带信号最强,表明该蛋白质条带具有较好的反应原性。根据已有的研究显示多种蛋白质的相对分子质量在36 ku附近,例如MIC6、MIC7、GRA4以及GRA10等。20 ku的条带可能与MIC5、GRA1和GRA2密切相关,26 ku的蛋白质条带则与GRA7的相对分子质量一致,另外MIC3和ROP9的相对分子质量大小也正好与38 ku的条带匹配,而ROP2蛋白家族的多个成员的相对分子质量大小则分布于54和62 ku,正好与本文的结果相一致[1,10,12-15]。
通过双向电泳考马斯亮蓝染色图谱共检测到超过1 000个蛋白质斑点,其等电点主要分布于4.0~7.0,并结合蛋白质免疫印迹技术共检测到了18个具有免疫原性的蛋白质点,其中一些蛋白质点紧密靠在一起,根据经验判断极有可能是同一蛋白质的不同修饰类型所造成,所以对于这类蛋白质选取其中具有代表性的6个蛋白质斑点进行质谱分析和数据库检索,并成功对其进行了鉴定,它们归属于4种特定蛋白质,包括MIC1、MIC4、包囊基质蛋白(cyst matrix protein)和14-3-3蛋白(14-3-3 protein)。
MIC1和MIC4是由位于弓形虫虫体前端的分泌器官——微线体分泌的蛋白质,是一种重要的宿主结合蛋白,与虫体识别和结合宿主密切相关,它们常与MIC6结合形成复合体而发挥作用,且这种复合体对分泌运输过程起着至关重要的作用[12,16-17]。本研究中MIC1和MIC4均被羊抗弓形虫血清检测到,表明其具有良好反应原性。对MIC1和MIC4已有的研究显示,它们具有良好的免疫保护性,用其研制的疫苗免疫小鼠能够引起显著的体液和细胞免疫应答,并延长小鼠的存活时间[18-19]。
包囊基质蛋白又叫基质抗原1(matrix antigen 1,MAG1),表达于寄生虫组织包囊、包囊基质和包囊壁,在弓形虫速殖子和缓殖子阶段均有表达,但在后者具有更高的表达[20]。M.Di Cristina等[21]的研究显示MAG1能够引起特异性的B、T细胞免疫应答反应,免疫保护试验也证实其具有一定的免疫保护性[22],同时也在弓形虫的诊断上显示出巨大的潜力。目前对MAG1的研究还非常有限,可能具有介导黏附和侵入宿主细胞的作用[21],还需要进一步的研究。
14-3-3蛋白广泛存在于真核细胞内,并且具有高度的保守性,参与多种重要细胞生理过程,主要包括细胞质信号转导、细胞周期的调控和细胞凋亡等,对真核生物具有重要意义[23-24]。目前,已经对包括弓形虫在内的多种寄生虫的14-3-3蛋白进行了研究,结果显示由其制备的多种疫苗均具有一定的免疫保护作用,而由14-3-3蛋白作为抗原进行ELISA检测,显示出高度的敏感性和特异性,表明14-3-3蛋白是良好的疫苗和诊断试剂候选分子。本研究中6号斑点14-3-3蛋白信号非常强,表明其具有良好的反应原性。
4 结 论
应用双向电泳和免疫印迹技术,对弓形虫具有强免疫原性的排泄分泌抗原中具有的蛋白质组分进行了筛选,分析发现,筛选到18个免疫显性蛋白质点,并对其中6个具有代表性的蛋白质点进行质谱鉴定,显示为微线体蛋白1、 微线体蛋白4、包囊基质蛋白和14-3-3蛋白。
[1] DUBEY J P.Toxoplasmosis of animals and humans[M].Secondth edition,Boca Raton,NewYork:CRC Press Inc,2010:1-313.
[2] COOK G C.Toxoplasmagondiiinfection a potential danger to the unborn fetus and AIDS sufferer[J].QJMed,1990,74(273):3-19.
[3] DODDS E M.Toxoplasmosis[J].CurrOpinOphthalmol,2006,17(6):557-561.
[4] MONTOYA J G,LIESENFELD O.Toxoplasmosis[J].Lancet,2004,363(9425):1965-1976.
[5] ZHANG N Z,CHEN J,WANG M,et al.Vaccines againstToxoplasmagondii:new developments and perspectives[J].ExpertRevVaccines,2013,12(11):1287-1299.
[6] 李润花,孟晓丽,殷国荣,等.霍乱毒素佐剂联合弓形虫ESA鼻内免疫小鼠抗弓形虫感染作用[J].热带医学杂志,2010,10(10):1184-1186. LI R H,MENG X L,YIN G R,et al.Intranasal immunization with CT adjuvant and ESA proteces mice againstToxoplasmagondiiinfection[J].JournalofTropicalMedicine,2010,10(10):1184-1186.(in Chinese)
[7] 白 昀,王海燕,王占伟,等.猪弓形虫重组MIC3蛋白单克隆抗体的制备及其初步应用[J].畜牧兽医学报,2013,44(10):1622-1628. BAI Y,WANG H Y,WANG Z W,et al.Preparation and preliminary application of monoclonal antibodies against rMIC3 ofToxoplasmagondii[J].ActaVeterinariaetZootechnicaSinica,2013,44(10):1622-1628.(in Chinese)
[8] COSTA-SILVA T A,MEIRA C S,FERREIRA I M,et al.Evaluation of immunization with tachyzoite excreted-secreted proteins in a novel susceptible mouse model(A/Sn) forToxoplasmagondii[J].ExpParasitol,2008,120(3):227-234.
[9] BLANCHARD N,GONZALEZ F,SCHAEFFER M,et al.Immunodominant,protective response to the parasiteToxoplasmagondiirequires antigen processing in the endoplasmic reticulum[J].NatImmunol,2008,9(8):937-944.
[10] AHN M H,SON H J,LEEM M H,et al.Antigen analysis ofToxoplasmagondiilysate and excretory-secretory materials by enzyme-linked immunoelectrotransfer blot(EITB)[J].KoreanJParasitol,1994,32(4):249-257.
[11] DARYANI A,SHARIF M,KALANI H,et al.Electrophoretic patterns ofToxoplasmagondiiexcreted/secreted antigens and their role in induction of the humoral immune response[J].JundishapurJMicrobiol,2014,7(4):e9525.
[12] REISS M,VIEBIG N,BRECHT S,et al.Identification and characterization of an escorter for two secretory adhesins inToxoplasmagondii[J].JCellBiol, 2001,152(3):563-578.
[13] MEISSNER M,REISS M,VIEBIG N,et al.A family of transmembrane microneme proteins ofToxoplasmagondiicontain EGF-like domains and function as escorters[J].JCellSci,2002,115(Pt 3):563-574.
[14] AHN H J,KIM S,NAM H W.Host cell binding of GRA10,a novel,constitutively secreted dense granular protein fromToxoplasmagondii[J].BiochemBiophysResCommun,2005,331(2):614-620.
[15] BRADLEY P J,WARD C,CHENG S J,et al.Proteomic analysis of rhoptry organelles reveals many novel constituents for host-parasite interactions inToxoplasmagondii[J].JBiolChem,2005,280(40):34245-34258.
[16] SAOUROS S,EDWARDS-JONES B,REISS M,et al.A novel galectin-like domain fromToxoplasmagondiimicronemal protein 1 assists the folding,assembly and transport of a cell adhesion complex[J].JBiolChem,2005,280(46):38583-38591.
[17] FRIEDRICH N,SANTOS J M,LIU Y,et al.Members of a nove1 protein family containing microneme adhesive repeat domains act as sialic acid-binding lectins during host cell invasion by apicomplexan parasites[J].JBiolChem,2010,285(3):2064-2076.
[18] LOURENÇO E V,BERNARDES E S,SILVA N M,et al.Immunization with MIC1 and MIC4 induces protective immunity againstToxoplasmagondii[J].MicrobesInfect,2006,8(5):1244-1251.
[19] PENG G H,YUAN Z G,ZHOU X H,et al.Sequence variation inToxoplasmagondiiMIC4 gene and protective effect of an MIC4 DNA vaccine in a murine model against toxoplasmosis[J].JAnimVetAdv,2010,9(10):1463-1468.
[20] FERGUSON D J,PARMLEY S F,TOMAVO S,et al.Evidence for nuclear localisation of two stage-specific isoenzymes of enolase inToxoplasmagondiicorrelates with active parasite replication[J].IntJParasitol,2002,32(11):1399-1410.
[21] DI CRISTINA M,DEL PORTO P,BUFFOLANO W,et al.TheToxoplasmagondiibradyzoite antigens BAG1 and MAG1 induce early humoral and cell-mediated immune responses upon human infection[J].MicrobesInfect,2004,6(2):164-171.
[22] PARMLEY S,SLIFER T,ARAUJO F.Protective effects of immunization with a recombinant cyst antigen in mouse models of infection withToxoplasmagondiitissue cysts[J].JInfectDis,2002,185(suppl 1):90-95.
[23] FU H,COBURN J,COLLIER R J.The eukaryotic host factor that activates exoenzyme S ofPseudomonasaeruginosais a member of the 14-3-3 protein family[J].ProcNatlAcadSciUSA,1993,90(6):2320-2324.
[24] ZHA J,HARADA H,YANG E,et al.Serine phosphorylation of death agonist BAD in response to survival factor results in binding to 14-3-3 not BCL-X(L)[J].Cell,1996,87(4):619-628.
(编辑 白永平)
Identification of High Immunogenic Components ofToxoplasmagondiiExcreted-secreted Antigens
YE Qiang1,WANG Meng1,ZHANG Nian-zhang1,YIN Hong1,2,ZHANG De-lin1,2*
(1.StateKeyLaboratoryofVeterinaryEtiologicalBiology,KeyLaboratoryofVeterinaryParasitologyofGansuProvince,LanzhouVeterinaryResearchInstitute,ChineseAcademyofAgriculturalSciences,Lanzhou730046,China;2.JiangsuCo-innovationCenterforPreventionandCentralofImportantAnimalInfectiousDisease,Yangzhou225009,China)
The objective of this study was to screen the main immunogenic antigen ofToxoplasmagondiiexcreted-secreted antigen(ESA).2-DE combined with Western blotting were used to analysis the components ofT.gondiiESA.Eighteen positive protein points were detected in this study.Among them,6 protein spots were selected to identify by matrix-assisted laser desorption/lionization time of flight mass spectrometry(MALDI-TOF/TOF),belonging to microneme protein 1,microneme protein 4,cyst matrix protein and 14-3-3 protein.This study provides a new reference for looking for new candidate molecules for prevention and diagnosis of toxoplasmosis.
Toxoplasmagondii;ESA;2-DE;Western blotting;mass spectrometry
10.11843/j.issn.0366-6964.2015.11.020
2015-02-12
甘肃省创新研究团体计划项目(1210RJA006);国家肉牛牦牛产业技术体系(NBCIS CARS-38)
叶 强(1986-),男,四川绵阳人,硕士,主要从事蛋白质组学研究,E-mail:yeqiang251@163.com
*通信作者:张德林,E-mail:zhangdl2005@163.com
S852.729
A
0366-6964(2015)11-2063-06
