BAT3过表达缓解由PrP106-126毒性多肽诱导的神经元凋亡
2015-03-22宋志琦赵文杰杨利峰王运盛程广宇周向梅赵德明
宋志琦,赵文杰,杨利峰,王运盛,朱 婷,程广宇,周向梅,赵德明*
( 1.中国农业大学动物医学院,国家动物海绵状脑病实验室,北京 100193;2.河南农业大学牧医工程学院,郑州 450000)
BAT3过表达缓解由PrP106-126毒性多肽诱导的神经元凋亡
宋志琦1#,赵文杰2#,杨利峰1,王运盛1,朱 婷1,程广宇1,周向梅1,赵德明1*
( 1.中国农业大学动物医学院,国家动物海绵状脑病实验室,北京 100193;2.河南农业大学牧医工程学院,郑州 450000)
拟检测BAT3蛋白过表达对由PrP106-126毒性多肽引起的神经元凋亡现象的影响。首先通过免疫荧光、CCK8细胞活性检测试剂盒和免疫印迹检测带FITC标签的PrP106-126-FITC毒性多肽的生物学毒性。分别用PrP106-126-FITC和PrP106-126神经毒性多肽处理原代神经元和Neuro2a细胞,通过免疫荧光技术和免疫印迹方法分别检测受刺激后的原代神经元和Neuro2a细胞中BAT3表达的变化情况。通过脂质体转染方法将已经构建好的pcDNA-3.1-HA-BAT3质粒转染进入原代神经元,用CCK8检测细胞活性;以同样方式将质粒转染进入小鼠神经瘤细胞系Neuro2a,用TUNEL凋亡检测试剂盒分析经BAT3转染或对照组的N2a细胞的凋亡水平;Western blot检测PrP106-126神经毒性多肽处理前后,胞质内细胞色素C和Bcl-2的变化,进一步了解BAT3在神经元凋亡中发挥作用的机制。结果显示,PrP106-126-FITC和PrP106-126神经毒性多肽具有相似的神经毒性。受到多肽刺激之后,无论在原代神经元还是传代细胞系Neuro2a中,BAT3都发生核输出现象,BAT3从细胞核转移进入细胞质。BAT3的过表达使受到PrP106-126毒性多肽刺激的神经元的细胞活性有所提高,Neuro2a的细胞凋亡现象减轻,同时抑制了由PrP106-126毒性多肽引起的细胞色素C的过度释放并且维持细胞内抗凋亡蛋白Bcl-2的稳定。BAT3蛋白的表达缓解PrP106-126毒性多肽对神经细胞造成的凋亡现象,为进一步阐释该蛋白质对朊病毒引起的神经元损失的治疗作用机制提供了依据。
BAT3;PrP106-126毒性多肽;神经凋亡;传染性海绵状脑病;原代神经元
朊病毒病(prion disease)是一组累及人类和动物的传染性神经退行性疾病,随着疯牛病和人类变异性克雅病(variant Creutzfeldt-Jacob disease,vCJD)的出现,该类疾病对公共卫生和人类健康的威胁日益显著[1-2]。组织病理学病变局限于中枢神经系统(CNS),以神经元空泡化、灰质海绵状病变、神经元丧失、神经胶质和星状细胞增生、病原因子PrPSc蓄积和淀粉样蛋白质斑块为特征[3]。PrP106-126是细胞性朊蛋白的一个多肽片段,位于朊蛋白的N端,最早报道于 1993 年[4-5],其具有类似于 PrPSc的生化特性,例如富含β-折叠以及具有蛋白酶抗性等,该多肽在体外对神经元具有神经毒性,同时该多肽的神经毒性在实验动物体内也得到证实,其为淀粉样病变形成的重要参与分子。正由于其特殊的性质,现在 PrP106-126 已成为在体外研究朊病的朊病毒模型,被广泛应用于朊病的致病机制的研究。人类白细胞抗原B相关转录因子3(BAT3),于1990年被发现位于人类6号染色体上,属于主要组织相容性复合物(MHC)第三族的成员。BAT3是一个多功能蛋白,其中一项重要的功能是其对细胞凋亡的调节作用[6-8]。但是BAT3在神经细胞中的过表达对由PrP106-126毒性多肽引起的神经细胞凋亡的缓解作用尚未有人研究与报道过。BAT3本身可能成为药物的研究靶点,对朊病及相关神经退行性疾病的治疗有重要意义。
1 材料与方法
1.1 试剂与材料
BAT3鼠源单克隆抗体,细胞色素C兔源多克隆抗体购自Santa Cruz公司;HA标签鼠源单克隆抗体,Bcl-2(P65)兔源多克隆抗体,β-actin兔源多克隆抗体,Lamin B1鼠源单克隆抗体,GAPDH兔源多克隆抗体,辣根过氧化物酶标记的山羊抗兔二抗购自Bioworld公司,辣根过氧化物酶标记的山羊抗鼠二抗,Alexa Fluor594标记的山羊抗小鼠IgG二抗购自中杉金桥公司;FITC标记的山羊抗兔二抗和Cy5标记的山羊抗兔二抗,兔源TUBB3/betaIII tubulin(神经元标记物)购自博奥森公司,神经元III族-β-Tubulin(Tuj1)抗体,DAPI二氢氯化物和碘化丙啶(PI),免疫荧光染色用的免疫固定液、免疫洗涤液,免疫封闭液购自碧云天公司;脂质体转染试剂Lipofectamine 2000和无血清培养基Opti-MEM购自Invitrogen公司;细胞质蛋白质提取试剂盒购自武汉博士德公司;多肽:朊蛋白多肽片段(KTNMKHMAGA AAAGAVVGGLG;PrP106-126)由上海生物公司合成;FITC标记的PrP106-126毒性多肽购自FANBO生化制剂公司;TUNEL试剂盒购自Roche公司;2 mmol·L-1多肽以PBS配制,存储于-20 ℃;电泳仪、电转仪均为美国BIO-RAD产品。
1.2 Neuro2a细胞的复苏与培养
1.3 原代神经元的分离与培养
出生24 h内的SD乳鼠75%酒精浸泡消毒5~10 min,浸于无菌水中清洗,取头置无菌平皿中,小剪刀沿大脑中部将皮肤剪开,露出颅骨。眼科剪沿着颅骨中缝剪开,用小止血钳去除颅骨,暴露出大脑皮质和小脑,小心分离出大脑,置4 ℃ DMEM液中(冰上),在解剖显微镜下分离出双侧大脑皮层,仔细剥除软脑膜和血管,然后沉淀洗涤分离出的组织5~6次(每次静止2 min,弃上清),将分离的大脑皮质部分剪碎成1~2 mm3的小组织块。将组织悬液置于无菌的瓶中消化,加入终质量浓度3 mg·mL-1木瓜蛋白酶+适量(0.05 mg·mL-1)DNA酶。37 ℃培养箱消化30~40 min,每10 min稍微摇动一下。加入少许血清终止反应,1 000 r·min-1离心5 min,弃上清,加入3~4 mL DMEM。用大口径吸管(配合枪头吹打)轻轻吹打组织块使细胞均匀分散为初细胞悬液。对初级细胞悬液经75 μm的不锈钢滤网过滤,转移至细胞培养瓶,培养箱培养30 min(差速去杂细胞)后,台盼蓝染色后细胞计数。细胞1 000 r·min-1离心5 min,用10%胎牛血清的DMEM/F12+0.5%B27培养液悬起细胞沉淀。将初细胞悬液经计数稀释到2×106·mL-1,接种到预先经50 μg·mL-1多聚左旋赖氨酸包被的培养板中,12孔板500 μL,置CO2培养箱中孵育24 h换液,每孔加1 mL培养基,24 h后半量换液,加入10 μmol·L-1的阿糖胞苷以抑制胶质细胞的生长,以后每隔48 h半量换液1次。培养6~7 d使用细胞。
1.4 质粒转染
收获处于对数生长期的N2a细胞或原代神经元细胞,以2×105·孔-1接种于12孔培养板中,37 ℃,5% CO2环境中培养24 h,细胞长至80%~90%融合,按转染试剂说明书进行转染,质粒和转染试剂的比例为2 μg∶3 μL,转染过程使用Opti-MEM无血清培养基,转染后5 h换为正常细胞培养时的10%FBS培养基。用于Western blot检测的细胞分为阴性对照组(转染pcDNA3.1-HA空载体)和试验组(转染pcDNA3.1-HA-BAT3重组质粒)。用于免疫荧光试验的细胞接种于之前铺好爬片的12孔培养板中。转染48 h后收集蛋白质进行相应检测。
1.5 免疫荧光试验
教学任务是数学教学的载体,学生的学习很大程度上受任务的影响.在创造性数学课堂中,教师选择的任务类型及教学策略不仅影响学生如何感知数学这门创造性学科,还影响学生数学创造性潜能的发展.
用洁净的盖玻片种入细胞进行培养,待细胞贴在盖玻片上生长良好后,进行过表达或用毒性多肽处理。前期试验结束后,进行免疫荧光染色。免疫染色固定液室温固定30 min以上。然后用免疫染色洗涤液洗涤2次,每次5 min。加入免疫染色封闭液,封闭60 min。按照适当比例用稀释一抗: BAT3抗体为1∶100、HA抗体为1∶1 000、TUBB3/beta III tubulin神经元标记物为1∶100、Tuj1为1∶250。吸尽封闭液,立即加入稀释好的一抗,37 ℃孵育2 h。 之后弃去一抗,洗涤液洗涤5 min,共洗涤3次。按照适当比例稀释二抗:Alexa Fluor 594标记的山羊抗小鼠IgG二抗、FITC标记的山羊抗兔二抗和Cy5标记的山羊抗兔二抗稀释比例都为1∶100。吸尽洗涤液后,立即加入稀释好的二抗,37 ℃孵育1 h。 之后加入免疫染色洗涤液,洗涤5 min,共洗涤3次。最后加入DAPI染核3 min,洗涤5 min,共洗涤3次。用抗淬灭剂封片,在正置激光共聚焦显微镜(Olympus,日本)下观察。
1.6 CCK8细胞活力检测试验
依照CCK8检测试剂盒说明书对不同试验组进行细胞活力检测,各组细胞接种到96孔板中,经过前期试验处理后,每组加入10 μL WST-8试剂,之后将96孔板放回细胞培养箱,在 37 ℃、5% CO2的条件下孵育2 h。样品检测时的吸光度为450 nm,以空白组作为对照。
1.7 TUNEL试剂盒检测细胞凋亡
将培养好的细胞调整到2×105·mL-1,加入铺好爬片的12 孔培养板上。首先进行转染,分别将BAT3重组质粒和空载体转染入N2a细胞,然后将室温处理过的终浓度为 200 μmol·L-1PrP106-126作用于经转染的N2a细胞以及设立未转染对照组,每个样品设三个重复,培养24 h后按照试剂盒使用说明进行TUNEL检测,最后用PI染核,以显示所有细胞数目。使用正置激光共聚焦显微镜(Olympus,日本)观察。
1.8 Western blot检测细胞色素C、Bcl-2、BAT3
细胞质和细胞核蛋白质的提取按照试剂盒(武汉博士德公司)说明书操作。提取各试验组和对照组的细胞质蛋白质,将样品调成相同的浓度,加入5×SDS凝胶加样缓冲液,沸水煮10 min,用SDS聚丙烯酰胺凝胶电泳,转移至PVDF膜,5%脱脂奶粉37 ℃封闭1 h,将膜与一抗4 ℃ 孵育过夜,一抗的稀释浓度:兔抗HA标签抗体1∶3 000稀释;鼠抗BAT3抗体1∶100稀释;兔抗细胞色素C抗体1∶500稀释;兔抗Bcl-2抗体1∶500稀释;兔源β-actin 抗体1∶3 000稀释。用TBST洗膜3次,每次5 min,再与辣根过氧化物酶标记的鼠源(1∶5 000)或兔源(1∶5 000)二抗在室温下孵育1 h,TBST洗膜3次,每次5 min,用化学发光液室温孵育5 min,曝光。
2 结 果
2.1 神经元细胞的鉴定
用两种神经元特异性抗体对分离的神经元进行鉴定,如图1所示,两种抗体的荧光染色都显示所分离的神经元纯度很高。

图1 神经元细胞的鉴定(比例尺=20 μm)Fig.1 The identification of the primary cultures of rat cortical neurons(bar=20 μm)
2.2 PrP106-126-FITC在细胞中的定位和细胞毒性的检测
用免疫荧光的方式对PrP106-126-FITC进行亚细胞定位,如图2所示,PrP106-126-FITC被神经元细胞吞噬之后,主要在细胞质中核周围存在。用CCK8细胞活性检测试剂盒对各试验组进行细胞活力测定,结果表明PrP106-126-FITC与PrP106-126有相似的细胞毒性;随后免疫印迹方法验证同样的结果,PrP106-126-FITC与PrP106-126相似,可以引起细胞质中细胞色素C的释放(图2)。
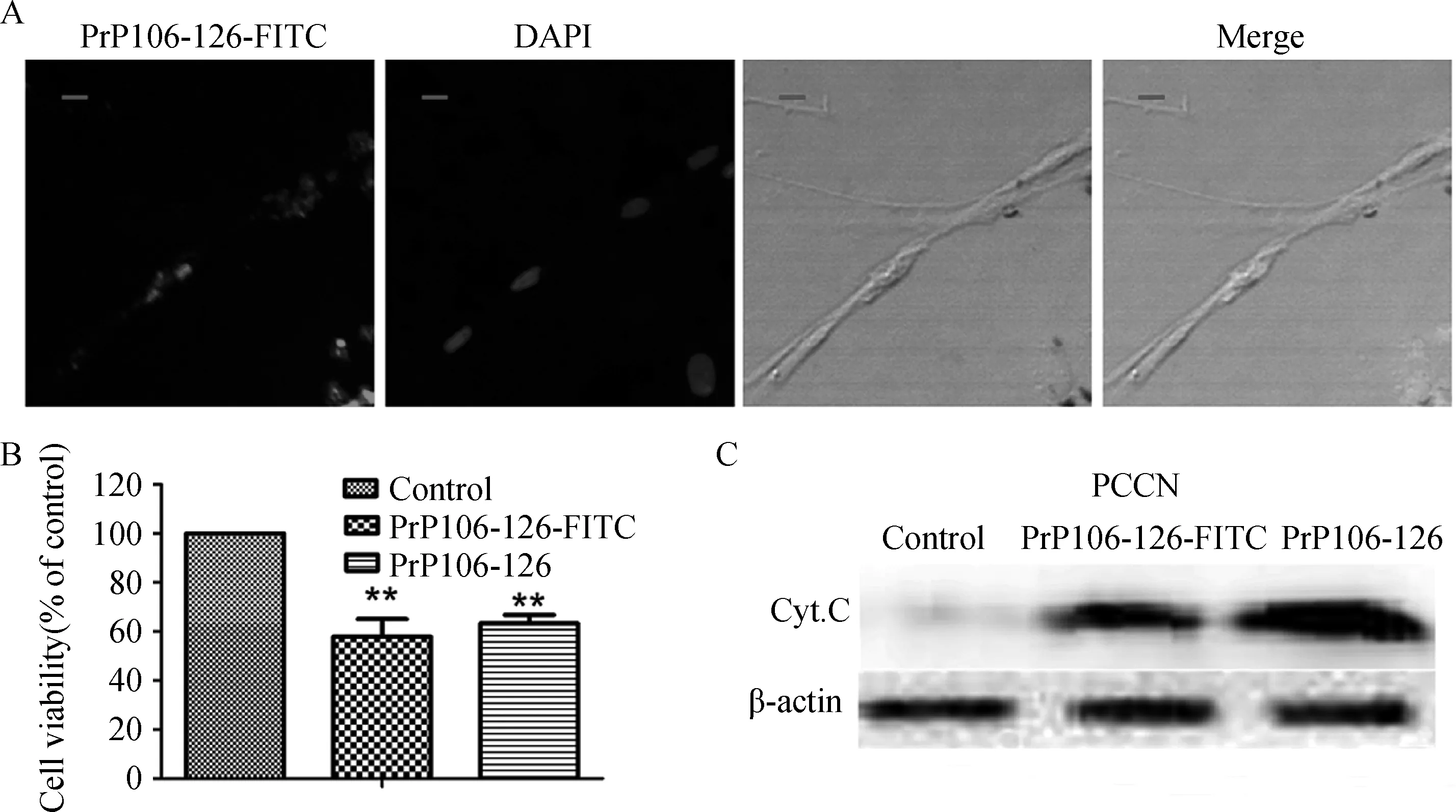
A.PrP106-126-FITC亚细胞定位(比例尺=10 μm);B、C.CCK8和WB对细胞毒性的检测A.Subcellular localization of PrP106-126-FITC(Scale bars=10 μm);B,C.Cytotoxicity assay by CCK8 and WB图2 PrP106-126-FITC和PrP106-126具有相似的细胞毒性Fig.2 PrP106-126-FITC has similar cytotoxicity to PrP106-126
2.3 用PrP106-126毒性多肽刺激原代神经元或N2a细胞后,BAT3从细胞核转移到细胞质
用免疫荧光和免疫印迹两种方法分别检测PrP106-126刺激细胞后,BAT3的亚细胞定位情况。如图3(A)所示,在未受刺激的细胞中,BAT3主要在细胞核中存在,PrP106-126-FITC刺激之后,BAT3向细胞质转移。PrP106-126刺激后,收获不同时间段的细胞质、细胞核蛋白质,用GAPDH和Lamin B分别作为内参蛋白质,图3(B)显示,PrP106-126刺激后,3~24 h,细胞质中的BAT3逐渐增加,经过检测细胞核BAT3蛋白的变化,我们了解到,这种变化是由于蛋白质从胞核转移到细胞质。
用FITC标记的PrP106-126毒性多肽刺激原代神经元24 h,用免疫荧光染色试验证实,多肽刺激之后,BAT3从细胞核转移到细胞质(图3A)。Western blot证实PrP106-126毒性多肽刺激N2a细胞后,BAT3蛋白从细胞核向细胞质转移。分别收获不同时间段的细胞,提取细胞质和细胞核BAT3蛋白,分别用β-actin和Lamin B1作为细胞质和细胞核的内参蛋白质,经过蛋白质相对密度分析,证实BAT3蛋白的核输出(图3B、C)。
2.4 BAT3过表达后可以缓解由PrP106-126毒性多肽引起的神经细胞凋亡
分别用CCK8细胞活性检测试剂盒(图4A)和TUNEL细胞凋亡检测试剂盒(图4C)检测BAT3的过表达对受PrP106-126刺激的细胞的影响。TUNEL试验证实BAT3过表达之后,与只攻毒组以及转染空载体+攻毒组相比,神经细胞凋亡水平明显下降。Western blot检测BAT3在对应组别中的表达量(图4B)。两个试验结果相似,都说明BAT3过表达后可以缓解由PrP106-126毒性多肽引起的神经细胞凋亡。
2.5 用PrP106-126毒性多肽刺激Neuro2a细胞引起细胞色素C向细胞质中的释放以及Bcl-2抗凋亡蛋白水平下调
进一步了解BAT3对神经元的保护作用的机制。首先验证经典通路,作者用PrP106-126刺激Neuro2a细胞,收获细胞质蛋白质,检测细胞色素C和Bcl-2的变化情况。结果和文献报道相符合,如图5(A 和B)所示,受到刺激后,随着刺激时间延长,细胞质中细胞色素C逐渐增多,Bcl-2逐渐减少。2.6 BAT3过表达后可以抑制细胞色素C向细胞质的释放,同时稳定细胞质中Bcl-2抗凋亡蛋白的水平
进一步了解BAT3过表达后,PrP106-126刺激对神经元细胞中这两种蛋白质的影响。BAT3过表达后,即使PrP106-126刺激24 h,与只经受PrP106-126孵育的细胞相比,细胞质中细胞色素C的释放量明显减少,Bcl-2的表达量明显增加(图6A)。并且细胞色素C的释放量与BAT3的转染剂量成反比关系减少(图6B)。随着BAT3表达量的增加,细胞色素C的释放量逐渐减少。
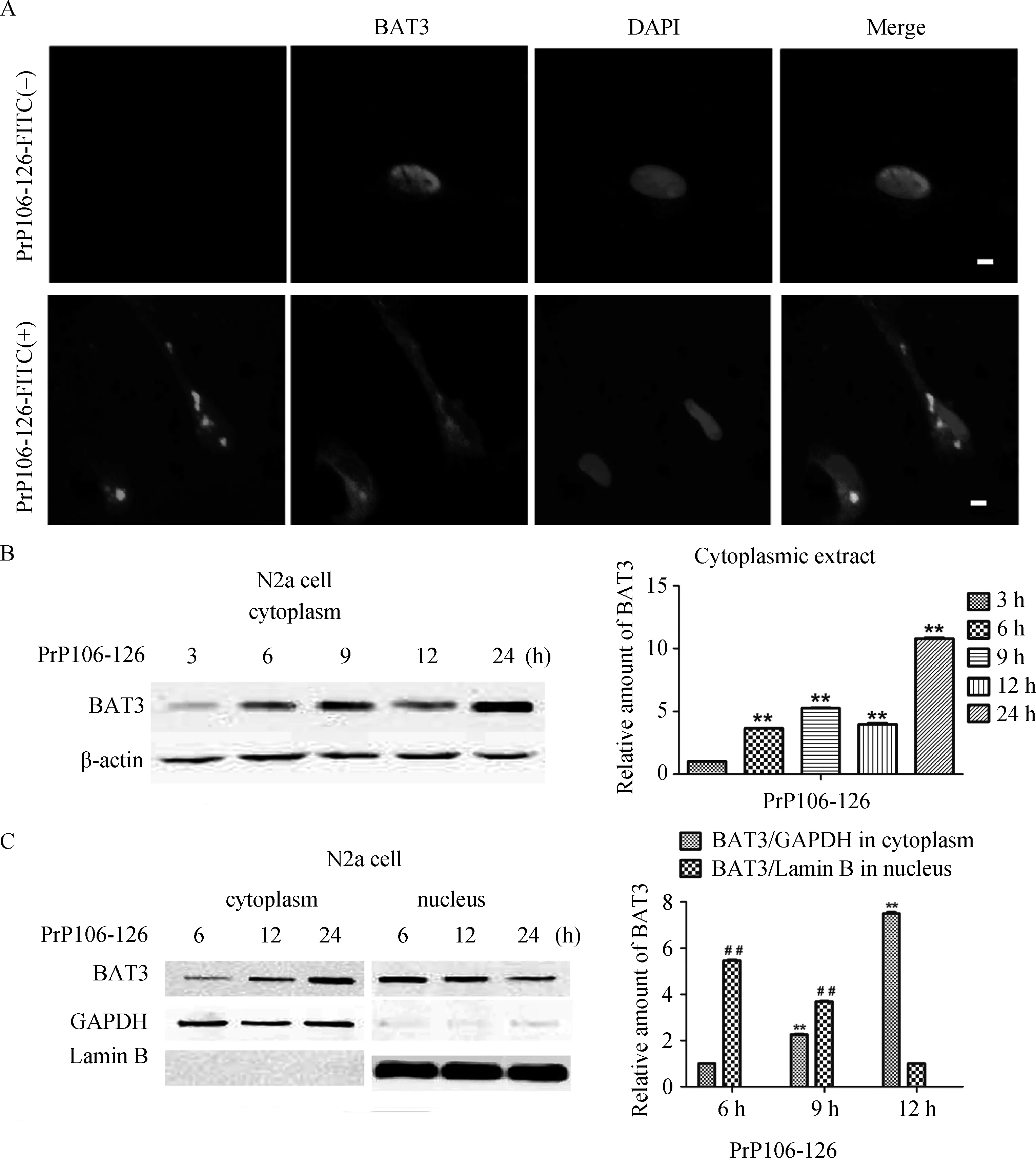
图3 受到PrP106-126刺激后,BAT3的核输出(比例尺=5 μm)Fig.3 PrP106-126 stimulation induces BAT3 export from nucleus to cytoplasm(Scale bars=5 μm)
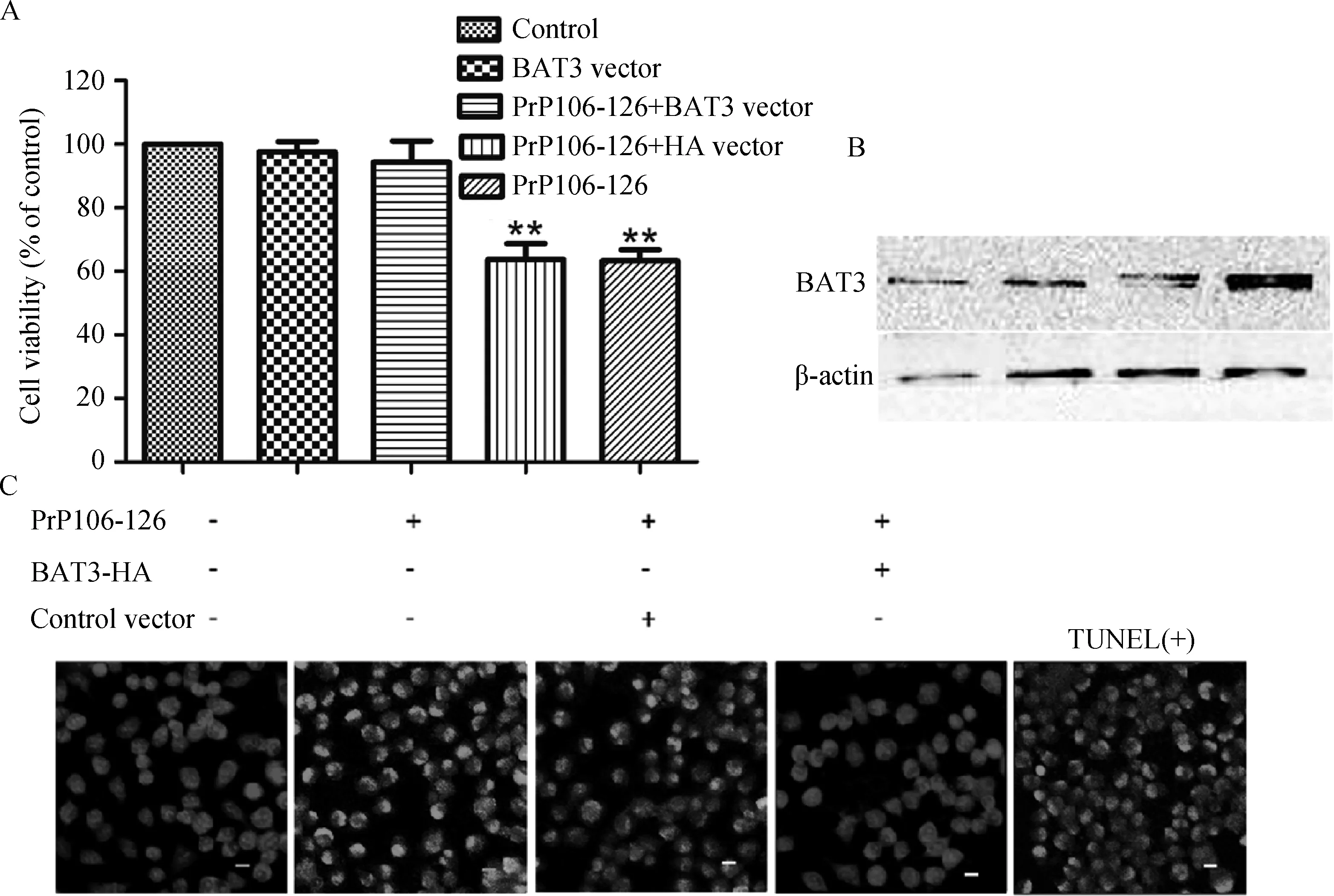
图4 BAT3过表达后可以缓解由PrP106-126毒性多肽引起的神经细胞凋亡(比例尺=5 μm)Fig.4 BAT3 overexpression increases cell viability and suppresses PrP106-126-induced neuronal apoptosis(Scale bars=5 μm)
3 讨 论
3.1 PrP106-126-FITC和PrP106-126具有相似的细胞毒性
首次对FITC标记的PrP106-126毒性多肽在神经元中进行定位和细胞毒性检测。PrP106-126-FITC主要分布在神经元细胞质中,在细胞核周围分布。它具有和PrP106-126相似的细胞毒性,攻毒后可以诱导细胞质中细胞色素C的释放。因为PrP106-126-FITC带有荧光标记的FITC标签,使作用后的定位可视化,便于研究中直接、准确地观察攻毒前后的变化。
3.2 对BAT3在由PrP106-126毒性多肽引起的神经元凋亡中作用的深入研究填补了BAT3作为抗凋亡蛋白,在海绵状脑病中发挥作用机制研究的空白
人类白细胞抗原B相关转录因子3(BAT3),于1990年被发现位于人类6号染色体上,属于主要组织相容性复合物(MHC)第三族的成员。BAT3是一个多功能蛋白质,其中一项重要的功能是其对细胞凋亡的调节作用[9]。BAT3含有一段核定位信号(NLS)和一段核输出信号(NES),表明它具有核输出功能。蛋白通过细胞核和细胞质间的穿梭调节凋亡,维持转录因子的基本活动。BAT3作为细胞核-细胞质穿梭蛋白早有报道,它可以通过此过程调节由结核抗原ESAT-6(早期分泌抗原靶点-6)、喜树碱(CPT)-a拓扑异构酶抑制剂、乳头瘤病毒绑定因子(PBF)诱导的细胞凋亡[8,10-12]。与此前的报道相一致的是,作者的研究发现,N2a细胞受到PrP106-126毒性多肽刺激之后,BAT3表现为时间依赖性核输出。之前有报道表明,BAT3的转移至少有部分原因来自于其伴侣分子TRC35(跨膜区识别复合物35)对NLS信号的覆盖[13]。作者推测,受到PrP106-126毒性多肽刺激后,BAT3蛋白在细胞质中的瞬时增加可能为细胞对凋亡的抵御机制,但是之后由于蛋白酶系统或其他的动力学机制,BAT3可能被降解而失去抗凋亡作用。因为作为BAG蛋白家族成员之一,BAG3在受到内质网应激诱导的凋亡过程中会被蛋白酶降解。为了深入了解BAT3

A、B.PrP106-126诱导细胞质中细胞色素C的释放和Bcl-2的减少;C.外源BAT3和PrP106-126的共定位(比例尺=5 μm)A,B.PrP106-126 induced Cytochrome C release and Bcl-2 protein decrease in the cytoplasm;C.The exogenous BAT3 colocalized with PrP106-126 in the cytoplasm(Scale bars=5 μm)图5 PrP106-126毒性多肽刺激Neuro2a细胞引起细胞色素C以及Bcl-2的变化Fig.5 PrP106-126 induced changes of cytochrome C release and Bcl-2 protein in the cytoplasm of Neuro2a
图6 过表达全长BAT3抑制由PrP106-126诱导的细胞色素C的释放和Bcl-2的减少Fig.6 Overexpression of full-length BAT3 inhibits PrP106-126-induced cytochrome C release and stabilizes the Bcl-2 protein
在此过程中的作用机制,作者过表达BAT3,探索BAT3作为药物靶点可能发挥的作用。之前有报道指出,Bcl-2本身可以通过抑制细胞色素C的释放抑制细胞凋亡[14],另一方面,BAT3(BAG6)属于BAG蛋白家族,拥有一组保守的BAG蛋白区域,该家族其他成员,比如BAG1、BAG3、BAG4可以通过BAG区域与Bcl-2相关联[15]。与之前的研究相一致的是,试验结果表明,BAT3的过表达可以缓解由PrP106-126毒性多肽诱导的神经元凋亡,并且这一
过程是通过抑制细胞色素C的释放和稳定细胞质中Bcl-2的含量所发挥的作用。
3.3 由PrP106-126毒性多肽引起神经元凋亡作用机制的新思路,为相关疾病的研究提供新思路,拓展新思维,为相关药物研发提供新的靶点和理论依据
BAT3为一个多功能蛋白质,在蛋白酶体系统、内质网相关蛋白质降解、错误折叠和错误蛋白质降解中也发挥重要作用。其在朊病毒和神经退行性疾病中的作用可能不止如此,还有待进一步研究。
[1] AGUZZI A,HEIKENWALDER M,POLYMENIDOU M.Insights into prion strains and neurotoxicity[J].NatRevMolCellBiol,2007,8(7):552-561.
[2] PRUSINER S B.Novel proteinaceous infectious particles cause scrapie[J].Science,1982,216(4542):136-144.
[3] ZHOU M,OTTENBERG G,SFERRAZZA G F,et al.Highly neurotoxic monomeric α-helical prion protein[J].ProcNatlAcadSciUSA,2012,109(8):3113-3118.
[4] SHI F,YANG Y,KOUADIR M,et al.Inhibition of phagocytosis and lysosomal acidification suppresses neurotoxic prion peptide-induced NALP3 inflammasome activation in BV2 microglia[J].JNeuroimmunol,2013,260(1-2):121-125.
[5] SONG Z,ZHAO D,YANG L.Molecular mechanisms of neurodegeneration mediated by dysfunctional subcellular organelles in transmissible spongiform encephalopathies[J].ActaBiochimBiophysSin(Shanghai),2013,45(6):452-464.
[6] GROVER A,IZZO A A.BAT3 regulates Mycobacterium tuberculosis protein ESAT-6-mediated apoptosis of macrophages[J].PLoSOne,2012,7(7):e40836.
[7] MINAMI R,HAYAKAWA A,KAGAWA H,et al.BAG-6 is essential for selective elimination of defective proteasomal substrates[J].JCellBiol,2010,190(4):637-650.
[8] TSUKAHARA T,KIMURA S,ICHIMIYA S,et al.Scythe/BAT3 regulates apoptotic cell death induced by papillomavirus binding factor in human osteosarcoma[J].CancerSci,2009,100(1):47-53.
[9] WU Y H,SHIH S F,LIN J Y.Ricin triggers apoptotic morphological changes through caspase-3 cleavage of BAT3[J].JBiolChem,2004,279(18):19264-19275.
[10] VIRADOR V M,DAVIDSON B,CZECHOWICZ J,et al.The anti-apoptotic activity of BAG3 is restricted by caspases and the proteasome[J].PLoSOne,2009,4(4):e5136.
[11] DESMOTS F,RUSSELL H R,MICHEL D,et al.Scythe regulates apoptosis-inducing factor stability during endoplasmic reticulum stress-induced apoptosis[J].JBiolChem,2008,283(6):3264-3271.
[12] SASAKI T,MARCON E,MCQUIRE T,et al.Bat3 deficiency accelerates the degradation of Hsp70-2/HspA2 during spermatogenesis[J].JCellBiol,2008,182(3):449-458.
[13] WANG Q,LIU Y,SOETANDYO N,et al.A ubiquitin ligase-associated chaperone holdase maintains polypeptides in soluble states for proteasome degradation[J].MolCell,2011,42(6):758-770.
[14] RAMBOLD A S,MIESBAUER M,RAPAPORT D,et al.Association of Bcl-2 with misfolded prion protein is linked to the toxic potential of cytosolic PrP[J].MolBiolCell,2006,17(8):3356-3368.
[15] KAWAHARA H,MINAMI R,YOKOTA N.BAG6/BAT3:emerging roles in quality control for nascent polypeptides[J].JBiochem,2013,153(2):147-160.
(编辑 白永平)
Overexpression of BAT3 Alleviates Prion Protein Fragment PrP106-126-Induced Neuronal Apoptosis
SONG Zhi-qi1#,ZHAO Wen-jie2#,YANG Li-feng1,WANG Yun-sheng1,ZHU Ting1,CHENG Guang-yu1,ZHOU Xiang-mei1,ZHAO De-ming1*
(1.StateKeyLaboratoriesforAgrobiotechnology,KeyLabofAnimalEpidemiologyandZoonosis,MinistryofAgriculture,NationalAnimalTransmissibleSpongiformEncephalopathyLaboratory,CollegeofVeterinaryMedicine,ChinaAgriculturalUniversity,Beijing100193,China;2.CollegeofAnimalHusbandaryandVeterinaryScience,HenanAgriculturalUniversity,Zhengzhou450000,China)
The objective of this study was to investigate the interactions between BAT3 and prion protein and the potential role of BAT3 in PrP106-126-induced apoptosis.Immunofluorescence,the CCK-8 assay kit and western blotting were used to test the cytotoxicity of PrP106-126-FITC.After the stimulation of PrP106-126-FITC or PrP106-126,the location of BAT3 was tested by immunofluorescence and western blotting in the neurons.BAT3 was overexpressed in Neuro2a or primary neuronal cells by transfection with pcDNA3.1-HA-BAT3 expression plasmids.The effect of BAT3 on PrP106-126-induced cytotoxicity and apoptosis were detected by the CCK-8 assay and TUNEL assay.The expression of cytochrome c and Bcl-2 were examined by western blotting.Results were as follows:PrP106-126-FITC has similar cytotoxicity with PrP106-126.BAT3 interacted with prion protein and enhanced PrP expression.After PrP106-126 peptide treated,BAT3 was transported from the nucleus to cytoplasm,increased cell viability and protected neurons from PrP106-126-induced apoptosis through stabilizing the level of Bcl-2 protein and inhibiting the release of cytochrome c to cytoplasm.Our present data showed a novel molecular mechanism of PrP106-126-induced apoptotic process regulation through the overexpression of BAT3,which may be important for the basic regulatory mechanism of neuron survival in prion diseases and associated neurodegenerative diseasesinvivo.
BAT3;PrP106-126;neuronal apoptosis;transmissible spongiform encephalopathies;primary cortical neurons
10.11843/j.issn.0366-6964.2015.05.022
2014-09-04
国家自然科学基金(31272532)
宋志琦(1989-),女,内蒙古赤峰人,博士生,主要从事动物海绵状脑病致病机制和兽医病理学方面工作,E-mail:songzhiqi1989@gmail.com;赵文杰(1990-),女,山东人,研究生,主要从事动物海绵状脑病致病机制和兽医病理学方面工作,E-mail:hnndwenjiezhao@163.com。二者为共同第一作者
*通信作者:赵德明,教授,博士生导师,E-mail:zhaodm@cau.edu.cn
S852.659.7
A
0366-6964(2015)05-0841-08
