绵羊AA-NAT基因mRNA表达与常年发情相关性研究
2015-03-22卢璐璐孙晓笛储明星王永娟黄冬维王金玉潘章源刘秋月
卢璐璐,孙晓笛,储明星*,王永娟,黄冬维,王金玉,狄 冉,潘章源,刘秋月
(1.中国农业科学院北京畜牧兽医研究所,农业部畜禽遗传资源与种质创新重点实验室,北京 100193;2.扬州大学 动物科学与技术学院,扬州 225009)
绵羊AA-NAT基因mRNA表达与常年发情相关性研究
卢璐璐1,孙晓笛2,储明星1*,王永娟2,黄冬维1,王金玉2,狄 冉1,潘章源1,刘秋月1
(1.中国农业科学院北京畜牧兽医研究所,农业部畜禽遗传资源与种质创新重点实验室,北京 100193;2.扬州大学 动物科学与技术学院,扬州 225009)
为了探讨AA-NAT基因表达与绵羊常年发情之间的关联性,本研究以常年发情小尾寒羊和季节性发情滩羊各9只为研究对象,利用real-time PCR技术检测AA-NAT基因在这2种绵羊不同发情阶段下丘脑、垂体、松果体、卵巢、子宫体和肾上腺6种组织中的mRNA表达情况。结果显示,AA-NAT基因在不同情期的两个绵羊品种的6个组织中表达有明显差异,在发情期绵羊的卵巢、子宫体、松果体中高水平表达。春秋季发情期小尾寒羊与秋季发情期滩羊相比,其卵巢和子宫体中AA-NAT基因表达量极显著偏低(P<0.01),而松果体中表达量极显著偏高(P<0.01)。本研究结果初步表明,卵巢、子宫体和松果体中AA-NAT基因表达上调可能与小尾寒羊常年发情相关。
绵羊;常年发情;AA-NAT基因;real-time PCR;基因表达
芳基烷基胺-N-乙酰转移酶(Arylalkylamine-N-acetyltransferase,AA-NAT)是褪黑激素(Melatonin,MLT)合成分泌的关键节律酶,是分子量约23 ku的可溶性胞液蛋白[1]。有报道显示,动物的季节性繁殖活动与褪黑激素的调控有关[2-4]。MLT主要调控包括昼夜节律在内的生物钟节律以及动物的繁殖活动[5]。研究显示,正常儿童的血清MLT水平明显高于相应年龄的性早熟患儿[6]。青春期延迟伴随性功能减退者的血清MLT水平明显高于正常人,青春期会随着MLT水平的自发性下降而到来[7]。埋植MLT可以使母马鹿的配种季节与产仔日期提前,使公马鹿的睾丸发育提前[8-10],由此可见,MLT通过调控动物青春期的启动来影响动物的繁殖活动。季节性发情与常年发情的绵羊品种 MLT 的季节性变化规律存在显著差异[11]。大多数哺乳动物体内MLT有节律的合成与分泌一般通过AA-NAT酶活性的昼夜节律来控制,并通过AA-NAT基因mRNA的自动转录调节和转录后的调节修饰来实现[12-13]。AA-NAT酶的活性与MLT的合成分泌节律保持一致,AA-NAT基因的突变会影响MLT的合成,并与MLT节律水平相关[14-15]。绵羊的季节性繁殖活动受下丘脑-垂体-性腺轴系统的调控。有研究表明,发情时小尾寒羊和滩羊血液中MLT水平明显升高[11]。MLT是由松果体分泌的一种重要的内分泌激素,它的合成与昼夜节律以及季节转换同步[16-17]。MLT调节雌激素抑制垂体分泌促性腺激素[18],从而调控绵羊的季节性发情[19],而AA-NAT是MLT合成的关键调控酶,AA-NAT基因的表达水平直接影响MLT的合成,进而影响动物的发情节奏。另外,D.C.Klein等研究发现,AA-NAT酶的分泌对绵羊血液MLT分泌有重要影响,可能是导致绵羊季节发情或常年发情的原因之一[20]。MLT分泌的季节性变化调控动物的季节性繁殖,AA-NAT基因影响动物季节性繁殖是通过影响MLT的合成分泌来实现的,AA-NAT基因的表达间接地影响了动物的季节性繁殖。大多数绵羊季节性发情,仅少数常年发情,这严重制约了绵羊产业的发展,因此研究AA-NAT基因的表达与常年发情性状的关联性,对进一步了解绵羊常年发情和季节性发情的调控机制具有重要意义。
小尾寒羊是典型的常年发情绵羊,滩羊是典型的季节性发情绵羊。小尾寒羊和滩羊体型和体重相近、遗传距离较近[21-22],同时季节性发情绵羊中滩羊地理位置与小尾寒羊产区相对较近,因此本试验选取小尾寒羊和滩羊为研究对象,利用real-time PCR技术检测AA-NAT基因在不同发情阶段小尾寒羊和滩羊松果体、下丘脑、垂体、卵巢、子宫体、肾上腺6个组织中的表达情况,希望为从遗传上调控绵羊的常年发情提供科学依据,为通过遗传选择等手段诱发绵羊常年发情、提高繁殖性能奠定理论基础。
1 材料与方法
1.1 试验动物
选择发育良好、健康的小尾寒羊和滩羊各9只。其中处于春季发情期、春季间情期和秋季发情期的2.5岁小尾寒羊母羊各3只;处于春季乏情期、秋季发情期和秋季间情期的2.5岁滩羊母羊各3只。
来自山东省嘉祥县保种基地的9只小尾寒羊和来自宁夏盐池滩羊选育场的9只滩羊都饲养在宁夏农科院畜牧所种羊场。饲养管理条件完全一致。母羊屠宰后30 min内,完成其下丘脑、垂体、松果体、卵巢、子宫体、肾上腺6种新鲜组织样的采集,并立即放于装有RNAfixer液体的无RNase离心管中,同时剪成小块(至少一侧厚度小于0.5 cm),用放有冰块的保温箱带回实验室,-20 ℃保存。
1.2 RNA提取
使用高纯总RNA快速提取试剂盒(离心柱型)提取组织总RNA。提取过程中使用RNase-free DNase I去除基因组DNA。利用NANODROP 2000检测总RNA浓度和纯度,并用1%的琼脂糖凝胶对RNA进行电泳检测,无明显降解且A260 nm/A280 nm为1.8~2.1的RNA置于-80 ℃冷冻备用。
1.3 cDNA第一链的合成
以1 μL总RNA为模板,使用Quantscript RT Kit反转录合成cDNA第一链,反转录体系为20 μL:10× RT mix 2 μL, dNTPs (2.5 mmol·L-1) 2 μL,Oligo-dT15 2 μL,Quant Reverse Transcriptase 1 μL,最后用无RNA酶H2O补充使总体积达20 μL。反应条件:37 ℃孵育 60 min。
1.4 目的基因扩增与克隆测序
根据NCBI上公布的绵羊AA-NAT基因CDS区序列(Gene ID:443531),并结合笔者克隆得到的部分DNA序列设计引物,设计的AA-NAT基因引物序列信息:上游引物F:CCGAGCGTCCACTGCCTGAAAC,下游引物R:GATGGAAGCCAAACCTCTGGTAAAA;引物方向为5′→3′;产物大小为514 bp;退火温度为55 ℃。
目的基因扩增时PCR体系:小尾寒羊cDNA模板 2 μL,2×GC Buffer(含Mg2+)15 μL,上下游引物(10 μmol·L-1)各 0.75 μL,2.5 mmol·L-1dNTP Mix 3 μL,rTaq酶 0.3 μL,超纯水 8.2 μL,总体积共30 μL。PCR扩增条件:94 ℃预变性5 min;94 ℃变性30 s,55 ℃退火30 s,72 ℃延伸40 s,35个循环;然后延伸72 ℃ 10 min,4 ℃保存。扩增产物经1.5%琼脂糖凝胶电泳检测后,用DNA回收试剂盒回收目的基因,连接pMD19-T载体,转化大肠杆菌TOP10感受态细胞,每个片段挑选3个阳性克隆质粒进行扩大培养,并送至北京六合华大基因股份有限公司进行双向测序。
1.5 荧光定量PCR
根据本研究克隆测序获得的小尾寒羊AA-NAT基因CDS区序列设计real-time PCR引物(表1),以GAPDH为内参基因进行real-time PCR分析。
表1 荧光定量PCR引物序列信息
Table 1 Information of primer sequences for real-time PCR
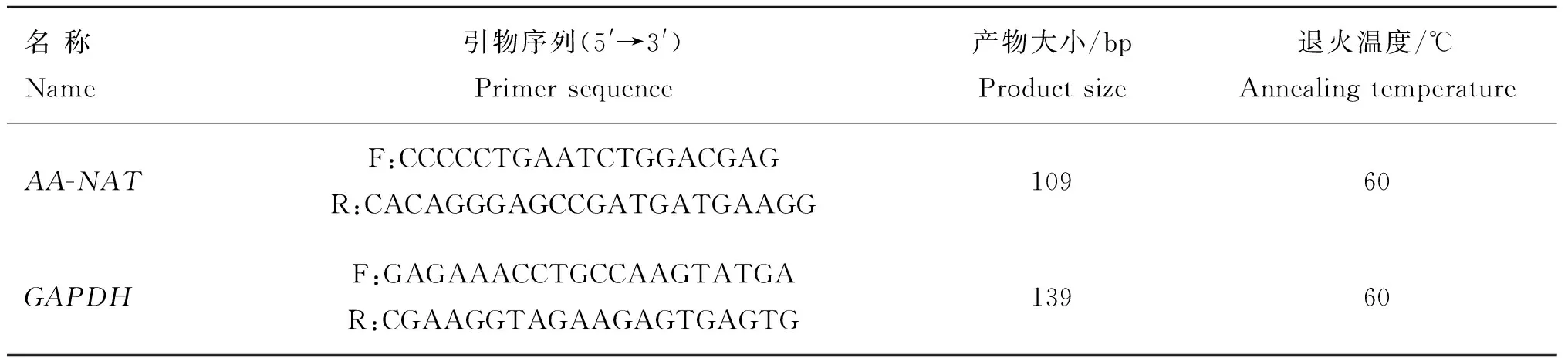
名称Name引物序列(5'→3')Primersequence产物大小/bpProductsize退火温度/℃AnnealingtemperatureAA-NATF:CCCCCTGAATCTGGACGAGR:CACAGGGAGCCGATGATGAAGG10960GAPDHF:GAGAAACCTGCCAAGTATGAR:CGAAGGTAGAAGAGTGAGTG13960
荧光定量PCR扩增体系:2×PCR Mix 15 μL,上下游引物(10 μmol·L-1)各0.75 μL,20×EVA Green 1.5 μL,ddH2O 7.0 μL,模板 5 μL,总体积30 μL。扩增条件:95 ℃ 5 min;95 ℃ 15 s,60 ℃ 30 s,72 ℃ 20 s,共40个循环;72 ℃ 2 min(收集荧光)。
标准曲线的建立:取3只小尾寒羊卵巢cDNA 部分混合,然后进行5 倍等比稀释制备成5 个浓度梯度(1、1/5、(1/5)2、(1/5)3、(1/5)4)的cDNA样品。以这些cDNA 为模板进行荧光定量PCR,以获得的Ct 值为纵坐标,以浓度梯度的对数值(10为底)为横坐标,构建标准曲线。
荧光定量:建立标准曲线和荧光定量时均设置阴性对照(模板为H2O),每个样品均设置3次平行样,荧光定量PCR全部在ABI7900荧光定量PCR仪器上进行。
1.6 统计分析
荧光定量PCR结果分析采用2-△△Ct法计算相对表达量,所有数据采用SPSS 16.0软件t检验进行差异显著性分析,结果以“平均值±标准差”表示。
2 结 果
2.1 RNA提取
提取的绵羊各组织的总RNA,经1%琼脂糖凝胶电泳检测,结果如图1,28S rRNA和18S rRNA条带清晰可见,且灰度值约为2︰1,而5S rRNA带几乎没有,说明提取的总RNA无明显降解。用NANODROP 2000检测各组织RNA提取的效果,发现浓度均在100 mg·μL-1以上,A260 nm/A280 nm均为1.8~2.1,表明提取的RNA可用于后续荧光定量PCR。
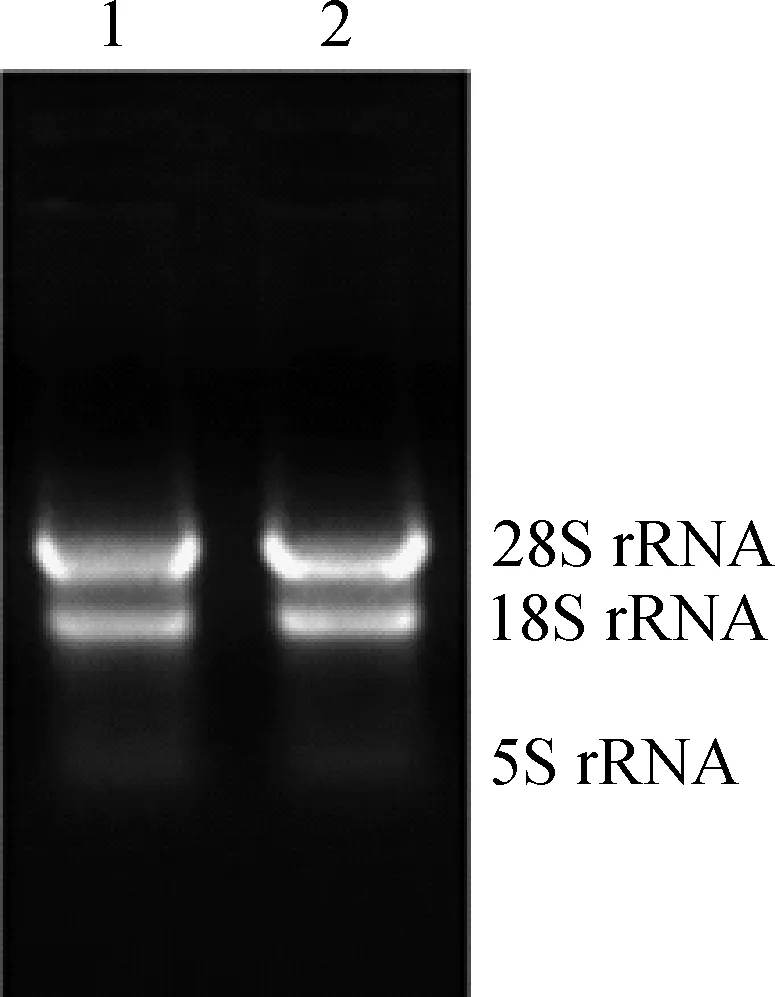
图1 总RNA电泳图Fig.1 Gel electrophoresis of total RNA
2.2 PCR扩增目的基因AA-NAT
目的基因PCR扩增结果如图2:AA-NAT基因扩增片段长为514 bp,其中泳道1和2为AA-NAT基因的PCR产物,泳道3为阴性对照。所得条带单一,特异性好,能满足后续测序要求。
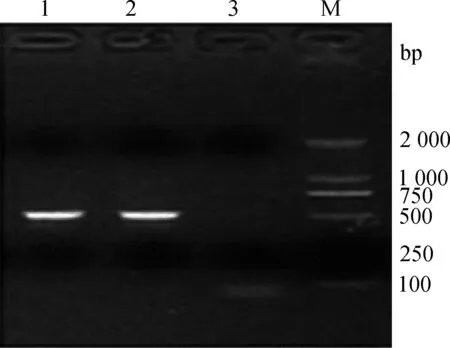
图2 绵羊AA-NAT基因PCR扩增产物Fig.2 PCR amplification products of sheep AA-NAT gene
2.3 绵羊AA-NAT基因在各组织中的表达水平
本试验以滩羊间情期子宫体△Ct平均值为对照组,小尾寒羊3个情期以及滩羊发情期和乏情期各组织△Ct平均值为试验组,计算出各样本AA-NAT基因的相对表达量(表2)。结果表明,该基因在不同情期小尾寒羊和滩羊6个组织中均表达,不同组织间表达量有明显差异,在发情期绵羊的卵巢、子宫体、松果体中高水平表达。
2.3.1 两品种绵羊相同组织不同情期AA-NAT基因表达量变化 由表2可见,卵巢中小尾寒羊发情期AA-NAT基因的表达量极显著高于间情期(P<0.01);滩羊3个情期间差异都极显著(P<0.01),发情期表达量最高,间情期次之,乏情期最低。子宫体中两品种绵羊秋季发情期AA-NAT基因的表达量极显著高于其他情期(P<0.01)。松果体中小尾寒羊各情期之间AA-NAT基因表达量差异都极显著(P<0.01),而滩羊秋季发情期极显著高于其他情期(P<0.01)。肾上腺中小尾寒羊AA-NAT基因在各个情期的表达量差异均不显著(P>0.05),而滩羊秋季发情期极显著高于其他情期(P<0.01)。下丘脑中小尾寒羊春季发情期AA-NAT基因的表达量极显著高于其他情期(P<0.01),而滩羊秋季发情期极显著高于其他情期(P<0.01)。垂体中两品种绵羊AA-NAT基因各个情期的表达量差异均不显著(P>0.05)。结果提示卵巢和子宫体中AA-NAT基因的表达差异可能与绵羊常年发情有关。
2.3.2 同一情期相同组织两品种绵羊间AA-NAT基因表达量变化 由表2可见,卵巢和子宫体中秋季发情期滩羊AA-NAT基因的表达量极显著高于小尾寒羊(P<0.01)。松果体中小尾寒羊各个情期AA-NAT基因的表达量均极显著高于滩羊(P<0.01),秋季发情期表达量最高,提示小尾寒羊松果体中AA-NAT基因表达的机制可能不同于滩羊。肾上腺中滩羊各个情期AA-NAT基因的表达量均极显著高于小尾寒羊(P<0.01),秋季发情期表达量最高。下丘脑中秋季发情期滩羊AA-NAT基因的表达量极显著高于小尾寒羊(P<0.01),而乏情期和间情期的小尾寒羊和滩羊之间AA-NAT基因的表达量都无显著差异(P>0.05)。垂体中小尾寒羊和滩羊之间AA-NAT基因表达量差异均不显著(P>0.05)。
表2 小尾寒羊与滩羊各组织中AA-NAT基因mRNA相对表达量
Table 2 The expression level ofAA-NATmRNA in different tissues of Small Tail Han and Tan sheep
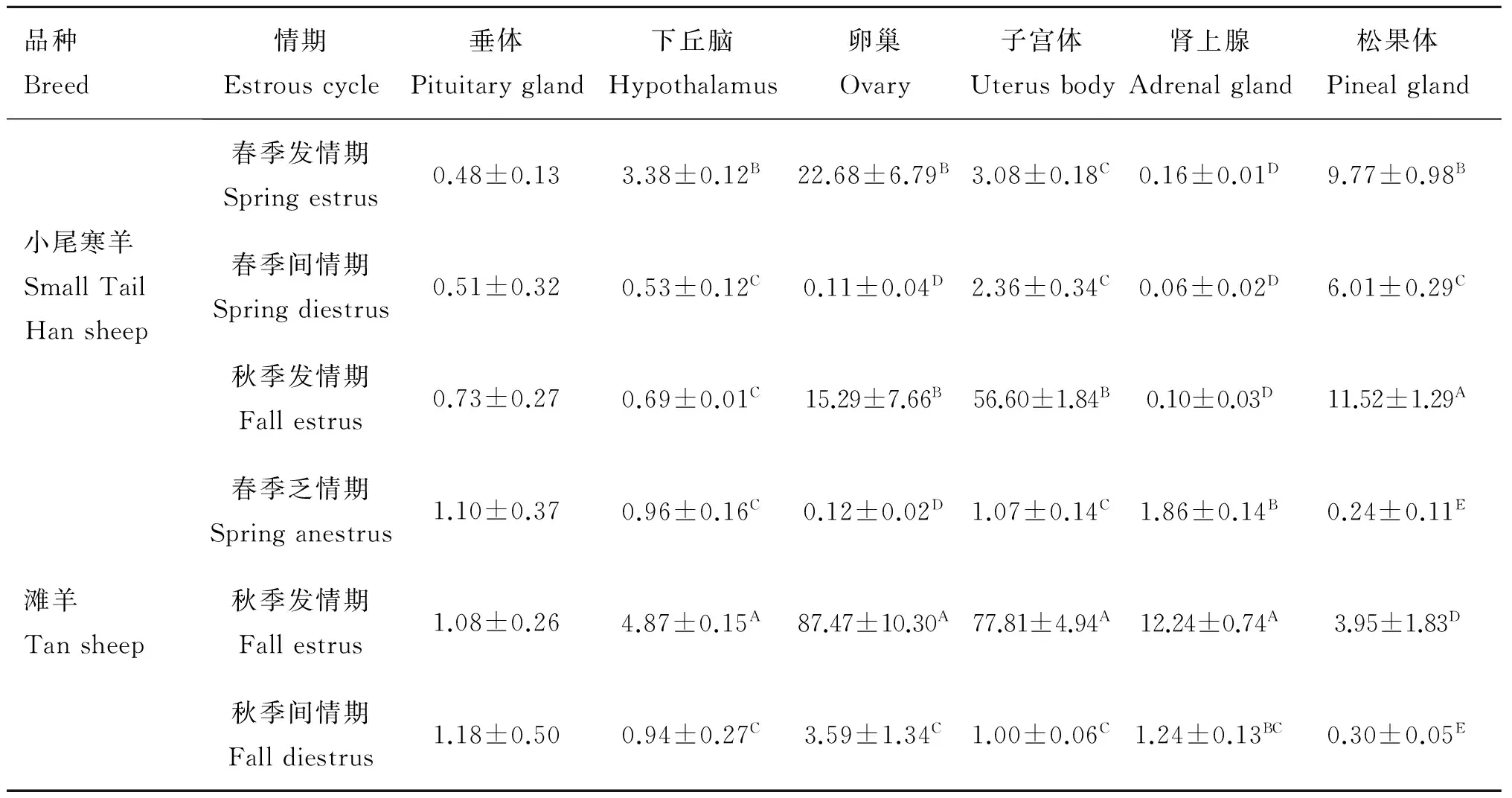
品种Breed情期Estrouscycle垂体Pituitarygland下丘脑Hypothalamus卵巢Ovary子宫体Uterusbody肾上腺Adrenalgland松果体Pinealgland小尾寒羊SmallTailHansheep春季发情期Springestrus0.48±0.133.38±0.12B22.68±6.79B3.08±0.18C0.16±0.01D9.77±0.98B春季间情期Springdiestrus0.51±0.320.53±0.12C0.11±0.04D2.36±0.34C0.06±0.02D6.01±0.29C秋季发情期Fallestrus0.73±0.270.69±0.01C15.29±7.66B56.60±1.84B0.10±0.03D11.52±1.29A滩羊Tansheep春季乏情期Springanestrus1.10±0.370.96±0.16C0.12±0.02D1.07±0.14C1.86±0.14B0.24±0.11E秋季发情期Fallestrus1.08±0.264.87±0.15A87.47±10.30A77.81±4.94A12.24±0.74A3.95±1.83D秋季间情期Falldiestrus1.18±0.500.94±0.27C3.59±1.34C1.00±0.06C1.24±0.13BC0.30±0.05E
同列数据肩标具有相同字母表示差异不显著(P>0.05),字母不同表示差异极显著(P<0.01)
Means in the same column with a same letter superscript indicate no significant difference(P>0.05),with different superscripts differ significantly(P<0.01)
3 讨 论
AA-NAT是合成MLT的关键调控酶[23-24],它通过MLT对青春期启动的调控来影响动物的繁殖活动。前人研究发现,AA-NAT基因在松果体和视网膜有较高水平的表达,在不同的神经组织(如脑垂体远侧部﹑视交叉上核﹑海马)和外周组织(主要包括睾丸和卵巢)有极低水平的表达[20,25-28]。E.Isorna等研究了AA-NAT基因在松果体中表达对比目鱼发育的影响,发现AA-NAT基因与甲状腺激素作用相关[29-30]。AA-NAT基因还表达于绿蛙视网膜、间脑、室管膜细胞层及卵巢中[31]。T.Uz等应用RT-PCR及原位杂交RT-PCR技术对AA-NAT基因在大鼠大脑中的表达分布进行了研究,发现AA-NAT基因在海马、小脑及脊索中均表达[32]。对济宁青山羊繁殖季节性的研究表明,AA-NAT基因表达具有明显的组织特异性,主要表达于松果体组织[33]。本研究表明,AA-NAT基因在常年发情小尾寒羊和季节性发情滩羊下丘脑、垂体、松果体、卵巢、子宫体和肾上腺中都表达,但在不同组织中的表达量有明显差异,主要在发情期绵羊卵巢、松果体、子宫体中高水平表达。可见AA-NAT基因表达具有组织特异性,影响动物发育及繁殖活动。
常年发情和季节性发情显然影响羊的繁殖能力。有研究表明,AA-NAT基因的突变可能对山羊的繁殖活动起到关键作用[34-35],也有研究表明,绵羊的季节性繁殖和非季节性繁殖活动与AA-NAT基因的多态性有密切关联[36-37]。藏黄牛和牦牛是典型的季节性繁殖动物,普通黄牛繁殖季节性不明显。陈朝坚等发现,藏黄牛AA-NAT基因的表达序列和编码氨基酸与亲缘关系较远的牦牛一致,而与亲缘关系较近的普通黄牛却有一定差异,这种差异可能与繁殖的季节性有关[13]。P.Wongchitrat等研究了不同日龄大鼠松果体中AA-NATmRNA的表达,结果显示,4日龄大鼠在夜间具有较高的表达,且表达水平随着日龄的增长而增加,到初情期时达到最高,8周龄AA-NATmRNA表达水平降低;AA-NAT基因的表达与大鼠发育程度有密切关联[38]。本研究中,AA-NAT基因在发情期小尾寒羊和滩羊卵巢和子宫体中的表达量显著高于其他组织,提示卵巢和子宫体中AA-NAT基因的高水平表达对绵羊发情有一定影响。本研究还发现,滩羊发情期松果体中AA-NAT基因的表达量极显著高于其它情期(P<0.01),表明,AA-NAT基因mRNA表达的高低对绵羊发情启动具有重要作用,其具体机制有待进一步研究。因此,本研究结果初步表明,卵巢、子宫体和松果体中AA-NAT基因表达上调可能与小尾寒羊常年发情相关。
4 结 论
本研究采用real-time PCR方法检测了AA-NAT基因在小尾寒羊和滩羊不同情期6个组织中的相对表达量。结果发现,AA-NAT基因在6个组织中的表达量具有明显差异,卵巢、子宫体和松果体中AA-NAT基因表达上调可能与小尾寒羊常年发情相关。
[1] MIGLIORI M L,ROMANOWSKI A,SIMONETTA S H,et al.Daily variation in melatonin synthesis and arylalkylamine N-acetyltransferase activity in the nematodeCaenorhabditiselegans[J].JPinealRes,2012,53(1):38-46.
[2] 张 凯.牦牛褪黑激素合成酶AA-NAT、HIOMT基因CDS克隆及序列分析[D].雅安:四川农业大学,2007. ZHANG K.Molecular cloning and nucleotide sequence analysis of the yak melatonin synthetase genes:AA-NAT and HIOMT [D].Ya’an:Sichuan Agricultural University,2007.(in Chinese)
[3] 赵 瑛.褪黑激素及其合成受体生理功能和病理状态的改变及意义[J].第二军医大学学报,2007,28(7):755-756. ZHAO Y.Melatonin and its receptor:physiological function and pathological implication [J].AcademicJournalofSecondMilitaryMedicalUniversity,2007,28(7):755-756.(in Chinese)
[4] 郭玉强,蔡国宝,刘艳婷,等.褪黑激素对绵羊季节性繁殖的调控机理[J].甘肃畜牧兽医,2008,38(1):43-46. GUO Y Q,CAI G B,LIU Y T,et al.Melatonin regulation mechanism of seasonal breeding in sheep[J].GansuAnimalandVeterinarySciences,2008,38(1):43-46.(in Chinese)
[5] CASSONE V M.Effects of melatonin on vertebrate circadian systems [J].TrendsNeurosci,1990,13(11):457-464.
[6] CAVALLO A,RITSCHEL W A.Pharmacokinetics of melatonin in human sexual maturation [J].JClinEndocrinolMetab,1996,81(5):1882-1886.
[7] PUIG-DOMINGO M,WEBB S M,SERRANO J,et al.Melatonin-related hypogonadotropic hypogonadism [J].NEnglJMed,1992,327(19):1356-1359.
[8] LINCOLN G A,FRASER H M,FLETCHER T J.Induction of early rutting in male red deer by melatonin and its dependence on LHRH [J].JReprodFertil,1984,72(2):339-343.
[9] WILSON P R,WALKER I H,BOND D B,et al.Field evaluation of melatonin implants to advance the breeding season in 1-year-old farmed red deer hinds [J].NZVetJ,1991,39(1):23-28.
[10] WEBSTER J R,SUTTIE J M,CORSON I D.Effects of melatonin implants on reproductive seasonality of male red deer [J].JReprodFertil,1991,92(1):1-11.[11] 张小辉.MLT、LH 和 FSH 对绵羊季节性发情的调控作用研究[D].杨凌:西北农林科技大学,2004. ZHANG X H.The regulation of MLT,LH and FSH on the seasonal estrus of sheep[D].Yangling:NorthwestA&FUniversity,2004.(in Chinese)
[12] KIM T D,KIM J S,KIM J H,et al.Rhythmic serotonin N-acetyltransferase mRNA degradation is essential for the maintenance of its circadian oscillation [J].MolCellBiol,2005,25(8):3232-3246.
[13] 陈朝坚,雷 申,文勇立,等.藏黄牛褪黑激素合成酶AA-NAT基因cDNA克隆及序列的比较分析[J].西南民族大学学报:自然科学版,2010,36(2):220-225. CHEN C J,LEI S,WEN Y L,et al.Molecular cloning and sequence analysis of Tibetan cattle melatonin synthetase AA-NAT gene [J].JournalofSouthwestUniversityforNationalities:NaturalScienceEdition,2010,36(2):220-225.(in Chinese)
[14] ROSEBOOM P H,COON S L,BALER R,et al.Melatonin synthesis:analysis of the more than 150-fold nocturnal increase in serotonin N-acetyltransferase messenger ribonucleic acid in the rat pineal gland [J].Endocrinology,1996,137(7):3033-3045.
[15] KLEIN D C,ROSEBOOM P H,COON S L.New light is shining on the melatonin rhythm enzyme:the first postcloning view [J].TrendsEndocrinolMetab,1996,7(3):106-112.
[16] HARDELAND R,MADRID J A,TAN D X,et al.Melatonin,the circadian multioscillator system and health:the need for detailed analyses of peripheral melatonin signaling [J].JPinealRes, 2012,52(2):139-166.
[17] BARRETT P,BOLBOREA M.Molecular pathways involved in seasonal body weight and reproductive responses governed by melatonin [J].JPinealRes,2012,52(4):376-388.
[18] BITTMAN E L.The role of rhythms in the response to melatonin [J].CibaFoundSymp, 1985,117:149-169.[19] YELLON S M,BITTMAN E L,LEHMAN M N.Importance of duration of nocturnal melatonin secretion in determining the reproductive response to inductive photoperiod in the ewe [J].BiolReprod,1985,32(3):523-529.
[20] KLEIN D C,COON S L,ROSEBOOM P H,et al.The melatonin rhythm-generating enzyme:molecular regulation of serotonin N-acetyltransferase in the pineal gland [J].RecentProgHormRes,1997,52:307-358.
[21] 巩元芳,李祥龙,刘铮铸,等.我国主要地方绵羊品种随机扩增多态DNA研究[J].遗传,2002,24(4):423-426. GONG Y F,LI X L,LIU Z Z,et al.Studies of random amplified polymorphic DNA (RAPD) of main indigenous sheep breeds in China[J].Hereditas,2002,24(4):423-426.(in Chinese)
[22] 李小勤,冷向军,吴登俊.国内主要绵羊品种基于染色体核型进化距离的聚类分析[J].扬州大学学报:农业与生命科学版,2009,30(3):26-30. LI X Q,LENG X J,WU D J.The cluster analysis of karyotype evolutionary distance in native sheep[J].JournalofYangzhouUniversity:AgriculturalandLifeScienceEdition,2009,30(3):26-30.(in Chinese)[23] BLOMEKE B,GOLKA K,GRIEFAHN B,et al.Arylalkylamine N-acetyltransferase (AA-NAT) genotype as a personal trait in melatonin synthesis [J].JToxicolEnvironHealthA,2008,71(13-14):874-876.
[24] SANCHEZ-BARCELO E J,MEDIAVILLA M D,ZINN S A,et al.Melatonin suppression of mammary growth in heifers [J].BiolReprod,1991,44(5):875-879.[25] BORJIGIN J,WANG M M,SNYDER S H.Diurnal variation in mRNA encoding serotonin N-acetyltransferase in pineal gland [J].Nature,1995,378(6559):783-785.
[26] FLEMING J V,BARRETT P,COON S L,et al.Ovine arylalkylamine N-acetyltransferase in the pineal and pituitary glands:differences in function and regulation [J].Endocrinology,1999,140(2):972-978.
[27] HAMADA T,OOTOMI M,HORIKAWA K,et al.The expression of the melatonin synthesis enzyme:arylalkylamine N-acetyltransferase in the suprachiasmatic nucleus of rat brain [J].BiochemBiophysResCommun,1999,258(3):772-777.
[28] UZ T,MANEV H.Chronic fluoxetine administration increases the serotonin N-acetyltransferase messenger RNA content in rat hippocampus [J].BiolPsychiatry,1999,45(2):175-179.
[29] ISORNA E,EI M′RABET A,CONFENTE F,et al.Cloning and expression of arylalkylamine N-acetyltranferase-2 during early development and metamorphosis in the soleSoleasenegalensis[J].GenCompEndocrinol,2009,161(1):97-102.
[30] ISORNA E,ALIAGA-GUERRERO M,M′RABET A E,et al.Identification of two arylalkylamine N-acetyltranferase 1 genes with different developmental expression profiles in the flatfishSoleasenegalensis[J].JPinealRes,2011,51(4):434-444.
[31] ISORNA E,BESSEAU L,BOEUF G,et al.Retinal,pineal and diencephalic expression of frog arylalkylamine N-acetyltransferase-1[J].MolCellEndocrinol,2006,252(1-2):11-18.
[32] UZ T,QU T,SUGAYA K,et al.Neuronal expression of arylalkylamine N-acetyltransferase (AA-NAT) mRNA in the rat brain [J].NeurosciRes,2002,42(4):309-316.
[33] 黄冬维.山羊繁殖季节性调控通路相关基因的克隆、多态与表达研究[D].北京:中国农业科学院,2012. HUANG D W.Study on cloning,polymorphisms and expression of genes related with seasonal reproduction pathways in goats [D].Beijing:Chinese Academy of Agricultural Sciences,2012.(in Chinese)
[34] 杨大前,字向东,王 永,等.乐至黑山羊褪黑素合成酶AA-NAT基因cDNA克隆及序列分析[J].西南民族大学学报:自然科学版,2011,37(4):575-581. YANG D Q,ZI X D,WANG Y,et al.Molecular cloning and sequence analysis of Lezhi Black-goat melatonin synthetase AA-NAT gene [J].JournalofSouthwestUniversityforNationalities:NaturalScienceEdition,2011,37(4):575-581.(in Chinese)
[35] CHU M X,YAN Y,WANG P Q,et al.Polymorphism of AA-NAT gene and its relationship with litter size of Jining Grey goat of China [J].AnimSciPapersRep,2013,31(1):15-26.
[36] 于成江.常年性和季节性发情绵羊AA-NAT和HIOMT基因遗传多态性的研究[D].杨凌:西北农林科技大学,2007. YU C J.Studies on genetic polymorphism of AA-NAT and HIOMT genes in nonseasonal and seasonal estrus sheep[D].Yangling:NorthwestA&FUniversity,2007.(in Chinese)
[37] BAI D P,YU C J,CHEN Y L.Association between AA-NAT gene polymorphism and reproductive performance in sheep [J].ElectJBiotechnol,2012,15(2):1-7.
[38] WONGCHITRAT P,GOVITRAPONG P,PHANSUWAN-PUJITO P.The expression of Per1 and AA-NAT genes in the pineal gland of postnatal rats [J].JMedAssocThai,2012,95(12):S69-75.
(编辑 郭云雁)
Association betweenAA-NATmRNA Expression and Year-round Estrus in Sheep
LU Lu-lu1,SUN Xiao-di2,CHU Ming-xing1*,WANG Yong-juan2,HUANG Dong-wei1,WANG Jin-yu2,DI Ran1,PAN Zhang-yuan1,LIU Qiu-yue1
(1.KeyLaboratoryofFarmAnimalGeneticResourcesandGermplasmInnovationofMinistryofAgriculture,InstituteofAnimalScience,ChineseAcademyofAgriculturalSciences,Beijing100193,China;2.CollegeofAnimalScienceandTechnology,YangzhouUniversity,Yangzhou225009,China)
In order to study the association ofAA-NATgene and year-round estrus in sheep,year-round estrous Small Tail Han ewes and seasonal estrous Tan ewes were selected as tested subjects.Real-time PCR method was used to detectAA-NATmRNA expression in hypothalamus,pituitary gland,pineal gland,ovary,uterus body and adrenal gland at different estrus stages.The results showed that the expression ofAA-NATgene in all 6 tissues at different estrous stages of the 2 breeds was significantly different.The expression ofAA-NATgene was at high level in ovary,uterus body and pineal gland in sheep at estrus.In ovary and uterus body,AA-NATgene expression was significantly lower (P<0.01) in Small Tail Han sheep at spring and fall estrus stage than that in Tan sheep at fall estrus stage,but in pineal gland it was significantly higher (P<0.01).The results preminarily indicated that the up-regulated expression ofAA-NATgene in ovary,uterus body and pineal gland was associated with year-round estrus in Small Tail Han sheep.
sheep;year-round estrus;AA-NATgene;real-time PCR;gene expression
10.11843/j.issn.0366-6964.2015.04.005
2014-05-05
国家自然科学基金项目(31101687);中国农业科学院科技创新工程(ASTIP-IAS13);国家肉羊产业技术体系专项(CARS-39);中央级公益性科研院所基本科研业务费专项(2011cj-7;2013ywf-zd-1)
卢璐璐(1990-),女,安徽宿州人,硕士生,主要从事动物分子遗传学研究,E-mail:lulululu2012@sina.cn
*通信作者:储明星,研究员,E-mail:mxchu@263.net
S826;S814.8
A
0366-6964(2015)04-0542-07
