猪肝羧酸酯酶1基因的克隆和在原核细胞中的功能性表达
2015-03-22肖启玲李朋辉闫秉芳王喜亮肖运才李自力毕丁仁石德时
肖启玲,李朋辉,闫秉芳,杨 路,王喜亮,肖运才,李自力,刘 梅,毕丁仁,石德时*
(1.华中农业大学动物医学院,农业微生物学国家重点实验室,武汉 430070;2.华中农业大学动物医学院,农业部兽用诊断制剂创制重点实验室,武汉 430070;3.罗德岛大学生物医学科学系,药物基因组学与分子治疗中心,金士顿02881,美国)
猪肝羧酸酯酶1基因的克隆和在原核细胞中的功能性表达
肖启玲1,2,李朋辉1,2,闫秉芳3,杨 路1,2,王喜亮1,2,肖运才1,2,李自力1,2,刘 梅1,2,毕丁仁1,2,石德时1,2*
(1.华中农业大学动物医学院,农业微生物学国家重点实验室,武汉 430070;2.华中农业大学动物医学院,农业部兽用诊断制剂创制重点实验室,武汉 430070;3.罗德岛大学生物医学科学系,药物基因组学与分子治疗中心,金士顿02881,美国)
为获得有活性的猪肝羧酸酯酶1(PLE1)并研究其功能,利用RT-PCR与常规PCR方法,从大白猪肝组织中扩增PLE1基因的ORF。将PLE1的ORF序列连接到pET15b原核表达载体,在OrigamiTM2(DE3)中与pGro7质粒共诱导表达,纯化目的蛋白质并检测其酶活性。测序结果表明克隆到PLE1基因编码区全长1 686 bp的片段,该片段编码562个氨基酸。SDS-PAGE和Western blotting 结果显示,PLE1融合蛋白质成功表达,在30 ℃的培养温度下,IPTG诱导6 h后,PLE1重组蛋白质表达量最高,且大部分以可溶性形式存在。酶活性试验结果表明,PLE1融合蛋白质水解底物p-NPA的酶活力为1.24 U。研究结果不仅为研究PLE1水解兽药特性提供高纯度的具有原有酶活性的重组蛋白质,也为PLE同工酶家族其他重要成员的活性功能研究提供理论依据和技术手段。
猪肝羧酸酯酶1;功能性表达;活性检测
由多种同功酶组成的哺乳动物的羧酸酯酶是一个同工酶超家族,其成员核酸序列高度同源,生物学特性相似,根据核酸序列同源性该超家族又分为5个亚家族(CES 1~5),其中绝大部分已发现的同功酶属于CES1或CES2亚家族[1-2]。哺乳动物的羧酸酯酶均属于α/β折叠水解酶类,广泛存在于机体内各种组织中,其中以肝含量最为丰富[3-4]。肝羧酸酯酶可以水解酯类、硫酯类和酰胺类等多种内、外源性化合物,对多种药物、环境毒物及致癌物有解毒作用[3,5]。大量被设计成酯类前药的人类临床药物(如奥司他韦、CPT-11、洛伐他汀等)就是利用该酶的这种水解作用,在机体内这些酯类前药被水解而生成具有活性的药物分子发挥作用[6]。除此之外,哺乳动物羧酸酯酶还参与了跨膜信号转导、生物膜完整性的维持等重要的生理过程[7-9]。
猪肝羧酸酯酶(pig liver esterase,PLE)属于哺乳动物羧酸酯酶,是由多种同工酶组成的酶家族,属于丝氨酸水解酶类,已有研究提示PLE可能在水解和代谢猪内、外源性酯类物质(包括前药)的过程中发挥重要作用[10-11],且我们的研究已发现猪肝羧酸酯酶1(PLE1)可水解磺胺类等临床常用抗菌药物(待发表)。PLE家族是目前已知的最复杂的哺乳动物羧酸酯酶家族,因其成员的物理化学性质极其相似,故用一般的物理化学方法难以将彼此完全分开,直接从肝组织中提取的PLE是多种同工酶的混合物,因此,用这种提取的混合物得到的试验结果也是多种同工酶共同作用的结果[12-13]。据报道不同的PLE同工酶亚型具有不同的相对分子质量和等电点,并且PLE同工酶各亚型对抑制剂的敏感性和对底物的特异性也都各异。根据相对分子质量和等电点的差异,PLE被分为α-PLE、β-PLE、γ-PLE三种类型[12-15]。A.Hummel等在猪肝中克隆出了7种核苷酸序列高度同源的PLE同工酶亚型,这7种同功酶基因ORF大小均为1 698 bp(最后的12个bp 编码内质网潴留信号,在进行体外表达时,多将其去掉)[16],由14个外显子组成,所有亚型的第1、2、5、7、10、11、13、14外显子的序列相同,因此利用PLE第1外显子和第14外显子的序列设计引物,可克隆到多种PLE同工酶亚型。根据同源性和酶活性差异,这7种PLE分别被命名为PLE1~6和APLE[9,16-17]。目前只能确定PLE1就是γ-PLE,APLE、PLE2~6与α-PLE、β-PLE的对应关系还不清楚。
人们对PLE的研究始于20世纪初,但是由于从猪肝中粗提的PLE是多种同工酶的混合物、每批次提取物的成分不稳定,严重阻碍了人们对PLE的研究和应用。为了获得高纯度的、具有酶活性的PLE,2001年S.Lange等运用基因工程技术在毕赤酵母中表达γ-PLE,成功获得能够水解脯氨酸-β-萘酰胺且具有较强酶活性的γ-PLE,但是产量较低[18]。同时A.Musidlowska等在酵母中表达的具有活性的重组γ-PLE表现出了与粗提PLE明显不同的水解动力学特性和立体选择特性[19]。2007年D.Böttcher等在经过基因工程改造和转入分子伴侣pGro7的大肠杆菌表达系统中成功地表达出具有酶活性的γ-PLE[20]。在大肠杆菌表达的γ-PLE具有与酵母表达的γ-PLE相似的生化特性和立体选择性,并且产量大大提高。
PLE具有强大的水解活性,而且更加重要的是,PLE对底物的水解还具有高度的立体选择性,因此,PLE在有机化学合成领域是水解酶的主角[21-22];但长期以来,人们对PLE作为药物代谢酶角色的研究很少。
受PLE在化学合成中表现出的强大水解活性和哺乳动物羧酸酯酶通过水解作用控制药物疗效和毒副作用的启发,作者推测:与其他哺乳动物的羧酸酯酶一样,PLE可能在某些兽药的代谢中发挥不可忽视的作用,与兽药的疗效和毒副作用有紧密关联。为了得到纯化的PLE进行药物代谢研究,对PLE家族的重要成员PLE1进行了克隆和功能性表达。
1 材料与方法
1.1 试验材料
样品采集:大白猪(70日龄)购自湖北天种畜牧股份有限公司。试验猪经颈部放血处死后,立即采取右侧肝组织样品(约30 g),用锡箔纸包裹迅速置于液氮中速冻,置-80 ℃冻存。
主要试剂:TaqDNA聚合酶、dNTPs、反转录试剂盒、6×Loading Buffer、DL2000、DL15000 Marker、各种限制性内切酶、T4 DNA连接酶均为大连宝生物(TaKaRa)工程有限公司产品;引物由南京金斯瑞生物科技有限公司合成;琼脂糖购自BIOWEST,DNA凝胶回收试剂盒购自天根生化科技有限公司;酵母提取物、胰蛋白胨、琼脂粉均购自杭州微生物试剂有限公司,Trizol试剂购自Invitrogen公司;L-Arabinose购自Sigma公司,氨苄青霉素、氯霉素、IPTG、甲酸、甲醇、SDS、甘氨酸、Tris均购自武汉生命科技有限公司;小鼠6×His标签蛋白质单克隆抗体、辣根过氧化物酶标记的兔抗小鼠IgG多克隆抗体均购自ABGENT公司,蛋白质Marker及5×protein loading buffer均购自Fermentas公司,30%的丙烯酰胺购自BIO-RAD公司,Tween-20购自Solarbio公司,TEMED购自Thermo公司。OrigamiTM2(DE3)和pET-15b购自Merck Millipore公司,E.coliDH5α、分子伴侣pGro7和pMD18-T Vector购自TaKaRa公司。
1.2 肝组织总RNA提取、反转录和PLE基因克隆
按照Trizol试剂盒说明书提取肝组织总RNA,取2 μg总RNA用于RT-PCR。参照GenBank中收录的PLE1的cDNA序列(登录号:X63323),利用Primer Premier 5.0设计1对引物(PLE-up:5′-GGAATTCCATATGATGTGGCTTCTCCCGCT-3′,划线为NdeⅠ酶切位点;PLE-down:5′-CCGCTC-GAGCTTTATCTTGGGTGGCT-3′,划线为XhoⅠ酶切位点)进行PCR扩增。琼脂糖凝胶回收扩增片段,并将该片段克隆到pMD18-T载体,随后转化E.coliDH5α。将所获得的PLE基因T-A克隆质粒进行NdeⅠ和XhoⅠ双酶切鉴定,筛选出阳性克隆送南京金斯瑞生物科技有限公司测序,利用DNAStar软件对测序结果进行比对与拼接,在线运行Blast及利用BioEdit软件分析测序结果,将测序结果与已发表的PLE1序列(登录号:X63323)比对,获得的正确重组质粒命名为pMD18-T-PLE1。
1.3PLE1原核表达载体构建及鉴定
以pMD18-T-PLE1质粒为模板、上述PLE-up和PLE-down为引物PCR扩增PLE1片段。PCR扩增的PLE1片段和pET-15b分别用NdeⅠ和XhoⅠ进行双酶切,胶回收目的片段和载体pET-15b,T4 DNA ligase连接后转化E.coliDH5α感受态细胞,重组质粒经NdeⅠ和XhoⅠ双酶切后进行琼脂糖凝胶电泳和测序鉴定分析。将获得的具有正确读码框的阳性重组质粒命名为pET15b-PLE1。
1.4 PLE1功能性表达及SDS-PAGE分析
首先将分子伴侣pGro7转化OrigamiTM2(DE3)感受态细胞,在LB(Chl+)琼脂平板上筛选出阳性菌落后命名为Origami-pGro7并扩大培养用来重新制备感受态细胞,再取1 μL的pET15b-PLE1转化制备好的Origami-pGro7感受态细胞,将转化产物涂布LB(Amp+和Chl+)琼脂平板进行筛选。37 ℃培养16 h后随机挑取平板上的单个菌落扩大培养,提取质粒后用NdeⅠ和XhoⅠ进行双酶切鉴定。筛选出的阳性克隆命名为Origami-pGro7-PLE1。
将经鉴定正确的阳性克隆子接种于LB(Amp+和Chl+)培养液中(1%比例),首先诱导分子伴侣pGro7表达,加入L-Arabinose至终浓度为1 mg·mL-1,30 ℃摇床200 r·min-1培养2~3 h至菌液OD600 nm为0.6~0.8 时加入IPTG至终浓度为1 mmol·L-1,继续振荡培养,分别于诱导3、6、9、12、24 h后取1 mL菌液12 000 r·min-1离心2 min收集菌体,加入灭菌ddH2O 40 μL重悬细菌,混匀后加入SDS上样缓冲液,煮沸5~10 min使蛋白质变性,SDS-PAGE电泳、考马斯亮蓝染色检测分析重组蛋白质的表达情况。
按照上述方法的最佳培养时间(IPTG诱导6 h),大量培养表达PLE1。同时设置OrigamiTM2(DE3)和Origami-pGro7两个对照组,在IPTG诱导6 h后3组菌液各取1 mL制备SDS-PAGE电泳样品。Origami-pGro7-PLE1在IPTG诱导6 h后收集菌体,用压力细胞破碎仪破碎菌体,直至溶液清亮。4 ℃ 12 000 r·min-1离心30 min,收集上清和沉淀并分别取样制备SDS-PAGE电泳样品。SDS-PAGE电泳分析重组蛋白质的表达形式。
1.5 Western blotting检测PLE1的表达
原核表达产物变性处理后进行SDS-PAGE 电泳,电泳完成后将产物转印至PVDF膜。5%脱脂牛奶(0.5%TBST配制)封闭1 h,弃去封闭液后加入抗His-tag抗体,室温作用1 h,TBST洗涤杂交膜3次后再加入辣根过氧化物酶标记兔抗小鼠IgG反应0.5~1 h,暗室显影。
1.6 PLE1融合蛋白的纯化
取400 mL IPTG诱导表达6 h的菌液,离心菌体,在4 ℃下,用压力细胞破碎仪破碎菌体至溶液透亮,12 000 r·min-1离心30 min收集上清液,上清液用0.45 μm滤膜过滤后,用HisTrap FF crude亲和层析柱纯化。
1.7 PLE1酶活力单位测定
2 结 果
2.1PLE基因的RT-PCR扩增结果和PLE1的克隆
提取大白猪肝总RNA,以RT-PCR的方法克隆得到PLE各亚型基因混合物,经琼脂糖凝胶电泳检测,扩增片段大小为1 700 bp左右(图1),与预期大小(1 686 bp)相符。
回收PLE各亚型混合片段连接pMD18-T载体,转化DH5α感受态细胞,挑取单菌落经测序鉴定得到PLE1、PLE6等多个PLE亚型,而且还分离出多种之前未发现的亚型(结果待发表)。克隆获得的PLE1基因ORF序列见图2,与已发表的PLE1ORF序列 (登录号:X63323) 相似性99%。
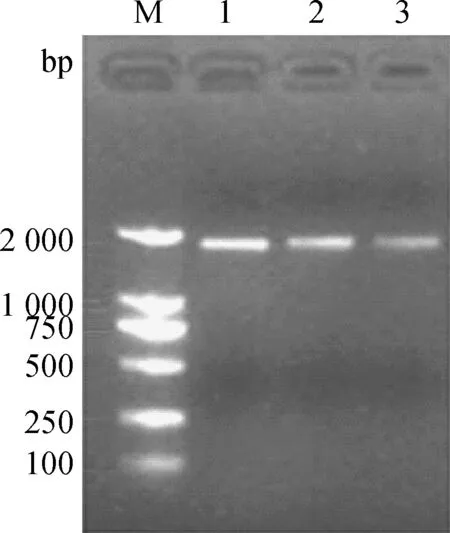
M.DL2000 DNA相对分子质量标准;1~3.PLE基因产物M.DL2000 DNA marker;1-3.PLE gene products图1 琼脂糖凝胶电泳检测RT-PCR扩增PLE基因Fig.1 Agarose gel electrophrosis of PLE gene products amplified by RT-PCR
2.2PLE1原核表达载体的构建和双酶切鉴定
将PLE1连接到pET15b表达载体,重组质粒pET15b-PLE1双酶切鉴定结果如图3所示。经测序,PLE1序列正确,无突变,读码框正确。
2.3PLEI基因的功能性表达和融合蛋白质的纯化
IPTG诱导结束后收集菌体,SDS-PAGE分析融合蛋白质表达情况(图4、5)。结果显示:(1)如图4所示,相对分子质量为60 ku的分子伴侣pGro7诱导表达成功(第2泳道), 61 ku的PLE1也表达成功(第3泳道),因为分子伴侣与PLE1的相对分子质量接近,所以第3泳道的条带应该包含了分子伴侣与PLE1。(2)如图5所示,IPTG诱导6 h后,PLE1重组蛋白质表达量最高。检测细胞碎片的上清(图4泳道4)和沉淀(图4泳道6)的对比结果表明,PLE1重组蛋白质主要以可溶性形式存在。利用His层析柱对上清进行纯化,如图4(泳道5)、图5(泳道6、7)所示,纯化效果良好。
图2 pMD18-T-PLE1基因ORF序列Fig.2 PLE1 ORF sequence in pMD18-T-PLE1
M1.DL15000 DNA相对分子质量标准;1. NdeⅠ、XhoⅠ消化的pET15b-PLE1;M2.DL2000 DNA相对分子质量标准M1.DL15000 DNA marker;1.pET15b-PLE1 digested by NdeⅠ and XhoⅠ;M2.DL2000 DNA marker图3 pET15b-PLE1双酶切鉴定Fig.3 Identification of pET15b-PLE1 recombinant plasmid with double restriction enzymes
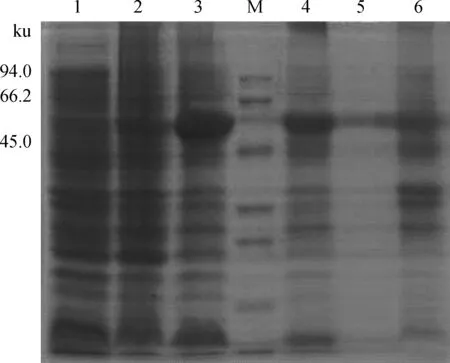
1.Origami WT对照;2.Origami-pGro7对照;3.Origami-pGro7-PLE1;M.蛋白质相对分子质量标准;4.Origami-pGro7-PLE1上清;5.His-tag纯化PLE1;6.Origami-pGro7-PLE1包涵体1.Control 1 (Origami WT);2.Control 2 (Origami-pGro7);3.Origami-pGro7-PLE1;M.Protein molecular weight marker;4.The supernatant of sample from lane 3;5.His-tag-purified PLE1;6.Inclusion body fraction of sample from lane 3图4 PLE1和pGro7共表达的SDS-PAGE分析Fig.4 SDS-PAGE analysis of coexpression of PLE1 and pGro7

1~5.Origami-pGro7-PLE1 IPTG 30 ℃分别诱导3、6、9、12、24 h;M.蛋白质相对分子质量标准;6、7.His-tag纯化 PLE1-5.Origami-pGro7-PLE1 induced for 3,6,9,12,24 h,respectively,by IPTG at 30 ℃;M.Protein molecular weight marker;6,7.His-tag-purified PLE图5 pET15b-PLE1重组蛋白的纯化Fig.5 Purified recombinant proteins of pET15b-PLE1
2.4 Western blotting检测PLE1的表达
为了证明PLE1重组蛋白的表达,用抗His-tag抗体对PLE1重组蛋白质进行鉴定,结果如图6所示,出现大小符合预期61 ku的目标条带。
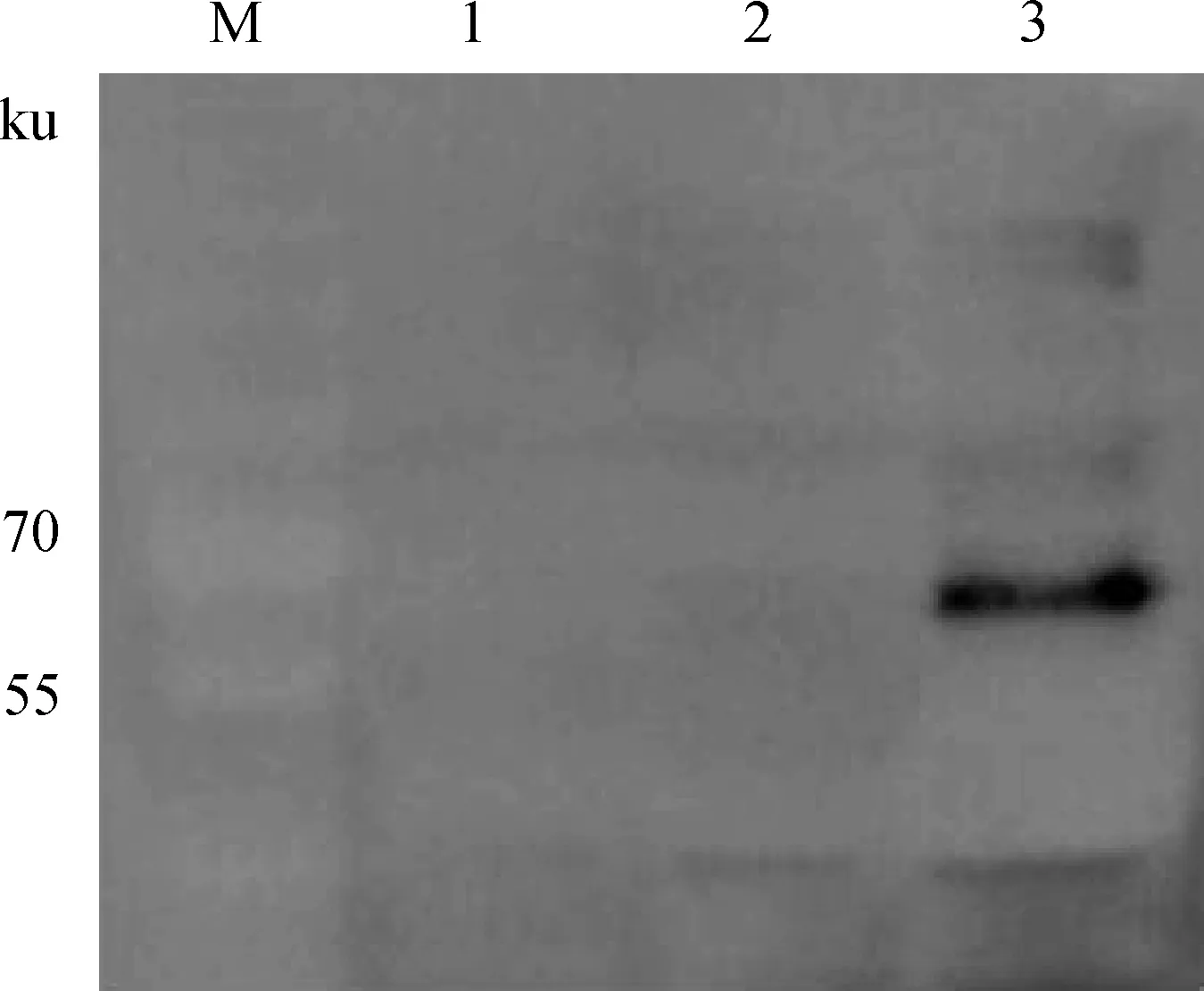
M.蛋白质相对分子质量标准;1.Origami IPTG 30 ℃诱导6 h;2.Origami-pGro7 IPTG 30 ℃诱导6 h;3.Origami-pGro7-PLE1 IPTG 30 ℃诱导6 hM.Protein molecular weight marker;1.Origami induced for 6 h by IPTG in 30 ℃;2.Origami-pGro7 induced for 6 h by IPTG in 30 ℃;3.Origami-pGro7-PLE1 induced for 6 h by IPTG in 30 ℃图6 pET15b-PLE1重组蛋白Western blotting鉴定Fig.6 Identification of pET15b-PLE1 recombinant protein by Western blotting
2.5 PLE1重组蛋白酶活性的检测
通用底物p-NPA检测纯化重组PLE1蛋白酶活性试验的结果显示,Origami-pGro7-PLE1上清具有酶活性,可水解p-NPA产生p-NP,使溶液颜色由白变黄。
3 讨 论
作者通过T-A克隆法不仅分离到了PLE1等多个已见报道的PLE同工酶亚型,而且还克隆到多种重复出现且尚未见报道的PLE新亚型,提示先前报道的PLE同工酶亚型种类尚不完全,存在未被发现的其他亚型,这更说明了PLE家族的复杂性。
为了表达出以可溶性形式存在且具有原有酶活性的PLE1融合蛋白,作者选取了具有trxB和gor双突变的OrigamiTM2(DE3)为宿主菌,该菌可形成氧化性微环境利于重组蛋白质二硫键的正确折叠,从而更有利于融合蛋白质的可溶表达,同时其抗性少,对卡那霉素敏感,适用范围广;选择含有T7启动子的pET15b为表达载体,OrigamiTM2(DE3)能表达T7 RNA聚合酶,能够保证pET15b载体上T7启动子对外源蛋白表达的高效性和专一性[23-24],此外,该载体结构简单,能够表达含有His-tag的外源蛋白质,His-tag相对分子质量相对PLE1可以忽略不计,不仅不影响外源蛋白质的空间结构和功能,并且易于外源蛋白质的纯化从而获得高纯度的重组蛋白质;同时选取pGro7作为表达的辅助质粒,通过表达分子伴侣pGro7辅助重组蛋白质正确折叠,从而大大提高了PLE1重组蛋白质的可溶性。对诱导表达条件优化的研究显示:30 ℃条件下表达可以增加PLE1重组蛋白质正确折叠的比例,使之以可溶性形式存在,这可能是因为在30 ℃条件下大肠杆菌的生长速率下降,利于对真核蛋白质进行翻译后的修饰和正确折叠;接菌后先用L-Arabinose诱导pGro7表达,使小量分子伴侣pGro7先于重组蛋白质存在,可提高辅助效率;与之前D.Böttcher等用IPTG诱导表达24 h的研究结果[20]相比,本研究发现IPTG诱导表达24 h重组蛋白质表达量并不是最大,而是诱导6 h后PLE1的产量达到最大,推测可能是因为细菌培养超过6 h后逐渐进入衰退期,代谢产物和有害有毒物累积造成菌液性质改变,如酸碱度等,而不利于重组蛋白质表达,同时重组蛋白质也可能降解。
本研究中,PLE1重组蛋白质以可溶性形式在上清中表达。加入蛋白质保护剂采用压力破碎法破碎菌体,在此过程中最大程度地降低了破碎对重组蛋白质的损害。由于PLE1重组蛋白质中的His-tag可以与 Ni-NTA树脂结合,可采用Ni-NTA His·Bind树脂进行纯化,该方法技术成熟、操作简便且不影响酶活性。纯化过程中发现洗脱液中咪唑的浓度为500 mmol·L-1时,洗脱效率最高,纯化效果最好,提高了PLE1重组蛋白酶的浓度。
根据检测PLE酶活性的通用方法[17,18,20],以p-NPA为底物,检测PLE1重组蛋白酶的活力为1.24 μmol·mg-1·min-1,表明来源于高等动物的PLE1在原核细胞中实现了功能性表达,其酶活性达到进行后续水解兽药研究的要求。
4 结 论
克隆了包括PLE1在内的多种PLE同工酶基因,并在原核细胞-大肠杆菌中实现了PLE1的功能性表达,纯化的重组PLE1水解p-NPA的活力为1.24 U,为进一步开展PLE1水解兽药特性等研究奠定了物质基础,也为PLE同工酶家族其他重要成员的功能性表达及酶活性研究、其他生理功能研究搭建了技术平台。
[1] HOLMES R S,COX L A,VANDEBERG J L.Mammalian carboxylesterase 3:comparative genomics and proteomics[J].Genetica,2010,138(7):695-708.
[2] HOSOKAWA M,FURIHATA T,YAGINUMA Y,et al.Structural organization and characterization of the regulatory element of the human carboxylesterase (CES1A1 and CES1A2) genes[J].DrugMetabPharmacokinet,2008,23(1):73-84.
[3] SATOH T,HOSOKAWA M.Structure,function and regulation of carboxylesterases[J].ChemBiolInteract,2006,162(3):195-211.
[4] SHI D,YANG J,YANG D,et al.Dexamethasone suppresses the expression of multiple rat carboxylesterases through transcriptional repression:evidence for an involvement of the glucocorticoid receptor[J].Toxicology,2008,254(1-2):97-105.
[5] SATOH T,HOSOKAWA M.The mammalian carboxylesterases:from molecules to functions[J].AnnuRevPharmacolToxicol,1998,38:257-288.
[6] SHI D,YANG D,PRINSSEN E P,et al.Surge in expression of carboxylesterase 1 during the post-neonatal stage enables a rapid gain of the capacity to activate the anti-influenza prodrug oseltamivir[J].JInfectDis,2011,203(7):937-942.
[7] IMAI T,TAKETANI M,SHII M,et al.Substrate specificity of carboxylesterase isozymes and their contribution to hydrolase activity in human liver and small intestine[J].DrugMetabDispos,2006,34(10):1734-1741.
[8] HOSOKAWA M,FURIHATA T,YAGINUMA Y,et al.Genomic structure and transcriptional regulation of the rat,mouse,and human carboxylesterase genes[J].DrugMetabRev,2007,39(1):1-15.
[9] BRÜSEHABER E,BÖTTCHER D,BORNSCHEUER U T.Insights into the physiological role of pig liver esterase:isoenzymes show differences in the demethylation of prenylated proteins[J].BioorgMedChem,2009,17(23):7878-7883.
[10] HOSOKAWA M,HIRATA K,NAKATA F,et al.Species differences in the induction of hepatic microsomal carboxylesterases caused by dietary exposure to di(2-ethylhexyl)phthalate,a peroxisome proliferator[J].DrugMetabDispos,1994,22(6):889-894.
[11] MORRIS A P,BRAIN K R,HEARD C M.Synthesis of haloperidol prodrugs and their hydrolysis by porcine liver esterase[J].DrugMetabLett,2008,2(4):275-279.
[12] HEYMANN E,JUNGE W.Characterization of the isoenzymes of pig-liver esterase.1.Chemical studies[J].EurJBiochem,1979,95(3):509-518.
[13] JUNGE W,HEYMANN E.Characterization of the isoenzymes of pig-liver esterase 2.Kinetic studies[J].EurJBiochem,1979,95(3):519-525.
[14] FARB D,JENCKS W P.Different forms of pig liver esterase[J].ArchBiochemBiophys,1980,203(1):214-226.
[15] ÖHRNER N,MATTSON A,NORIN T,et al.Enantiotopic selectivity of pig-liver esterase isoenzymes[J].BiocatalBiotransfor,1990,4(2-3):81-88.
[16] HUMMEL A,BRÜSEHABER E,BÖTTCHER D,et al.Isoenzymes of pig-liver esterase reveal striking differences in enantioselectivities[J].AngewChemIntEdEngl,2007,46(44):8492-8494.
[17] HERMANN M,KIETZMANN M U,IVANCIC' M,et al.Alternative pig liver esterase(APLE)-cloning,identification and functional expression inPichiapastorisof a versatile new biocatalyst[J].JBiotechnol,2008,133(3):301-310.
[18] LANGE S,MUSIDLOWSKA A,SCHMIDT-DANNERT C,et al.Cloning,functional expression,and characterization of recombinant pig liver esterase[J].Chembiochem,2001,2(7-8):576-582.
[19] MUSIDLOWSKA A,LANGE S,BORNSCHEUER U T.By overexpression in the yeastPichiapastoristo enhanced enantioselectivity:new aspects in the application of pig liver esterase[J].AngewChemIntEdEngl,2001,40(15):2851-2853.
[20] BÖTTCHER D,BRÜSEHABER E,DODERER K,et al.Functional expression of the γ-isoenzyme of pig liver carboxyl esterase inEscherichiacoli[J].ApplMicrobiolBiotechnol,2007,73(6):1282-1289.
[21] GALL M,KOURIST R,SCHMIDT M,et al.The role of the GGGX motif in determining the activity and enantioselectivity of pig liver esterase towards tertiary alcohols[J].BiocatalBiotransfor,2010,28(3):201-208.
[22] SMITH M E,BANERJEE S,SHI Y,et al.Investigation of the cosolvent effect on six isoenzymes of PLE in the enantioselective hydrolysis of selected α,α-disubstituted malonate esters[J].ChemCatChem,2012,4(4):472-475.
[23] DAVANLOO P,ROSENBERG A H,DUNN J J,et al.Cloning and expression of the gene for bacteriophage T7 RNA polymerase[J].ProcNatlAcadSciUSA,1984,81(7):2035-2039.
[24] STUDIER F W,ROSENBERG A H,DUNN J J,et al.Use of T7 RNA polymerase to direct expression of cloned genes[J].MethodsEnzymol,1990,185:60-89
(编辑 白永平)
Cloning and Functional Expression of Pig Liver Esterase 1 Gene in Prokaryotic Cells
XIAO Qi-ling1,2,LI Peng-hui1,2,YAN Bing-fang3,YANG Lu1,2,WANG Xi-liang1,2,XIAO Yun-cai1,2,LI Zi-li1,2,LIU Mei1,2,BI Ding-ren1,2,SHI De-shi1,2*
(1.StateKeyLaboratoryofAgriculturalMicrobiology,CollegeofVeterinaryMedicine,HuazhongAgriculturalUniversity,Wuhan430070,China;2.KeyLaboratoryofDevelopmentofVeterinaryDiagnosticProductsofMinistryofAgriculture,CollegeofVeterinaryMedicine,HuazhongAgricultural
University,Wuhan430070,China;3.DepartmentofBiomedicalSciences,CenterforPharmacogenomicsandMolecularTherapy,UniversityofRhodeIsland,Kingston02881,USA)
In order to obtain active pig liver carboxylesterase 1 (PLE1) and study its function,PLE1 were obtained by RT-PCR and normal PCR from large white pig liver.PLE1 ORF was linked into the prokaryotic expression vector pET15b,and was functional expressed inE.coliOrigamiTM2(DE3) cells which were transformed ahead with pGro7.The target protein was purified and its enzyme activity was tested.The sequencing results showed that total length of PLE1 ORF is 1 686 bp,which coding 562 aa.The SDS-PAGE and Western Blotting results demonstrated that recombinant protein PLE1 was expressed successfully,and the highest amount was acquired after culture in 30 ℃ for 6 h,and most of the protein is soluble,and the recombinant PLE1 hydrolysis activity for p-NPA is 1.24 U.The research results not only provide high purity active PLE1 for the study of PLE1 hydrolysis of veterinary medicine,but also provide the theory basis,technical methods for the function study of other important PLE isoenzymes.
pig liver carboxylesterase 1;functional expression;activity measurement
10.11843/j.issn.0366-6964.2015.04.020
2014-07-04
国家自然科学基金(31372484);湖北省自然科学基金(2012FFB02906);中央高校基本科研业务费专项资金(2011PY117)
肖启玲(1989-),女,四川达州人,硕士,主要从事药物代谢酶的分子生物学研究,Tel:027-87280032,E-mail:xiaoqilingk@sina.com
*通信作者:石德时,E-mail:rock@mail.hzau.edu.cn
S852
A
0366-6964(2015)04-0650-07
