维生素E对小鼠体内精子品质及精子DNA的保护作用
2015-03-22赵宪林曹少杰赵春平郝瑞杰桂林生昝林森
赵宪林,曹少杰,赵春平,郝瑞杰,桂林生,昝林森*
(1.西北农林科技大学动物科技学院,杨凌 712100;2.渭南职业技术学院,渭南市农产品食品检验检测研究中心,渭南714000)
维生素E对小鼠体内精子品质及精子DNA的保护作用
赵宪林1,曹少杰2,赵春平1,郝瑞杰1,桂林生1,昝林森1*
(1.西北农林科技大学动物科技学院,杨凌 712100;2.渭南职业技术学院,渭南市农产品食品检验检测研究中心,渭南714000)
旨在研究维生素E对小鼠精子DNA的保护作用及对精液中抗氧化物酶活性的影响。以小鼠为动物模型,选日龄、大小相同的健康雄性小白鼠50只,随机分成5组,在试验组小鼠的每千克日粮中分别添加4、8、12、16 g 的维生素E,对照组添加量为0,饲喂30 d后,通过颈椎脱臼处死小鼠,解剖后通过附睾和曲精细管获得小鼠精液。通过单细胞凝胶电泳及相关检测试剂盒检测分析各组间精液DNA的完整性、精子活力、密度、畸形率、精浆中的超氧化物歧化酶(SOD)、谷胱甘肽过氧化物酶(GSH)、谷胱甘肽还原酶(GR)和过氧化氢酶(CAT)的活性。结果表明:每千克日粮中维生素E的添加量为12 g 时,0级精子百分率与对照组相比差异显著(P<0.05);添加量为8~16 g 时,精子活力与对照组相比差异显著(P<0.05);GR和SOD酶的活性与对照组相比差异显著(P<0.05)。每千克日粮中维生素E添加量为12~16 g 时,CAT酶的活性与对照组相比差异显著(P<0.05)。综上表明,在饲粮中添加维生素E浓度为12 g·kg-1时可以明显提高小鼠精液中CAT、GR、GSH和SOD酶的活性及精子DNA的完整性。
小鼠;维生素E;精子;DNA完整性
在家畜育种过程中,如何提高精子品质及精子受精率,一直是人们研究的重要问题[1]。精子在体内产生、生长、成熟过程中,由于各种原因使得部分或者全部精子丧失了活力,或者精浆中抗氧化酶活性不足则是导致人类男性不育的重要原因[2]。由于各种体外或体内的原因导致精子DNA受损[3],授精后将会导致胎儿畸形或者怀孕过程中形成死胎,引起流产,或者直接无法受孕[4]。所以以试验动物为试验模型探讨如何在体内对精子形成有效的保护,一直以来是人们研究的重点。
存在于精浆中的ROS,主要来源于芳香族氨基酸催化死亡精子所发生的反应[5]。当体内ROS含量过多时,会对细胞、组织、器官造成一定的损伤[6]。在精液中,少量的ROS对精子的活率,顶体完整率及精子受精过程起着十分重要的作用[6-7]。当ROS在体内产生过多且体内抗氧化酶不能消除这些自由基时,ROS含量增高就会产生氧化应激[5],对精子品质造成较大的损伤,导致精浆中抗氧化酶的活性降低,影响精液品质[6]。R.Jones 等[8]对人的精液进行研究时认为,ROS不但能降低精子的活性,而且能引起男性不育[9]。在精液中本身就含有多种抗氧化酶,其主要功能就是消除ROS,但是这些自然的抗氧化酶活性相对较弱,而精子对氧化应激较为敏感[10]。
精液中ROS 的含量与精子活率、顶体完整率、精子受精率的高低有很大的关系[11]。正常生理条件下,ROS水平和抗氧化酶活性在雄性动物生殖器官内保持平衡状态[12],就不会对精子品质造成损伤。精子最重要的使命是携带DNA并与卵子结合,使后代获得父亲的遗传信息,正常的生殖功能完成离不开精子DAN的完整性。在对精液中精子DNA的研究发现ROS对精子DNA造成损伤[13]是造成精子DNA损伤的重要因素之一。研究表明ROS可以攻击精子核中的DNA,这些结构的过氧化能引起碱基修饰、DNA链断裂,对DNA完整性造成损伤[13-14]。DNA序列的复杂性使得精子DNA抵抗氧化侵蚀的能力非常微弱[15],同时又缺乏DNA损伤修复机制,所以目前寻找有效的能够较好保护精子DNA完整性的抗氧化剂迫在眉睫。
维生素E作为一种抗氧化剂对细胞的线粒体、网状组织或浆膜的磷脂有着特殊的亲和性[16],存在于这些膜的特定部位,能通过抑制自由基的形成,阻止诱发的膜脂质发生过氧化[17],从而维持精子顶体膜的完整,提高精子顶体完整率和降低精子畸形率,并且在器官组织中具有抗氧化,保护机体细胞免受自由基的毒害[18]。在精液生产中,通常通过添加抗氧化剂来减少和消除ROS对精子的不良作用[19]。M.I.Yousef等[20]研究发现给兔饲喂维生素E能够提高兔精子的浓度和射精量,降低精子死亡率和畸形率。P.J.I.Ellis等[21]试验发现,在公羊日粮中添加适量的维生素E能够提高公羊射精量、精子活力、精液浓度,同时提高母羊的受胎率和产羔率。在妊娠母猪日粮中补加维生素E还可提高产仔数,降低仔猪断奶前死亡率[22]。给怀孕母猪饲料中补充 20 g·kg-1维生素E,可以预防维生素E缺乏所导致的死胎、窝产仔数减少、仔猪早期死亡率增加及产后可能无乳等[23]。由此可见,维生素E对家畜的繁殖性能有重大影响。迄今为止,饲喂维生素E能否对小鼠精液中抗氧化酶的活性起到保护作用研究还未见相关报道。 本研究分别利用精子分析的常规技术和单细胞凝胶电泳技术从精子常规品质和精子DNA方面对小鼠精子进行研究,以期对探讨维生素E在动物体内对精子保护作用机制提供理论依据。
1 材料与方法
1.1 主要仪器与试剂
仪器设备:恒温水槽(上海福玛),水平电泳槽(北京六一),电子天平(Mettler Toledo),荧光显微镜(OLYPUS),电冰箱(海尔BCD-205TA),离心机(Eppendorf),磁力搅拌器(国华),微波炉(美的),pH酸度计(Mettler Toledo)等。正常熔点琼脂糖、低熔点琼脂糖、NaCl、十二烷基肌氨酸钠、TritonX-100、RNaseA、蛋白酶K、醋酸钠、氢氧化钠、盐酸、EB、PBS、DMSO(上海生工),维生素E、Na2EDTA和Tris(Sigma)。
1.2 溶液的配制
正常溶点的琼脂糖溶液的配制:称取0.2 g正常溶点的琼脂糖,混匀在20 mL超纯水,微波炉加热45 s。低溶点的琼脂糖溶液的配制:准确称取0.15 g低溶点的琼脂糖,加20 mL超纯水,混匀后放置在60 ℃水浴锅中待完全溶解后转移到37.5 ℃。精子膜裂解液的配制:准确称取146.25 g NaCl,37.224 g Na2EDTA,1.211 4 g Tris,10 g十二烷基肌氨酸钠,用超纯水定容到1 000 mL,溶解后调pH为10,使用前分别加2 mL TritonX-100和2 mL DMSO。平衡液的配制:称取8.16 g,醋酸钠和2.42 g Tris,加入200 mL超纯水,溶解并调pH为10。电泳液的配制:称取8.02 g NaOH和0.644 g Na2EDTA,用超纯水定容到1 600 mL,溶解并调pH为10。
1.3 精液采集与处理
同批出生的健康雄性小白鼠50只,随机分成5组,每组10只,单笼单鼠饲喂:在每千克小鼠日粮中维生素E的添加量分别为0、4、8、12、16 g。不同小组分别饲喂1个月后,用颈椎脱臼法将小鼠处死,用酒精棉球全身消毒后,在无菌操作台上切开下腹部,分别取出小鼠睾丸和储精管,并分别放入装有1 mL PBS的小平皿中。然后将其剪成几段并转移至离心管中,1 400 r·min-1离心5 min,取上清液。测定精浆酶前精液的处理:小鼠被处死后,取出双侧附睾和储精管,并立即放入提前在37.5 ℃进行预热的含有10%胎牛血清的200 μL孵育液中,培养5 min,收集上清液50 μL送医院对精子进行检测,另外50 μL检测精液中精浆酶活力。余下的放置37 ℃且含有5% CO2饱和湿度的细胞培养箱中待用。
1.4 精子特性检测
1.4.1 精子活力的测定及精子密度的测定 本次试验样品提取后直接送杨凌示范区惠仁医院进行检测,主要检测精子活力和精子密度。
1.4.2 精子畸形率的测定 将精子悬液500 μL 加入2%伊红溶液50 μL染色1 min,涂片,甲醇固定。在油镜下每只小鼠的样品观察100个精子,找出头部膨大、断尾等与正常精子形态不同的精子,用百分率表示精子畸形率。
1.4.3 精浆酶的测定 本试验共测定4种精浆酶的活力,包括超氧化物歧化酶(SOD)、过氧化氢酶(CAT)、谷胱甘肽还原酶(GR)、谷胱甘肽过氧化物酶(GSH),采用南京建成生物技术公司生产的试剂盒进行检测。严格按照操作规程进行试验。
1.4.4 精子DNA损伤检测 利用单细胞凝胶电泳技术检测DNA损伤程度。根据张忠诚等[14]介绍的方法,在荧光显微镜下选择无重叠、荧光信号强的精子核计数。按照细胞荧光图像是否像彗星一样头尾分明,将其分为彗星样细胞和非彗星样细胞,然后根据尾长将DNA损伤程度分为5级,0级:正常的非彗星样细胞,尾长小于5%,无损伤,精子核完整;I级:尾长5%~20%,轻度损伤,可见彗尾,并且精子核缩小;Ⅱ级:尾长20%~40%,中度损伤,可见明显彗尾,精子核缩小;Ⅲ级:尾长40%~95%,重度损伤,彗尾荧光信号强而密,并见明显缩小的精子核;Ⅳ级:尾长大于95%,完全损伤,仅见荧光强而密的彗尾,精子核模糊或消失
1.5 统计学处理
所有数据均用“平均数±标准差(Mean ± SD)”表示,采用SPSS 13.0软件和Cometscore彗星试验图像处理软件进行统计分析。
2 结 果
2.1 维生素E的添加量对精子品质的影响
日粮中添加不同含量的维生素E对小鼠精子品质的影响结果见表1。当每千克日粮中的维生素E添加量为8 g时,精子活力与对照组相比差异显著(P<0.05)。不同添加量的维生素E对小鼠精子的密度和畸形率,与对照组相比均无显著差异(P>0.05)。由表中的数据可知,当每千克日粮中维生素E添加量为12 g时,小鼠精子的活力最强、畸形率最低、精子密度较大,则说明对小鼠精子的保护作用最佳。
2.2 维生素E的不同添加量对精浆酶活性的影响
不同添加量的维生素E对精浆酶活性的影响见表2。随着维生素E添加量的增加,精浆酶活性基本呈上升趋势。经分析,当每千克日粮中维生素E的添加量为8 g时,过氧化氢酶和谷胱甘肽还原酶的活性与对照组相比差异显著(P<0.05);当日粮中维生素E的添加量为4 g时,超氧化物歧化酶的活性与对照组相比差异显著(P<0.05);但是谷胱甘肽过氧化物酶的活性与对照组相比均无显著差异(P>0.05)。综合分析可知,当日粮中维生素E的添加量为12 g时,过氧化氢酶、谷胱甘肽还原酶、超氧化物歧化酶、谷胱甘肽过氧化物酶的活性值均最大,对小鼠精子的保护作用最佳。结果说明,在动物日粮中添加维生素E可以大大提高动物的精液品质。
表1 不同添加量的维生素E对精子品质的影响
Table 1 The effects of different amount of vitamin E on sperm quality
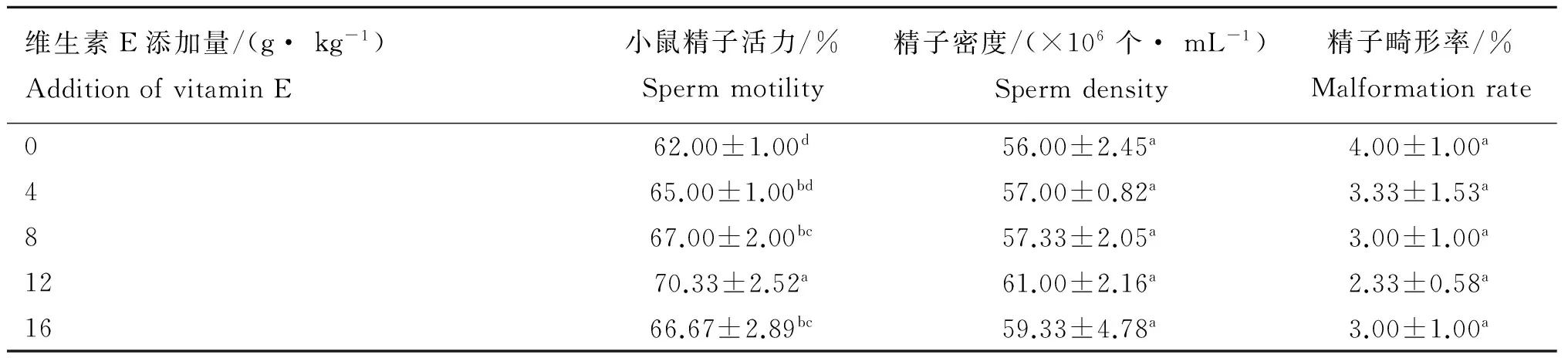
维生素E添加量/(g·kg-1)AdditionofvitaminE小鼠精子活力/%Spermmotility精子密度/(×106个·mL-1)Spermdensity精子畸形率/%Malformationrate062.00±1.00d56.00±2.45a4.00±1.00a465.00±1.00bd57.00±0.82a3.33±1.53a867.00±2.00bc57.33±2.05a3.00±1.00a1270.33±2.52a61.00±2.16a2.33±0.58a1666.67±2.89bc59.33±4.78a3.00±1.00a
表中数据后标不同小写字母表示差异显著(P<0.05),标不同大写字母表示差异极显著(P<0.01).下表同
Different little letters mean significant difference (P<0.05),different capital letters mean super significant difference each other (P<0.01).The same as below
表2 不同添加量的维生素E对精浆酶活性的影响
Table 2 The effect of vitamin E on the activities of frozen-thawed semen
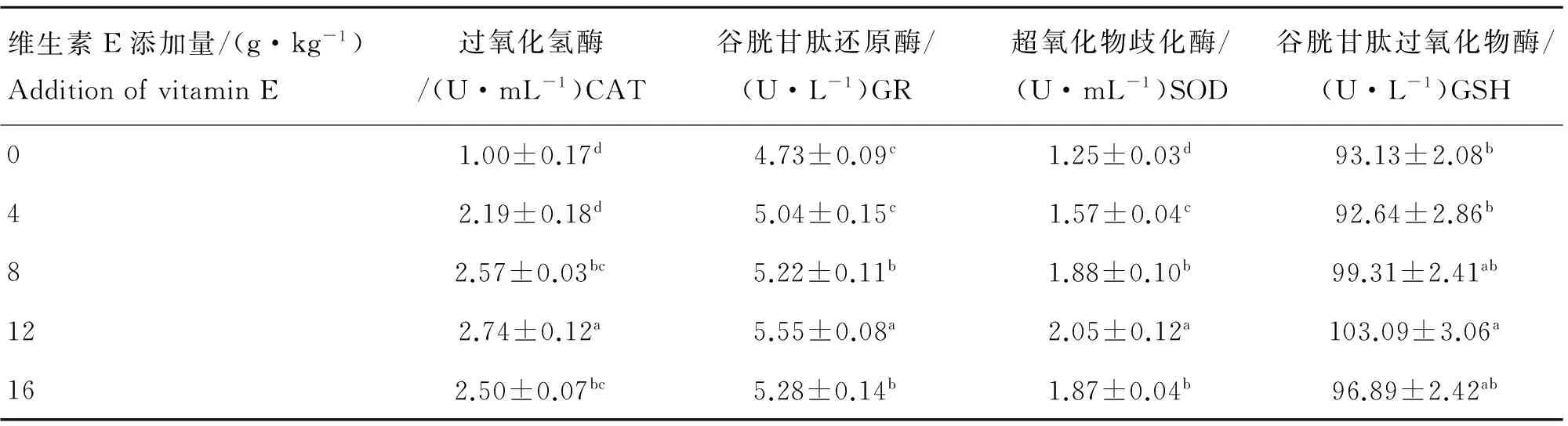
维生素E添加量/(g·kg-1)AdditionofvitaminE过氧化氢酶/(U·mL-1)CAT谷胱甘肽还原酶/(U·L-1)GR超氧化物歧化酶/(U·mL-1)SOD谷胱甘肽过氧化物酶/(U·L-1)GSH01.00±0.17d4.73±0.09c1.25±0.03d93.13±2.08b42.19±0.18d5.04±0.15c1.57±0.04c92.64±2.86b82.57±0.03bc5.22±0.11b1.88±0.10b99.31±2.41ab122.74±0.12a5.55±0.08a2.05±0.12a103.09±3.06a162.50±0.07bc5.28±0.14b1.87±0.04b96.89±2.42ab
2.3 最佳保护组中精子DNA的完整性分析
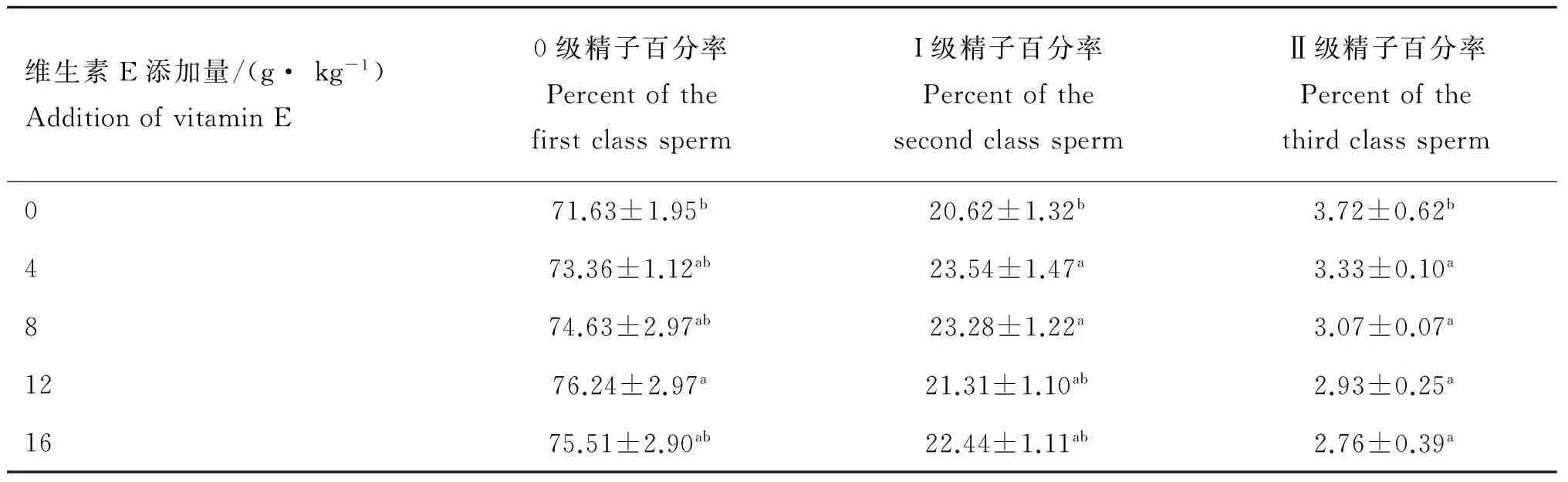
用Cometscore彗星试验图像处理软件进行统计分析后,最佳保护组中精子DNA的完整性分析结果见表3。 在本试验中0级、I级、Ⅱ级精子做了相关统计分析。由表3可以看出,每千克日粮中维生素E添加量为12 g,0级精子百分率和II级精子百分率与对照组相比差异显著(P<0.05),当添加量为8 g Ⅰ级精子百分率为23.28,与对照组相比差异显著(P<0.05)。
3 讨 论
3.1 日粮中维生素E不同添加量对小鼠精液品质的影响
精子的活力与受精能力密切相关,既是评定精液品质的重要指标又是评定精子是否具备输精条件的重要因素。在对人类精液的研究上,精子品质的高低在一定程度上决定了精子是否能够有效地穿过女性生殖道到达受精部位,当精子品质下降时可干扰精子受精过程,使生育指数下降[4,24]。P.Sarlos等[25]研究发现,维生素E是机体中最重要的抗氧化剂,能通过抑制自由基的形成,阻止诱发的膜脂质发生过氧化,提高精子顶体完整率和降低精子畸形率,同时对精子DNA完整性造成一定影响。
M.I.Yousef 等[20]证明,在日粮中补饲维生素E能有效减少兔精液中活性氧(ROS)的产物,有效改善精液品质。本试验也证明维生素E可以提高小鼠精子精液品质,在每千克的日粮中添加 12 g的效果尤为显著,精子活力及运动特性明显提高,但是添加量与M.I.Yousef 等研究的不同,其原因可能是因为兔精子和小鼠精子在生物学特性上的差异,也有可能是因所添加的维生素E的形式不同,本试验添加的为粉末状维生素E,而非油状的维生素E胶丸。本次试验还表明,在日粮中添加维生素E量较少对小鼠精液品质没有明显的保护作用,而添加量加大又会降低精子品质。当每千克日粮中维生素E的添加量为12 g时,精子的活力最强,精子的密度最大,精子的畸形率最小。试验表明,随着维生素E添加量的增加,精子的活力增强,精子密度增大,精子畸形率减小。这可能是由于添加维生素E后,增强了精子的抗氧化能力,降低顶体脱落程度,增强顶体的完整性。
表3 不同饲喂量对精子DNA的保护作用
Table 3 Protective effect of different amount of vitamin E on sperm DNA
%
3.2 日粮中维生素E的不同添加量对小鼠精浆酶活性的影响
精子在产生、生长、成熟的过程中,会有部分精子死亡。 死亡精子在精浆中经过芳香族氨基酸催化反应产生ROS,在精浆中,少量的ROS对于精子的获能和顶体反应是必须的。但是精浆中的ROS过多,就会使精浆中抗氧化物酶相对减少,造成精液解冻后精子活力降低,授精率下降[26]。虽然精子拥有防御活性氧簇(ROS)的主要酶系,如超氧化物歧化酶(SOD)、过氧化氢酶(CAT)和谷胱甘肽过氧化物酶(GSH-Px)。但是由于浓度和分布的局限性而使它们的清除效率降低。而维生素E作为一种抗氧化剂可以捕获并中和一部分活性氧簇离子自由基,从而祛除自由基对精子细胞的损害[27]。H.Massaeli等[28]发现维生素E可以有效抑制脂质过氧化反应;M.Sonmez等[29]研究揭示,维生素E可以减少兔睾丸中ROS的产生,提高精子活力。
在本试验中,日粮中添加维生素E后,对照组和添加维生素E最适宜组(12 g·kg-1)的CAT分别为1.00和2.74 U·mL-1,SOD分别为1.57和2.05 U·mL-1,GSH分别为93.13和103.09 U·L-1,GR值分别为4.73和5.55 U·L-1。这些结果表明,在小鼠日粮中添加维生素E可以有助于提高精浆中抗氧化酶类的活力,这一结果和H.Massaeli等[28}[29]研究结果相一致。在日量中添加维生素E可以提高精浆中抗氧化酶的活性,这可能是由于维生素E作为抗氧化剂,一方面是抑制了部分自由基的产生,其次是维生素E可能抵御了ROS对精浆中抗氧化酶的损害,抑制了ROS的有害作用。即说明了在日粮中添加适量的维生素E能够在体内有效改善精子的品质及精浆中抗氧化酶的活性。
3.3 日粮中添加维生素E对精子DNA保护情况
研究表明,ROS具有强烈的氧化特性,精子发生过程中,如果染色质浓缩过程异常,使染色质致密性降低,容易引起活性氧(ROS)氧化精子DNA 碱基或脂质过氧化产物与DNA 的共价结合[12],造成精子DNA 损伤,导致DNA链的断裂,引起核DNA降解。最具破坏性的细胞内ROS之一是羟自由基,它能够引起DNA碱基的化学变化。作为抗氧化剂的维生素E不仅能够体内羟自由基的产生和羟自由基碱基修饰,而且还可以减少 H2O2诱导人皮肤细胞系VH10的DNA链断裂,同时维生素E可以阻止吸烟引起的DNA单链断裂[30]。
本研究结果表明,维生素E作为一种抗氧化剂在保护精子DNA完整性上有一定的效果。O.Tunc等对不育症患者给予含维生素E的片剂治疗后,精子核DNA 的完整性提高,凋亡精子和精液中抗氧化酶活性显著提高[31],与本研究结果相一致。本研究结果表明,随着小鼠日粮中维生素E添加量的增加,小鼠精子DNA“彗星”的0级精子百分率增加。并且添加量为12 g时,0级精子百分率最大,说明当日粮中维生素E的添加量为12 g时,对小鼠精子DNA的保护效果最佳,在这一结论上与O.Tunc等研究认为维生素E能提高DNA的完整性结果相同,说明维生素E对小鼠精子中的DNA具有保护作用。
4 结 论
综上表明,日粮中随着维生素E添加量的增加,精子活力增强,精子密度增大,精子畸形率减小,精浆酶活性增强,但是随着维生素E的添加量加大,各项指标均有下降趋势。当每千克日粮中维生素E的添加量为12 g时,精子活力最强,精子密度最大,精子畸形率最小,精浆酶活性最强。则说明在日粮中添加维生素E对体内精子品质及DNA完整性具有良好的保护作用。
[1] AITKEN R J,WEST K M P.Analysis of the relationship between reactive oxygen species production and leukocyte infiltration in fractions of human semen separated on percoll gradients [J].IntJAndrol,1990,13(5):430-439.
[2] HU J H,TIAN W Q,ZHAO X L,et al.The cryoprotective effects of ascorbic acid supplementation on bovine semen quality [J].AnimReprodSci,2010,121(1-2):72-77.
[3] NMEZ M S,YBCE A,TBRK G.The protective effects of melatonin and vitamin E on antioxidant enzyme activities and epididymal sperm characteristics of homocysteine treated male rats [J].ReprodToxicol,2007,23(2):226-231.
[4] 高久春,王瑞雪,许宗革,等.精子形态学分析中染色方法的比较[J].吉林大学学报,2005,31(5):778-780. GAO J C,WANG R X,XU Z G,et al.Comparison of staining methods in evaluation of sperm morphology [J].JournalofJilinUniversity,2005,31(5):778-780.(in Chinese)
[5] SHARMA R K,PASQUALOTTO F F,NELSON D R,et al.The reactive oxygen species-total antioxi-dant capacity score is a new measure of oxidative stress to predict male infertility [J].HumReprod,1999,14:2801-2807.
[6] AITKEN R J,BAKER H W.Seminal leukocytes:passengers,terrorists or good samaritans [J].HumReprod,1995,10:1736-1739.
[7] LEWIS S E,BOYLE P M,MCKINNEY K A,et al.Total antioxidant capacity of seminalplasma is different in fertile and infertile men [J].FertilSteril,1995,64:868-870.
[8] JONES R,MANN T.Damage to ram spermatozoa by peroxidation of endogenous phospholipids [J].JReprodFertil,1977,50(2):261-268.
[9] AITKEN R J,WEST K M.Analysis of the relationship between reactive oxygen species production and leukocyte infiltration in fractions of human semen separated on percoll gradients [J].IntJAndrol,1990,13(6):433-451.
[10] HAMMADEH M E,ZAVOS P M,ROSENBAUM P,et al.Comparison between the quality and function of sperm after semen processing with two different methods [J].AsianJAndrol,2001,3(2):115-130.
[11] GRIVEAU J F,LE LANNOU D.Reactive oxygen species and human spermatozoa:physiology and pathology [J].IntJAndrol,1997,20:61-69.
[12] SIKKA S C,RAJASEKARAN M,HELLSTROM W J.Role of oxida-tive stress and antioxidants in male infertility [J].JAndrol,1995,16:464-468.
[13] SAID T M,AGARWAL A,SHARMA R K,et al.Impact of sperm morphology on DNA damage caused by oxidative stress induced by beta-nicotina-mide adenine dinucleotide phosphate [J].FertilSteril,2005,83:95-103.
[14] SAKKAS D,MARIETHOZ E,MANICARDI G,et al.Origin of DNA damage in ejaculated human spermatozoa [J].RevReprod,1999,4:31-37.
[15] AGARWAL A,ALLAMANENI S S.Role of free radicals in female reproductive diseases and assisted reproduction [J].ReprodBiomedOnline,2004,9:338-347.
[16] OLLERO M,PEREZ-PE R,MUINO-BLANCO T,et al.Improvement of ram sperm cryopreservation protocols assessed by sperm quality parameters and heterogeneity analysis [J].Crybiology,1998,37(1):1-12.
[17] EL-DEMERDASH F M,YOUSEF M I,KEDWA-NY F S,et al.Cadmium-induced changes in lipid peroxidation,blood hematology,biochemical parameters and semen quality of male rats:protective role of vitamin E and β-carotene [J].FoodChemToxicol,2004,42(10):1563-1571.
[18] KAMMANN U,BUNKE M,STEINHART H,et al.Apermanent fish cell line (EPC) for genotoxicity testing of marine sediments with the comet assay [J].MutatRes, 2001,498:67-77.
[19] 肖 雄.维生素E的研究与应用[J].畜禽业,2002,(4):27. XIAO X.The research and application of vitamin E [J].LivestockandPoultryIndustry,2002,(4):27.
[20] YOUSEF M I,ABDALLAH G A,KAMEL K I.Effect of ascorbic acid and vitamin E supplementation on semen quality and biochemical parameters of male rabbits [J].AnimReprodSci,2003,76(1-2):99-111.
[21] ELLIS P J I,YU Y,ZHANG S J.Transcriptional dynamics of the sex chromosomes and the search for offspring sex specific antigens in sperm [J].Reproductiong,2011,142:609-619.
[22] 孙 黎,房 晶,佟向阳,等.饲料中添加维生素E的生物学意义 [J].饲料工业,2000,21(6):29-30. SUN L,FANG J,TONG X Y,et al.The biological significance of the add vitamin E in feed [J].FeedIndustryMagazine,2000,21(6):29-30.(in Chinese)
[23] 庞全海,张焕杰.维生素E在动物健康及营养中的研究进展 [J].动物医学进展,2002,23(3):36-38. PANG Q H,ZHANG H J.Advances of vitamin E research in the health and nutrition of animals [J].ProgressinVeterinaryMedicine,2002,23(3):36-38.(in Chinese)
[24] 马玉涵,刘睿智,许宗革,等.精子形态与精子运动参数关系研究 [J].中华男科学杂志,2006, 12 (7):590-592. MA Y H,LIU R Z,XU Z G,et al.Relationship between sperm motility parameters and sperm morphology [J].NationalJournalofAndrology,2006,12 (7):590-592.(in Chinese)
[25] SARLOS P,BLANCO M T.Improvement of ram sperm cryopreservation protocols assessed by sperm quality parameters and heterogeneity analysis [J].Crybiology,1998,37(1):1-12.
[26] AITKEN R J,WEST K M.Analysis of the relationship between reactive oxygen species production and leukocyte infiltration in fractions of human semen separated on percoll gradients [J].IntJAndrol,1990,3:433-451.
[27] EI-DEMERDASH F M,YOUSEF M I,KEDWANY F S,et al.Cadmiuminduced changes in lipid peroxidation,blood haematology,biochemical parameters and semen quality of male rats:protective role of vitamin E and beta-carotene [J].FoodChemToxicol, 2004,42(10):1563-1571.
[28] MASSAELI H,SOBRATTEE S,PIERCE G N.The importance of lipid solubility in antioxidants and free radical generating sys-tems for determining lipoprotein peroxidation [J].FreeRadicBiolMed,1999,26:1524-1530.
[29] SONMEZ M,YUCE A,TURK G.The protective effects of melatonin and vitamin E on antioxidant enzyme activities and epididymal sperm characteristics of homocysteine treated male rats [J].ReprodToxicol, 2007,23:226-231.
[30] ROYACK G A,NGUYEN M P,TONG D C,et al.Response of human oral epithelial cells to oxidative damage and effect of bitamin E [J].OralOncol,2000,36(1):37-41.
[31] TUNC O,THOM PSON J,TREM ELLEN K.Improvement in sperm DNA quality using an oral antioxidant therapy [J].ReprodBiomOnline,2009,18(6):761-768.
(编辑 程金华)
The Protection of Vitamin E on Quality and Integrity of Mice Semeninvivo
ZHAO Xian-lin1,CAO Shao-jie2,ZHAO Chun-ping1,HAO Rui-jie1,GUI Lin-sheng1,ZAN Lin-sen1*
(1.CollegeofAnimalScienceandTechnology,NorthwestA&FUniversity,Yangling712100,China; 2.WeinanVocational&TechnicalCollege,WeinanTesting&InspectionandResearchCenterofAgriculturalProductsandFood,Weinan714000,China)
This study aimed to investigate the effects of vitamin E added in diet on sperm DNA integrity and antioxidant activities of semen in mice.50 mice divided into 5 groups were fed in the experiment,in which vitamin E was added in diet with the different content of 0(Control),4,8,12 and 16 g·kg-1,respectively.The mice were killed by cervical vertebra dislocation and dissected after 30 days when semen was obtained from epididymis and seminiferous tubules.The sperm motility,density,deformity rate and DNA integrity were detected by single cell gel electrophoresis(SCGE) assay and test kits,as well as the antioxidant activities including superoxide dismutase (SOD),glutathione peroxidase (GSH),glutathione reductase (GR) and catalase (CAT).The percentage of “grade 0” sperm in diet supplemented with 12 g·kg-1vitamin E was significantly higher than that of other treatment groups (P<0.05).The sperm motility was significantly improved (P<0.05) and the levels of GR and SOD in seminal plasma were significantly higher (P<0.05) by the supplementing with 8-16 g·kg-1vitamin E in diet than the control,respectively.The CAT activity in seminal plasma reached the highest level with supplementation of 12-16 g·kg-1vitamin E in diet,when compared to the others (P<0.05).In conclusion,we could infer that 12 g·kg-1vitamin E added could obviously improve the sperm DNA integrity and the antioxidant activities of CAT,GR,GSH and SOD in seminal plasma.
mice;vitamin E;sperm;DNA integrity
10.11843/j.issn.0366-6964.2015.02.022
2014-11-02
“十二五”国家863计划(2011AA100307-02);国家自然科学基金(31272411);新疆建设兵团重大科技计划(2014AA001-1);“十二五”国家转基因育种重大专项(2014ZX08007-002)
赵宪林(1984-),男,河南濮阳人,博士,主要从事动物遗传育种与繁殖的相关研究,E-mail:xianlin688@126.com
*通信作者:昝林森,教授,博导,E-mail:zanlinsen@163.com
Q492.6
A
0366-6964(2015)02-0332-07
