禽呼肠孤病毒蛋白质启动PI3K/Akt信号通路的分析
2015-03-22谢丽基谢芝勋谢志勤邓显文刘加波罗思思黄娇玲曾婷婷张艳芳
谢丽基,谢芝勋,黄 莉,谢志勤,邓显文,刘加波,罗思思,黄娇玲, 曾婷婷,张艳芳,王 盛
(广西壮族自治区兽医研究所 广西畜禽疫苗新技术重点实验室, 南宁 530001)
禽呼肠孤病毒蛋白质启动PI3K/Akt信号通路的分析
谢丽基,谢芝勋*,黄莉,谢志勤,邓显文,刘加波,罗思思,黄娇玲, 曾婷婷,张艳芳,王盛
(广西壮族自治区兽医研究所 广西畜禽疫苗新技术重点实验室, 南宁 530001)
旨在找出激活PI3K/Akt信号通路的禽呼肠孤病毒(ARV)蛋白质。选取ARV中潜在具有激活PI3K/Akt信号通路活性的σA、σNS、μA、μB和μNS蛋白作为研究对象,将这5个基因克隆到真核表达载体pcAGEN,成功构建重组质粒σA-pcAGEN、σNS-pcAGEN、μA-pcAGEN、μB-pcAGEN和μNS-pcAGEN。将构建的重组质粒转染Vero细胞,采用间接免疫荧光和Western blot检测目的蛋白质的表达,并通过流式细胞术和Western blot,检测转染后Vero细胞磷酸化Akt(P-Akt)的表达量。结果显示,5个目的蛋白质均得到表达。转染σA-pcAGEN或σNS-pcAGEN的Vero细胞,P-Akt的表达量明显升高,而使用PI3K特异性抑制剂LY294002则能抑制P-Akt的表达量明显升高。结果表明,ARV的σA蛋白和σNS蛋白能激活细胞的PI3K/Akt信号通路。
禽呼肠孤病毒;PI3K/Akt信号通路;蛋白质
真核细胞内存在多条信号转导通路,磷脂酰肌醇3-激酶(PI3K)信号通路在众多信号通路中发挥十分重要的作用,可通过其下游效应分子蛋白激酶B(Akt)来调控多种细胞功能,如细胞增殖与分化、抑制细胞凋亡等,病毒感染通常会干扰该信号通路。PI3K是由催化亚基p110和调节亚基p85所组成的二聚体蛋白,具有类脂激酶和蛋白激酶的双重活性[1]。研究表明,病毒蛋白质或细胞蛋白质通过PXXP(P为脯氨酸,X为任意氨基酸)或YXXXM/YXXM(Y为酪氨酸,X为任意氨基酸,M为蛋氨酸)基序与p85结合,从而激活PI3K/Akt信号通路,使磷酸化的Akt(P-Akt)表达量升高,实现抑制细胞凋亡的发生[2-7]。
L.Labrada等[8]和W.L.Shih等[9]的研究表明,禽呼肠孤病毒(avian reovirus,ARV)引起感染细胞出现细胞凋亡是发生在其感染的中后期。P.Y.Lin等[10]使用ARV感染Vero细胞后,通过Western blot检测P-Akt的表达量,从病毒的角度证实ARV感染的早期激活PI3K/Akt信号通路,从而抑制感染细胞的凋亡,以有利于ARV完成其复制周期。ARV有10个结构蛋白(λA、λB、λC、μA、μB、μBc、μBN、σA、σB、σC)和5个非结构蛋白(μNSC、μNS、σNS、和P10、P17)[11-12], ARV是通过哪一个蛋白质来启动PI3K/Akt信号通路,实现抑制感染细胞的凋亡,目前还不清楚。
本研究对ARV 15个蛋白质的氨基酸序列进行了分析,表明其中σA、σNS、μA、μB和μNS共5个蛋白质具有PXXP和YXXXM/YXXM基序(即这5个蛋白质具有潜在激活PI3K/Akt信号通路的活性),并且这些氨基酸序列在ARV不同毒株之间都是保守的。因此本课题选取这5个蛋白质作为研究对象,构建了重组质粒σA-pcAGEN、σNS-pcAGEN、μA-pcAGEN、μB-pcAGEN和μNS-pcAGEN,转染Vero细胞后,分析Vero细胞P-Akt表达量的差异,旨在找出能激活PI3K/Akt信号通路的ARV蛋白,从细胞信号转导的角度揭示ARV的分子致病机制,为寻找抗ARV药物作用靶点提供新的思路。
1 材料与方法
1.1材料
1.1.1毒株、质粒和细胞禽呼肠孤病毒S1133标准强毒株(ARV-S1133)购自中国兽医药品监察所;真核表达载体pcAGEN由美国南达科他州大学Xiu-qing Wang教授惠赠;Vero细胞由本实验室保存。1.1.2试剂及仪器TaKaRa RNA LA PCR Kit(AMV)、pMD18-T载体、限制性内切酶(XhoⅠ与NotⅠ)和T4连接酶购自宝生物工程(大连) 有限公司;Easy pure viral DNA/RNA kit、胶回收试剂盒、无内毒素质粒大量提取试剂盒购自北京TransGen Biotech公司; Lipofectamin2000购自Invitrogen公司;Alexa fluor 488标记的羊抗鸡IgY、Alexa fluor标记的羊抗兔IgG 、HRP标记的羊抗鸡IgG、HRP标记的羊抗兔IgG和Phospho-Akt 单克隆抗体购自CST公司;DMEM培养基购自GIBCO公司;胎牛血清购自Hyclone公司;Cytofix固定/破膜试剂盒购自BD公司;PI3K特异性抑制剂LY294002购自CST公司;ARV阳性血清由本实验室保存。贝克曼Navios 流式细胞仪;Invitrogen IblotTM干式Western blotting转印仪;BioRad成像系统。
1.2引物的设计与合成
根据ARV的σA、σNS、μA、μB和μNS基因序列,设计了5对引物(表1),斜体标记为酶切位点(XhoⅠ与NotⅠ),下划线处为Kozak序列。
1.3核酸提取与目的基因扩增
参照Easy pure viral DNA/RNA kit说明书,抽提ARV的RNA,使用试剂盒TaKaRa RNA LA PCR Kit进行反转录和PCR反应。
PCR反应程序:94 ℃ 5 min;94 ℃ 60 s,55 ℃ 1 min,72 ℃ 90 s,32个循环;72 ℃ 10 min。
1.4与pMD18-T载体的连接及转化
使用胶回收试剂盒对PCR产物进行回收,回收产物与pMD18-T于16 ℃连接过夜,转化到DH5α感受态细胞中。得到的阳性质粒分别命名为σA-pMD18-T、σNS-pMD18-T、μA-pMD18-T、μB-pMD18-T和μNS-pMD18-T。
1.5重组质粒的构建
使用质粒提取试剂盒提取质粒pcAGEN、σA-pMD18-T、σNS-pMD18-T、μA-pMD18-T、μB-pMD18-T和μNS-pMD18-T。 将真核表达载体pcAGEN质粒和含有目的基因的pMD18-T质粒分别用XhoⅠ与NotⅠ进行双酶切,切胶回收,使用T4连接酶连接过夜,转化到DH5α感受态细胞中。阳性克隆分别命名为σA-pcAGEN、σNS-pcAGEN、μA-pcAGEN、μB-pcAGEN和μNS-pcAGEN。阳性重组质粒送英潍捷基(上海)贸易有限公司进行测序。
表1引物序列
Table 1Primer sequence

扩增基因Gene引物名称Primername引物序列(5′⁃3′)Sequence(5′⁃3′)目的片段/bpTargetfragmentsizeσAσA⁃FσA⁃RGATGATCTCGAGGCCACCATGGCGCGTGCCATATACGACATCGCGGCCGCTTAGGCGGTAAAAGTGGCTAGAAC1248σNSσNS⁃FσNS⁃RGATGATCTCGAGGCCACCATGGACAACACCGTGCGTGTTATCGCGGCCGCTTACGCCATCCTAGCTGGAGAGAC1101μAμA⁃FμA⁃RGATGATCTCGAGGCCACCATGGCCTATCTAGCCACACCTATCGCGGCCGCTTAGTGCTCGCCTCCAACCGTCGA2196μBμB⁃FμB⁃RGATGATCTCGAGGCCACCATGGGAAACGCAACGTCTGTCATCGCGGCCGCTTACGATGGTTTGAACAACGTCTG2028μNSμNS⁃FμNS⁃RGATGATCTCGAGGCCACCATGGCGTCAACCAAGTGGGGAATCGCGGCCGCTTACAGATCATCCACCAACTCTTC1905
1.6转染细胞
参照无内毒素质粒大量提取试剂盒说明书大量提取质粒(pcAGEN、σA-pcAGEN、σNS-pcAGEN、μA-pcAGEN、μB-pcAGEN和μNS-pcAGEN),-20 ℃保存备用。
参照脂质体转染试剂盒LipofectamineTM2000的使用说明,将质粒分别转染长成单层的Vero细胞(6孔板),同时设立阴性细胞对照组。
1.7间接免疫荧光、Western blot检测目的蛋白质的表达
转染Vero 细胞2、4、6、12和24 h后,用PBST洗涤3次,用置于-20 ℃保存的冷丙酮(丙酮∶乙醇=2∶3)进行固定,500 μL·孔-1,室温作用10 min。用PBST洗涤3次,加入1∶100倍稀释的ARV阳性血清200 μL·孔-1,37 ℃作用1 h。用PBST洗涤3次,加入1∶500稀释的Alexa fluor标记的羊抗鸡IgY,200 μL·孔-1,37 ℃作用1 h。用PBST洗涤3次,加甘油缓冲液(甘油∶PBS=1∶1)100 μL·孔-1。倒置荧光显微镜下观察。
同时,收集转染后的Vero细胞,参照Z.Xie等[13]的方法,对目的蛋白质σA、σNS、μA、μB和μNS进行Western blot检测。
1.8流式细胞术和Western blot检测P-Akt的表达
由于ARV激活P-Akt是发生在ARV感染的早期,并且根据1.7的检测结果,选择转染4、6和12 h后的Vero细胞,进行流式细胞术和Western blot的检测。收集的Vero细胞,用Cytofix固定/破膜试剂盒固定细胞20 min,FACS洗涤2次,加入1∶100稀释的Phospho-Akt 单克隆抗体作用30 min,FACS洗涤2次,加入1∶500稀释的Alexa fluor标记的羊抗兔IgG 作用30 min,FACS洗涤1次,加入300 μL FACS重悬浮细胞,上流式细胞仪检测P-Akt的表达量,记录分析数据。
同时,收集转染后的Vero细胞,参照X.Wang等[14]的方法,对Vero细胞中的P-Akt进行Western blot检测。重复整个试验3次。
1.9依赖于PI3K途径的检测
按照1.6的步骤进行转染,设立σA-pcAGEN、σNS-pcAGEN、LY294002+σA-pcAGEN、LY294002+σNS-pcAGEN、pcAGEN和空白细胞对照组。转染前1 h,LY294002+σA-pcAGEN和LY294002+σNS-pcAGEN组,加入PI3K特异性抑制剂LY294002,并使终浓度为20 μmol·L-1。然后按照1.8的步骤检测P-Akt的表达。分析检测转染σA-pcAGEN和σNS-pcAGEN后,细胞P-Akt表达的升高是否依赖于PI3K的激活。
2 结 果
2.1目的基因的扩增
扩增的σA、σNS、μA、μB和μNS编码基因片段大小与预期相符(图1)。
2.2重组质粒的体外瞬时表达
间接免疫荧光和Western blot检测结果显示,转染6 h后,目的蛋白质σA、σNS、μA、μB和μNS均得到了较好的表达,而空载体pcAGEN组和阴性细胞对照组均为阴性。其中,转染6 h的间接免疫荧光检测结果见图2,Western blot检测结果见图3。

M.DL2500 bp ladder DNA marker;1.σA;2.σNS;3.μA;4.μB;5.μNS图1 σA、σNS、μA、μB和μNS编码基因的PCR扩增产物Fig.1 PCR amplified products of σA,σNS,μA,μB and μNS encoding gene
2.3流式细胞术和Western blot检测P-Akt的表达
流式细胞术和Western blot检测发现,σA-pcAGEN和σNS-pcAGEN在转染细胞4、6和12 h后,阳性率均高于阴性对照组和pcAGEN空载体组(P<0.01),表明转染σA-pcAGEN和σNS-pcAGEN的Vero细胞P-Akt的表达量,明显高于阴性对照组和pcAGEN空载体组(表2)。而μA-pcAGEN、μB-pcAGEN和μNS-pcAGEN转染细胞后,阳性率与阴性对照组和pcAGEN空载体组差异不大(P>0.05),表明P-Akt的表达量未产生明显变化。在σA-pcAGEN和σNS-pcAGEN转染的不同时间里(4、6和12 h),Vero细胞P-Akt的表达量差异不大。转染6 h的流式细胞术检测结果见图4,Western blot检测结果见图5。

A.阴性对照;B.pcAGEN;C.σA-pcAGEN;D.σNS-pcAGEN;E.μA-pcAGEN;F.μB-pcAGEN;G.μNS-pcAGENA.Negative control;B.pcAGEN;C.σA-pcAGEN;D.σNS-pcAGEN;E.μA-pcAGEN;F.μB-pcAGEN;G.μNS-pcAGEN图2 重组质粒转染Vero细胞后的瞬时表达(6 h)Fig.2 Expression of recombined plasmid on the transfected Vero cells (6 h)
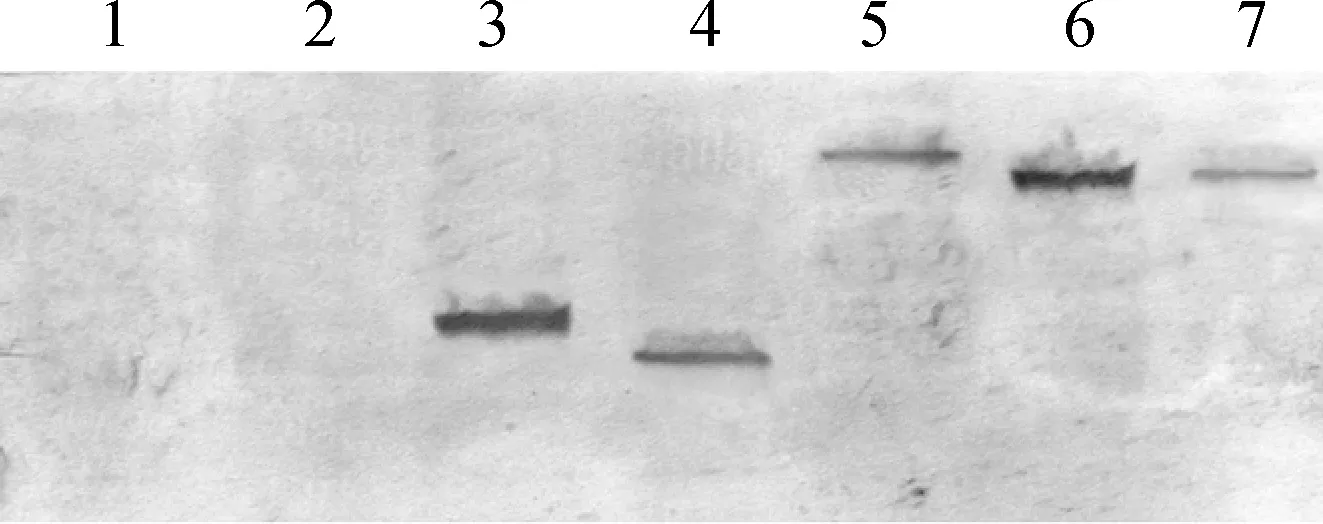
1.阴性对照;2.pcAGEN;3.σA-pcAGEN;4.σNS-pcAGEN;5.μA-pcAGEN;6.μB-pcAGEN;7.μNS-pcAGEN1.Negative control;2.pcAGEN;3.σA-pcAGEN;4.σNS-pcAGEN;5.μA-pcAGEN;6.μB-pcAGEN;7.μNS-pcAGEN图3 Western blot 检测目的蛋白质的表达 (6 h)Fig.3 Western blot analysis of the expression of the proteins(6 h)
使用流式细胞术和Western blot方法,检测转染σA-pcAGEN和σNS-pcAGEN后,细胞P-Akt表达的升高是否依赖于PI3K的激活。流式细胞术检测结果显示,转染LY294002+σA-pcAGEN和LY294002+σNS-pcAGEN的细胞,P-Akt的表达量明显少于转染σA-pcAGEN和σNS-pcAGEN的细胞(P<0.05),而与pcAGEN和空白细胞对照组差异不大(P>0.05),说明细胞P-Akt表达的升高,依赖于σA-pcAGEN和σNS-pcAGEN对PI3K激活。Western blot的检测结果与流式细胞术检测结果一致。

Table 2 FCM analysis of the P-Akt expression levels (±s) %
同一行中相同字母代表差异不显著(P>0.05),不同字母代表差异极显著(P<0.01)
Different letters in the same row means extremely significant difference between the treatments (P<0.01),same letters in the same row means no significant difference between treatments (P>0.05)

A.阴性对照;B.pcAGEN;C.σA-pcAGEN;D.σNS-pcAGEN;E.μA-pcAGEN;F.μB-pcAGEN;G.μNS-pcAGENA.Negative control;B.pcAGEN;C.σA-pcAGEN;D.σNS-pcAGEN;E.μA-pcAGEN;F.μB-pcAGEN;G.μNS-pcAGEN图4 流式细胞术检测P-Akt的表达Fig.4 FCM analysis of the P-Akt expression levels
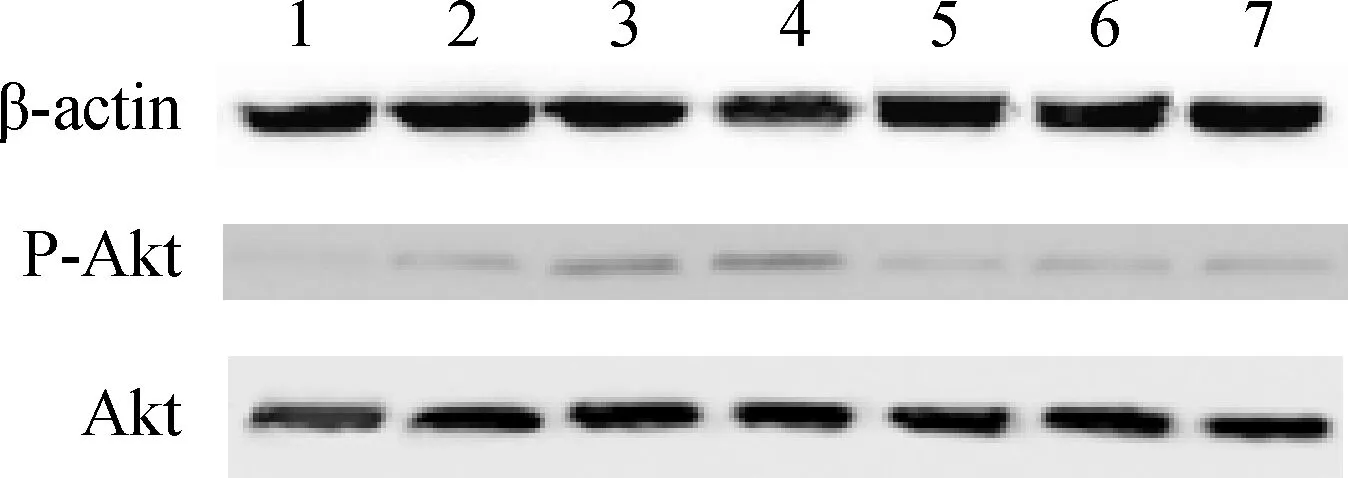
1.阴性对照;2.pcAGEN;3.σA-pcAGEN;4.σNS-pcAGEN;5.μA-pcAGEN;6.μB-pcAGEN;7.μNS-pcAGEN1.Negative control;2.pcAGEN;3.σA-pcAGEN;4.σNS-pcAGEN;5.μA-pcAGEN;6.μB-pcAGEN;7.μNS-pcAGEN图5 Western blot 检测P-Akt的表达Fig.5 Western blot analysis of the P-Akt expression levels
3 讨 论
大量的研究资料表明,当病毒侵入宿主细胞后,被感染的细胞能被宿主的免疫系统识别,并通过诱导细胞凋亡而对感染了病毒的细胞加以清除,从而限制病毒在细胞内的复制及传播[15-17]。但是在选择压力的作用下,许多病毒已经进化出某些可以逃避细胞凋亡的机制,使得病毒在宿主细胞死亡之前能完成其复制周期,这些对抗措施通常是由病毒蛋白质来介导的[6,15-17]。许多病毒通过自身的某些蛋白质与PI3K的 P85调节亚基结合,进而激活PI3K/Akt信号通路,促进P-Akt的转录表达。P-Akt 表达量的升高,可磷酸化许多信号蛋白,并通过这些蛋白质调节与细胞生存、增殖、迁移、分化和凋亡有关的多条下游信号转导通路,如通过抑制促凋亡蛋白质的活性,从而抑制凋亡刺激信号诱发的细胞凋亡,还可通过控制凋亡调节基因的表达而抑制细胞凋亡[2-7,18-19]。
目前,还未见有相关研究报道指出,ARV是通过哪一个病毒蛋白质来激活PI3K/Akt信号通路的。本研究选取ARV中潜在具有激活PI3K/Akt信号通路的σA、σNS、μA、μB和μNS蛋白作为研究对象,将这5个ARV蛋白质的编码基因克隆到真核表达载pcAGEN,成功构建了重组质粒σA-pcAGEN、σNS-pcAGEN、μA-pcAGEN、μB-pcAGEN和μNS-pcAGEN。将构建的5种重组质粒分别转染Vero细胞,通过流式细胞术和Western blot,检测转染后Vero细胞P-Akt的表达量,发现转染σA-pcAGEN或σNS-pcAGEN的Vero 细胞,P-Akt 的表达量明显升高。而转染σA-pcAGEN或σNS-pcAGEN前在细胞培养液中加入PI3K特异性抑制剂LY294002,结果显示检测到的P-Akt并没有升高,说明Akt磷酸化依赖于PI3K的激活,首次证实了ARV的σA蛋白和σNS蛋白能激活细胞内的PI3K/Akt信号通路。
PI3K/Akt信号转导通路的激活可抑制宿主细胞的凋亡,以有利于病毒的复制[2-7,14,18-19]。与许多病毒相似,PI3K/Akt信号转导通路的激活与ARV的复制有密切关系[10],因此,有望通过控制ARV σA蛋白和σNS蛋白的表达,来调节PI3K/Akt信号转导通路进而抑制ARV的复制,从而发现新的药物靶点,为ARV的治疗提供新的方向和思路。同时,本研究从细胞信号转导的角度,揭示了ARV的分子致病机制,也为进一步探索针对ARV的有效防治措施提供理论依据。
Y.Shin等[6]对甲型流感病NS1蛋白的研究表明,NS1蛋白同时通过PXXP和YXXXM位点与p85结合,从而激活了PI3K/Akt信号途径。人乳头瘤病毒则通过YXXM位点来激活PI3K/Akt信号途径[7]。ARV的σA和σNS蛋白是否与这些病毒一样,是通过PXXP或YXXXM/YXXM基序与P85结合,从而激活PI3K/Akt信号通路,使磷酸化的Akt(P-Akt)表达量升高,实现抑制细胞凋亡的,还有待进一步的研究。
本研究将构建的μA-pcAGEN、μB-pcAGEN和μNS-pcAGEN重组质粒,转染Vero细胞后,采用间接免疫荧光和Western blot检测,证实μA、μB和μNS这3个目的蛋白质,与σA和σNS一样均得到了很好的表达,但在转染后的检测中却发现,其转染的细胞P-Akt的表达量并没有明显改变,推测这3个蛋白质与PI3K/Akt信号通路之间并没有直接的激活作用。μA、μB和μNS这3个蛋白质以及ARV的其他蛋白质是否有增强或抑制σA和σNS激活PI3K/Akt信号通路的作用,目前还不清楚。W.L.Shih等[9]构建表达ARVσC蛋白的重组表达质粒σC-pcDNA3.1,σC-pcDNA3.1转染Vero细胞后发现,σC蛋白可诱导细胞发生凋亡。σC蛋白的功能,与ARV σA和σNS蛋白的功能(抑制细胞凋亡)相反,σC蛋白的表达是否会抑制σA和σNS蛋白激活PI3K/Akt信号通路,目前也还不清楚。这些问题还有待进一步的研究。
4 结 论
ARV的σA蛋白和σNS蛋白能激活PI3K/Akt信号通路,使细胞P-Akt的表达量增高。
[1]VIVANCO I,SAWYERS C L.The phosphatidylinositol 3-Kinase AKT pathway in human cancer[J].NatRevCancer,2002,2(7):489-501.
[2]KAY B K,WILLIAMSON M P,SUDOL M.The importance of being proline:the interaction of proline-rich motifs in signaling proteins with their cognate domains[J].FASEBJ,2000,14(2):231-241.
[3]PAWSON T.Protein modules and signalling networks[J].Nature,1995,373(6515):573-580.
[4]STREET A,MACDONALD A,CROWDER K,et al.The Hepatitis C virus NS5A protein activates a phosphoinositide 3-kinase-dependent survival signaling cascade[J].JBiolChem,2004,279(13):12232-12241.
[5]SONGYANG Z,SHOELSON S E,CHAUDHURI M,et al.SH2 domains recognize specific phosphopeptide sequences[J].Cell,1993,72(5):767-778.
[6]SHIN Y,LIU Q,TIKOO S K,et al.Influenza A virus NS1 protein activates the phosphatidylinositol 3-kinase(PI3K)/Akt pathway by direct interaction with the p85 subunit of PI3K[J].JGenVirol,2007,88(Pt 1):13-18.
[7]ZHANG B,SPANDAU D F,ROMAN A.E5 protein of human papillomavirus type 16 protects human foreskin keratinocytes from UV B-irradiation-induced apoptosis[J].JVirol,2002,76(1):220-231.
[8]LABRADA L,BODELN G,VIUELA J,et al.Avian reoviruses cause apoptosis in cultured cells:viral uncoating,but not viral gene expression,is required for apoptosis induction[J].JVirol,2002,76(16):7932-7941.
[9]SHIH W L,HSU H W,LIAO M H,et al.Avian reovirus sigmaC protein induces apoptosis in cultured cells[J].Virology,2004,321(1):65-74.
[10]LIN P Y,LIU H J,LIAO M H,et al.Activation of PI 3-kinase/Akt/NF-κB and Stat3 signaling by avian reovirus S1133 in the early stages of infection results in an inflammatory response and delayed apoptosis[J].Virology,2010,400(1):104-114.
[11]LIU H J,LEE L H,HSU H W,et al.Molecular evolution of avian reovirus :evidence for genetic diversity and reassortment of the S-class genome segments and multiple cocirculating lineages[J].Virology,2003,314(1):336-349.
[12]TENG L,XIE Z,XIE L,et al.Sequencing and phylogenetic analysis of an avian reovirus genome[J].VirusGenes,2014,48(2):381-386.
[13]XIE Z,QIN C,XIE L,et al.Recombinant protein-based ELISA for detection and differentiation of antibodies against avian reovirus in vaccinated and non-vaccinated chickens[J].JVirolMethods, 2010,165(1):108-111.
[14]WANG X,ZHANG H,ABEL A M,et al.Role of phosphatidylinositol 3-kinase(PI3K) and Akt1 kinase in porcine reproductive and respiratory syndrome virus(PRRSV) replication[J].ArchVirol,2014,159(8):2091-2096.
[15]BARBER G N.Host defense,viurses and apoptosis[J].CellDeathDiffer,2001,8(2):113-126.
[16]BENEDICT C A,NORRIS P S,WARE C F.To kill or be killed:viral evasion of apoptosis[J].NatImmunol,2002,3(11):1013-1018.
[17]HAY S,KANNOURAKIS G.A time to kill:viral manipulation of the cell death program[J].JGenVirol,2002,83(Pt 7):1547-1564.
[18]KRAJCSI P,WOLD W S.Viral proteins that regulate cellular signalling[J].JGenVirol,1998,79(Pt 6):1323-1335.
[19]D’ANGLEMONT DE TASSIGNY A,BERDEAUX A,SOUKTANI R,et al.The volume-sensitive chloride channel inhibitors prevent both contractile dysfunction and apoptosis induced by doxorubicin through PI3kinase,Akt and Erk 1/2[J].EurJHeartFail,2008,10(1):39-46.
(编辑白永平)
The Study of the Activation of PI3K/Akt Pathway by the Protein of Avian Reovirus
XIE Li-ji,XIE Zhi-xun*,HUANG Li,XIE Zhi-qin,DENG Xian-wen,LIU Jia-bo,LUO Si-si, HUANG Jiao-ling,ZENG Ting-ting,ZHANG Yan-fang,WANG Sheng
(GuangxiVeterinaryResearchInstitute,GuangxiKeyLaboratoryofAnimalVaccinesandDiagnostics,Nanning530001,China)
This study was conducted to find out the avian reovirus (ARV) proteins which can activate the phosphatidylinositol 3-Kinase-dependent Akt(PI3K/Akt) pathway.According to the analysis of amino acid sequence of ARV proteins,the σA,σNS,μA,μB and μNS were selected as the putative proteins which mediated the activation of PI3K/Akt pathway.Reconbinant plasmids,σA-pcAGEN,σNS-pcAGEN,μA-pcAGEN,μB-pcAGEN and μNS-pcAGEN were constructed and transfected into Vero cells,and the expression of the target genes were identified by immunofluorescence test and Western blot.The phosphorylated Akt (P-Akt) profile of transfected cells were examined by flow cytometry and Western blot.The results showed that σA,σNS,μA,μB and μNS genes were expressed in the Vero cells,and the expression of P-Akt of σA-pcAGEN and σNS-pcAGEN groups increased markedly.The PI3K inhibitor LY294002 could inhibit the expression of the P-Akt of σA-pcAGEN and σNS-pcAGEN groups.The results indicate that σA and σNS protein could activate the PI3K/Akt pathway.
ARV;PI3K/Akt pathway; protein
10.11843/j.issn.0366-6964.2015.09.017
2014-12-19
国家自然科学基金项目(31160512);广西特聘专家专项(2011B020);广西科技重大专项(1222003-2-4)
谢丽基(1981-),女,广西灵山人,副研究员,硕士,主要从事动物传染病病原分子生物学研究, Tel:0771-3120371, E-mail: xie3120371@126.com
*通信作者:谢芝勋, E-mail: xiezhixun@126.com
S852.659.4
A
0366-6964(2015)09-1613-07
