爪蟾卵母细胞抽提物可诱导牛胎儿成纤维细胞发生部分重编程
2015-03-22杜卫华范宗兴王皓宇郝海生赵学明朱化彬
杜卫华,范宗兴,王皓宇,郝海生,刘 岩,赵学明,秦 彤,朱化彬
(中国农业科学院北京畜牧兽医研究所,北京 100193)
爪蟾卵母细胞抽提物可诱导牛胎儿成纤维细胞发生部分重编程
杜卫华,范宗兴,王皓宇,郝海生,刘 岩,赵学明,秦 彤,朱化彬*
(中国农业科学院北京畜牧兽医研究所,北京 100193)
应用非洲爪蟾卵母细胞抽提物处理和牛胎儿成纤维细胞(Japanese Black cattle fetal fibroblasts,JBCFF),观察处理前后细胞的形态学变化,同时用免疫荧光染色法检测组蛋白的乙酰化状态和OCT4蛋白的表达,并对其多能性标志基因的mRNA表达水平进行定量分析。结果表明,与未处理细胞相比,经抽提物处理和牛胎儿成纤维细胞组蛋白H3K9乙酰化程度与未处理组无显著差异;培养5~6 d后细胞聚集形成“克隆簇”中碱性磷酸酶和Oct4蛋白染色阳性;同时也检测到Oct4和Nanog基因在其中的表达,而Sox2基因未见表达;且Oct4、Nanog基因表达量随处理后细胞培养时间的延长(4、5、6 d)而呈依次上升趋势。可见,爪蟾卵母细胞抽提物能诱导和牛胎儿成纤维细胞发生部分重编程,恢复其发育全能性,这对牛诱导性干细胞制备方法的探索和体细胞克隆及转基因克隆牛效率的提高具有一定的借鉴意义。
爪蟾;卵母细胞抽提物;牛胎儿成纤维细胞;重编程;多能性基因
细胞抽提物诱导是近年来发展迅速的一种体细胞重编程方法,其利用卵母细胞、干细胞或不同类型细胞的提取物诱导体细胞,使其发生重编程,恢复部分全能性或表现其他细胞类型的典型特征[1]。N.Kikyo等[2]用非洲爪蟾(Xenopuslaevis)卵母细胞抽提物处理爪蟾上皮细胞,发现体细胞的蛋白组成发生变化,以TATA盒结合蛋白为代表的一类蛋白从细胞中擦除,以OCR2为代表的抽提物特有蛋白整合入体细胞内,自此开创了抽提物诱导体细胞重编程研究的先河。用非洲爪蟾卵母细胞抽提物处理人239T细胞[3]、猪[4]和小鼠[5-6]胎儿成纤维细胞时,均发现多能性标志基因Oct4和Sox2表达,爪蟾特有的组蛋白B4和核纤层蛋白III整合到体细胞中,体细胞本身的组蛋白H3K9去乙酰化,并形成类胚胎干细胞样的“克隆簇”,发生部分重编程。另外,蝾螈卵母细胞抽提物也能使体细胞发生同样变化,具有去分化恢复多能性的趋势[7];西伯利亚鲟卵母细胞抽提物处理能诱导猪胎儿成纤维细胞中H3K9的甲基化水平降低和组蛋白乙酰化水平升高[8]。Y.Liu等[9]研究发现爪蟾卵母细胞抽提物诱导供体细胞重编程后形成的“克隆簇”细胞,且该细胞显著提高克隆胚胎的囊胚发育率[10]。来自两栖动物卵母细胞或激活后牛卵母细胞的抽提物可诱导乳腺癌细胞重编程,引起肿瘤抑制基因启动子去甲基化,使沉默基因重新表达,为癌症的治疗提供了新思路[11-12]。
哺乳动物卵母细胞也常用于同种属间的重编程研究,小鼠卵母细胞抽提物处理体细胞后,细胞核重塑,H3K9完全去甲基化,H3K9、H3K14部分乙酰化;且重编程后的体细胞有助于后续克隆胚胎的发育[13]。猪GV期卵母细胞抽提物可诱导激活多能性标志基因的表达,细胞呈“克隆样”生长,并能在体内或体外发育为3个原始胚层[14];而MⅡ卵母细胞抽提物则引起H3K9去乙酰化和TATA框结合蛋白的消失,却没有明显的形态学变化,说明GV期和MⅡ期卵母细胞都具有诱导体细胞重编程能力,但其中不同的因子发挥不同的作用[15]。抽提物诱导重编程方法操作简便,不仅可以获得所需类型的细胞,而且抽提物作为脱离细胞的独立成分,更宜于重编程相关因子的识别,探求重编程的机制。
目前抽提物诱导体细胞重编程的机制尚未明确,而对大家畜,牛体细胞重编程的研究仍鲜有报道。本研究利用非洲爪蟾卵母细胞抽提物与和牛胎儿成纤维细胞共孵育,诱导和牛胎儿成纤维细胞重编程,探索牛iPS细胞的重编程方法,为体细胞克隆牛和转基因牛生产效率的提高奠定基础。
1 材料与方法
1.1 材料
性成熟非洲爪蟾来源于中国科学院遗传发育研究所动物实验中心。
1.2 和牛胎儿成纤维细胞的建立和培养
取妊娠40日龄的和牛胎儿,去头尾、四肢和内脏后将躯干组织采用贴壁法建立成纤维细胞系。将组织块剪切成碎沫,移至培养瓶底壁并分散均匀,倒置培养瓶,旋紧瓶盖倒置于37.5 ℃的CO2培养箱中6~8 h;加入常规培养液(含20% FBS的DMEM),轻轻翻转培养瓶,让培养液浸润组织块,置培养箱培养;当有铺满瓶底50%以上成纤维细胞爬出,用0.25%胰蛋白酶(0.02% EDTA)消化传代或冻存。
1.3 爪蟾卵母细胞抽提物的提取
选择性成熟雌性非洲爪蟾,背部淋巴囊处浅表注射PMSG(1 IU·μL-1)100 μL,提取抽提物前1 d,同一位置注射HCG(5 IU·μL-1)100 μL,16~22 h后,收集卵母细胞。挑选轮廓清晰、形态统一的卵母细胞,添加2%半胱氨酸,去除卵胶膜;移除胶膜液,用0.25×MMR漂洗3次,1×MMR(100 mmol·L-1NaCl+2 mmol·L-1KCl+1 mmol·L-1MgSO4+ 2 mmol·L-1CaCl2+0.1 mmol·L-1EDTA+5 mmol·L-1Hepes)漂洗1次;细胞裂解液(2.5 mmol·L-1MgCl2+ 50 mmol·L-1KCl+10 mmol·L-1Hepes+250 mmol·L-1Sucrose)漂洗2次后,将卵移入含1 mmol·L-1二巯基苏糖醇和1 mmol·L-1蛋白酶抑制剂的细胞裂解液中;800 r·min-1离心10~15 s,移去裂解液;添加抑酶肽、亮肽素、蛋白酶抑制剂(终浓度5 μg·mL-1)到卵顶部;4 ℃、10 000 r·min-1离心15 min后,液体分为3层,抽取中间层粗提物至预冷的离心管中;再次添加抑酶肽、亮肽素、蛋白酶抑制剂到卵顶部(终浓度5 μg·mL-1),4 ℃、10 000 r·min-1离心15 min,同样移出抽提物至预冷离心管,添加甘油,4 ℃混匀后分装,液氮冷冻,保存于-80 ℃备用。
1.4 爪蟾卵母细胞抽提物处理JBCFF
将生长良好的第4代JBCFF接种于24孔板中,至50%~60%汇片时,用预冷的PBS清洗后添加浓度为7 μg·mL-1的digitonin溶液200 μL·孔-1,迅速冰上作用2 min;预冷的PBS清洗后,添加包含ATP-再生体系的爪蟾卵母细胞抽提物250 μL·孔-1,23 ℃条件下与细胞共孵育1 h;吸去抽提物,加入含2 mmol·L-1CaCl2的常规培养液,孵育2 h后移除封闭液,分别于常规培养液(DMEM+10% FBS)或干细胞培养液(0.1 mmol·L-12-巯基乙醇+1% MEM/NEAA+1 mmol·L-1谷氨酰胺+0.3 μmol·L-1核苷酸+103IU·mL-1LIF+5% FBS+10% 血清替代物+1% 青链霉素+ DMEM)中继续培养,隔天换液以清除死细胞。
1.5 组蛋白H3K9和Oct4免疫荧光染色
经过抽提物处理和未处理的JBCFF(同一来源、同一代数)分别于干细胞培养液中孵育24 h后,分别进行其组蛋白H3K9和Oct4免疫荧光染色。吸除培养液,加入4%多聚甲醛,室温固定20 min;清洗3次,含0.5% TritonX-100的PBS与细胞共孵育30 min;10%山羊血清封闭细胞30 min后,于兔抗H3K9的多抗(1∶200稀释于含1% BSA的PBS)中室温孵育1 h;清洗后,室温下于FITC标记的山羊抗兔IgG(1∶200稀释于1% BSA的PBS)避光放置1 h;然后用10 μg·mL-1的PI室温作用5 min,在荧光显微镜下观察。试验重复3次,每次随机选取3个视野拍照,并用Image-pro Plus软件分析结果。Oct4蛋白的免疫荧光染色,一抗为兔抗Oct4多抗(1∶100稀释于含1% BSA的PBS)其余则与H3K9染色相同。
1.6 碱性磷酸酶染色
经过抽提物处理和未处理的JBCFF(同一来源、同一代数),分别置于常规培养液和干细胞培养液中培养6~7 d后,进行碱性磷酸酶染色。细胞经PBS清洗后,加入4%多聚甲醛,室温固定30 min;清洗后加入500 μL BCIP/NBT染色工作液,室温避光染色30 min;移除染色液,PBS清洗2~3次,镜下观察,拍照。
1.7 抽提物处理细胞中多能性相关基因的PCR和qPCR检测
以抽提物处理后6 d形成“克隆簇”的细胞为试验组,抽提物处理后用常规培养液培养的细胞、未处理的JBCFF(同一来源、同一代数)分别置于常规培养液和干细胞培养液中培养6 d后,均作为对照组进行PCR反应。多能性标志基因Oct4、Sox2、Nanog为目标基因,GAPDH为内参基因。参考GenBank中牛(Bostaurus)Oct4基因序列(NM_174580.2)、Sox2基因序列(NM_001105463.1)、Nanog基因序列(NM_001025344.1)和GAPDH基因序列(NM_001034034),采用primer 5.0软件设计引物(表1)。采用20 μL扩增体系,PCR条件为94 ℃预变性5 min;94 ℃变性30 s,56 ℃退火30 s,72 ℃延伸30 s,30个循环。2%琼脂糖凝胶检测PCR产物。
表1 引物序列
Table 1 Primer sequences
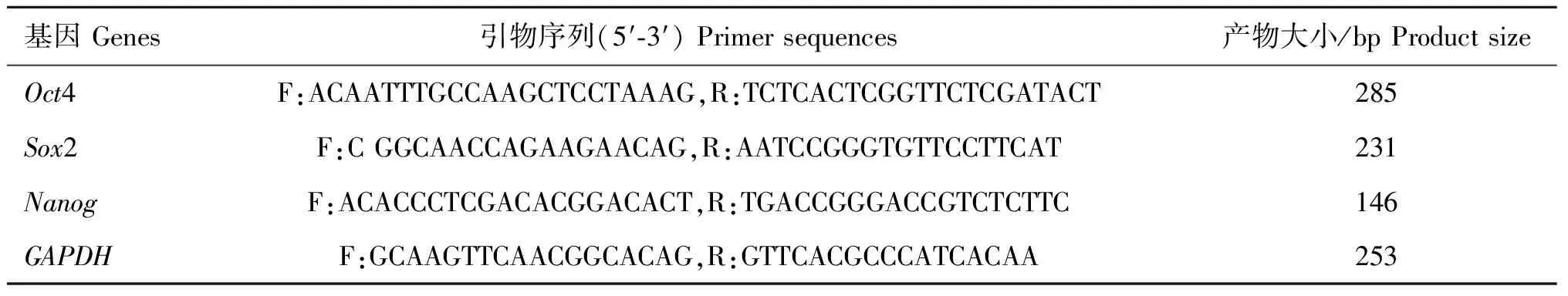
基因Genes引物序列(5′⁃3′)Primersequences产物大小/bpProductsizeOct4F:ACAATTTGCCAAGCTCCTAAAG,R:TCTCACTCGGTTCTCGATACT285Sox2F:CGGCAACCAGAAGAACAG,R:AATCCGGGTGTTCCTTCAT231NanogF:ACACCCTCGACACGGACACT,R:TGACCGGGACCGTCTCTTC146GAPDHF:GCAAGTTCAACGGCACAG,R:GTTCACGCCCATCACAA253
选择抽提物处理4、5、6 d的JBCFF进行多能性基因Oct4和Nanog实时荧光定量PCR检测。分别提取细胞总RNA,反转录为cDNA,以cDNA为模板进行梯度稀释后选定最佳模板浓度,以牛GAPDH基因为内参,进行qPCR,测定Oct4、Nanog表达水平。按照ABI定量试剂说明书,反应体系20 μL,反应条件为95 ℃预变性30 s,95 ℃变性5 s ,60 ℃退火34 s,72 ℃延伸30 s, 40个循环。利用7500 System SDS软件(V 1.4.0),根据2-ΔΔCT方法,对定量结果进行分析。
2 结 果
2.1 JBCFF系的建立和培养
采用组织块贴壁法建立JBCFF系,组织块贴壁1~2 d后,可见零星细胞从组织块周边爬出(图1A),4~5 d后大量成纤维细胞长出,同时伴随有少量上皮细胞出现,6~7 d细胞至70%~80%汇合时传代。根据成纤维细胞与上皮细胞对胰蛋白酶的敏感性不同,经传代培养逐渐纯化,获得纯化的JBCFF(图1B)。
2.2 爪蟾卵母细胞抽提物处理后JBCFF形态变化
选择7 μg·mL-1digitonin处理JBCFF(图2A),透化后细胞表面可见大量黑点(图2B),抽提物处理后细胞稍有回缩,但形态正常,肉眼可见20%~30%细胞死亡或脱落(图2C)。继续培养2~3d后,细胞状态恢复,开始快速增殖,4~5 d细胞开始聚集生长,6~7 d细胞形成“克隆簇”(图2D)。对照组,未处理细胞(同一来源、同一代数)在干细胞培养液中(图2E)和常规培养液培养(图2G)后,以及抽提物处理细胞经常规培养液培养后(图2F),均正常生长,未见细胞聚集,成簇生长。
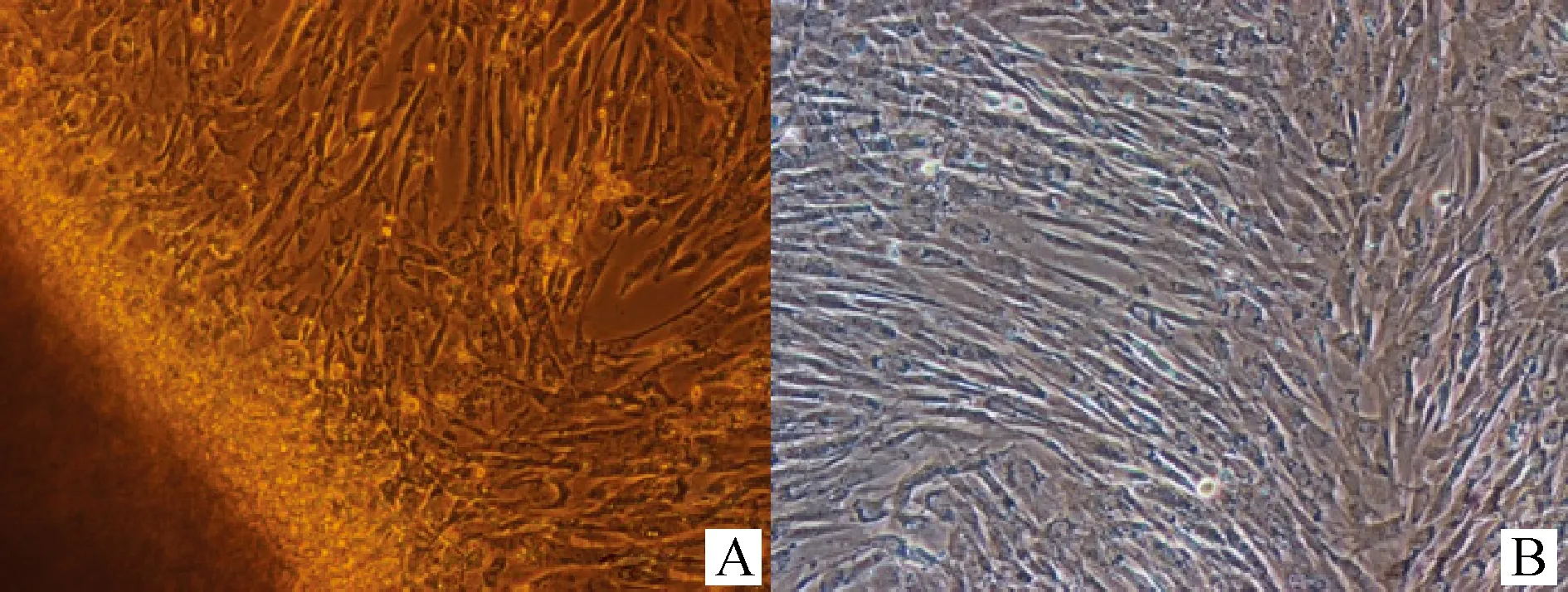
A.组织块贴壁长出的原代细胞;B.第5代和牛胎儿成纤维细胞A.Primary cells around the bovine fetal tissue;B.F5 JBCFF图1 和牛胎儿成纤维细胞(JBCFF) 100×Fig.1 The construction of Japanese Black cattle fetal fibroblasts 100×
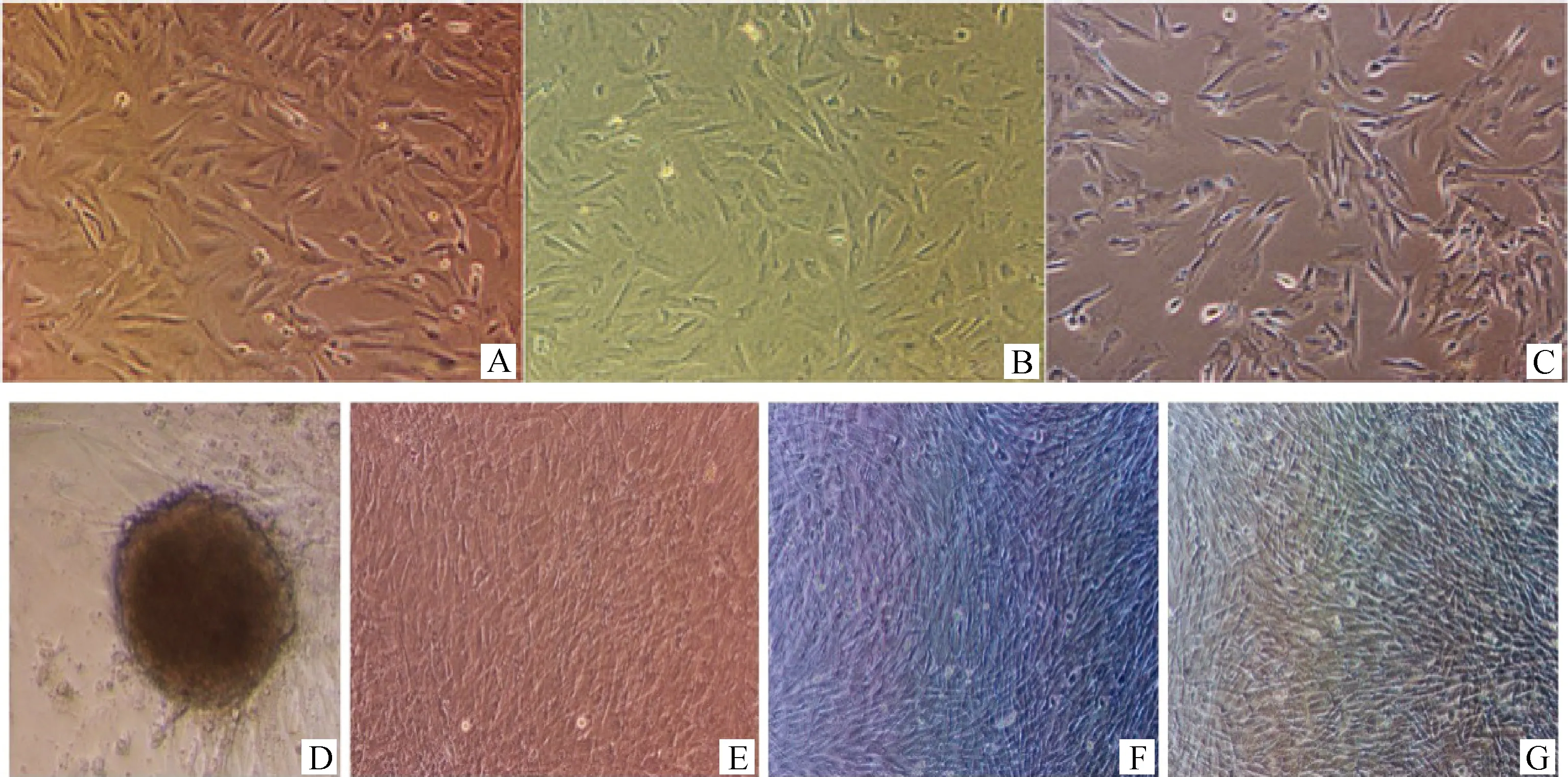
A.抽提物处理前细胞;B.抽提物处理中细胞;C.抽提物处理后细胞;D.抽提物处理后6 d 细胞形成“克隆簇”;E.干细胞培养液培养6 d的未处理细胞;F.常规培养液培养6 d的抽提物处理细胞;G.常规培养液培养6 d的未处理细胞A.JBCFF before extracts treatment;B.JBCFF during the treatment with extracts;C.JBCFF after extracts treatment;D.Cells colony formed 6 days after extracts treatment;E.JBCFF without extracts treatment cultured with stem cell medium for 6 days as control;F.JBCFF treated with extracts and cultured with common cell medium for 6 days as control;G.JBCFF without extracts treatment cultured with common cell medium for 6 days as control图2 爪蟾卵母细胞抽提物处理的JBCFF 100×Fig.2 JBCFF treated with Xenopus laevis oocytes extracts 100×
2.3 爪蟾卵母细胞抽提物处理后JBCFF的组蛋白H3K9免疫荧光染色
组蛋白H3K9染色结果表明(图3),经抽提物处理后的JBCFF在干细胞培养液中培养24 h后,其组蛋白H3K9乙酰化程度(H3K9相对表达量(263±0.26))低于未经抽提物处理的对照组(295±1.31),但二者差异不显著(P>0.05)。
2.4 抽提物处理后JBCFF的碱性磷酸酶染色
抽提物处理6 d后,JBCFF成簇生长(图4A);碱性磷酸酶染色后“克隆簇”呈阳性(图4B),而其它未形成克隆簇的细胞几乎没有着色,呈阴性。而3个对照组细胞(干细胞培养液培养的抽提物未处理细胞、常规培养液培养的抽提物处理和未处理细胞),则染色呈阴性(图4C、D、E)。
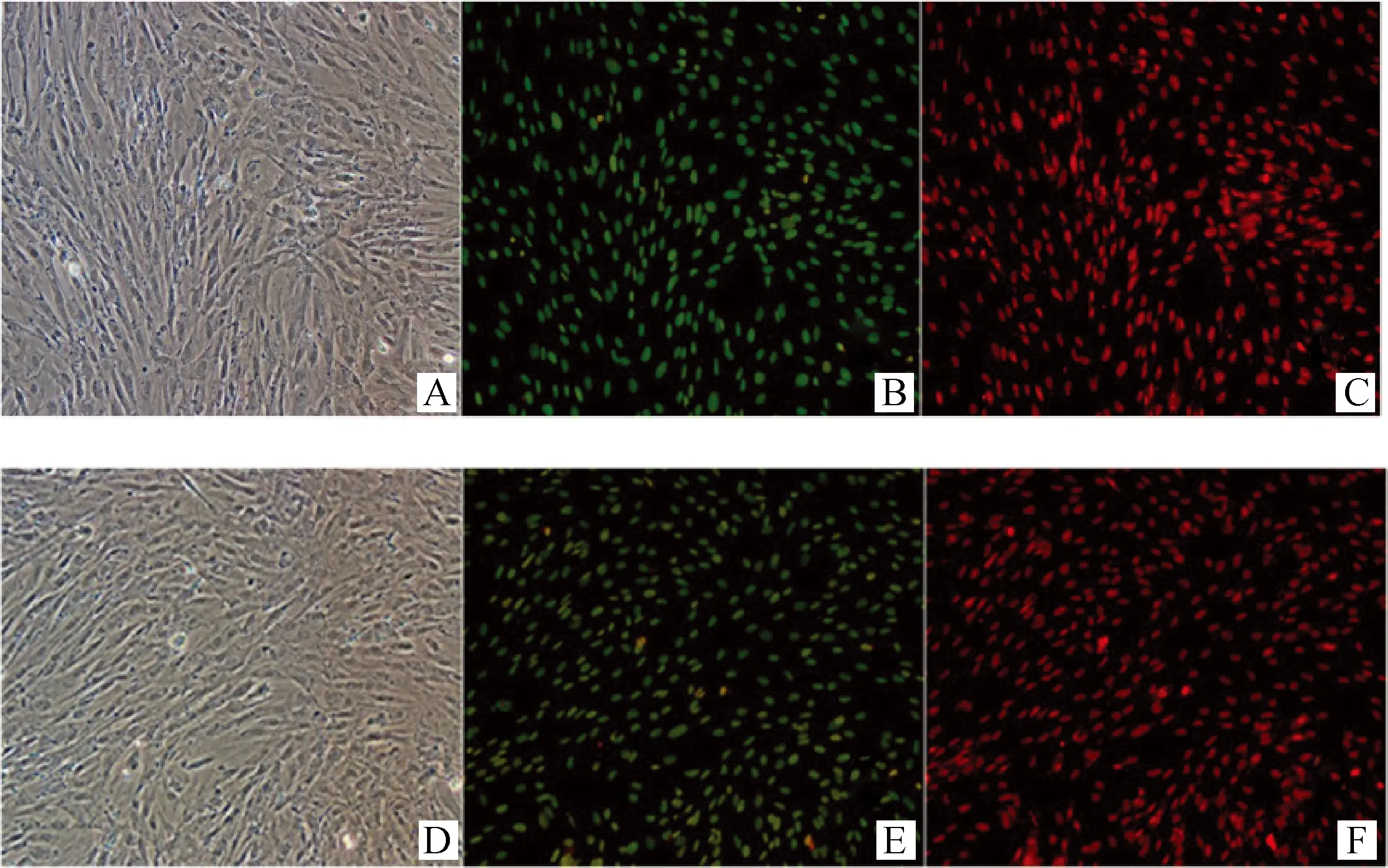
A.经抽提物处理的JBCFF;B.经抽提物处理JBCFF的组蛋白H3K9荧光染色;C.经抽提物处理的JBCFF细胞核PI染色;D.普通光下的抽提物未处理的JBCFF;E.抽提物未处理JBCFF的组蛋白H3K9荧光染色;F.抽提物未处理的JBCFF细胞核PI染色A.JBCFF treated with extracts;B.H3K9 immunofluorescence staining of JBCFF treated with extracts;C.PI staining of JBCFF treated with extracts;D.JBCFF untreated with extracts;E.H3K9 immunofluorescence staining of JBCFF without treatment extracts;F.PI staining of JBCFF without treatment of extracts图3 JBCFF的H3K9免疫荧光染色100×Fig.3 JBCFF with H3K9 Immunofluorescence 100×
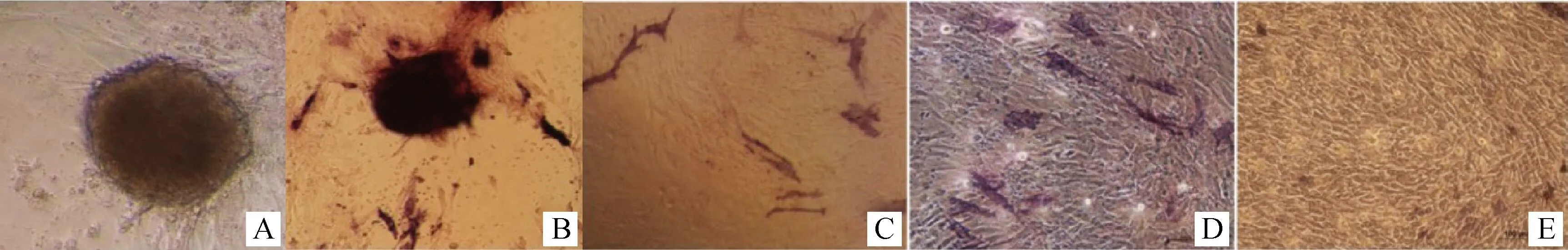
A.抽提物处理后6 d细胞形成“克隆簇”;B.“克隆簇”细胞碱性磷酸酶染色阳性;C.干细胞培养液培养的抽提物未处理细胞碱性磷酸酶阴性;D.常规培养液培养的抽提物处理细胞碱性磷酸酶染色阴性;E.常规培养液培养的抽提物未处理细胞碱性磷酸酶阴性A.JBCFF colony formed 6 days after extracts treatment;B.Positive reaction of cell colony with alkaline phosphatase staining;C.Negative reaction of JBCFF without extracts treatment cultured with stem cell medium for 6 days as control;D.Negative reaction of JBCFF treated with extracts and cultured with common cell medium for 6 days as control;E.Negative reaction of JBCFF without extracts treatment cultured with common cell medium for 6 days as control图4 JBCFF碱性磷酸酶染色100×Fig.4 JBCFF stained with alkaline phosphatase 100×
2.5 Oct4蛋白的表达分析
抽提物处理6 d后,和牛胎儿成纤维细胞成簇生长(图5A);Oct4免疫荧光染色发现,“克隆簇”呈绿色,染色呈阳性(图5B),而其它未形成克隆簇细胞没有着色,染色呈阴性(图5D、E)。经干细胞培养液和常规培养液培养的同一来源、同时培养的未处理细胞Oct4免疫荧光染色未着色,染色结果呈阴性。
2.6 爪蟾卵母细胞抽提物处理细胞中多能性相关基因的表达检测
采用RT-PCR检测试验组和对照组细胞中多能性标志基因Oct4、Sox2、Nanog的表达情况,结果显示,抽提物处理后6 d形成“克隆簇”的细胞有Oct4、Nanog基因表达,Sox2基因未见表达,对照组均无上述基因表达(图6),说明抽提物处理和牛胎儿成纤维细胞经过重编程,具有干细胞的多能性。
收集抽提物处理后4、5和6 d的细胞,采用定量PCR检测Oct4、Nanog基因的表达水平,结果表明,处理后5 d的细胞中Oct4表达量显著高于处理后4 d细胞(P<0.05,图8);Nanog基因表达量也升高,但差异不显著(P>0.05,表2)。而处理后6 d细胞中Oct4和Nanog基因的表达量均极显著高于其它两组(P<0.01,表2)。
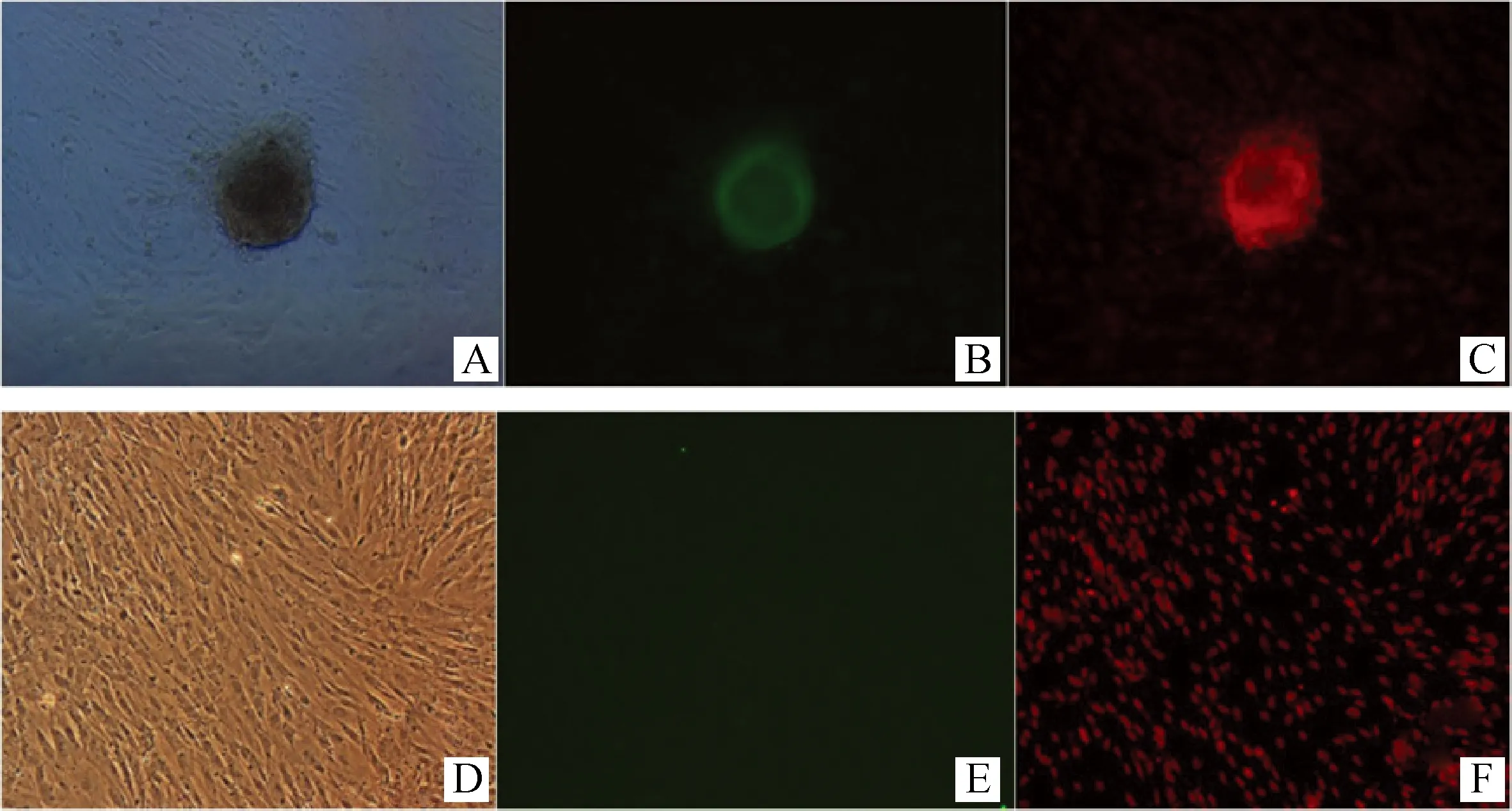
A.抽提物处理6 d细胞形成“克隆簇”;B.“克隆簇”细胞中Oct4免疫荧光染色阳性;C.“克隆簇”细胞的细胞核PI染色;D.未处理细胞6 d未形成“克隆簇”;E.非“克隆簇”细胞中Oct4免疫荧光染色阴性;F.非“克隆簇”细胞的细胞核PI染色A.JBCFF colony formed 6 days after extracts treatment;B.Oct4 immunofluorescence staining of JBCFF treated with extracts;C.PI staining of JBCFF treated with extracts;D.JBCFF untreated with extracts without formation of colony;E.Oct4 immunofluorescence staining of JBCFF without colony formation;F.PI staining of JBCFF without colony formation图5 胎儿成纤维细胞Oct4免疫荧光染色100×Fig.5 JBCFF stained with Oct4 immunofluorescence 100×
表2 抽提物处理后不同天数的JBCFF中Oct4和Nanog基因表达
Table 2 Expression level ofOct4 andNanoggenes in JBCFF treated with extracts at different days

培养天数/dDaysOct4Nanog41.8±2.01a0.9±0.64a54.3±1.58b1.2±2.17a6145.1±1.24A16.2±3.21A
a、b.P<0.05;A.P<0.01
3 讨 论
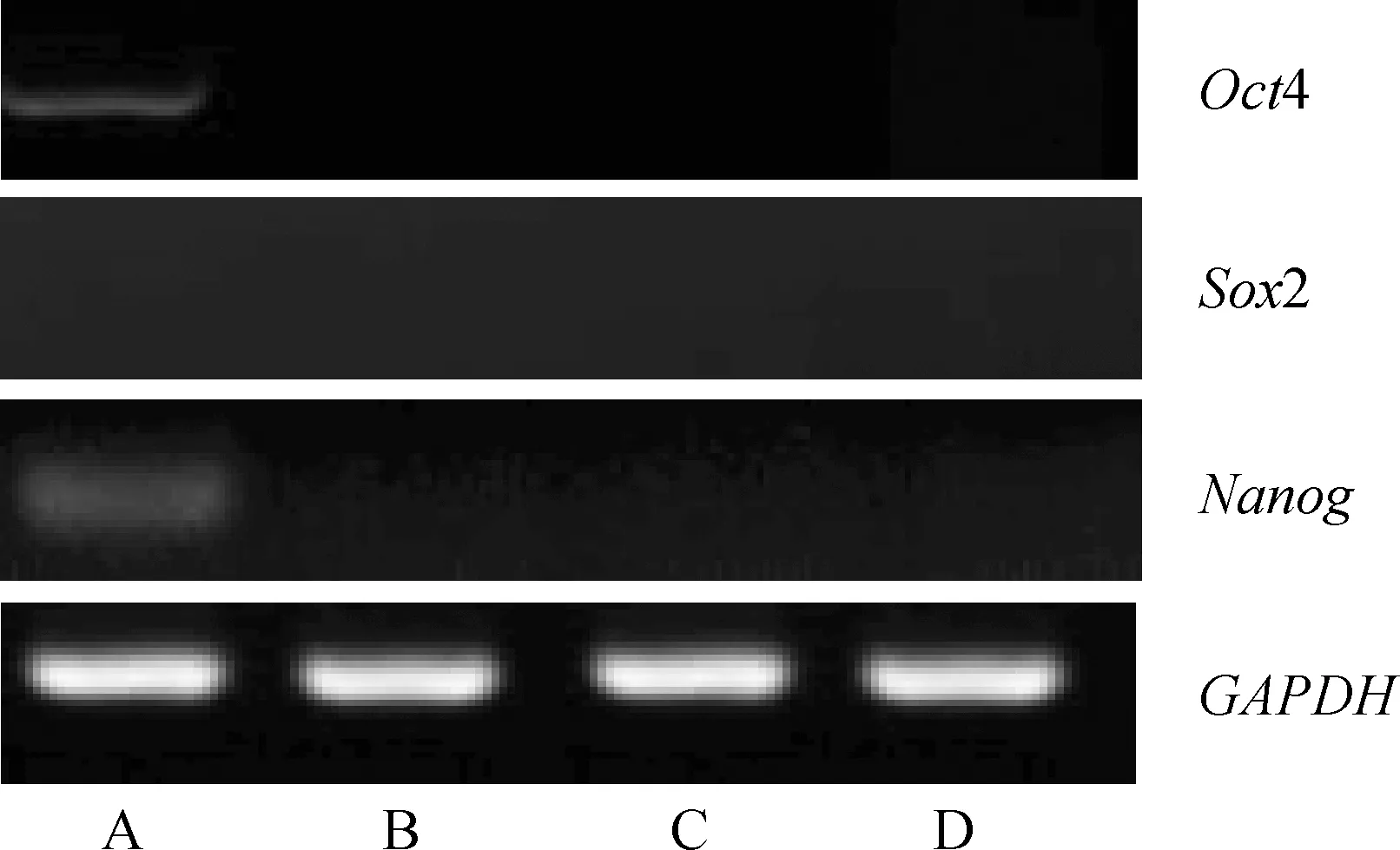
A.抽提物处理后6 d形成“克隆簇”细胞;B.常规培养液培养的抽提物处理细胞;C.干细胞培养液培养的抽提物未处理细胞;D.常规培养液培养的抽提物未处理细胞A.JBCFF colony formed 6 days after extracts treatment;B.JBCFF treated with extracts and cultured with common cell medium for 6 days as control;C.JBCFF without extracts treatment cultured with stem cell medium for 6 days as control;D.JBCFF without extracts treatment cultured with common cell medium for 6 days as control图6 抽提物处理细胞中Oct4和Nanog基因的RT-PCR检测Fig.6 Expression analysis of Oct4 and Nanog genes in JBCFF treated with extracts by RT-PCR
体细胞重编程是指通过一定方法将已分化的体细胞逆转回原始多能状态,获得的多能性细胞有巨大的分化潜力,在再生医学研究方面有巨大的应用前景。研究表明,卵母细胞或干细胞中存在某些因子可诱导体细胞恢复发育全能性,因此其提取物可用于体外诱导体细胞发生重编程[16]。细胞抽提物早期用于真核生物DNA复制、染色质重塑研究[17-19],而现在抽提物被广泛用于体细胞重编程[13,20-23]和提高体细胞克隆效率[24]的研究。非洲爪蟾卵母细胞因其体积大、易于获得、抽提物制备方便而成为研究抽提物诱导体细胞重编程的首选材料[3,9,11,15,25]。本文利用爪蟾卵母细胞抽提物诱导JBCFF重编程,旨在获得重编程细胞系,为后续体细胞克隆提供试验材料,同时为研究体细胞重编程的分子机制提供试验基础。本研究参考相关文献[4,9],选择适合非洲爪蟾细胞生长的23 ℃为处理温度,处理时间为1 h,处理完毕后添加含Ca2+的培养基以封闭细胞膜上透化过程中形成的可逆孔道,处理后的体细胞形态正常,生长良好,初步建立了稳定的抽提物处理体系,然后对处理后的体细胞进行重编程能力的相关检测。
组蛋白H3K9是表观遗传修饰的重要位点,H3K9去乙酰化往往与异染色质形成和抑制基因转录活性相关[26]。在爪蟾胚胎发育中,去乙酰化发生在母源积累的核心组蛋白整合到胚胎染色质上,胚胎发育阶段的去乙酰化被认为是细胞重新分化的必要准备[27],本试验中非洲爪蟾卵母细胞抽提物处理的JBCFF,培养24 h后检测到其组蛋白H3K9的乙酰化程度与未处理组间差异不显著,而X.R.Xiong等[28]认为牛卵母细胞抽提物能诱导牦牛成纤维细胞中H3K9乙酰化程度升高,该结果的不同可能与卵母细胞抽提物的来源、抽提物供体与受体细胞间种属的差异等因素有关,因此还需要进一步研究。
抽提物处理的细胞用干细胞培养基培养4~5 d后,细胞开始聚集生长,6~7 d形成“克隆簇”,同时“克隆簇”对碱性磷酸酶染色呈阳性,而同样培养条件下未处理的体细胞未见形态学改变,该结果与文献[3-4,10,20]等一致。细胞成簇生长被认为是干细胞和诱导性多潜能干细胞的典型特征,因此本研究中JBCFF经爪蟾卵母细胞抽提物处理后形成的“克隆簇”呈现出一定的干细胞特征。然而同一条件下,未成簇生长的细胞染色呈阴性,说明同种细胞、不同个体的重编程能力有所不同。同类研究中,也有未见“克隆簇”样细胞形成的报道[9,22,25],推测可能是由于不同的细胞类型、培养条件和处理体系导致细胞间重编程能力的差异,造成试验结果不同。
Oct4、Sox2、Nanog是保证多能性细胞自我更新和维持未分化状态最重要的3个因子,Oct4通过激活或抑制多种基因表达来实现对细胞多能性的维护,Sox2可维持Oct4的表达量,与Oct4共同发挥作用,Nanog功能与Oct4类似,主要是帮助细胞获得多能性。最近有研究表明Nanog对于诱导牛iPS细胞至关重要[29],因此推测Nanog基因对维持牛细胞多能性有突出作用,因而被认为是干细胞的多能性标记物,本研究对这3个基因的表达检测发现,形成“克隆簇”细胞表达Oct4、Nanog,并且荧光染色检测到Oct4蛋白的表达;未形成克隆簇细胞和未处理细胞均未见上述基因和蛋白的表达;该结果与O.Ganier等[5]和S.Em等[30]的研究结果相似,说明JBCFF经抽提物处理后发生重编程,恢复部分全能性。但是,“克隆簇”细胞中未检测到Sox2基因的表达,与文献[4,9,31]的研究不同,可能是由于不同细胞类型重编程能力不同,或是抽提物处理体系不同所致。进一步采用实时荧光定量PCR检测抽提物处理后不同天数(4、5、6 d)的细胞中Oct4、Nanog基因的表达量变化,发现其随着培养天数增加表达量呈上升趋势,这与“克隆簇”生长状态一致,形成“克隆簇”的细胞被重编程恢复到部分多能状态,随着形成“克隆簇”细胞数量的增加,多能性标志基因Oct4、Nanog的表达量也随着升高。
综上表明,本研究应用爪蟾卵母细胞抽提物处理和牛胎儿成纤维细胞,诱导了体细胞重编程,使细胞恢复到较低的分化状态,其中形成“克隆簇”的细胞可能是重编程效果较好的细胞。
[1] HALLEY-STOTT R P,PASQUE V,GURDON J B.Nuclear reprogramming[J].Development,2013,140(2):2468-2471.
[2] KIKYO N,WADE P A,GUSCHIN D,et al.Active remodeling of somatic nuclei in egg cytoplasm by the nucleosomal atpase iswi[J].Science,2000,289(5488):2360-2362.
[3] HANSIS C,BARRETO G,MALTRY N,et al.Nuclear reprogramming of human somaticcells byXenopusegg extract requires Brg1[J].CurrBiol,2004,14(16):1475-1480.
[4] MIYAMOTO K,FURUSAWA T,OHNUKI M,et al.Reprogramming events of mammalian somatic cells induced byXenopuslaevisegg extracts[J].MolReprodDev,2007,74(10):1268-1277.
[5] GANIER O,BOCQUET S,PEIFFER I,et al.Synergic eeprogramming of mammalian cells by combined exposure to MitoticXenopusegg extracts and transcription factors[J].ProcNatlAcadSciUSA,2011,108(42):17331-17336.
[6] RATHBONE A J,LIDDELL S,CAMPBELL K H S.Proteomic analysis of early reprogramming events in murine somatic cells incubated withXenopuslaevisoocyte extracts demonstrates network associations with induced pluripotency markers[J].CellReprogram,2013,15(4):269-280.
[7] BIAN Y,ALBERIO R,ALLEGRUCCI C,et al.Epigenetic marks in somatic chromatin are remodelled to resemble pluripotent nuclei by amphibian oocyte extracts[J].Epigenetics,2009,4(3):194-202.
[8] KIM S Y,KIM T S,PARK S H,et al.Siberian sturgeon oocyte extract induces epigenetic modifications of porcine somatic cells and improves developmental competence of SCNT embryos[J].Asian-AustralasJAnimSci,2014,27(2):266-277.
[9] LIU Y,OSTRUP O,LI J,et al.Cell colony formation induced byXenopusegg extract as a marker for improvement of cloned blastocyst formation in the pig[J].CellReprogram,2011,13(6):521-526.
[10] LIU Y,OSTRUP O,LI J,et al.Increased blastocyst formation of cloned porcine embryos produced with donor cells pre-treated withXenopusegg extract and/or digitonin[J].Zygote,2012,20(1):61-66.
[11] ALLEGRUCCI C,RUSHTON M D,DIXON J E,et al.Epigenetic reprogramming of breast cancer cells with oocyte extracts[J].MolCancer,2011,10(1):7.
[12] WANG Z H,DAO R N,BAO L R,et al.Epigenetic reprogramming of human lung cancer cells with the extract of bovine parthenogenetic oocytes[J].JCellMolMed,2014,18(9):1807-1815.
[13] BUI H T,WAKAYAMA S,KISHIGAMI S,et al.The cytoplasm of mouse germinal vesicle stage oocytes can enhance somatic cell nuclear reprogramming[J].Development,2008,135(23):3935-3945.
[14] BUI H T,KWON D N,KANG M H,et al.Epigenetic reprogramming in somatic cells induced by extract from germinal vesicle stage pig oocytes[J].Development,2012,139(23):4330-4340.
[15] MIYAMOTO K,TSUKIYAMA T,YANG Y,et al.Cell-free extracts from mammalian oocytes partially induce nuclear reprogramming in somatic cells[J].BiolReprod,2009,80(5):935-943.
[16] HAN J,SIDHU K.Embryonic stem cell extracts:use in differentiation and reprogramming[J].RegenMed,2011,6(2):215-227.
[17] WOLFFE A P,SCHILD C.Xenopuslaevis:practical uses in cell and molecular biology[J].MethodsCellBiol,1991(36):541-549.
[18] ADAM S A,STERNE-MARR R,GERACE L.Nuclear protein import using digitonin-ermeabilized cells[J].MethodsEnzymol,1992(219):97-110.
[19] SOPHIE M,JEAN M L,ALAN H,et al.DNA replication and chromatin assembly usingXenopuseggs or embryos[J].AdvMolBiol,1999:196-226.
[20] FREBERG C T,DAHL J A,TIMOSKAINEN S,et al.Epigenetic reprogramming of Oct4 and Nanog regulatory regions by embryonal carcinoma cell extract[J].MolBiolCell,2007,18(5):1543-1553.
[21] MIYAMOTO K,YAMASHITA T,TSUKIYAMA T,et al.Reversible membrane permeabilization of mammalian cells treated with digitonin and its use for inducing nuclear reprogramming byXenopusegg extracts[J].ClonStemCells,2008,10(4):535-542.
[22] TANG S,WANG Y,ZHANG D,et al.Reprogramming donor cells with oocyte extracts improves in vitro development of nuclear transfer embryos[J].AnimReprodSci,2009,115(1-4):1-9.
[23] HAN J,SACHDEV P S,SIDHU K S.A combined epigenetic and non-genetic approach for reprogramming human somatic cells[J].PLoSONE,2010,5(8):e12297.
[24] ØSTRUP O,PEDERSEN H S,HOLM H M,et al.Analysis of nucleolar morphology and protein localization as an indicator of nuclear reprogramming[J].MethodsMolBiol,2015(1222):161-174.
[25] RATHBONE A J,FISHER P A,LEE J H,et al.Reprogramming of ovine somatic cells withXenopusLaevisoocyte extract prior to SCNT improves live birth rate[J].CellReprogram,2010,12(5):609-616.
[26] RICE J C,ALLIS C D.Histone methylation versus histone acetylation:new insights into epigenetic regulation[J].CurrOpinCellBiol,2001,13(3):263-273.[27] WOLFFE A P.Nucleosome positioning and modification:Chromatin structures that potentiate transcription[J].TrendsBiochemSci,1994,19(6):240-244.
[28] XIONG X R,LI J,FU M,et al.Oocyte extract improves epigenetic reprogramming of yak fibroblast cells and cloned embryo development[J].Theriogenology,2013(79):462-469.
[29] SUMER H,LIU J,MALAVER-ORTEGA L F,et al.Nanog is a key factor for induction of pluripotency in bovine adult fibroblasts[J].JAnimSci,2011,89(9):2708-2716.
[30] EM S,KATARIA M,YADAY P S B,et al.Expression profile of developmentally important genes between hand-made cloned buffalo embryos produced from reprogramming of donor cell with oocytes extract and selection of recipient cytoplast through brilliant cresyl blue staining and in vitro fertilized embryos[J].JAssistReprodGenet,2014,31(11):1541-1552.
[31] XU Y N,GUAN N,WANG Z D,et al.ES cell extract-induced expression of pluripotent factors in somatic cells[J].AnatRec(Hoboken),2009,292(8):1229-1234.
(编辑 程金华)
Reprogramming of Japanese Black Cattle Fetal Fibroblasts Treated withXenopuslaevisOocytes Extracts
DU Wei-hua,FAN Zong-xing,WANG Hao-yu,HAO Hai-sheng, LIU Yan,ZHAO Xue-ming,QIN Tong,ZHU Hua-bin*
(InstituteofAnimalScience,ChineseAcademyofAgriculturalSciences,Beijing100193,China)
In order to reprogram the Japanese Black cattle fetal fibroblasts(JBCFF),theXenopuslaevisoocyte extracts was used to incubation with the cells in present study.After 24 hours of culture in medium,there was no significant difference in acetylation of histone H3K9 between the JBCFF treated with extracts and the cells untreated by immunofluorescence assay.The well-defined colony structures of JBCFF treated with extracts were formed with the continuous culture for 5-6 d and the alkaline phosphatase staining of the cells colony was positive.Similarly,the OCT4 protein was detected in the cells colony.Additionally,Oct4 andNanogmRNA expression,two pluripotency marker genes,were detected in those cells by RT-PCR,butSox2 gene expression was not detected.Furthermore,qPCR results showed that the expression levels ofOct4 andNanoggenes in colony cells increased with days of culture(4,5,6 d ) after extracts treatment.In conclusion,theXenopuslaevisoocyte extracts could induce the partial reprogramming of the JBCFF into a low differentiated state.
Xenopuslaevis;oocyte extract;bovine fetal fibroblast;reprogramming;pluripotency marker genes
10.11843/j.issn.0366-6964.2015.09.009
2015-01-26
基本科研业务费重点项目(2013ywf-zd-2);国家科技支撑项目(2012BAD12B01-2);家畜胚胎工程与繁殖创新团队(ASTIP-IAS06-2015)
杜卫华(1974-),女,山西晋中人,博士,副研究员,主要从事家畜胚胎工程研究,E-mail:dwh@iascaas.net.cn
*通信作者:朱化彬,博士,研究员,E-mail:zhuhuabin@caas.cn
S823.2
A
0366-6964(2015)09-1549-08
