牛卵泡ODF1与ODF2转录组发育相关基因筛选及表达差异分析
2015-03-22李鹏飞孟金柱谢建山朱芷葳姜晓龙陈建伟姚晓磊赵妙妙吕丽华
李鹏飞,孟金柱,谢建山,朱芷葳,刘 岩,姜晓龙,陈建伟,姚晓磊,赵妙妙,吕丽华*
(1.山西农业大学生命科学学院,太谷 030801;2.山西农业大学动物科技学院,太谷 030801)
牛卵泡ODF1与ODF2转录组发育相关基因筛选及表达差异分析
李鹏飞1,孟金柱2,谢建山2,朱芷葳1,刘 岩2,姜晓龙2,陈建伟2,姚晓磊2,赵妙妙2,吕丽华2*
(1.山西农业大学生命科学学院,太谷 030801;2.山西农业大学动物科技学院,太谷 030801)
旨在从牛发情周期第一卵泡波中最大卵泡ODF1(The largest follicle at onset of deviation)和第二大卵泡ODF2(The second largest follicle at onset of deviation)转录组水平上筛选卵泡发育差异表达基因。采集牛发情周期第一卵泡波ODF1和ODF2,分别分离颗粒细胞并提取总RNA,构建RNA文库,通过Illumina平台对ODF1和ODF2测序;筛选出ODF1与ODF2两个转录本之间比值大于2的差异表达基因,并采用qRT-PCR对筛选出的基因在牛发情周期内第一卵泡波优势卵泡(Dominant follicles,DF)和从属卵泡(Subordinate follicles,SF)颗粒细胞中功能验证。共获得8个卵泡发育差异表达基因,其中7个基因筛选自ODF1/ODF2(BEX2、UBN1、SIK1、SPARCL1、LOC784256、LOC789231和LOC785462),1个筛选自ODF2/ODF1(SAFB2);qRT-PCR结果表明,BEX2、UBN1、LOC784256和LOC789231在DF中mRNA表达量极显著高于SF(P<0.01),SAFB2在SF中mRNA表达量极显著高于DF(P<0.01),SIK1和SPARCL1在SF中mRNA表达量显著高于DF(P<0.05),虽然LOC785462在SF中mRNA表达量高于DF,但差异不显著(P>0.05)。qRT-PCR检测BEX2、UBN1、LOC784256、LOC789231和SAFB2的结果与高通量测序中该基因在ODF1和ODF2的RPKM的差异趋势基本一致,而SIK1、SPARCL1和LOC785462不一致。
牛;ODF1;ODF2;转录本;卵泡发育;基因
J.C.Venter等[1]发布人类基因组全序列,标志着生物研究进入了后基因组时代。对基因组序列的利用,从不同水平进行研究,例如基因组、转录组等。在卵泡发育的不同阶段,转录、翻译等在一系列特定基因顺序表达基础上进行,卵泡发育相关基因的特定表达对卵泡的募集、选择及凋亡发挥关键作用[2]。近年来,在卵泡生长和闭锁规律方面进行了大量研究,尤其是卵泡发育基因与内分泌调控的关系方面取得了一定进展[3-4]。姚晓磊等[3]通过GEO数据库结合基因功能分析,筛选出6个候选基因。X.Li等[5]通过采用深度测序技术,系统地筛选出与多种免疫通路(Toll通路、IMD通路和MAPK通路)相关的功能基因,并首次检测到SAAT、FGF等基因的表达。本研究运用新一代高通量测序技术,以转录组为基础,在牛卵泡发育全基因组范围内规模化筛选与卵泡发育相关基因,结合基因功能分析,运用qRT-PCR对筛选基因进行功能验证,大大提高了卵泡发育基因筛选的准确性。
1 材料与方法
1.1 试验动物及样品采集
选取8头10月龄青年母牛,注射PGF2α(前列腺素F2α)同期发情,分别进行为期11 d的饲养管理,此间每天用B超仪检测并记录卵泡的生长情况。在第一卵泡波的偏差期启动时,摘除卵巢并用眼科剪剪下出现偏差时的最大卵泡ODF1和第二大卵泡ODF2,放入灭菌的DPBS中准备分离颗粒细胞。
1.2 主要试剂
Solexa测序芯片、TruSeq RNA Sample Prep Kit、QiaQuick PCR kit、TruSeq SBS kit、裂解缓冲液(Illumina,美国)、PrimeScript®RT reagent Kit With gDNA Eraser、dNTP、DNA Marker DL2000、SYBR®Premix Ex TaqTM II(TaKaRa,大连),Trizol、DEPC(Invitrogen公司,美国),固相RNase清除剂(Andybio公司,美国)。
1.3 卵泡发育相关基因的筛选
1.3.1 ODF1和ODF2颗粒细胞总RNA提取 将已经处理好的卵泡用眼科剪剪开,放到盛有DPBS的表面皿上,用细胞刮刀刮取颗粒细胞,DPBS清洗数次,混合液置于无菌EP管,2 000 r·min-1离心10 min,弃上清并加入1 mL RNAiso Plus,提取总RNA。
1.3.2 牛ODF1和ODF2颗粒细胞RNA文库构建并测序 取ODF1和ODF2总RNA样品各6 μL,Oligo(dT)磁珠富集后,加裂解缓冲液使其裂解为200 nt左右的片段;以此为模板,加入随机引物六聚体合成cDNA第一链;再加入一系列缓冲液、RNase H和dNTPs,经聚合酶I合成cDNA第二链;经QiaQuick PCR kit纯化,EB缓冲液洗脱,末端修复,加Poly A尾巴,加5′和3′接头;琼脂糖凝胶电泳回收目的片段,PCR扩增,完成整个cDNA文库构建;Illumina HiSeq 2000测序平台进行测序。
1.3.3 ODF1和ODF2两个转录本中筛选牛卵泡差异表达基因 从Illumina平台对ODF1和ODF2测序得到的两个转录本中筛选卵泡发育差异表达基因,参照S.Audic等[6]方法,设定条件:ODF1 RPKM /ODF2 RPKM>2及ODF2 RPKM /ODF1 RPKM>2,结合Gene Ontology(GO)功能显著性富集分析,使用FDR校正(P<0.05)的基因。
1.4 试验方法
1.4.1 总RNA提取及反转录 试验所用DF和SF颗粒细胞总RNA均为本课题组前期获得,具体参照姚晓磊等[3]方法,分别对3头牛DF和SF颗粒细胞总RNA分别进行反转录,反应条件稍作调整:7 ℃ 15 min,85 ℃ 5 s,-20 ℃保存。
1.4.2 引物合成 参考NCBI上的Bostaurus(Calve)的卵泡发育相关基因序列,设计候选基因引物,利用Primer 3.0软件设计合成引物(表1);由上海生工生物工程股份有限公司合成。RPLP0为内参基因。
表1 荧光定量引物
Table 1 Primers of quantitative PCR

基因名称Genesymbol引物序列(5′⁃3′)PrimersequenceBEX2F:TTGCCTTATGCCTTGAATCC,R:GGTAATAGGAAACGCGCAAGUBN1F:ACCCGTTCTGGAGTGTATGC,R:TCACAGAGGTGCAGTTTTCGSIK1F:ACCTCAGTGGTTTCGAGGTG,R:GTAGGACAGACTGCCCCAAGSPARCL1F:TGTGCGAAGACAGGATTCAG,R:TGCTTGTGTCGGAATAGCACLOC784256F:AGACAACCAAAAGGGCATTG,R:TCACAGAGCACATTGGCTTCLOC789231F:TCGTGCTGTTTGTTTCTTCG,R:AGTCGGCAACTGCTAAATGGLOC785462F:AGACAACCAAAAGGGCATTG,R:TCACAGAGCACATTGGCTTCSAFB2F:TCCTGGAATCCCTTTGTGAG,R:ACAGCGTGTCCTGTGAACTGRPLP0F:CAACCCTGAAGTGCTTGACAT,R:AGGCAGATGGATCAGCCA
1.4.3 qRT-PCR 数据经3方面校正:重复校正、物理校正和内参基因校正,扩增前先制作标准曲线。依据标准曲线和不同基因及不同的扩增条件进行qRT-PCR反应,反应体系为20 μL,严格按照qRT-PCR试剂盒说明书进行;反应条件:95 ℃变性10 s,95 ℃ 5 s,60 ℃ 25 s,40个循环。
1.5 统计分析
各目的基因的相对表达量采用△△CT法计算,目的基因的相对表达水平= 2-△△CT。结果均用“平均值±标准差”表示,其中各基因的表达量结果均应经内参基因RPLP0表达量校正,数据采用SPSS 18.0统计软件进行t检验分析。
2 结 果
2.1 从牛ODF1和ODF2转录本中筛选获得的卵泡发育相关基因
从Illumina平台对ODF1和ODF2测序得到的两个转录本中筛选卵泡发育差异表达基因,经过设定ODF1-RPKM/ODF2-RPKM>2或者ODF2-RPKM/ODF1-RPKM过滤,基因功能分析及FDR(P<0.05)校正后,得到8个卵泡发育相关基因(表2)。其中7个基因筛选自ODF1-RPKM/ODF2-RPKM(BEX2、UBN1、SIK1、SPARCL1、LOC784256、LOC789231和LOC785462),1个基因筛选自ODF2-RPKM/ODF1-RPKM(SAFB2)。
表2 ODF1/ODF2和ODF2/ODF1转录本中筛选得到卵泡发育相关基因
Table 2 Candidate genes associated with follicular development selected by ODF1/ODF2 and ODF2/ODF1 transcript analysis

FeatureIDODF1⁃RPKMODF2⁃RPKMODF1/ODF2ODF2/ODF1基因功能GenefunctionBEX2345.003141.0642.446-雌激素诱导下调控细胞凋亡UBN12.6641.2712.097-抑制促增殖基因表达SIK11.0910.2145.104-细胞信号通路和细胞分化SPARCL14.1460.7495.539-细胞增殖活性和细胞周期LOC7842562.5920.4515.742-调节雌二醇、睾酮的合成LOC7892312.8980.9802.955-调节垂体前叶促性腺激素的分泌LOC7854626.0891.4274.269-调节皮质醇和性激素合成途径SAFB21.0612.727-2.569细胞应激、细胞增殖和凋亡过程
2.2 卵泡发育相关基因在第一卵泡波DF和SF颗粒细胞中表达差异
qRT-PCR结果显示(图1),BEX2、UBN1、LOC784256、LOC789231在DF中mRNA表达量极显著高于SF(P<0.01),SAFB2在SF中mRNA表达量极显著高于DF(P<0.01),SIK1和SPARCL1在SF中mRNA表达量显著高于DF(P<0.05),虽然LOC785462在SF中mRNA表达量高于DF,但差异不显著(P>0.05)。
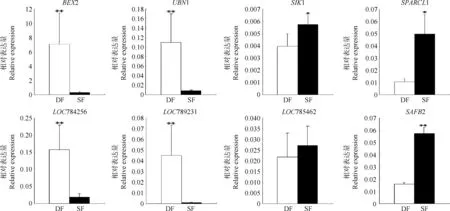
**和*.分别表示在0.01和0.05显著水平上的比较结果** and * indicate significant difference at the level of 0.01 and 0.05,respectively图1 卵泡发育相关基因在牛DF与SF mRNA表达Fig.1 Real time PCR analysis of candidate genes in DF vs SF in follicular development
3 讨 论
转录组是某一组织或细胞在不同状态下所有RNA转录的集合。转录组水平的研究从组织或细胞全方位分析各基因功能及结构,是研究生物分子机理的一种高效方法。RNA-Seq即转录组测序技术,和其他测序技术相比,显著优势是测序通量高,可以深度挖掘组织或细胞中各基因差异表达的微小变化[7-8]。RNA-Seq技术不仅能够全面快速得到基因表达图谱,还可以精确分析长链非编码RNA[9]、可变剪接[10]等序列及结构变异[11]。J.C.Marioni等[12]用相同肝和肾组织分别采用深度测序和芯片技术在检测差异表达基因方面作对比研究,在相同FDR(False discovery rate)情况下,新一代测序技术比芯片多检测出30%的差异表达基因。N.J.Croucher等[13]研究表明,Illumina技术具有高度重复性,技术误差相对较小。本试验借助RNA-Seq技术对牛发情周期内第一卵泡波中的ODF1和ODF2进行深度测序,找出ODF1 RPKM/ODF2 RPKM>2或者ODF2 RPKM/ODF1 RPKM>2的差异表达基因,结合基因功能显著性分析,FDR校正(P<0.05)后,共筛选出8个与卵泡发育相关的基因。DF和SF发育过程中,颗粒细胞具有明显的增殖或凋亡趋势,因此,选用牛发情周期第一卵泡波中DF和SF为研究对象。采用qRT-PCR技术对筛选得到可能影响卵泡发育基因进行功能验证。
BEX(Brain expressed X-linked gene)家族是X染色体连锁基因家族,BEX2是BEX家族中主要成员。X.Zhou等[14]报道,BEX2通过介导JNK信号通路来促进U251细胞的增殖,下调BEX2则促进U251及U87细胞凋亡。A.Naderi等[15]研究表明,BEX2 基因表达水平下调,引起线粒体凋亡,并使细胞周期阻滞于G1期。韩秋悦等[16]证实BEX2可通过调控细胞周期进程来调控细胞增殖和凋亡。UBN1(Ubinuclein 1,泛核蛋白)是一种衰老调控子,参与衰老相关异染色质凝集(SAHF)的形成,进而抑制促增殖基因的表达。K9M-H3和HP1是SAHF的标志性蛋白。M.Narita等[17]研究表明,衰老细胞中SAHF能够抑制E2F与K9M-H3和HP1启动子的结合,从而使细胞衰老状态保持稳定。本研究表明,BEX2和UBN1在DF中mRNA 的表达量极显著高于SF,推测BEX2是通过促进颗粒细胞的增殖来促使卵泡随即呈现优势发育,最终导致其他卵泡闭锁,而UBN1在牛DF和SF中都有表达,DF和SF中颗粒细胞是否都存在程序性的凋亡,还需要进一步验证。
盐诱导激酶(Salt inducible kinase,SIK)是一种丝氨酸/苏氨酸激酶。研究表明,SIK1可以通过调控CREB来抑制相关基因的表达[18],而CREP与细胞增殖、类固醇激素的合成等有很大关系[19]。J.D.Feldman等[20]证实,SIK1在大鼠的肾、脑、卵巢都有表达,且卵泡的发育与类固醇激素密切相关。本研究表明SIK1在SF中mRNA的表达量显著高于DF,这可能由于SIK1通过负调控CREB,进而导致颗粒细胞凋亡和类固醇激素的缺失。SPARCL1(SPARC-like protein 1)是SPARC家族一员。SPARCL1缺失表达与细胞增殖和细胞周期相关[21]。A.Claeskens等[22]研究证实,SPARCL1能够阻止细胞从G1期到S期,进而抑制细胞增殖。SPARCL1具有抗黏附功能,其在绝大多数肿瘤中表现为表达下调,起着肿瘤抑制作用,原因可能是缺失/突变或者启动子甲基化[23]。A.Claeskens等[22]研究表明,SPARCL1在卵巢上表达,且表现为下调,在卵巢癌中诱导肿瘤细胞的凋亡。本研究结果显示,SPARCL1在SF中mRNA表达量显著高于DF,表明其在卵泡发育过程中为下调基因,进而促进卵泡闭锁。SAFB(Scaffold attachment factor B,核基质结合因子)是一种多功能蛋白,其中SAFB1和SAFB2都参与发育、细胞增殖和凋亡过程[24]。M.Ivanova等[25]研究表明,SAFB1的缺失导致小鼠生长缓慢与胰岛素生长因子-1水平下降有关,SAFB1的缺失导致雌鼠生育能力降低是由于雌二醇和黄体酮水平下降。同时,SAFB1的过表达能够缩短细胞周期的S期,进而促使细胞凋亡[26],敲低SAFB1则促进细胞增殖[27]。在牛卵泡发育过程中,SAFB2在SF中过表达可能抑制了颗粒细胞的增殖,这与S.M.Townson等[26]结论一致。
迄今对LOC784256、LOC789231和LOC785462功能研究不够深入,还未对其命名。LOC789231为促性腺激素释放激素Ⅱ受体样物质,主要是通过调节垂体前叶分泌促性腺激素的分泌;LOC784256和LOC785462为类固醇17-α羟化酶的成员,二者的缺陷,能够导致皮质醇、雌二醇和睾丸酮合成减少,进而影响机体发育[28]。S.Arianne等[29]研究证实,LOC784256与牛的CYP17A1相似度高达98%,而CYP17A1是细胞色素 P450 超家族蛋白之一,主要功能是催化雄激素生成雌激素。
4 结 论
本研究结果表明,通过qRT-PCR检测BEX2、UBN1、LOC784256、LOC789231和SAFB2基因表达与高通量测序中该基因在ODF1和ODF2的RPKM的差异趋势基本一致,而SIK1、SPARCL1和LOC785462不一致。同时,BEX2、UBN1、LOC784256、LOC789231、SAFB2、SIK1、SPARCL1参与牛卵泡颗粒细胞的增殖或凋亡,进而影响牛卵巢卵泡的发育。
[1] VENTER J C,ADAMS M D,MYERS E W,et al.The sequence of the human genome[J].Science,2001,291(5507):1304-1351.
[2] BEG M A,BERGFELT D R,KOT K,et al.Follicle selection in cattle:dynamics of follicular fluid factors during development of follicle dominance[J].BiolReprod,2002,66(1):120-126.
[3] 姚晓磊,李鹏飞,姜晓龙,等.卵泡发育相关基因在牛优势和从属卵泡颗粒细胞中表达的研究[J].畜牧兽医学报,2014,45(12):1957-1963. YAO X L,LI P F,JIANG X L,et al.Research of the genes expression associated with follicular development in bovine dominant and subordinate follicle granulose cells[J].ActaVeterinariaetZootechnicaSinica, 2014,45(12):1957-1963.(in Chinese)
[4] 李鹏飞,岳文斌,黄 洋,等.可卡因-苯丙胺调控转录肽对绵羊卵巢卵泡颗粒细胞雌激素产生的影响[J].畜牧兽医学报,2013,44(6):853-857. LI P F,YUE W B,HUANG Y,et al.Effect of CART on estradiol productioninvitroin follicular granulose cells of sheep ovarian[J].ActaVeterinariaetZootechnicaSinica, 2013,44(6):853-857.(in Chinese)[5] LI X,CUI Z,LIU Y,et al.Transcriptome analysis and discovery of genes involved in immune pathways from hepatopancreas of microbial challenged mitten crab Eriocheir sinensis[J].PLoSONE,2013,8(7):e68233.[6] AUDIC S,CLAVERIEJ M.The significance of digital gene expression profiles[J].GenomeRes,1997,7(10):986-995.
[7] WANG Z,GERSTEIN M,SNYDER M.RNA-Seq:a revolutionary tool for transcriptomics[J].NatRevGenet,2009,10(1):57-63.
[8] HAAS B J,ZODY M C.Advancing RNA-Seq analysis[J].NatBiol,2010,28(5):421-423.
[9] PENG X,GRALINSKI L,ARMOUR C D,et al.Unique signatures of long noncoding RNA expression in response to virus infection and altered innate immune signaling[J].MBiol,2010,1(5):e00206-10.
[10] SHAO W,ZHAO Q Y,WANG X Y,et al.Alternative splicing and trans-splicing events revealed by analysis of the Bombyx mori transcriptome[J].RNA,2012,18(7):1395-1407.
[11] CANOVAS A,RINCON G,ISLAS-TREJO A,et al.SNP discovery in the bovine milk transcriptome using RNA-Seq technology[J].MammGenome,2010,21(11-12):592-598.
[12] MARIONI J C,MASON C E,MANE S M,et al.RNA-seq:an assessment of technical reproducibility and comparison with gene expression arrays[J].GenomeRes,2008,18(9):1509-1517.
[13] CROUCHER N J,FOOKES M C,PERKINS T T,et al.A simple method for directional transcriptome sequencing using Illumina technology[J],NucleicAcidsRes,2009,37(22):e148.
[14] ZHOU X,MENG Q,XU X,et al.Bex2 regulates cell proliferation and apoptosis in malignant glioma cells via the c-Jun NH2-terminal kinase pathway[J].BiochemBiophysResCommun,2012,427(3):574-580.
[15] NADERI A,LIU J,BENNETT I C.BEX2 regulates mitochondrial apoptosis and G1 cell cycle in breast cancer[J].IntJCancer,2010,126(7):1596-1610.
[16] 韩秋悦,范彦会,王雅丽,等.BEX2 与INI1/hSNF5 蛋白的相互作用及其在细胞周期中的功能鉴定[J].遗传,2012,34(6):711-718. HAN Q Y,FAN Y H,WANG Y L,et al.BEX2 regulates cell cycle through the interaction with INI1/hSNF5[J].Hereditas,2012,34(6):711-718.(in Chinese)[17] NARITA M,SABRINA N,EARD E H,et al.Rb-Mediated heterochromatin formatipon and silencing of E2F Target genes during cellular senescence[J].Cell,2003,113(6):703-716.
[18] LIN X,TAKEMOR I H,KATOH Y,et al.Salt inducible kinase is involved in the ACT H/ cAMP dependent protein kinase signaling in Y1 mouse adrenocortical tumor cells[J].MolEndocrinol,2001,15(8):1264-1276.
[19] LIU J,PARK E,GURNEY A,et al.Cyclic AMP induction of phosphoenolpyruvate carboxykinase(GTP) gene transcription is mediated by multiple promoter elements[J].JBiolChem,1991,266(28):19095-19102.[20] FELDMAN J D,VICIAN L,CRISPINO M,et al.The salt-inducible kinase,SIK,is induced by depolarization in brain[J].JNeurochem,2002,74(6):2227-2238.
[21] BREKKEN R A,SULLIVAN M,WORKMAN G,et al.Expression and characterization of murine hevin(SC1),a member of the SPARC family of matricellular proteins[J]JHistochemCytochem,2004,52(6):735-748.
[22] CLAESKENS A,ONGENAE N,NEEFS J M,et al.Hevin is down-regulated in many cancers and is a negative regulator of cell growth and proliferation[J].BrJCancer,2000,82(6):1123-1130.
[23] LAU C Y,POON R P,CHEUNG S T,et al.SPARC and Hevin expression correlate with tumour angiogenesis in hepatocellular carcinoma[J].JPathol,2006,210(4):459-468.
[24] OESTERREICH S.Scaffold attachment factors SAFB1 and SAFB2:innocent bystanders or critical players in breast tumorigenesis[J].JCellBiochem,2003,90(4):653-661.
[25] IVANOVA M,DOBRZYCKA K M.Scaffold attachment factor B1 functions in development,growth,and reproduction[J].MolCellBiol,2005,25(8):2995-3006.[26] TOWNSON S M,KANG K,LEE A V,et al.Structure-function analysis of the estrogen receptor alpha corepressor scaffold attachment factor-B1:identification of a potent transcriptional repression domain[J].BiolChem,2004,279(25):26074-26081.
[27] JASON P.SAFBl multiple functions in biological control-Lots still to be done[J].JCellBiochem,2010,109(2):312-319.
[28] BIGLIERI E G.17-hydroxylation deficiency in man[J].JClinInvest,1966,45(12):1946-1954.
[29] ARIANNE S,LAURA O,PILA R Z,et al.A false single nucleotide polymorphism generated by gene duplication compromises meat traceability[J].MeatSci, 2012,91(3):347-351.
(编辑 程金华)
Screening and Analyse Study of Genes Associated with Follicular Development in Bovine ODF1 and ODF2 Transcript
LI Peng-fei1,MENG Jin-zhu2,XIE Jian-shan2,ZHU Zhi-wei1,LIU Yan2,JIANG Xiao-long2,CHEN Jian-wei2,YAO Xiao-lei2,ZHAO Miao-miao2,LÜ Li-hua2*
(1.CollegeofLifeScience,ShanxiAgriculturalUniversity,Taigu030801,China;2.CollegeofAnimalScienceandVeterinaryMedicine,ShanxiAgriculturalUniversity,Taigu030801,China)
This study was performed to screen genes associated with follicular development from ODF1(The largest follicle at onset of deviation)and ODF2(The second largest follicle at onset of deviation)in transcript levels of bovine.The largest and second largest follicle were collected from onset of deviation then separated granulosa cells from which extracted total RNA.High-throughput deep sequencing was carried out by sequencing platform of Illumina.According to the results of assessment analysis in significant enrichment analysis of Gene Ontology function and differential expression in gene screening.Further,screening differential expression gene by ODF1/ODF2 or ODF2/ODF1>2 as the candidate genes.By real-time fluorescent quantitative PCR(qRT-PCR) was performed to detect the gene expression pattern between DF and SF granulose cells of the first follicular wave during estrous cycle in bovine.Eight candidate genes related to follicular development were screened and 7 genes(BEX2,UBN1,SIK1,SPARCL1,LOC784256,LOC789231,LOC785462)from ODF1/ODF2 and one (SAFB2)from ODF2/ODF1,BEX2,UBN1,LOC784256,LOC789231 expressed in DF was extremely significantly higher than that in SF(P<0.01).But the expression levels ofSAFB2 was extremely significantly higher in SF than those in DF(P<0.01) andSIK1,SPARCL1 were significantly greater in SF compared with DF(P<0.05).This indifferences trends was consistent between qRT-PCR test results ofBEX2,UBN1,LOC784256,LOC789231,SAFB2 and high-throughput sequencing results of RPKM in ODF1 and ODF2.The qRT-PCR test results ofSIK1,SPARCL1 andLOC785462 was opposite with the high-throughput sequencing of the gene RPKM in ODF1 and ODF2.
bovine;ODF1;ODF2;transcript;follicle development;gene
10.11843/j.issn.0366-6964.2015.11.007
2015-02-02
国家自然科学基金(31172211);农业部948项目(2010-Z43);山西省横向协作与委托项目(2010HX54);山西省回国留学人员科研资助项目(2014-重点5);山西省科技攻关项目(20130311027-2);山西省人事厅人才引进项目;山西农业大学引进人才博士科研启动费(2014ZZ04);科研管理费资助重大项目;标志性成果培育项目(71060003)
李鹏飞(1978-),男,山西偏关人,博士,副教授,主要从事动物生殖生理方面的研究,E-mail:adamlpf@126.com
*通信作者:吕丽华,E-mail:lihualvsxau@126.com
S823.2
A
0366-6964(2015)11-1961-06
