RSK2与恶性肿瘤的关系及其抑制剂的研究进展*
2015-03-22陈康杏王籽又黄燕霞钟承志李凯恒黄遵楠广东医学院第二临床医学院中美肿瘤研究所公共卫生学院广东东莞5808
陈康杏,王籽又,黄燕霞,钟承志,李凯恒,黄遵楠△(广东医学院第二临床医学院,中美肿瘤研究所,公共卫生学院,广东东莞5808)
·综述·
RSK2与恶性肿瘤的关系及其抑制剂的研究进展*
陈康杏1,王籽又2,黄燕霞3,钟承志1,李凯恒1,黄遵楠2△
(广东医学院1第二临床医学院,2中美肿瘤研究所,3公共卫生学院,广东东莞523808)
[ABSTRACT]Ribosomal S6 kinase 2 (RSK2) is a member of the p90Rsk,which belongs to Ser/Thr kinase family.It is a downstream molecule of Ras/MAPK cascade and regulates a variety of cellular processes.RSK2 plays a key role in the cell proliferation,survival and transformation.Furthermore,the aberrant up-regulation of RSK2 was observed in different malignancies.We here briefly review the structure and function of RSK2,the relationship between RSK2 and tumor,and the existing RSK2 inhibitors.
核糖体S6激酶2;结构;功能;肿瘤;抑制剂
[KEY WORDS]Ribosomal S6 kinase 2; Structure; Function; Tumor; Inhibitors
核糖体S6激酶(ribosomal S6 kinase,RSK) 2属于Ras-MAPK下游通路的90 kD的RSK家族,该家族包含4个成员(RSK1~4)及2个结构同系物MSK1/2。RSK家族的成员具有高度的序列同源性(75%~80%的氨基酸序列是一致的),只有2个激酶功能域不同。尽管结构相似,它们在组织内的分布及功能却不尽相同[1],而本文主要介绍RSK2。RSK2的发现起始于它的基因缺陷会导致科-勒二氏综合征(Coffin-Lowry syndrome,CLS),一种罕见的神经退行性疾病[1]。后来深入的研究发现,RSK2是ERK1/2直接的下游底物,RSK2一旦被激活就会转入到核中磷酸化多种核蛋白,从而调控细胞的多项生命活动包括细胞的增殖、周期、转化等。近几年有不少研究证实RSK2的蛋白水平在恶性肿瘤及组织中较正常细胞及组织明显偏高[2],而研究者们一直致力于寻找高效低毒的靶向RSK2的抑制剂。由此可见,RSK2是一个很有潜力的抗癌靶标。本文主要就RSK2的结构功能、与肿瘤的关系及现有抑制剂展开介绍。
1RSK2的结构
RSK2的结构比较复杂,包含2个功能不同的激酶结构域,分别是N端激酶结构域(N-terminal kinase domain,NTKD)与C端激酶结构域(C-terminal kinase domain,CTKD) ;另有1个铰链区(linker region,LR)、1个N端结构域(N-terminal domain,NTD)及1 个C端结构域(C-terminal domain,CTD)[1]。NTKD属于AGC激酶家族,主要负责底物的磷酸化。CTKD则属于CaMKs家族,主要负责自身的磷酸化(活化)[1]。2个激酶结构域由1个保守的铰链结构相连,在CTD上有1个ERK1/2对接基序(Leu-Arg-Gln-Arg-Arg),而LR中包含ERK介导的RSK2自动磷酸化位点[1,3]。
2RSK2的活化机制
在生长因子等刺激因素的影响下,RSK2的多个磷酸化残基依次被不同激酶磷酸化,具体活化路线见图1。RSK2的完全活化需要ERK1/2与3-磷酸肌醇依赖性蛋白激酶1 (3-phosphoinositide-dependent protein kinase-1,PDK1)的共同作用,缺一不可。首先,非活化状态下的ERK1/2连接到RSK2 CTD的特定结合位点上,这是RSK2活化必不可少的一步[4]。然后刺激信号如分裂素等刺激ERK1/2活化,ERK1/ 2活化后使得RSK2铰链区的Ser369和CTKD上的Thr577磷酸化;这2个位点的磷酸化活化了CTKD;上文提到过CTKD负责自身的磷酸化,所以,CTKD活化后,Ser386发生了磷酸化; Ser386位于铰链区芳香环残基的疏水部位,它磷酸化后产生了1个可与PDK1对接的位点[5]; PDK1连接上去后,反过来在NTKD的激活回路中磷酸化Ser227[6]。与PDK1分离后,磷酸化的Ser386连接到NTKD的1个磷酸化连接位点上,从而导致芳香环残基上的疏水基序稳定连接到附近的1个疏水口袋上,部分形成了α螺旋,这个α螺旋同活化环中磷酸化的Ser227将NTKD稳定在一个活性构象中[5]。另外有研究发现,成纤维细胞生长因子受体3(fibroblast growth factor receptor 3,FGFR3)可磷酸化RSK2的Y529,而这一步磷酸化可调控初始阶段非活化状态的ERK1/2连接到RSK2上[4]。
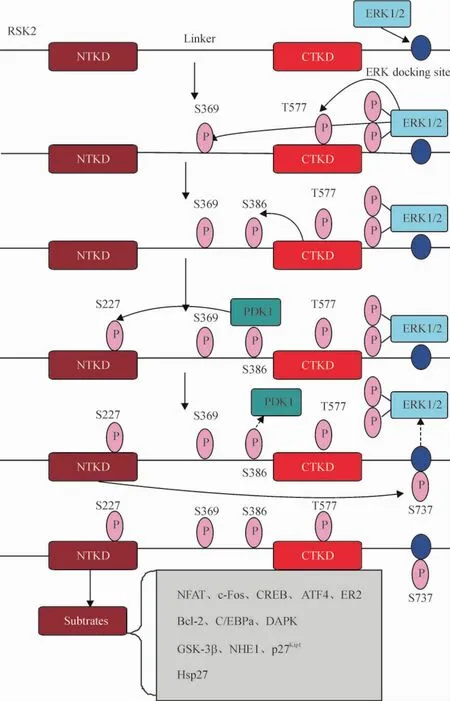
Figure 1.Molecular mechanism of RSK2 activation.图1 RSK2激活的分子机制
3 RSK2的功能
RSK2一旦活化,就可转入核中磷酸化多种核蛋白从而调控细胞的各项生命活动。RSK2的底物非常多,见表1,因此RSK2的功能很广泛。(1) RSK2调节转录因子的活化,促进相关蛋白质的表达。比如可调控cAMP反应元件结合蛋白(cAMP response element-binding protein,CREB)[7]、c-Fos[8]、活化T细胞核因子c4(nuclear factor of activated T-cells c4,NFATc4)[9]、活化T细胞核因子3(nuclear factor of activated T-cells 3,NFAT3)[10]、活化转录因子4(activating transcription factor 4,ATF4)[11]、神经孤束核受体Nur77[12]和IκBα[13]的磷酸化。(2) RSK2可抑制细胞的凋亡,促进细胞的存活。RSK2可通过磷酸化促凋亡蛋白Bad[14]及死亡相关蛋白激酶(DAPK)[15]使这些蛋白丧失促凋亡的作用。(3) RSK2可促进细胞增殖。通过磷酸化糖原合酶激酶3β(GSK-3β)[16]、Na+/H+交换器1(NHE1)[17]和细胞周期蛋白依赖性激酶抑制剂1B(p27Kip1)[18]促进细胞增殖。(4) RSK2通过磷酸化热休克蛋白27 (heat shock protein 27,Hsp27)[19]促进肿瘤细胞迁移和侵袭。RSK2就像一个钥匙,通过激活多个信号网络的信号效应来促进细胞的存活、增殖和迁移。

表1 RSK2的底物及其作用Table 1.Substrates and effects of RSK2
4RSK2与肿瘤
4.1RSK2与造血系统恶性肿瘤目前已有研究证实RSK2除了是ERK1/2的直接底物外还是FGFR3的底物。FGFR3可磷酸化RSK2的Y529及Y707,有助于ERK1/2连接到RSK2上并使得RSK2保持在活性状态[4]。FGFR3在一些造血系统恶性肿瘤如急性髓系白血病、淋巴瘤以及多发性骨髓瘤等的发生与发展过程中扮演着重要的角色。而RSK2与FGFR3诱导的造血转换过程密切相关。FGFR3的失调激活了RSK2进而促进造血系统恶性肿瘤的发生与发展[20]。
4.2RSK2与转移型头颈部鳞状细胞癌头颈部鳞状细胞癌(head and neck squamous-cell carcinoma,HNSCC)是一种比较常见的实体瘤,全世界每年超过50 000个病人罹患此病。目前临床上比较有效的药物有顺铂、紫杉醇、5-氟尿嘧啶等,然而用药后,病人的存活率没有得到提高,病人在4年后的存活率不足50%。存活率不高的主要原因是HNSCC易转移,可转移到淋巴结及其它比较远的器官。有研究证实在转移HNSCC细胞株中,RSK2的表达量显著增加。下调RSK2或用RSK2的抑制剂FMK处理后,转移型的HNSCC细胞的侵袭力下降。稳定敲除RSK2的HNSCC裸鼠模型的淋巴结转移及肺转移也明显减少,究其原因可能是RSK2通过磷酸化Hsp27来促进转移[21]。
4.3RSK2与前列腺癌迄今为止,前列腺癌依然是世界上主要的一种致死癌症。有研究发现,RSK2可调控前列腺特异性抗原(prostate-specific antigen,PSA)的表达,PSA是一种重要的前列腺癌诊断标志物。另外发现RSK2在前列腺癌组织中的表达量较正常前列腺组织高出了2.5倍。用RSK特异性的抑制剂3Ac-SL0101处理后,人前列腺癌细胞株的增殖得到抑制。文献报道AR在前列腺癌的进展中扮演着重要的角色。而RSK2可能的作用机制就是通过磷酸化雄激素受体(androgen receptor,AR)的共激活因子而非直接磷酸化AR来增强AR的活性,从而增加了PSA的表达量并促进前列腺癌细胞株的增殖[22]。
4.4RSK2与皮肤癌皮肤癌是一种比较常见的肿瘤,在美国每年有超过两百万患者被诊断患有此病。而近些年来,随着环境臭氧层的破坏及人口的老龄化,得皮肤癌的患者的人数正在逐年增加[3]。有研究证实相较于正常的皮肤组织,人皮肤癌组织中的RSK2的总蛋白表达量及磷酸化水平明显偏高。加了UV照射后,不仅RSK2的总蛋白表达增加,磷酸化水平提高,RSK2的mRNA表达水平及核定位水平均增加。敲除RSK2可抑制人皮肤癌细胞株的增殖及转化。由此可见,RSK2同皮肤癌细胞的增殖及转化密切相关[23]。
4.5RSK2与三阴性乳腺癌三阴性乳腺癌(triplenegative breast cancer,TNBC)是乳腺癌中的一种特殊种类,因雌激素受体(estrogen receptor,ER)、孕激素受体(progesterone receptor,PR)及人表皮生长因子受体2均为阴性而得名。相较于其它正常的乳腺癌,TNBC的预后更差,虽然它对化疗药物的敏感性高,但因为未知的分子机制,传统疗法对它并不起作用,所以目前临床研究的发展趋势是找出一个可能的治疗靶标[24]。据文献报道,在对244例乳腺癌病人进行跟踪调查后发现,RSK2表达水平高的乳腺癌病人的存活率更低,且RSK2在TNBC细胞株中的含量较非TNBC乳腺癌细胞株的含量高,用siRNA沉默RSK2也是优先抑制TNBC模型,对于非TNBC模型的效果不是那么理想。沉默RSK2或使用RSK抑制剂SL0101或BI-D1870处理细胞后发现超过90% 的TNBC细胞株SUM149的生长受到抑制。RSK2促进TNBC肿瘤生长的分子机制可能是通过磷酸化YB-1最终促进了CD44的表达[25]。所以,RSK2是一个很好的治疗TNBC的分子靶标。
5RSK2现有抑制剂的研究进展
近年来,人们根据RSK2的结构通过实验或计算的方法,发现或设计合成了一系列的抑制剂,这些抑制剂分为选择性抑制剂和非选择性抑制剂,见表2。选择性抑制剂是针对RSK2具有一定的特异性,如SL010、BI-D1870和FMK;非选择性抑制剂是指这类抑制剂除了抑制RSK2外还能对其它激酶具有活性,如GF109203X。

表2 RSK2抑制剂Table 2.RSK2 inhibitors
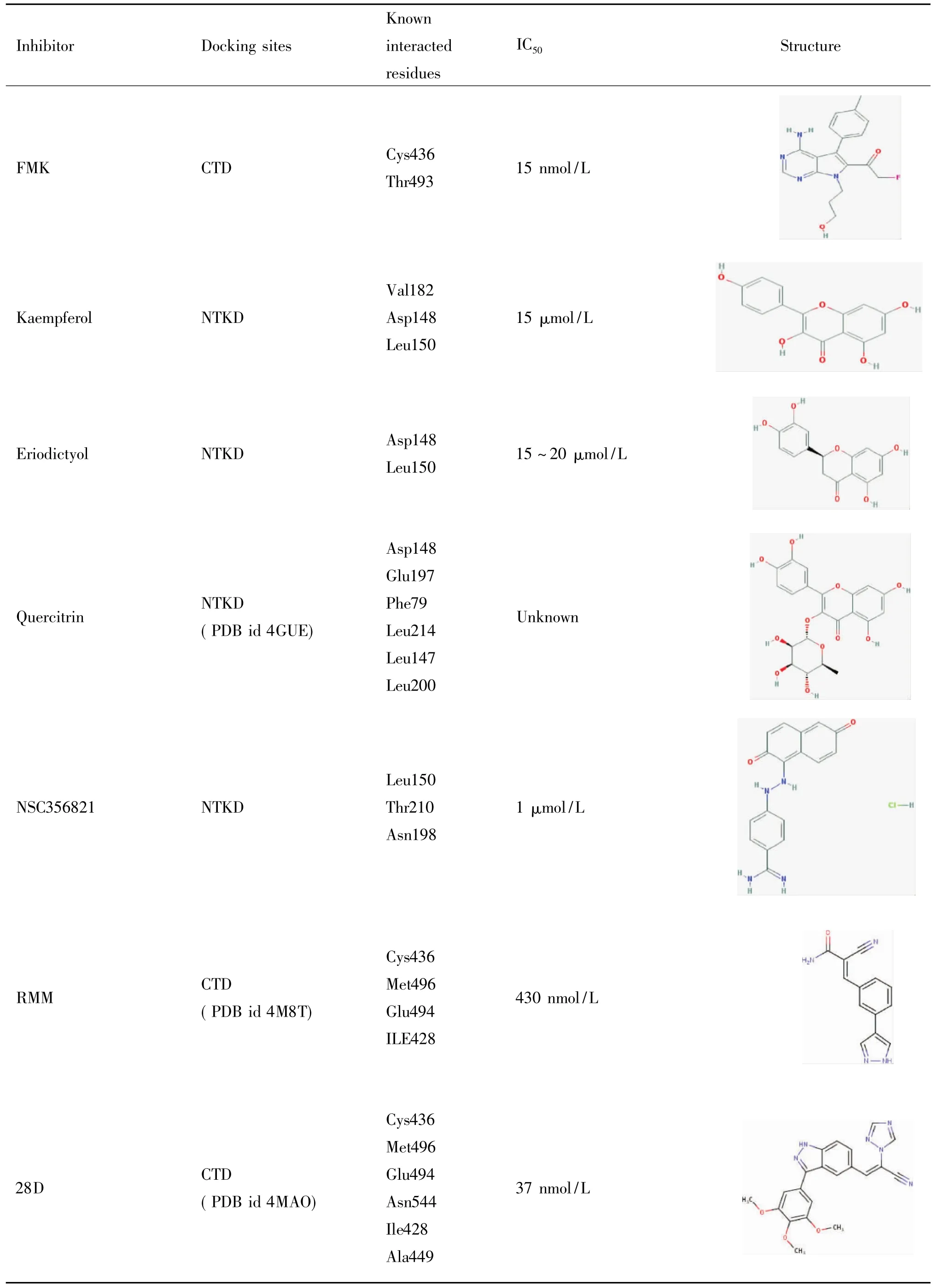
续表2Continued Table 2
5.1RSK2选择性抑制剂SL0101是被发现的第一种具有相对特异性的RSK2抑制剂。该化合物提取自生长在亚马逊热带雨林的Forsteronia refracta,由4,5,7-三羟基酮醇和乙酰化的鼠李糖组成,其中乙酰化的鼠李糖起主要作用。SL0101能与ATP竞争性地结合到RSK2的N端激酶上从而发挥其抑制作用。使用SL0101后,细胞内>90%的RSK2被抑制,然而这种选择性并不是绝对的,SL0101无法区分RSK家族的其它成员,不过,纯化的SL0101能抑制RSK却不能抑制P70S6K及MSK1。研究表明,在体外实验中,ATP浓度为10 μmol/L时,SL0101有效抑制RSK2的IC50约为1 μmol/L。然而在完整细胞中,EC50为50 μmol/L[26]。
BI-D1870是一种合成的小分子化合物,该化合物可抑制RSK1~4的活性。在体外实验中,BID1870的抑制效果与ATP的浓度有关,当ATP浓度为10 μmol/L时BI-D1870对RSK的IC50为10 nmol/ L,若ATP浓度为100 μmol/L时,BI-D1870对RSK 的IC50为15~30 nmol/L[27]。BI-D1870对RSK1~4的抑制效果并不完全一样,比如相较于抑制RSK1,BI-D1870对RSK4的抑制效果要好2倍。但不可否认的是,BI-D1870对每种RSK的抑制作用都很强[26]。BI-D1870还可抑制AGC激酶家族的成员,但有效浓度要提高一百倍甚至更多[27]。同样用0.1 μmol/L BI-D1870处理,98%的RSK2可得到抑制,而MSK1的抑制程度还不足13%[26]。
FMK(吡咯并嘧啶类化合物)是一种作用于RSK2的C末端激酶的选择性抑制剂。它含有一个亲电的氟甲基酮结构,此结构通过与ATP结合区域内的半胱氨酸436(Cys436)共价结合而发挥其抑制作用,为ATP竞争性抑制剂。FMK是一种高度特异性的RSK1和RSK2的抑制剂。在用生物素标记的FMK同人表皮细胞底物发生反应后,发现FMK只与2种蛋白发生了反应,一种是RSK1,另外一种就是RSK2。在体外实验中,FMK对RSK2的IC50为15 nmol/L。而FMK对RSK2的上游激酶ERK1/2没有抑制作用,也不可抑制MSK1调控的组蛋白磷酸化。只可抑制RSK2调控的组蛋白磷酸化[26]。
5.2非选择性抑制剂GF109203X和Ro31-8220是星孢菌素类化合物,这2个化合物是传统的蛋白激酶C(PKC)抑制剂,除了可抑制PKC的活性外还可抑制RSK1~3的活性。在体外实验中,ATP浓度为50 μmol/L时,GF109203X对RSK1~3的IC50分别为610、310和120 nmol/L,Ro31-8220对RSK的IC50分别为600、36和5 nmol/L[28]。由于RSK2的 NTKD同PKC的结构具有一定的相似性,所以GF109203X和Ro31-8220主要是通过结合于RKS2 NTKD上ATP口袋中的腺嘌呤识别位点来发挥其抑制作用[26]。
靛玉红-3’-肟(indirubin-3’-oxime)是一种非选择性高效的RSK2抑制剂,IC50为0. 1 μmol/L。其作用范围广泛,除可作用于RSK外还可作用于CDK5 和GSK-3β,其与CDK5和GSK-3β具有较确定的作用方式,主要是通过与蛋白激酶的腺嘌呤识别环路上的酰胺形成氢键而发挥作用。目前还无法证明它是如何抑制RSK2的,但推测作用方式与上述方式相似[26]。
最近几年内有人发现了新的RSK2抑制剂,该类抑制剂主要通过结合于RSK2的CTD来发挥作用,区别于前述主要作用于NTKD的抑制剂。研究者在设计合成激酶共价抑制剂时发现的系列化合物中,triazole19和triazole20 (ligand ID 28D in PDB code 4MAO)是作用于RSK2 C末端激酶的抑制剂。在RSK2 C末端激酶结构域的激酶分析实验中,这2种化合物对RSK2的IC50分别为3 nmol/L和37 nmol/ L。它们可与RSK2的C末端残基Cys436形成共价键[29]。另外研究者发现cyanoacrylamide抑制剂也是一种可作用于RSK2 C末端激酶的抑制剂,这种抑制剂同样通过与RSK2的C末端残基Cys436形成共价键来发挥作用。在ATP浓度为0.1 mmol/L和10 mmol/L时,系列cyanoacrylamide抑制剂中有5种cyanoacrylamides抑制剂对RSK2的IC50<10 μmol/ L,其中,pyridine 21 (ligand ID RMM in PDB code 4M8T)和pyrazole 24是最强大的拮抗野生型RSK2抑制剂(IC50分别为430 nmol/L和370 nmol/L)。另外,以pyridine为模板合成的pyrrolopyrimidine 27通过共价键与RSK2相连,尚未在商业上使用,但实验中发现pyrrolopyrimidine 27比21更有效。Pyrrolopyrimidine 27在体外抑制野生型RSK2激酶的IC50为42 nmol/L,抑制MSK1的EC50<1 μmol/L[30]。
5.3选择性未知的可能的RSK2抑制剂山奈酚(kaempferol)是一种黄酮类化合物,是SL0101的类似物,两者的相似度达到90%[26]。有文献报道山奈酚可与ATP竞争性结合RSK2与MSK1而非RSK1 和RSK3来抑制其活性[31]。山奈酚对RSK2的IC50为15 μmol/L。作用残基为Asp148与Leu150[26]。圣草酚(eriodictyol)是从散塔草(Eriodictyon californicum)中提取的一种黄酮类化合物,其结构与山奈酚相似。圣草酚可与ATP竞争性结合到RSK2的NTKD,对RSK2上游的MEK1/2、ERK1/2及MAPK的其它成员JNK、p38均无抑制作用。其作用残基为Asp148和Leu150,对RSK2的IC50约为15~20 μmol/L[32]。另外有文献报道栎素(quercitrin)——槲皮苷(quercitin)的衍生物——可连接到RSK2的N端激酶上,结合模式与SL0101非常相似,栎素甚至可以作为SL0101的替代品作用于细胞[33]。有研究者利用高通量筛选的方法筛选出了RSK2可能的抑制剂2-氨基-7’-苯并恶唑衍生物[34]。也有研究者用分子对接等计算机辅助药物设计的技术从数据库中筛选出了RSK2可能的抑制剂吲哚-2-酮类似物,其中抑制作用最强的化合物3s的IC50为0. 5 μmol/ L[35]。另外早在2006年,在RSK2的立体结构尚不清楚的时候,Nguyen等[36]采用PKA和ANP(一种ATP类似物)的复合物为模板,构建了一种比较精确的RSK2 N端结构的模型。随后这个模型被用来筛选出了NSC356821和NSC51023两种RSK2的NTD竞争性抑制剂。其中,NSC356821是一种二羟萘衍生物,具有与其它已报道的RSK抑制剂不一样的化学结构。NSC356281在体外实验中的IC50为1 μmol/ L,能与RSK2中的Leu150、Thr210和Asn198结合形成氢键,抑制ATP对RSK2的激活作用。上述提到的这几类化合物因缺乏实验数据,暂且归类到选择性未知的RSK2抑制剂。
6发展前景
过去的研究已经证实RSK2在细胞的生长、增殖、凋亡、转化等各项生命活动中扮演着重要的角色,并且发现RSK2在很多恶性肿瘤组织中的表达量明显高于正常组织,大大促进了恶性肿瘤的发生与发展。如造血系统恶性肿瘤、头颈部鳞状细胞癌、前列腺癌、皮肤癌,乳腺癌等。由此可见RSK2是一个很有潜力的抗癌靶标。然而纵观近些年来发现或合成的RSK2抑制剂,可以发现这些抑制剂的选择性不高。撇开非特异性的抑制剂如GF109203X和Ro31-8220不谈,具有相对特异性的抑制剂选择性也不是特别高,比如说BI-D1870和SL0101无法区分RSK家族的其它成员,特异性比较高的抑制剂如FMK除可抑制RSK2外还可抑制RSK1,山奈酚除可抑制RSK2外还可抑制MSK1。目前还未见RSK2抑制剂应用于临床的报道。因此研发出高效、特异性好的RSK2抑制剂并能应用于临床研究应是未来的研究方向之一。另外,据文献报道,在应用小分子抑制剂于临床十几年后发现,病人容易产生抗药性且易复发。在将小分子抑制剂应用于某些肿瘤后,复发甚至可以说是肯定的[37]。所以RSK2抑制剂要真正进入临床使用还有很长的路要走。
[1]Anjum R,Blenis J.The RSK family of kinases: emerging roles in cellular signalling[J].Nat Rev Mol Cell Biol,2008,9(10) : 747-758.
[2]Cho YY,Yao K,Pugliese A,et al.A regulatory mechanism for RSK2 NH2-terminal kinase activity[J].Cancer Res,2009,69(10) : 4398-4406.
[3]Arul N,Cho YY.A rising cancer prevention target of RSK2 in human skin cancer[J].Front Oncol,2013,3: 201.
[4]Kang S,Dong S,Gu TL,et al.FGFR3 activates RSK2 to mediate hematopoietic transformation through tyrosine phosphorylation of RSK2 and activation of the MEK/ERK pathway[J].Cancer Cell,2007,12(3) : 201-214.
[7]Xing J,Ginty DD,Greenberg ME.Coupling of the RASMAPK pathway to gene activation by RSK2,a growth factor-regulated CREB kinase[J].Science,1996,273 (5277) : 959-963.
[8]Bruning JC,Gillette JA,Zhao Y,et al.Ribosomal subunit kinase-2 is required for growth factor-stimulated transcription of the c-Fos gene[J].Proc Natl Acad Scie U S A,2000,97(6) : 2462-2467.
[9]Yang TT,Xiong Q,Graef IA,et al.Recruitment of the extracellular signal-regulated kinase/ribosomal S6 kinase signaling pathway to the NFATc4 transcription activation complex[J].Mol Cell Biol,2005,25(3) : 907-920.
[10]Cho YY,Yao K,Bode AM,et al.RSK2 mediates muscle cell differentiation through regulation of NFAT3[J].J Biol Chem,2007,282(11) : 8380-8392.
[11]Yang X,Matsuda K,Bialek P,et al.ATF4 is a substrate of RSK2 and an essential regulator of osteoblast biology: implication for Coffin-Lowry syndrome[J].Cell,2004,117(3) : 387-398.
[12]Wingate AD,Campbell DG,Peggie M,et al.Nur77 is phosphorylated in cells by RSK in response to mitogenic stimulation[J].Biochem J,2006,393(Pt 3) : 715-724.
[13]Peng C,Cho YY,Zhu F,et al.RSK2 mediates NF-κB activity through the phosphorylation of IκBα in the TNFR1 pathway[J].FASEB J,2010,24(9) : 3490-3499.
[14]She QB,Ma WY,Zhong S,et al.Activation of JNK1,RSK2,and MSK1 is involved in serine 112 phosphorylation of Bad by ultraviolet B radiation[J].J Biol Chem,2002,277(27) : 24039-24048.
[15]Anjum R,Roux PP,Ballif BA,et al.The tumor suppressor DAP kinase is a target of RSK-mediated survival signaling[J].Curr Biol,2005,15(19) : 1762-1767.
[16]Lee CJ,Lee MH,Lee JY,et al.RSK2-induced stress tolerance enhances cell survival signals mediated by inhibition of GSK3β activity[J].Biochem Biophys Res Commun,2013,440(1) : 112-118.
[17]Jaballah M,Mohamed IA,Alemrayat B,et al.Na+/H+exchanger isoform 1 induced cardiomyocyte hypertrophy involves activation of p90 ribosomal S6 kinase[J].PLoS One,2015,10(4) : e0122230.
[18]Fujita N,Sato S,Tsuruo T.Phosphorylation of p27Kip1at threonine 198 by p90 ribosomal protein S6 kinases promotes its binding to 14-3-3 and cytoplasmic localization [J].J Biol Chem,2003,278(49) : 49254-49260.
[19]Kang S,Elf S,Lythgoe K,et al.p90 ribosomal S6 kinase 2 promotes invasion and metastasis of human head and neck squamous cell carcinoma cells[J].J Clin Invest,2010,120(4) : 1165-1177.
[20]Kang S,Elf S,Dong S,et al.Fibroblast growth factor receptor 3 associates with and tyrosine phosphorylates p90 RSK2,leading to RSK2 activation that mediates hematopoietic transformation[J].Mol Cell Biol,2009,29(8) : 2105-2117.
[21]Kang S,Chen J.Targeting RSK2 in human malignancies [J].Expert Opin Ther Targets,2011,15(1) : 11-20.
[22]Clark DE,Errington TM,Smith JA,et al.The serine/ threonine protein kinase,p90 ribosomal S6 kinase,is an important regulator of prostate cancer cell proliferation [J].Cancer Res,2005,65(8) : 3108-3116.
[23]Cho YY,Lee MH,Lee CJ,et al.RSK2 as a key regulator in human skin cancer[J].Carcinogenesis,2012,33 (12) : 2529-2537.
[24]Bosch A,Eroles P,Zaragoza R,et al.Triple-negative breast cancer: molecular features,pathogenesis,treatment and current lines of research[J].Cancer Treat Rev,2010,36(3) : 206-215.
[25]Stratford AL,Reipas K,Hu K,et al.Targeting p90 ribosomal S6 kinase eliminates tumor-initiating cells by inactivating Y-box binding protein-1 in triple-negative breast cancers[J].Stem Cells,2012,30(7) : 1338-1348.
[26]Nguyen TL.Targeting RSK: an overview of small molecule inhibitors[J].Anticancer Agents Med Chem,2008,8 (7) : 710-716.
[27]Sapkota GP,Cummings L,Newell FS,et al.BI-D1870 is a specific inhibitor of the p90 RSK (ribosomal S6 kinase) isoforms in vitro and in vivo[J].Biochem J,2007,401 (1) : 29-38.
[28]Roberts NA,Haworth RS,Avkiran M.Effects of bisindolylmaleimide PKC inhibitors on p90RSKactivity in vitro and in adult ventricular myocytes[J].Br J Pharmacol,2005,145(4) : 477-489.
[29]Krishnan S,Miller RM,Tian B,et al.Design of reversible,cysteine-targeted Michael acceptors guided by kinetic and computational analysis[J].J Am Chem Soc,2014,136(36) : 12624-12630.
[30]London N,Miller RM,Krishnan S,et al.Covalent docking of large libraries for the discovery of chemical probes [J].Nat Chem Biol,2014,10(12) : 1066-1072.
[31]Yao K,Chen H,Liu K,et al.Kaempferol targets RSK2 and MSK1 to suppress UV radiation-induced skin cancer [J].Cancer Prev Res (Phila),2014,7(9) : 958-967.
[32]Liu K,Cho YY,Yao K,et al.Eriodictyol inhibits RSK2-ATF1 signaling and suppresses EGF-induced neoplastic cell transformation[J].J Biol Chem,2011,286 (3) : 2057-2066.
[33]Derewenda U,Artamonov M,Szukalska G,et al.Identification of quercitrin as an inhibitor of the p90 S6 ribosomal kinase (RSK) : structure of its complex with the N-terminal domain of RSK2 at 1.8resolution[J].Acta Crystallogr D Biol Crystallogr,2013,69(Pt 2) : 266-275.
[34]Costales A,Mathur M,Ramurthy S,et al.2-Amino-7-substituted benzoxazole analogs as potent RSK2 inhibitors [J].Bioorg Med Chem Lett,2014,24(6) : 1592-1596.
[35]Zhong Y,Xue M,Zhao X,et al.Substituted indolin-2-ones as p90 ribosomal S6 protein kinase 2 (RSK2) inhibitors: molecular docking simulation and structure-activity relationship analysis[J].Bioorg Med Chem,2013,21 (7) : 1724-1734.
[36]Nguyen TL,Gussio R,Smith JA,et al.Homology model of RSK2 N-terminal kinase domain,structure-based identification of novel RSK2 inhibitors,and preliminary common pharmacophore[J].Bioorg Med Chem,2006,14(17) : 6097-6105.
[37]Dobbelstein M,Moll U.Targeting tumour-supportive cellular machineries inanticancer drug development[J].Nat Rev Drug Discov,2014,13(3) : 179-196.
(责任编辑:林白霜,罗森)
Progress in association of RSK2 with malignancies and its inhibitors
CHEN Kang-xing1,WANG Zi-you2,HUANG Yan-xia3,ZHONG Cheng-zhi1,LI Kai-heng1,HUANG Zun-nan2
(1The Second Clinical Medical College,2China-American Cancer Research Institute,3School of Public Health,Guangdong Medical University,Dongguan 523808,China.E-mail: zn_huang@yahoo.com)
R363
A
10.3969/j.issn.1000-4718.2015.10.008
1000-4718(2015)10-1772-08
2015-04-13
2015-07-14
国家自然科学基金资助项目(No.31160706) ;广东省高等学校学科与专业建设专项资金(No.2013KJCX0090) ;广东医学院大学生创新实验项目启动资金(No.LZDS005)
△Tel: 0769-22896049; E-mail: zn_huang@yahoo.com
