Foxp3+Tregs和PD1在胃癌组织中的表达及其临床病理意义*
2015-03-22侯婧瑛向仍运陈淑芬吴淑云王凌云中山大学附属孙逸仙纪念医院急诊科重症医学科消化内科病理科广东广州00湘西自治州人民医院消化内科湖南吉首6000
侯婧瑛,向仍运,陈淑芬,于 钟,吴淑云,王 林,王凌云△(中山大学附属孙逸仙纪念医院急诊科,重症医学科,消化内科,病理科,广东广州00;湘西自治州人民医院消化内科,湖南吉首6000)
Foxp3+Tregs和PD1在胃癌组织中的表达及其临床病理意义*
侯婧瑛1,向仍运2,陈淑芬3,于钟4,吴淑云4,王林5,王凌云4△
(中山大学附属孙逸仙纪念医院1急诊科,3重症医学科,4消化内科,5病理科,广东广州510120;2湘西自治州人民医院消化内科,湖南吉首416000)
目的:探讨胃癌组织中Foxp3+调节性T细胞(Foxp3+Tregs)与程序性死亡受体1(PD1)的表达情况及两者与胃癌患者临床病理和预后的关系。方法:采用免疫组织化学方法检测111例胃癌患者癌组织和20例正常胃黏膜组织中Foxp3+Tregs及PD1的表达情况,分析胃癌组织中两者的表达与患者临床病理和预后的关系及两项指标之间的相关性。结果:胃癌组织中Foxp3+Tregs和PD1表达增加,PD1表达于肿瘤浸润性淋巴细胞(TILs),两者的表达均与淋巴结转移及TNM分期相关(P<0. 05),而与其它临床病理因素如肿瘤大小、病理类型,病变部位均无关,以上指标表达阳性者总体生存率低(P<0. 05),预后差。胃癌组织中Foxp3+Tregs与PD1+TILs的表达之间存在显著的正相关(P<0. 01)。结论:胃癌组织中存在Foxp3+Tregs和PD1+TILs共同表达,二者可作为判断胃癌患者疾病进展及预后的生物学标志物。
胃癌; Foxp3+调节性T细胞;程序性死亡受体1;肿瘤浸润性淋巴细胞;临床病理;预后
[ABSTRACT]AIM: To investigate the expression of Foxp3+regulatory T cells (Foxp3+Tregs) and programmed death receptor 1 (PD1) in gastric cancer tissues and their association with clinicopathological factors and prognosis of the patients.The correlation between the 2 molecules was also analyzed at the same time.METHODS: The tumor sections from 111 gastric cancer patients were stained for Foxp3 and PD1 by the method of immunohistochemistry.The associations of the expression levels of these 2 molecules with clinicopathological factors involved in the disease progression and prognosis were statistically analyzed.The relationship of their expression was detected.RESULTS: Foxp3+Tregs and PD1 were expressed in the gastric cancer tissues,and PD1 was expressed in the tumor infiltrating lymphocytes (TILs).The expression of Foxp3 and PD1 was correlated with lymph node metastasis,clinicopathological stage and prognosis of gastric cancer patients.The expression of these 2 determinants in the patients with lymph node metastasis and an advanced clinicopathological stage was distinctly higher (P<0. 05).The patients with positive expression of the 2 indexes presented a lower overall survival rate and worse prognosis (P<0. 05).A significantly positive correlation between the infiltration of Foxp3+Tregs and the expression of PD1+TILs was also observed (P<0. 01).CONCLUSION: Foxp3+Tregs and PD1+TILs coinfiltrate in the gastric cancer tissues,which can be used as biological markers to predict the disease progression and prognosis.
[KEY WORDS]Gastric cancer; Foxp3+regulatory T cells; Programmed death receptor 1; Tumor infiltrating lymphocytes; Clinicopathology; Prognosis
胃癌是消化系统常见的恶性肿瘤之一,流行病学资料显示,全球每年约有64万人因胃癌死亡,位居癌症死因的第2位[1]。由于早期胃癌症状无特异性,而当症状明显时病变已属晚期,因此大部分胃癌确诊时多为进展期胃癌,恶性程度高,易出现转移。因此,深入研究胃癌的发生发展机制,寻找治疗的新靶点,以预防肿瘤的复发和转移从而改善患者的预后意义重大。
调节性T细胞(regulatory T cells,Tregs)在免疫耐受中起着至关重要的作用,其中CD4+CD25+Tregs最受关注[2],是造成肿瘤免疫逃逸的重要机制之一,其特异性标记为叉头框蛋白P3(forkhead box protein P3,Foxp3)。研究表明多种肿瘤患者外周血及肿瘤局部组织中存在Tregs数量及比例升高,从而抑制了肿瘤免疫反应,加速了肿瘤生长,降低了患者的生存率[3]。应用治疗性肿瘤疫苗的同时清除体内的Tregs能够明显增强抗肿瘤治疗的效果[4]。我们的前期研究发现胃癌患者外周血中存在Tregs比例的显著增高[5-6]。因此,阐明Tregs在胃癌中的调节机制对于寻求更为有效的针对胃癌的抗肿瘤免疫治疗策略至关重要。
程序性死亡受体1(programmed death receptor 1,PD1)是CD28家族的成员之一,它能够通过与其配体相互作用引起活化的T细胞凋亡从而发挥负向免疫调控效应[7]。现发现PD1在多种肿瘤组织的肿瘤浸润淋巴细胞(tumor infiltrating lymphocytes,TILs)中高表达并介导了疾病的不良预后[8-9]。研究表明PD1与Tregs产生和功能维持相关[7]。而目前PD1的表达与胃癌的发生发展的关系尚不明确,PD1在胃癌组织中的表达如何及其与Tregs具有怎样的关系亦尚未见研究报道。本研究的目的在于检测胃癌患者肿瘤组织中Foxp3+Tregs与PD1的表达情况并进一步分析两者与胃癌临床病理和预后的关系,同时探讨两者表达之间的相关性。以为胃癌的早期诊治及寻求新的抗肿瘤免疫治疗策略提供一定的理论依据。
材料和方法
1病例收集
实验组来源于2007年7月~2011年2月期间在中山大学孙逸仙纪念医院进行手术治疗并经术后病理证实为胃癌的初治患者111例,所有患者术前均未行放疗、化疗并排除同时有自身免疫性疾病及免疫抑制剂使用病史者(本实验符合中山大学医学伦理学委员会的相关规定)。111例胃癌患者临床病理特点见表1。111例均获得完全随访,随访日期截至2011年9月,其中生存66例,死亡45例。对照组来源于同期经病理证实为胃溃疡并因发生穿孔而行穿孔修补术的术后正常胃黏膜组织20例。其中男16例,女4例。年龄13~74岁,平均年龄47岁,中位年龄54岁。

表1 111例胃癌患者临床病例特点Table 1.Clinicopathological characteristics of 111 gastric cancerpatients
2试剂
Foxp3兔抗人多克隆抗体(Sigma) ; PD1兔抗人多克隆抗体(Abcam) ;通用型免疫组化试剂盒、3,3-二氨基苯联胺(diaminobenzidine,DAB)显色剂Ⅰ抗稀释液(中杉金桥)。
3免疫组化染色方法
采用免疫组织化学SP三步法,将111例胃癌患者石蜡标本4 μm连续切片,烤干后备用。石蜡切片常规二甲苯,梯度乙醇,脱蜡至水,用pH = 6的柠檬酸盐持续沸腾状态热修复20 min后,室温冷却;磷酸缓冲盐溶液(phosphate-buffered saline,PBS)洗5 min,重复3次;阻断剂3%过氧化氢(hydrogen peroxide,H2O2)去内源性过氧化酶,室温15 min; PBS洗5 min,重复3次;加封闭液(正常山羊血清)室温封闭15 min;倾去封闭液,(勿洗)滴加Ⅰ抗,4℃过夜; PBS洗5分,重复3次;滴加生物素标记的抗鼠/兔IgG的Ⅱ抗(试剂C),室温20分钟; PBS洗5 min,重复3 次;滴加辣根过氧化酶标记的链霉菌抗生物素蛋白(试剂D)室温20 min; PBS洗5 min,重复3次;滴加显色剂DAB,光镜下观察,显色适当后用水终止;苏木素复染细胞核,水洗;脱水、透明、中性树胶封片。
4结果判断
阳性结果判定:细胞胞浆、胞核和(或)胞膜出现黄至棕褐色颗粒为阳性显色。PD1在TILs中表达,为胞膜或胞浆阳性; Foxp3在TILs表达,为胞核阳性。选择切片中富含淋巴细胞的区域,高倍视野下记录5个视野,计数表达阳性的淋巴细胞的个数,每个视野计数3次,取5个视野阳性细胞的均数作为表达阳性的淋巴细胞的数目,同时计数阳性淋巴细胞占总的TILs的百分比,每个视野计数3次,并将所得的5个视野阳性细胞百分比均值作为阳性细胞表达的百分数,阳性淋巴细胞数目占总的TIL超过5%为相应的指标表达阳性。
5统计学处理
采用SPSS 13. 0进行统计学分析,定量资料2组间比较采用两独立样本的秩和检验(Mann-Whitney 法),定性资料的比较采用χ2检验及Fisher确切概率法,定性资料的相关性分析采用χ2检验,用Kaplan-Meier法和log-rank检验逐一分析各变量与患者术后生存的关系,以P<0. 05为差异有统计学意义。

Figure 1.Immunohistochemical staining for Foxp3+Tregs derived from the tumor tissues of gastric cancer patients (×200).A: the positive expression of Foxp3+Tregs (nuclear,brown color) in the tumor tissues by immunohistochemical staining; B: immunohistochemical staining of Foxp3+Tregs in the normal tissues.图1 Foxp3+Treg在胃癌组织及正常胃黏膜组织中的表达情况

表2 111例胃癌患者胃癌组织中Foxp3+Tregs的表达与临床病理的关系Table 2.Correlation between expression of Foxp3+Tregs and clinicopathological parameters of 111 gastric cancer patients
结果
1Foxp3+Tregs在胃癌组织中的表达及与患者临床病理和预后的关系
111例胃癌患者Foxp3+Tregs阳性表达者77例,阳性表达率为69. 40%,胃癌组织中Foxp3+Tregs平均数目为7. 18±0. 68,占总TILs的平均比例为(11. 02±7. 86) %,正常胃黏膜组织中未见Foxp3+Tregs表达。胃癌组织中Foxp3+Tregs浸润的阳性细胞数目高于正常胃黏膜组织(P<0. 01),见图1。Foxp3+Tregs表达与淋巴结转移和TNM分期相关(P<0. 05),与其它临床病理因素无关(P>0. 05),淋巴结转移阳性、TNM分期越晚,Foxp3+Tregs表达的阳性率越高(表2)。生存分析结果显示本组胃癌患者胃癌组织中Foxp3+Tregs表达与患者术后生存情况相关,Foxp3+Tregs表达阳性者总体生存率低,预后差,见图2。
2PD1在胃癌组织中的表达情况及与胃癌患者临床病理和预后的关系
PD1表达于TILs,111例胃癌患者PD1+TILs阳性表达者72例,阳性表达率为64. 86%,胃癌组织中平均数目为9. 66±0. 42,占总TILs的平均比例为
(29. 44±0. 26) %,正常胃黏膜组织中未见表达。胃癌组织中PD1+TILs数目显著高于正常胃黏膜组织(P<0. 01),见图3。PD1+TILs表达与淋巴结转移和TNM分期相关(P<0. 05),与其它临床病理因素无关,淋巴结转移阳性者及TNM分期越晚,PD1+TILs表达的阳性率越高(表3)。生存分析结果显示本组胃癌患者胃癌组织中PD1+TILs的表达与患者术后生存相关,表达阳性者总体生存率低,预后差(图4)。
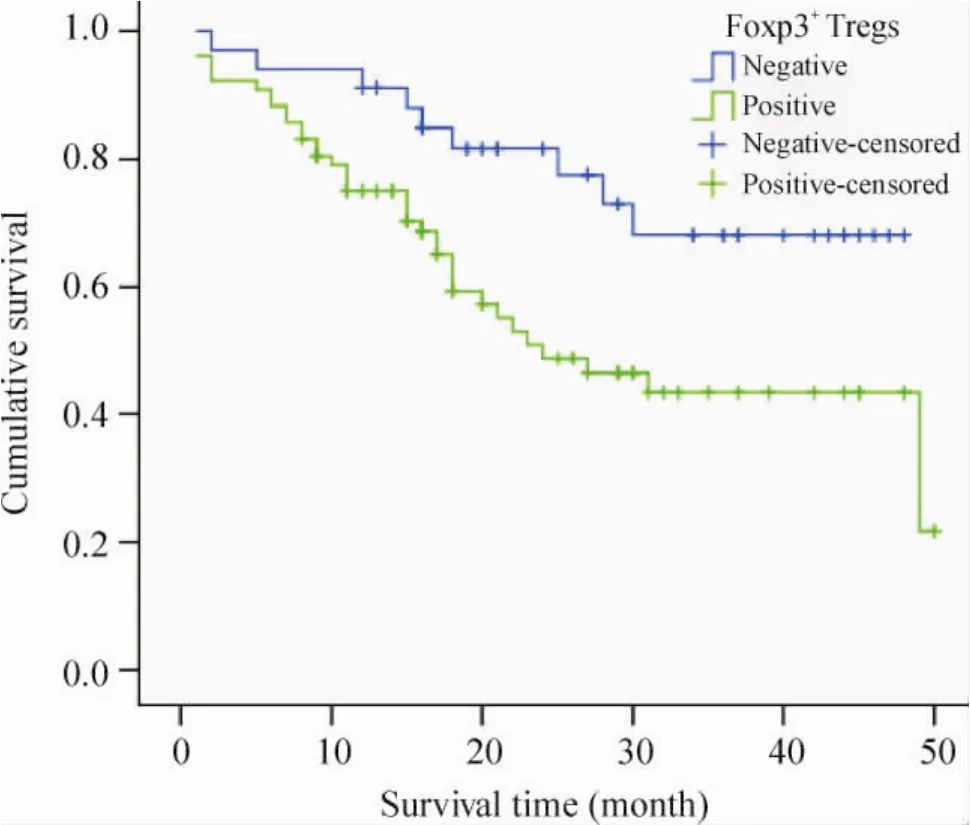
Figure 2.The Kaplan-Meier curve for the overall survival of 111 gastric cancer patients based on the expression of Foxp3+Tregs in the tumor tissues.Correlation of Foxp3+Tregs expression with the overall survival of 111 gastric cancer patients was checked with the logrank test.图2 111例胃癌患者胃癌组织Foxp3+Tregs的表达与患者术后生存的关系
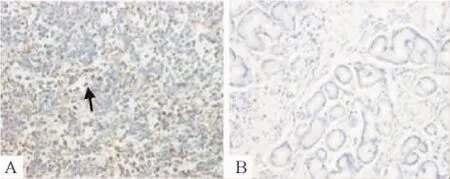
Figure 3.Immunohistochemical staining for PD1+TILs derived from the tumor tissues of gastric cancer patients (×200).A: the positive expression of PD1+TILs (membrane and cytoplasm,brown color) in the tumor tissues by immunohistochemical staining; B: immunohistochemical staining of PD1+TILs in the normal tissues.图3 PD1+TILs在胃癌组织及正常胃黏膜组织中的表达情况

表3 111例胃癌患者胃癌组织中PD1+TILs的表达与患者临床病理的关系Table 3.Correlation between expression of PD1+TILs and clinicopathological parameters of 111 gastric cancer patients

Figure 4.The Kaplan-Meier curve for the overall survival of 111 patients with gastric cancer based on the expression of PD1+TILs in the tumor tissues.Correlation of PD1+TILs expression with the overall survival of 111 gastric cancer patients was checked with the log-rank test.图4 111例胃癌患者胃癌组织PD1+TILs的表达与患者术后生存的关系
3胃癌组织Foxp3+Tregs浸润与PD1+TILs表达与之间的相关性
本组胃癌患者胃癌组织中Foxp3+Tregs的浸润与PD1+TILs的表达存在正相关性(P<0. 01),PD1+TILs表达阳性组的患者,其Foxp3+Tregs的阳性表达率亦显著增高(P<0. 01),见表4。

表4 111例胃癌患者胃癌组织Foxp3+Tregs与PD1+TILs的表达与之间的相关性Table 4.Correlation between infiltration of Foxp3+Tregs and expression of PD1+TILs in the tumor tissues of 111 gastric cancer patients
讨论
Foxp3+Tregs是一群具有独特免疫调节功能的T细胞亚群,在抑制免疫反应和维持机体免疫耐受中发挥着重要作用[2]。Foxp3已被证实是Tregs发育、分化和功能维持中的一个至关重要的决定性因子[10]。多项研究表明肿瘤患者外周血及肿瘤局部微环境中存在Tregs数量及比例升高,且这种现象直接介导了自身免疫效应细胞对肿瘤的免疫耐受,并与肿瘤的进展程度及不良预后密切相关[3]。我们的前期研究表明胃癌患者外周血中Tregs比例显著增高,并与患者临床病理存在相关性,淋巴结转移阳性和TNM分期越晚,Tregs表达率越高,切除原发肿瘤后机体内Tregs水平有所下降,复发时增加,Tregs比例对判断胃癌病期及预后有一定价值[5-6]。Perrone等[11]对胃癌患者进行的研究中发现,肿瘤内Foxp3高表达的患者根治术后预后较差。在本研究中,胃癌患者肿瘤组织中Foxp3+Tregs表达显著增加,并且其表达与患者的淋巴结转移及TNM分期相关。有淋巴结转移者及TNM分期越晚,Foxp3+Treg表达的阳性率明显增高,表明Foxp3+Tregs在胃癌组织中的表达介导了肿瘤的免疫逃逸,从而导致了疾病进展。生存分析结果显示Foxp3+Tregs的表达与患者术后生存相关,表达阳性者术后总体生存率低,预后差,提示Foxp3+Tregs可作为判断胃癌患者预后的生物学指标。
PD1作为免疫球蛋白超家族成员之一,是一类分子量为50~55 kD的I型跨膜糖蛋白。它可被诱导表达于多种免疫细胞,包括T细胞、B细胞、树突状细胞和单核细胞等[7],对T细胞的增殖和功能起负向调节作用。PD1信号通过多种机制抑制T细胞免疫,如抑制自身反应性初始T细胞向效应T细胞转化、直接抑制效应T细胞、诱导效应T细胞向Tregs转化以及通过激活Tregs或DC等来抑制效应T细胞,而对PD1信号通路进行阻断后能够逆转其介导的T细胞功能失调。目前已有多项证据表明阻断PD1途径是一个有效的抗肿瘤免疫治疗手段。研究证实在动物实验中对PD1或其配体进行阻断可增强肿瘤特异性T细胞反应,增强效应T细胞介导的抗肿瘤作用从而抑制肿瘤细胞增殖[12]。现已在多种肿瘤组织中检测到PD1的表达。PD1在TILs中的表达介导了肿瘤微环境中的免疫抑制效应并促进了肿瘤进展。研究表明在乳腺癌和肾癌组织中PD1在TILs表面的高表达介导了肿瘤的免疫逃逸及患者的不良预后[8-9]。另有研究发现PD1在黑色素瘤患者的外周血和肿瘤组织中的TILs表面呈高表达,引起效应T细胞的耗竭和功能障碍,并拮抗抗肿瘤免疫反应[13]。不仅如此,现已有临床研究运用相应抗体对PD1途径进行阻断以达到抗肿瘤免疫治疗的目的。在对多种实体肿瘤进行的研究中发现,运用PD1抗体间歇性治疗在转移性黑色素瘤、结肠直肠癌、前列腺癌及非小细胞肺癌及肾癌的患者中均表现出较好的耐受性及一定的抗肿瘤效应[14]。本研究发现PD1在胃癌组织的TILs中呈现高表达,并且其表达与及淋巴结转移和TNM分期相关,有淋巴结转移者及TNM分期越晚,PD1+TILs表达率越高。生存分析结果显示PD1+TILs阳性组总体生存率显著降低。我们推断胃癌组织中PD1在TILs的高表达抑制了TILs的增殖和活化并诱导T细胞无能,从而引起胃癌细胞的免疫耐受,并使其逃避机体的免疫监控,导致了患者的疾病进展及不良预后,PD1+TILs可以作为评估胃癌预后的一个指标。
PD1与Tregs的扩增和功能维持密切相关。研究证实PD1在TILs中的表达上调能够增强Tregs的免疫抑制功能[15]。Ghebeh等[16]对乳腺癌的研究显示肿瘤组织中PD1+TILs的表达与Foxp3+Tregs呈正相关; Kang等[9]对肾癌的研究发现PD1+TILs表达与Tregs在瘤体内浸润亦呈显著正相关; French等[17]发现在甲状腺乳头状癌转移的淋巴结组织中存在PD1+TILs高表达,并与Tregs浸润呈正相关。PD1/程序性死亡配体1(programmed death ligand 1,PDL1)通路能够诱导Foxp3的表达,阻断PD1信号能够抑制Foxp3+Tregs的增殖[18]。研究发现PD1/ PDL1通路在DCs诱导的Tregs的扩增中发挥重要作用。PDL1在耐受性树突状T细胞(tolerance dendri-tic T cells,Tol-DCs)表面的表达上调能够刺激Foxp3+Tregs的扩增[19].。Duraiswamy等[18]对卵巢癌的研究发现阻断PD-1/PD-L1通路能够增强TILs的扩增和其功能,同时抑制Tregs的产生。本研究发现在胃癌组织中Foxp3+Tregs和PD1+TILs的表达均明显增加,并且两者均与淋巴结转移、TNM分期及术后生存相关,两者的表达增加介导了患者的疾病进展及不良预后。对Foxp3+Tregs和PD1+TILs的表达进行相关分析发现两者之间呈现显著的正相关关系,我们推测胃癌组织中PD1+TILs的高表达可能参与调节Foxp3+Tregs的产生和其负向免疫调控功能的维持,因此对Foxp3+Tregs和PD1进行联合阻断将能够在针对胃癌的抗肿瘤免疫治疗中发挥更好的效应。到目前为止,肿瘤微环境中PD1对Tregs的具体调节作用及机制如何仍未明确,PD1的表达是否直接介导了Tregs的产生及通过何种途径介导其产生仍有待进一步深入研究。
[1]徐飚,王建明.胃癌流行病学研究[J].中华肿瘤防治杂志,2006,13(1) : 81-87.
[2]Nishikawa H,Sakaguchi S.Regulatory T cells in tumor immunity[J].Int J Cancer,2010,127(4) : 759-767.
[3]deLeeuw RJ,Kost SE,Kakal JA,et al.The prognostic value of FoxP3+tumor-infiltrating lymphocytes in cancer: a critical review of the literature[J].Clin Cancer Res,2012,18(11) : 3022-3029.
[4]Roselli M,Cereda V,di Bari MG,et al.Effects of conventional therapeutic interventions on the number and function of regulatory T cells[J].Oncoimmunology,2013,2 (10) : e27025.
[5]王凌云,陈映波,冯练强.胃癌患者外周血CD4+CD25+调节T细胞的检测及临床意义[J].中国免疫学杂志,2005,21(12) : 932-935.
[6]王凌云,黄开红,闵军.胃癌患者外周血调节性T细胞的多种细胞因子水平的检测及其意义[J].中华实验外科杂志,2006,23(11) : 1375-1377.
[7]Gianchecchi E,Delfino DV,Fierabracci A.Recent insights into the role of the PD-1/PD-L1 pathway in immunological tolerance and autoimmunity[J].Autoimmun Rev,2013,12(11) : 1091-1100.
[8]Sun S,Fei X,Mao Y,et al.PD-1+immune cell infiltration inversely correlates with survival of operable breast cancer patients[J].Cancer Immunol Immunother,2014,63(4) : 395-406.
[9]Kang MJ,Kim KM,Bae JS,et al.Tumor-infiltrating PD1-positive lymphocytes and Foxp3-positive regulatory T cells predict distant metastatic relapse and survival of clear cell renal cell carcinoma[J].Transl Oncol,2013,6(3) : 282-289.
[10]Darrasse-Jèze G,Podsypanina K.How numbers,nature,and immune status of Foxp3+regulatory T-cells shape the early immunological events in tumor development[J].Front Immunol,2013,4: 292.
[11]Perrone G,Ruffini PA,Catalano V,et al.Intratumoural FOXP3-positive regulatory T cells are associated with adverse prognosis in radically resected gastric cancer[J].Eur J Cancer,2008,44(13) : 1875-1882.
[12]Chauvin JM,Pagliano O,Fourcade J,et al.TIGIT and PD-1 impair tumor antigen-specific CD8+T cells in melanoma patients[J].J Clin Invest,2015,125(5) : 2046-2058.
[13]Mahoney KM,Freeman GJ,McDermott DF.The next immune-checkpoint inhibitors: PD-1/PD-L1 blockade in melanoma[J].Clin Ther,2015,37(4) : 764-782..
[14]Romano E,Romero P.The therapeutic promise of disrupting the PD-1/PD-L1 immune checkpoint in cancer: unleashing the CD8 T cell mediated anti-tumor activity results in significant,unprecedented clinical efficacy in various solid tumors[J].J Immunother Cancer,2015,3: 15.
[15]Park HJ,Kusnadi A,Lee EJ,et al.Tumor-infiltrating regulatory T cells delineated by upregulation of PD-1 and inhibitory receptors[J].Cell Immunol,2012,278(1-2) : 76-83.
[16]Ghebeh H,Barhoush E,Tulbah A,et al.Foxp3+Tregsand B7-H1+/PD-1+T lymphocytes co-infiltrate the tumor tissues of high-risk breast cancer patients: implication for immunotherapy[J].BMC Cancer,2008,8: 57.
[17]French JD,Kotnis GR,Said S,et al.Programmed death-1+T cells and regulatory T cells are enriched in tumor-involved lymph nodes and associated with aggressive features in papillary thyroid cancer[J].J Clin Endocrinol Metab,2012,97(6) : E934-E943.
[18]Duraiswamy J,Freeman GJ,Coukos G.Therapeutic PD-1 pathway blockade augments with other modalities of immunotherapy T-cell function to prevent immune decline in ovarian cancer[J].Cancer Res,2013,73(23) : 6900-6912.
[19]Wu C,Zhang Y,Jiang Y,et al.Apoptotic cell administration enhances pancreatic islet engraftment by induction of regulatory T cells and tolerogenic dendritic cells[J].Cell Mol Immunol,2013,10(5) : 393-402.
(责任编辑:林白霜,罗森)
Expression of Foxp3+Tregs and PD1 in gastric cancer tissues and their correlation with clinicopathological factors and prognosis
HOU Jing-ying1,XIANG Reng-yun2,CHEN Shu-fen3,YU Zhong4,WU Shu-yun4,WANG Lin5,WANG Ling-yun4
(1Emergency Department,3Intensive Care Medicine Department,4Gastroenterology Department,5Pathology Department,The Sun Yat-sen Memorial Hospital,Sun Yat-sen University,Guangzhou 510120,China;2Gastroenterology Department of People’s Hospital of Xiangxi Autonomous Prefecture,Jishou 416000,China.E-mail: xzr020@aliyun.com)
R363; R730. 23
A
10.3969/j.issn.1000-4718.2015.10.003
1000-4718(2015)10-1744-06
2015-06-01
2015-07-10
广东省科技社会发展项目(No.2012B031800362)
△Tel: 020-81332489; E-mail: xzr020@aliyun.com
