热打击对大鼠肺组织血管内皮生长因子A的影响
2015-03-21杨文超高铁婴李瑞生赵佳佳周京江
杨文超,高铁婴,胡 婕,李瑞生,赵佳佳,周京江,宋 青
1解放军总医院 重症医学科,北京 100853;2解放军第302医院 动物实验中心,北京 100039
热打击对大鼠肺组织血管内皮生长因子A的影响
杨文超1,高铁婴1,胡 婕1,李瑞生2,赵佳佳1,周京江1,宋 青1
1解放军总医院 重症医学科,北京 100853;2解放军第302医院 动物实验中心,北京 100039
目的研究热打击对大鼠肺组织血管内皮生长因子A(vascular endothelial growth factor A,VEGF-A)及相关细胞因子的影响。方法雄性SD大鼠30只,随机分为空白对照组(n=10),热打击+恢复15 min组(n=10),热打击+恢复3 h组(n=10)。热打击组大鼠麻醉后置于高温高湿模拟环境中,肛温达到42℃后置于室温分别恢复15 min及3 h。酶联免疫法(Elisa)测各组大鼠肺组织匀浆VEGF-A及相关细胞因子水平。结果热打击+恢复15 min组VEGF-A、转化生长因子β1(transforming growth factor beta1,TGF-β1)水平较空白对照组显著升高,热打击+恢复3 h组VEGF-A、TGF-β1水平较空白对照组显著降低,且VEGF-A水平与TGF-β1水平呈直线回归关系。热打击+恢复3 h组促炎细胞因子TNF-α水平略高于热打击+恢复15 min组和空白对照组。3组大鼠促炎细胞因子IL-6水平差异无统计学意义。结论热打击早期大鼠肺组织VEGF-A水平短暂升高后,下降至正常水平以下,可能成为热打击后大鼠急性肺损伤发病初始阶段的重要环节,且该变化可能仅与热直接损伤有关。
热打击;肺;血管内皮生长因子A
热射病是机体暴露在高温、高湿环境中,核心体温迅速升高伴中枢神经系统症状为特征的致命性急症,发病后迅速出现全身炎性反应综合征及多器官功能衰竭,病情重、病死率高[1-3]。临床上,75%热射病患者出现多器官功能障碍,其中呼吸窘迫综合征极为常见,为发病后热直接损伤和急性炎性损伤所致[4]。在热射病死亡病例中,14%的患者伴有呼吸衰竭[5]。动物实验证明,热打击后肺组织出现急性炎症反应、肺间质水肿和出血[4,6-8]。血管内皮生长因子A(vascular endothelial growth factor A,VEGF-A)通过增加血管通透性,促进内皮细胞增殖、血管生成、血管新生,防止细胞凋亡,募集单核细胞等过程调节内皮细胞功能,在急性肺损伤/急性呼吸窘迫综合征前期肺水肿及后期组织修复过程中发挥重要作用,其表达和功能与病程进展、上皮细胞及内皮细胞损伤程度有关。转化生长因子β1(transforming growth factor beta1,TGF-β1)、肿瘤坏死因子α(tumor necrosis factoralpha,TNF-α)、白细胞介素6(inter-leukin-6,IL-6)参与并上调肺组织VEGF-A表达[9]。热射病多为散发病例,发病率较低,大样本临床研究较困难,因此多应用动物实验进行。此外,热射病急性肺损伤过程中关于VEGF-A的研究国内外尚属空白。为此,我们设计了本实验,旨在通过研究热打击后大鼠肺组织VEGF-A及相关细胞因子的变化,初步探讨VEGF-A在热射病早期急性肺损伤中的作用。
材料和方法
1 实验对象 健康雄性Sprague-Dwley大鼠30只,12 ~ 14周龄,体质量(205±25) g,SPF级,由解放军第302医院提供,分笼适应性饲养3 d(使用动物合格证书编号为军动管字第2014022191号),温度(23±1)℃,湿度(40±5)%,灯光照明,12 h昼夜节律变化。实验过程中遵守实验动物伦理原则,关注动物福利,爱护动物,尽可能减少对动物的损害。
2 主要仪器和试剂 自制环境模拟舱,动物肛温表,定时秒表,离心机,电动匀浆器,EP管。PBS液,苯甲基磺酰氟(phenylmethylsulfonyl fluoride,PMSF),BCA蛋白定量试剂盒(碧云天生物技术有限公司),ELISA检测试剂盒(欣博盛生物科技有限公司):VEGF-A(ERC103.96),TGF-β1(ERC107b.96),TNF-α(ERC102a.96),IL-6(ERC003.96)。
3 实验分组与热打击模型建立 实验前12 h禁食不禁水。实验动物按随机数字表法随机分为空白对照组(n=10)和热打击组(n=20)。空白对照组始终置于室温环境[温度(23±1)℃,湿度(40±5)%]中。热打击组10%水合氯醛2 ml/kg腹腔麻醉后,置于温度(37.5±0.5)℃、湿度(65±5)%的模拟环境中,监测核心体温至达到42℃后,将热打击组随机分为2组,分别为热打击+恢复15 min组(n=10)、热打击+恢复3 h组(n=10)[10-12]。热打击组核心体温达到42℃时转移至室温环境中恢复,并在相应时间点处死动物。空白对照组10%水合氯醛2 ml/kg腹腔麻醉后测核心体温处死。
4 核心体温监测 使用动物肛温表测量肛温作为核心体温,记为Tc(℃)。Tc<41℃时,每15 min测量1次;Tc>41℃时,每5 min测量1次,直至造模成功,并记录造模时间(min)。
5 肺组织VEGF-A及相关细胞因子检测各组大鼠均在10%水合氯醛麻醉下颈动脉取血处死。剪取适量右肺下叶同一区域组织置于2 ml EP管中,加入500 μl遇冷PBS,加入终浓度为1 mmol/L的PMSF,电动匀浆器匀浆10 s×3次,冰上放置20 min。4℃,15 000 r/m离心20 min。离心后,收集上清液,BCA蛋白定量测定各个样本的蛋白浓度,用PBS将各个样本的蛋白调整为蛋白浓度一致(5 mg/ml),Elisa检测VEGF-A、TGF-β1、TNF-α、IL-6浓度。
6 数据处理 采用SPSS13.0进行分析。计量资料以-x±s表示,采用完全随机设计的方差分析,SNK-q检验法进行多重比较。Pearson相关描述两变量相关关系并做直线回归分析。两组样本均数比较采用两独立样本t检验。P<0.05为差异有统计学意义。
结 果
1 一般情况 各组大鼠体质量、造模前体温、造模成功体温、造模时间差异均无统计学意义。见表1。
2 热打击对肺组织VEGF-A的影响 热打击+恢复15 min组VEGF-A水平显著高于空白对照组(P<0.05),热打击+恢复3 h组VEGF-A水平显著低于空白对照组(P<0.05),热打击+恢复3 h组VEGF-A水平显著低于热打击+恢复15 min组(P<0.05)。见表2。
3 热打击对肺组织TGF-β1、TNF-α、IL-6的影响 热打击+恢复15 min组TGF-β1水平显著高于空白对照组(P<0.05),热打击+恢复3 h组TGF-β1水平显著低于空白对照组(P<0.05),热打击+恢复3 h组TGF-β1水平显著低于热打击+恢复15 min组(P<0.05)。热打击+恢复3 h组TNF-α水平略高于热打击+恢复15 min组和空白对照组(P<0.05,P<0.05),但热打击+恢复15 min组TNF-α水平与空白对照组相比差异无统计学意义(P>0.05)。3组大鼠IL-6水平差异均无统计学意义(P>0.05)。见表2。

表1 各组大鼠体质量、核心体温、造模时间比较Tab. 1 Weight, Tc and time of HS in each group?
HS: heat stress; Tc: core temperature

表2 热打击对肺组织VEGF-A及相关细胞因子的影响Tab. 2 Effect of heat stress on VEGF-A and related molecules?
aP<0.05 vs non-HS group;bP<0.05 vs HS + 15 min group
4 相关性分析 VEGF-A水平与TGF-β1水平呈直线回归关系(r=0.963,P=0.000;见图1),VEGF-A水平与TNF-α、IL-6水平无相关关系。
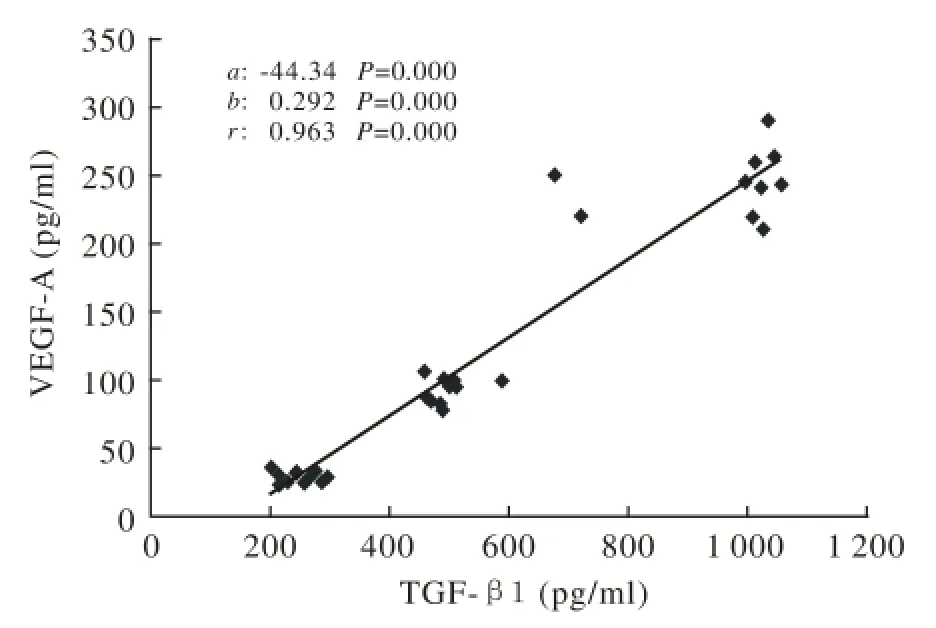
图 1 VEGF-A与TGF-β1直线相关及直线回归分析Fig. 1 Linear correlation and linear regression analysis of VEGF-A and TGF-β1 a: intercept; b: coefficient of regression; r: correlation coeff i cient
讨 论
VEGF-A是血管内皮生长因子蛋白家族的一员,与血管内皮细胞膜结合受体(VEGFR-1和VEGFR-2)结合调节内皮细胞功能[13-14]。原位杂交表明,人和动物肺组织VEGF-A主要来源为Ⅱ型肺泡上皮细胞和间质细胞[15]。急性炎症时,巨噬细胞、单核细胞和中性粒细胞也成为肺内VEGF-A的重要来源[15]。TGF-β1广泛表达于气道上皮细胞,强烈刺激非内皮细胞表达和释放VEGF-A[16]。本实验研究发现,热打击后15 min大鼠肺组织VEGF-A、TGF-β1水平较空白对照组显著升高,且二者呈强烈直线相关关系(r=0.963,P=0.000),该结果提示热打击15 min即出现气道上皮细胞动员分泌TGF-β1增加,刺激Ⅱ型肺泡上皮细胞和肺间质细胞分泌VEGF-A。
TNF-α是炎症反应过程中最早出现且最重要的多功能炎症因子之一,主要由活化的单核-巨噬细胞产生[17]。肺泡巨噬细胞(alveolar macrophage,AM)是构成肺部防御病原微生物和其他损伤因素的第一道防线。然而AM的功能与其他部位的巨噬细胞存在一定差异:一方面,AM具有更强的吞噬异物的能力,增加了多效性细胞因子TNF-α、活性氧簇、活性氮的产生;另一方面,它们减少了促炎细胞因子IL-6的释放,本实验中IL-6始终未出现明显变化可能与此有关[18]。虽然TNF-α在肺急性炎症时可上调VEGF-A水平,但热打击后15 min其水平较空白对照组无明显差异,且与VEGF-A水平无相关关系,提示热打击早期肺内尚未出现TNF-α大量分泌与广泛浸润[9]。由上可推测,热打击后15 min肺VEGF-A水平升高仅与TGF-β1的调节有关,而与促炎因子TNF-α、IL-6关系甚微,进一步可知,该阶段肺内促炎反应可能尚未启动,仍需进一步实验证实。
Maitre等[19]观察感染致急性肺损伤大鼠模型,在急性肺损伤初始阶段(4 h),肺组织VEGF-A水平较空白对照组降低。我们也观察到,热打击后3 h,大鼠肺组织TGF-β1、VEGF-A水平较空白对照组显著降低,二者呈强烈直线相关(r=0.963,P=0.000)。在热打击3 h时,VEGF-A水平的减少可能有以下两个原因:一是热直接损伤Ⅱ型肺泡上皮细胞、肺间质细胞和(或)气道上皮细胞导致TGF-β1、VEGF-A生成减少;二是细胞热应激后分泌TGF-β1、VEGF-A功能受到抑制,具体机制有待进一步研究。同时在该阶段,IL-6水平无明显变化,TNF-α轻微升高,提示该阶段肺内仍未出现明显的促炎反应,而TNF-α轻微升高可能与肺泡巨噬细胞开始活化有关。
目前认为,急性肺损伤早期,TGF-β1、TNF-α、IL-6等诱导VEGF-A表达和分泌增加,后者作用于血管内皮细胞,增大血管通透性,促成肺水肿。随着肺水肿进一步发展,肺泡上皮层广泛损伤,VEGF-A水平下降;此外,细菌和病毒感染、酸吸入、高浓度氧吸入等原发因素均可直接损伤肺组织结构,导致VEGF-A表达减少。急性肺损伤恢复阶段,肺泡上皮细胞修复,VEGF-A分泌增加,并通过其相应受体参与血管新生,成为肺组织修复的重要组成部分[9]。临床上,急性呼吸窘迫征患者支气管肺泡灌洗液中VEGF-A减少,且在病情进展过程中,上皮表面衬液VEGF-A增加的患者预后较好[20-24]。结合本实验热打击早期VEGF-A短暂升高后,显著下降至正常水平以下的结果可以推测,早期肺VEGF-A水平的变化可能成为影响热射病患者预后的因素之一。我们还观察到,热打击后VEGF-A与由气道上皮细胞分泌的TGF-β1变化同步,而与促炎因子TNF-α、IL-6关系甚微,由此推断热打击早期VEGF-A水平的变化可能仅与原位分泌及热直接损伤上皮细胞有关,而与肺内促炎反应无关,这与Leon等[25]观察到热打击恢复期3 h开始出现血浆促炎细胞因子浓度升高的病生过程相吻合。
本实验首次将VEGF-A引入热射病急性肺组织损伤研究领域,初步探讨了热射病早期VEGF-A及相关细胞因子在肺组织内的变化。但动物实验并不能完全代替临床实际情况,且VEGF-A及相关细胞因子变化与组织结构、器官功能变化之间的关系尚须进行更深入的研究。
1 宋青.热射病,致命的中暑[J].军医进修学院学报,2008,29(6):453-454.
2 Leon LR, Helwig BG. Heat stroke: Role of the systemic inflammatory response[J]. J Appl Physiol, 2010, 109(6): 1980-1988.
3 Kravchenko J, Abernethy AP, Fawzy M, et al. Minimization of heatwave morbidity and mortality[J]. Am J Prev Med, 2013, 44(3):274-282.
4 Wu WS, Chou MT, Chao CM, et al. Melatonin reduces acute lung inflammation, edema, and hemorrhage in heatstroke rats[J]. Acta Pharmacol Sin, 2012, 33(6): 775-782.
5 Stöllberger C, Lutz W, Finsterer J. Heat-related side-effects of neurological and non-neurological medication may increase heatwave fatalities[J]. Eur J Neurol, 2009, 16(7):879-882.
6 Chang CH, Kao CH, Chio CC, et al. Attenuating heatstroke-induced acute lung inflammation, edema, and injury in rats by exercise preconditioning[J]. J Trauma Acute Care Surg, 2013, 74(4):1052-1059.
7 Yang HH, Hou CC, Lin MT, et al. Attenuating heat-induced acute lung inflammation and injury by dextromethorphan in rats[J]. Am J Respir Cell Mol Biol, 2012, 46(3):407-413.
8 刘志锋,唐柚青,徐秋林,等.热打击后小鼠肺和脑组织病理学的改变[J].中华急诊医学杂志,2011,20(6):623-626.
9 高云,罗凤鸣,范志航.血管内皮生长因子与肺部疾病的关系[J].中华哮喘杂志:电子版,2013,7(5):369-374.
10 张婷,宋青,周飞虎,等.经典型与劳力性热射病动物模型之比较[J].解放军医学院学报,2013,34(12):1209-1212.
11 陈洁坤,宋青,李瑞生,等.肝素对劳力型热射病大鼠模型早期干预的作用[J].军医进修学院学报,2014,35(5):470-473.
12 Lord PF, Kapp DS, Hayes T, et al. Production of systemic hyperthermia in the rat[J]. Eur J Cancer Clin Oncol, 1984, 20(8):1079-1085.
13 Bates DO. Vascular endothelial growth factors and vascular permeability[J]. Cardiovasc Res, 2010, 87(2):262-271.
14 Shibuya M. VEGF-VEGFR signals in health and disease[J]. Biomol Ther (Seoul), 2014, 22(1): 1-9.
15 Barratt S, Medford AR, Millar AB. Vascular endothelial growth factor in acute lung injury and acute respiratory distress syndrome[J]. Respiration, 2014, 87(4):329-342.
16 Boussat S, Eddahibi S, Coste A, et al. Expression and regulation of vascular endothelial growth factor in human pulmonary epithelial cells[J]. Am J Physiol Lung Cell Mol Physiol, 2000, 279(2):L371-L378.
17 唐弋均,王三亨.重症肺炎患者血清肿瘤坏死因子α和白介素-10的变化及临床意义[J].广西医学,2014,36(3):396-397.
18 钟梓文.急性肺损伤时白细胞介素10在肺泡巨噬细胞中的表达[J].医学综述,2013,19(9):1555-1558.
19 Maitre B, Boussat S, Jean D, et al. Vascular endothelial growth factor synthesis in the acute phase of experimental and clinical lung injury[J]. Eur Respir J, 2001, 18(1):100-106.
20 Pickkers P, Sprong T, Van Eijk L, et al. Vascular endothelial growth factor is increased during the first 48 hours of human septic shock and correlates with vascular permeability[J]. Shock, 2005, 24(6):508-512.
21 Ito Y, Betsuyaku T, Nagai K, et al. Expression of pulmonary VEGF family declines with age and is further down-regulated in lipopolysaccharide (LPS)-induced lung injury[J]. Exp Gerontol,2005, 40(4):315-323.
22 李晗, 姜肖刚, 谢玮, 等. 急性肺损伤/急性呼吸窘迫综合征患者呼出气冷凝液血管内皮生长因子A降低[J] . 临床检验杂志,2012, 30(4): 315.
23 Thickett DR, Armstrong L, Millar AB. A role for vascular endothelial growth factor in acute and resolving lung injury[J]. Am J Respir Crit Care Med, 2002, 166(10):1332-1337.
24 Koh H, Tasaka S, Hasegawa N, et al. Vascular endothelial growth factor in epithelial lining fluid of patients with acute respiratory distress syndrome[J]. Respirology, 2008, 13(2): 281-284.
25 Leon LR, Dineen S, Blaha MD, et al. Attenuated thermoregulatory,metabolic, and liver acute phase protein response to heat stroke in TNF receptor knockout mice[J]. Am J Physiol Regul Integr Comp Physiol, 2013, 305(12): R1421-R1432.
Heat stress on vascular endothelial growth factor A in lungs of rats
YANG Wenchao1, GAO Tieying1, HU Jie1, LI Ruisheng2, ZHAO Jiajia1, ZHOU Jingjiang1, SONG Qing11Department of Critical Care Medicine, Chinese PLA General Hospital, Beijing 100853, China;2Laboratory Animal Center, 302 Military Hospital of China, Beijing 100039, China
SONG Qing. Email: songqing3010301@sina.com
Objective To investigate the effect of heat stress on vascular endothelial growth factor A and related molecules in lungs of rats. Methods Thirty male SD rats were randomly divided into three groups: non-HS group (n=10), HS + 15-minute-recovery group (n=10) and HS + 3-hour-recovery group (n=10).Two heated groups of animals were put in a folded heating pad with general anesthesia. Once their core temperature (Tc) elevated to 42℃, the heated animals were allowed to recover at a room temperature for 15 min and 3 h. Levels of vascular endothelial growth factor A (VEGF-A) and related molecules of the lung homogenate were detected by enzyme-linked immunosorbent assay. Results Compared with the non-HS group, the levels of VEGF-A and transforming growth factor beta1 (TGF-β1) increased significantly in the HS + 15-minute-recovery group, while decreased noticeably in the HS + 3-hour-recovery group. The level of pre-inf l amatory cytokine TNF-α slightly increased in the HS + 3-hour-recovery group. However, no signif i cant difference of the pre-inf l amatory cytokine IL-6 was found among the three groups. Conclusion The level of VEGF-A which may be only affected by heat injury in the early stage of heat stress decreases below the normal level after a transient elevation, and it plays a crucial role in the development of acute lung injury (ALI) in rats under heat stress.
heat stress; lung; vascular endothelial growth factor A
R 563
A
2095-5227(2015)02-0151-04
10.3969/j.issn.2095-5227.2015.02.016
时间:2014-09-12 11:35
http://www.cnki.net/kcms/detail/11.3275.R.20140912.1135.005.html
2014-07-30
国家自然科学基金项目(81050005)
Supported by the National Natural Science Foundation of China(81050005)
杨文超,女,在读硕士。研究方向:重症医学。Email: wenchao66397@163.com
宋青,女,主任医师,博士生导师。Email: songqing301 0301@sina.com
