甲基法尼酯在甲壳动物中的生理作用及其机制的研究进展
2015-03-21邱锡尔朱冬发崔晓雨周彦琦柳志业
邱锡尔, 朱冬发, 汤 洁, 崔晓雨, 周彦琦, 柳志业
(宁波大学 海洋学院, 浙江 宁波 315211)
甲基法尼酯在甲壳动物中的生理作用及其机制的研究进展
邱锡尔, 朱冬发, 汤 洁, 崔晓雨, 周彦琦, 柳志业
(宁波大学 海洋学院, 浙江 宁波 315211)
甲基法尼酯是一种类倍半萜烯激素,与昆虫的保幼激素在结构和功能上相似,是重要的内分泌调控因子。MF与甲壳动物的蜕皮、形态建成、渗透压调节、卵巢发育等生理活动的调控密切相关。主要就甲基法尼酯在甲壳动物中的生理功能、分子作用机制及其合成代谢等方面的研究进展进行综述,为进一步深入探讨甲基法尼酯的作用机制和解决虾蟹类养殖实践中的性早熟与亲本发育不良等难题奠定基础。
甲基法尼酯;生理功能;作用机制;甲壳动物
甲基法尼酯(Methyl farnesoate, MF)首先发现于蜘蛛蟹(Libiniaemarginata)的血淋巴。研究者通过GC(gas chromatography, 气相色谱)和SIM(selected ion monitoring,选择性离子检测)技术对甲壳动物血淋巴进行检测,确定了MF的存在;随后的研究显示MF是由大颚器(mandibular organ, MO)合成和分泌的[1]。目前已经在多种十足目甲壳动物中发现MO和MF的存在,例如蜘蛛蟹(L.emarginata)、克氏原螯虾(Procambarusclarkii)、美洲海鳌虾(Homarusamericanus)、色拉淡水蟹(Oziotelphusasenex)等。不同物种MO合成MF的速率和血淋巴中的MF浓度各不相同[2]。但是,到目前为止还未曾在非十足类甲壳动物体内发现MO的存在。
虽然近几年对于甲壳动物的神经内分泌研究发展迅速,但是相比于昆虫仍有不足,且研究物种也较单一。由于甲壳纲和昆虫纲的近缘关系使它们在形态结构和生理特征上具有极高的相似性,可以借鉴昆虫学上的研究进展来补足。甲壳动物分泌的MF与昆虫保幼激素(juvenile hormone, JH)在结构和功能上有极高的相似性[3-4]。JH由昆虫咽侧体(corpora allata,CA)分泌,调控着昆虫的生长变态、繁殖和级型分化,决定了昆虫由幼体到蛹再到成虫的生长周期变化[3]。而甲壳动物的大颚器(mandibular organ, MO)一般为椭圆形独立组织,呈乳白色或淡黄色,位于大颚与几丁质腱相连的外侧基部,呈左右对称分布,是甲壳动物合成和分泌MF的唯一组织[4]。几十年来的研究已证明MF是一种类倍半萜烯激素,受眼柄中多肽类激素大颚器抑制激素(mandibular organ inhibiting hormone, MOIH)的负调控,与甲壳动物生殖繁育、蜕皮、幼体发育、形态建成、渗透压调节等生理活动的调控有关[1-2, 4]。
1 MF的分子结构与合成途径
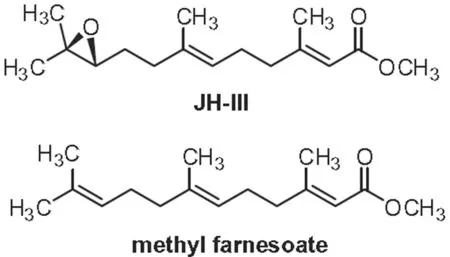
图1 MF和JHⅢ的分子结构
现已知昆虫JH与甲壳动物的MF在结构和功能具有相似性。MF经氧环化就可以生成JHⅢ,是JHⅢ的前体物质之一[3-4]。MF的生物合成遵循甲羟戊酸途径[5],可简要概括为:乙酰辅酶A → 甲羟戊酸 → 法尼焦磷酸 → 法尼醇→ 法尼酸 → MF,戊二酰辅酶A还原酶(3-hydroxy-3-methyl glutaryl coenzyme A reductase, HMGR)和法尼酸转甲基酶(farnesoic acid O-methyl transferase, FAMeT)是MF合成途径中两个最重要的关键限速酶[6]。HMGR是MF生物合成途径最初始阶段的限速酶,它的主要功能是催化乙酰辅酶A生成甲羟戊酸,在甲壳动物中仅见于美洲海鳌虾(H.americanus)、凡纳滨对虾(Litopenaeusvannamei)(NCBI登录号:GU969105.1)和三疣梭子蟹(NCBI登录号:KF280756)。HMGR氨基酸序列含两个HMG-CoA 结合基序和两个 NADP(H) 结合基序,是HMGR家族的保守功能域[7]。Li等人研究表明美洲海鳌虾MO中存在两种构型的HMGR;HMGR转录水平在美洲螯龙虾MO中最高[6]。FAMeT是MF的合成路线中最后阶段的关键酶,催化法尼酸向MF转化[8]。FAMeT在甲壳动物各组织中分布广泛,存在多种亚型;FAMeT氨基酸序列存在两个CF(CPAMD8/FAMeT)域,是甲壳动物FAMeT序列的标志性特征区域[9]。
2 MF的主要生理功能
2.1 调控蜕皮
蜕皮是甲壳动物蜕去旧的外骨骼并长出新的外骨骼的过程,受神经系统和内分泌系统共同调节。甲壳动物的蜕皮激素是由Y器合成分泌的,但是在早期研究中,就已经有证据显示MO与甲壳动物的蜕皮周期有关。将黄道蟹(Cancermagister)的Y器与MF在体外孵育24 h,发现其蜕皮激素的分泌量显著增多[10]。这就说明MO可能是作用于Y器,通过促进Y器蜕皮激素分泌的增加来诱导蜕皮的发生。注射MO匀浆或其提取液均可以促进蜕皮发生,缩短蜕皮周期,在Abdu等人的研究中,发现注射外源MF也能够促进雌性越冬克氏原螯虾(P.clarkii)蜕皮[11]。随后,Laufer等人也发现MF处理可以促进小龙虾(P.clarkii)蜕皮,并且发现血淋巴中的MF浓度在蜕皮前期上升,在蜕皮后期下降,与蜕皮激素的分泌周期趋于一致[12]。以上研究结果说明MF在甲壳动物蜕皮过程中具有重要作用,但是也有与之结论相反的研究,例如Felterman等人证明外源MF对招潮蟹(Ucapugilator)表皮组织蜕皮激素信号的启动无影响[13]。MF对甲壳动物蜕皮的调控可能因物种、蜕皮阶段和MF剂量的不同存在一定差异,有待进一步深入研究。
2.2 控制幼体发育与形态建成
对于昆虫,已证明JHⅢ与幼虫变态发育到成虫的过程有关。那么与之相似的MF是否也调控着甲壳动物的幼体发育和形态建成。虽然MF调控变态发育的机制还没有完全弄清楚,但是已经研究证明两者是有关系的。用含MF的饲料喂食对虾幼体,发现幼体后期的变态发育阶段明显被延迟,而MF对成熟个体的形态没有明显影响[14]。
雄性甲壳动物通常具有多种形态,在不同的形态特征期会出现不同的繁殖行为。例如雄性成年克氏原螯虾(P.Clarkii)存在两种形态,形态Ⅰ为初始繁殖形态,有较大的钳爪,在第3对和第4对步行足的坐肢节上有突起物;形态Ⅱ为非繁殖形态,钳爪较小且无突起物。Laufer等人通过眼柄切除和MF处理对其进行研究,发现眼柄切除和外源MF处理都会抑制形态Ⅱ到形态Ⅰ转换[12]。说明低浓度的MF会促进形态Ⅰ的形成,抑制蜕皮发生;而高浓度的MF则会促进形态Ⅱ的发生,证明MF调控着甲壳动物的形态转换。
2.3 应激性调节
甲壳动物生活的水生环境很不稳定,如溶解氧、温度和盐度等因子变动较大。甲壳动物就需要较大适应性来应对这些外界压力。已有研究表明在面对高渗透压、盐度降低、缺氧、低温这些外界压力下,血淋巴中MF含量也会上升。例如,在Lovett等人的研究中,发现青蟹(Carcinusmaenas)在盐度较低的低渗溶液中,血淋巴内MF含量显著上升[15]。随后,又发现处于Ca2+和Mg2+含量较低的等渗海水中,青蟹血淋巴中MF浓度上升[16]。MF可能是通过调控钠钾泵作用来维持体内的渗透压和离子平衡,但具体调节机制仍未研究清楚。
2.4 调控性腺发育
在甲壳动物性腺发育和繁殖方面的大量研究表明,MF能够刺激性腺发育成熟,促进繁殖的进行。Paran等发现注射MF能明显促进锐脊单肢虾(Sicyoniaingentis)的卵巢生长[17]。色拉淡水蟹(O.senex)血淋巴MF水平在卵黄发生前及早期最高[1],MF合成与促卵黄发生密切相关。MF能提高离体培养的罗氏沼虾(Macrobrachiumrosenbergii)卵黄发生前卵巢中卵黄蛋白原(vitellogenin, Vg)基因的表达水平,并促进卵巢总蛋白的合成[18];将MF与中华绒螯蟹卵母细胞共同进行离体培养,发现Vg表达显著上升[19]。
MF对于雄性甲壳动物精巢发育和繁殖行为的发生同样具有促进作用。头胸甲和螯足较大的雄性个体一般在繁殖中处于优势,其体内合成MF的速率高于繁殖能力低的个体,且性成熟雄性个体的MO体积、MF合成速率和血淋巴中MF含量都要高于未成熟个体[2],说明MF很可能与雄性甲壳动物的性腺发育和繁殖行为关系密切。
赵维信等发现早熟中华绒螯蟹(Eriocheirsinesis)大颚器合成MF的速率高于正常发育个体,且早熟蟹MO较正常发育个体提早一年[20],说明早熟蟹的MO提前发育导致MF的大量合成和分泌,刺激性腺提早发育成熟,这很可能导致河蟹性早熟的主要因素。因此,MF作为一种内分泌类萜激素,被认为与性激素[21]一起协同调控甲壳动物性腺的生长发育。
也有一些研究报道与以上结论相反。Abdu等人在研究中并没有证实外源MF对小龙虾(C.quadricarinatus)有促进其生殖及产卵作用,反而发现高浓度MF会导致小龙虾死亡率上升,且持续接触低浓度的MF会抑制其生长和繁殖[11]。Mak等发现MF只有在高浓度时才能促进卵巢发育早期阶段肝胰腺Vg表达,而且在卵巢发育晚期对肝胰腺Vg表达无影响[22]。Tiu等人的研究结果也表明MF对肝胰腺中Vg的表达没有显著的影响[23]。总之,越来越多的实验证明MF对甲壳动物卵巢发育和卵黄发生起着重要的调控作用,但其作用方式可由于物种不同、个体所处的卵巢发育阶段不同、MF使用剂量不同而存在一定差异,也有待进一步深入阐明。
3 MF的作用机制
MF的调控机制极其复杂,还未完全研究透彻,最大原因在于受到外界的环境讯号影响太大,直接影响体内的激素调节。目前多数的经济养殖种在人工饲养的环境下无法自然成熟进行繁殖,也给研究带来了困难。
JH是一种非极性的类脂分子,但研究显示它在昆虫体内的细胞水平上有核作用和膜作用两种形式。核作用形式是JH与核内亲合力高的受体结合;膜作用形式是JH与细胞膜上的受体结合后激活磷脂酰肌醇介导的第二信使系统[24]。保幼激素可能通过膜受体与蛋白激酶 C( PKC) 发挥作用[25],例如JH在昆虫的成虫期促进生殖腺发育成熟,主要是通过与细胞膜上的受体作用,引起PKC和Ca2+等信息传递而实现。与保幼激素Ⅲ类似,甲基法尼酯很可能也有膜和核两种作用方式,但是现有的研究还不足以具体阐明MF的信号通路。Tsukimura等研究发现cGMP和cAMP的类似物能在体外抑制美洲螯龙虾大颚器合成甲基法尼酯[26]。但是,Wainwright等人有不同的研究结果,他们发现只有cAMP的类似物才能抑制黄道蟹(C.Pagurus)大颚器中MF的合成,而Ca2+,cGMP和PKC对MF的合成并无明显影响[27]。这些结果表明MF的调控可能有多种信号途径,即存在物种差异性,但是环核苷酸类化合物在MF的调控中肯定具有重要的作用。
近年来对昆虫保幼激素受体研究较多,一般认为Met(methoprene tolerant)很可能是保幼激素核受体。但是甲壳动物MF核受体的研究尚存在争议,自从研究证明维甲类x受体(Retinoid X Receptor, RXR)可能是果蝇(Drosophilamagna)JH的核受体,越来越多的研究猜测RXR很可能也是MF信号转导途径的核受体。RXR是一类核受体,具有3种亚型,即RXRα、RXRβ和RXRγ,RXR的配体为9-顺式维甲酸(9-cis-RA),9-cis-RA能与RXR直接结合并激活后者[28-29]。
目前对RXR的研究多集中于哺乳类、鱼类、昆虫等,在甲壳动物方面只有日本沼虾(Macrobrachiumnipponense)、斑节对虾(Penaeusmonodon)、陆地蟹(Gecarcinusruricola)、招潮蟹(U.pugilator)等物种的RXR全长cDNA序列已获得,研究物种较为单一。RXR能与多种核受体形成异源二聚体后调节基因表达,也可以作为一个独立的配体激活的转录因子参与相关基因的调控,推测RXR很可能参与多个信号传导途径,具有多种重要作用。例如,RXR与蜕皮激素受体(eedysone receptor,EcR)形成二聚体复合物EcR/RXR,与激素应答元件(response element,RE)结合后调控下游相关基因转录表达,从而调节生长和蜕皮过程[30]。在日本沼虾(M.nipponense)卵巢中存在多种构型的RXR,说明RXR还可能在日本沼虾(M.nipponense)的生殖及性腺发育过程中起着重要的作用[29]。RXR在美洲螯龙虾MO中表达量高于其它组织;在卵巢发育后期的MO中表达量达到最高值,说明RXR很可能在MO中参与了MF的合成并进而调控卵巢发育的进行[31]。MF可以促进招潮蟹(U.pugilator)体内蜕化类固醇与RXR/EcR异质二聚体复合物的结合[32],荧光素酶实验发现大型蚤(Daphniamagna)RXR可以与MF结合,但随后是否激活RXR基因尚不明确[33]。甲壳动物MF的确切核受体及信号转导途径有待更深入地研究来阐明。
4 MF合成与分泌的调控
昆虫JH受到咽侧体促进激素(allatotropin, AT)和咽侧体抑制激素(allatostain, AST)的共同调控,甲壳动物MF不仅受眼柄中多肽类激素大颚器抑制激素 MOIH的负调控,也受到AST的正调控,而大颚器促进激素(mandibular organ stimulating hormone, MOSH)是否存在尚需进一步确认。
4.1 肽类激素MOIH的调控
MOIH基因的相关研究较为缺乏,仅见于蜘蛛蟹(L.emarginata)和黄道蟹(C.pagurus)。切除眼柄(ESA),即去除MOIH对MF的影响可以促进甲壳动物的MF水平上升,为了研究其中的作用机制,Li等人切除雄性美洲螯龙虾(H.americanus)的眼柄后检测到HMGR与FAO-MeT酶活性与表达水平均显著上升;将切除眼柄的龙虾用提纯后的MOIH处理后,血淋巴中MF水平下降,且MOIH只对FAMeT有调控作用,对HMGR并无影响;但是窦腺提取混合物却能抑制HMGR的表达[6],说明眼柄中不只有单一的MOIH多肽调控,很可能还具有其他的调控途径调控MO合成MF。
4.2 AST多肽调控
AST多肽是一类由脑神经细胞分泌的AST 多肽前体水解生成的几个至几十个氨基酸构成的神经肽, 通过神经或体液途径到达CA,抑制咽侧体的活性, 参与调节保幼激素的合成与释放, 在昆虫生长发育过程中具有重要地位。目前在甲壳动物中也分离提取到多种AST 多肽, 包括三叶真蟹(Carcinusmaenas)、斑节对虾(P.monodon)等,AST 多肽被证明在甲壳类动物体内参与刺激MO合成MF的过程,调节神经和肌肉的收缩活动,影响甲壳动物的蜕皮和生殖[34]。例如,蟑螂的咽侧体抑制素在克氏原螯虾(P.clarkii)体内可以促进MF的合成[35],所以AST可能通过调控MF来促进蜕皮以及性腺发育等生理功能的发生。目前有关甲壳动物AST基因的研究仅见于克氏螯虾(P.clarkii)、断沟龙虾(Panulirusinterruptus)、罗氏沼虾(Macrobrachiumrosenbergii)和日本沼虾(M.nipponense)。开展AST的研究对于了解甲壳动物生长发育机制具有重要意义。罗氏沼虾(M.rosenbergii)ASTcDNA全长为2855 bp,预测编码的701个氨基酸可形成35个AST多肽;在神经组织(脑、胸部神经节、腹部神经节)和内分泌组织(肠)中表达较高,而在其它组织(心脏、腮、卵巢、肝脏或肌肉组织中)均不表达。雌性罗氏沼虾(M.rosenbergii)MF在卵巢发育阶段逐渐上升,在第一次生殖蜕皮时MF出现下降趋势;在卵巢从未成熟阶段向生殖成熟阶段发育的过程中,咽侧体抑制素基因的表达量增加,而在生殖蜕皮后一天开始下降[36]。罗氏沼虾(M.rosenbergii)AST表达变化与甲基法尼酯含量的变化基本一致[36],暗示咽侧体抑制素也可能在罗氏沼虾体内对甲基法尼酯的合成与释放起着重要的调节作用。
日本沼虾(M.nipponense)ASTcDNA全长2995 bp,ORF编码701个氨基酸, 经蛋白酶水解能够转录并翻译出35个AST多肽,在C末端都具有相同的 Y/FXFGL-amide 结构, 属于A 型-AST;组织表达分析显示,AST表达水平由高到低依次为: 肝胰脏>肠道>精巢>脑>心脏>卵巢[37],这与罗氏沼虾(M.rosenbergii)组织表达结果部分不一致,推测AST表达水平因物种不同存在一定差异,有待更多的研究来证明。
5 MF的运输与代谢
根据现有的研究,MF在MO中合成后与MF结合蛋白(MF-binding protein, MFBP)结合,通过血淋巴运输到相应靶组织。目前已在多种甲壳动物中发现MFBP的存在[2],Takac在蜘蛛蟹(L.emarginata)血淋巴中发现97 kDa的MFBP[38];随后他们又在蜘蛛蟹(L.emarginata)血淋巴中发现29、35、66和116 kDa 4种MFBP,在精巢中发现29、35和 116 kDa 3种MFBP,在卵巢中有97 和 70 kDa 2种MFBP[39];Prestwich等在美洲螯龙虾(H.americanus)血淋巴发现1种特异性MFBP,分子量为44 kDa[40];King等在克氏原螯虾(P.clarkii)血淋巴中发现93 kDa 的MFBP[41];Tamone等人在雄性黄道蟹(C.magister)血淋巴中发现两种特异性MFBP,分子量分别为34 kDa和44 kDa[42]。但是Li在蜘蛛蟹中发现的特定MFBP蛋白与MF的亲和能力高于FA和类JH化合物,其分子量为650 kDa[43],远远高于上述MFBP的平均分子量。由于检测手段的不同,在同一个物种蜘蛛蟹中(Takac等人测得数据为97 kDa)检测到差异极大的MFBP,推测MFBP可能在血淋巴中会裂解成小分子量的亚基,与MF特异性结合后运输到靶器官。MFBP类似于昆虫血淋巴中的JHBP,研究其功能结构是了解MF作用机制的一条重要途径,有待进一步深入研究。
甲壳动物体内并没有检测到JH的存在,MF的去向不会是经环氧化形成JH。一般认为MF的代谢途径通过酯酶降解形成法尼酸(Farnesoic acid, FA)。研究表明蜘蛛蟹(L.emarginata)不同组织中脂酶活性具有差异性,MF酯酶活性最高的在肝胰腺、卵巢和精巢;而同一组织中的脂酶活性存在季节性变化[44]。在甲壳动物血淋巴中尚未检测到FA和MF酯酶,说明MF的降解很可能发生在肝胰腺等组织。
在昆虫体内关于JH的降解酶类,研究较多的主要有3种:保幼激素酯酶(juvenile hormone esterase, JHE)、保幼激素环氧化物水解酶(juvenile hormone epoxide hydrolase, JHEH)和保幼激素二醇激酶(juvenilehormone diol kinase, JHDK)。JHE属于羧基酯酶(carboxylesrerases)家族,在昆虫中研究较为完全,后两者研究相对较少。JHE是大多数昆虫中最主要的一种可降解保幼激素的酯酶,主要存在于昆虫血淋巴中和一些组织细胞中,主要作用是降解JH生成保幼激素酸(juvenile hormone acid,JHA )[45]。近年来在甲壳动物体内检测到JHE和JHEH的存在,但未发现JH存在,JHE和JHEH可能用于降解MF。
已有研究在克氏原螯虾(P.clarkii)和美洲螯龙虾(H.americanus)肝胰腺和性腺中检测到JHE活性[41, 46]。Lee等人获得日本仿长额虾(Pandalopsisjaponica)类保幼激素酯酶基因Pj-CXE1(2084 bp)和Pj-CXE2(1985 bp)的cDNA全长,Pj-CXE1在性腺中显著表达,在肝胰腺和后肠表达次之, 但是Pj-CXE2 在肝胰腺和后肠中表达最高,性腺和腹神经节次之[47]。该研究结果与在克氏原螯虾和美洲螯龙虾中酶活检测结果基本一致,说明甲壳动物JHE的降解作用主要发生肝胰腺和性腺。
JHEH属于环氧化合物水解酶,在节肢动物的生长发育、蜕皮等过程中起重要作用[45, 48]。已证明JHEH降解JH生成保幼激素二醇(juvenile hormone diol, JHD),在JH的代谢途径中起到重要作用,主要存在于某些昆虫的组织细胞中[48]。近期在日本沼虾(M.nipponensis)体内发现JHEH的存在[49],研究发现日本沼虾(M.nipponensis)JHEH在肝胰脏中表达量最高,与其他组织表达具有极显著差异,推断JHEH和JHE可能协同调控激素的合成与降解。
6 展望
近年来MF一直是甲壳动物学者的热点研究对象。MF是甲壳动物体内的一种重要内分泌激素,与昆虫JH类似,可以促进蜕皮的发生,控制甲壳动物的形态建成和性腺发育,调控对外界环境的应激性调节等。MF合成受到眼柄多肽类激素的调控,RXR是其可能受体,其作用方式可能因物种的不同而存在差异。目前的研究已成功揭示MF的合成路径及其重要功能,但是关于MF的作用机制仍未完全明确,有待更多的物种和进一步研究来完整阐明。MF的受体、信号转导途径、降解途径将是未来几年的研究热点,这些问题的解决将有助于了解MF在甲壳动物中的分子作用机制和解决在虾蟹类养殖实践中遇到的性早熟与亲本卵巢发育不良等难题。
[1]Nagaraju G P C, Reddy P R, Reddy P S, et al. Mandibular organ, its relation to body weight sex molt and reproduction in the crabOziotelphusasenexsenexFabricius[J]. Aquaculture, 2004, 232(1-4): 603-612.
[2]Nagaraju G P C. Is methyl farnesoate a crustacean hormone[J]. Aquaculture, 2007, 272: 39-54.
[3]李 娟, 周 娇, 骆有庆, 等. 保幼激素及其生理学作用的研究进展[J]. 中国医学创新, 2012, 9 (3): 154-157.
[4]李 胜, 赵维信. 甲壳动物的大颚器和甲基法尼酯[J]. 上海水产大学学报, 2000, 9(3): 240-244.
[5]Davies K A, Kou K G M, Wulff J E. Oxygen-containing analogues of juvenile hormone III[J]. Tetrahedron Letters , 2011, 52(18) : 2302-2305.
[6]Li S, Friesen J A, Holford K C, et al. Methyl farnesoate synthesis in the lobster mandibular organ: the roles of HMG-CoA reductase and farnesoic acid O-methyl transferase[J]. Comparative Biochemistry and Physiology, PartA: Molecular and Integrative Physiology, 2010, 155(1): 49-55.
[7]姜 鸣, 霍 棠, 吕淑敏, 等. 细纹豆芫菁3-羟甲基戊二酰辅酶A-还原酶基因全长cDNA克隆及生物信息学分析[J]. 昆虫学报, 2012, 55(7): 860-868.
[8]Yang Y, Ye H, Huang H Y, et al. Cloning, expression and functional analysis of farnesoic acid O-methyltransferase (FAMeT) in the mud crab,Scyllaparamamosain[J]. Marine and Freshwater Behaviour and Physiology, 2012, 45(3): 209-222.
[9]谢 熙, 朱冬发, 崔晓雨, 等. 三疣梭子蟹FAMeT基因克隆及其在蜕皮周期中的表达水平[J]. 水产学报, 2013, 37(7): 994-1001.
[10]Tamone S L, Chang E S. Methyl farnesoate stimulates ecdysteroid secretion from crab Y-organsinvitro[J].General and Comparative Endocrinology, 1993, 89(3): 425-432.
[11]Abdu U, Barkib A, Karplus Ilan, et al. Physiological effects of methyl farnesoate and pyriproxyfen on wintering female crayfishCheraxquadricarinatus[J]. Aquaculture, 2001, 202(1/2): 163-175.
[12]Laufer H, Demir N, Pan X, et al. Methyl farnesoate controls adult male morphogenesis in the crayfish,Procambarusclarkii[J]. Journal of Insect Physiology, 2005, 51(4): 379-384.
[13]Felterman M, Zou E. The exogenous methyl farnesoate does not impact ecdysteroid signaling in the crustacean epidermisinvivo[J]. Aquaculture, 2011, 317(1): 251-254.
[14]Tsukimura B, Nelson W K, Linder C J. Inhibition of ovarian development by methyl farnesoate in the tadpole shrimp,Triopslongicaudatus[J]. General and Comparative Endocrinology, 2006, 144(2): 135-144.
[15]Lovett D L, Verzi M P, Clifford P D, et al. Hemolymph levels of methyl farnesoate increase in response to osmotic stress in the green crabCarcinusmaenas[J]. Comparative Biochemistry and Physiology, 2001, 128(2): 299-306.
[16]Lovett D L, Tanner C A, Glomski K, et al .The effect of seawater composition and osmolality on hemolymph levels of methyl farnesoate in the green crabCarcinusmaenas[J].Comparative Biochemistry and Physiology, 2006, 143(1): 67-77.
[17]Paran B C, Fierro I J, Tsukimura B. Stimulation of ovarian growth by methyl farnesoate and eyestalk ablation in penaeoidean model shrimp,SicyoniaingentisBurkenroad[J]. Aquaculture Research, 2010, 41(12): 1887-1897.
[18]张 艳. 三疣梭子蟹卵巢发育期间卵黄蛋白原(Vg)、卵黄磷蛋白(Vn)及 Vg-mRNA 表达的变化研究[D]. 上海:上海海洋大学, 2011.
[19]郭 敏. 中华绒螯蟹(Eriocheirsinensis)大颚器的生理功能及其对卵巢发育的内分泌调控[D]. 上海:上海海洋大学, 2012.
[20]赵维信,陆剑锋. 早熟和正常中华绒螯蟹大颚器官发育及超微结构[J]. 上海水产大学学报, 2004, 13(1): 5-9.
[21]陆剑锋, 常国亮, 吴旭干,等. 两组不同饲料对中华绒螯蟹(Eriocheirsinensis)卵巢发育及卵黄发生的激素调控[J]. 海洋与湖沼, 2010, 41(4): 505-512.
[22]Mak A S C, Choi C L, Tiu S H K, et al. Vitellogenesis in the red crabCharybdisferiatus: hepatopancreas-specific expression and farnesoic acid stimulation of vitellogenin gene expression[J]. Molecular Reproduction and Development, 2005, 70(3): 288-300.
[23]Tiu S H, Chan S, Tobe S S. The effects of farnesoic acid and 20-hydroxyecdysone on vitellogenin gene expression in the lobster,Homarusamericanus, and possible roles in the reproductive process[J]. General and Comparative Endocrinology, 2010, 166(2): 337-345.
[24]Jones G. Molecular mechanisms of action of juvenile hormone[J]. Annual Review, 1995, 40: 147-169.
[25]Borst D W, Ogan J, Tsukimura B, et al. Regulation of the crustacean mandibular organ[J]. Integrative and Comparative Biology, 2001, 41(3): 430-441.
[26]Tsukimura B, Borst D W, Kamemoto F I. Cyclic nucleotide regulation of methyl farnesoate synthesis by the mandibular organ of the lobster,Homarusamericanus[J]. Journal of Experimental Zoology, 1993, 265(4): 427-431.
[27]Wainwright G, Webster S G, Rees H H. Involvement of adenosine cyclic-3′,5′-monophosphate in the signal transduction pathway of mandibular organ-inhibiting hormone of the edible crab,Cancerpagurus[J]. Molecular and Cellular Endocrinology, 1999, 154(1/2): 55-62.
[28]李 维, 王淑红, 王艺磊, 等. 软体动物维甲酸X受体研究进展[J]. 动物学杂志, 2013, 48(4): 17(1):655-664.
[29]王文青, 朱小玲.日本沼虾不同亚型维甲酸类X受体(RXR)cDNA克隆及序列分析[J]. 淡水渔业, 2010, 40(1): 4-10.
[30]Riddiford L M.Hiruma K, Nelson C A, et al. Insights into the molecular basis of the hormonal control of molting and metamorphosis fromManducasextaandDrosophilamelanogaster[J]. Insect Biochemistry and Molecular Biology, 2003, 33(12): 1327-1338.
[31]Tiu S H K, Hult E F, Yagi K J, et al. Farnesoic acid and methyl farnesoate production during lobster reproduction:Possible functional correlation with retinoid X receptor expression[J]. General and Comparative Endocinology, 2012, 175(2): 259-269.
[32]Hopkins P M, Durica D, Washington T, et al. RXR isoforms and endogenous retinoids in the fiddler crab,Ucapugilator[J]. Comparative Biochemistry and Physiology Part A: Molecular & Integrative Physiology, 2008, 151(4): 602-614.
[33]Wang Y H, LeBlanc G A. Interactions of methyl farnesoate and related compounds with a crustacean retinoid X receptor[J]. Molecular and Cellular Endocrinology, 2009, 309(1/2): 109-116.
[34]Kwok R, Rui Z J, Tobe S S, et al. Regulation of methyl farnesoale production by mandibular organs in the crayfish,Procambarusclarkii: a possible role for allatostatins[J]. Insect Physiology, 2005, 51(4): 367-378.
[35]Jorge R J, Marder Y E. Allatostatin decreases stomatogastric neuromuscular transmission in the crabCancerborealis[J]. Experimental Biology, 1997, 200: 37-46.
[36]银国利. 罗氏沼虾咽侧体抑制素基因及其天然反义RNA的分子特征与表达分析[D]. 杭州:浙江大学, 2006.
[37]卜宪飞, 李真真, 乔 慧, 等. 青虾咽侧体抑制激素基因全长cDNA 序列的克隆及表达分析[J].水生生物学报, 2013, 37(1): 116-124.
[38]Takac P, Laufer H, Prestwich G D. Characterization of methyl farnesoate (MF) binding proteins and the metabolism of MF by some tissues of the spider crab,Libiniaemarginata[J]. American Zoologist, 1993, 33(10A): 101-107.
[39]Takac P, Ahl J S B, Laufer H. Methyl farneoate binding proteins in tissues of the spider crab,Libiniaemarginata[J]. Comparative Biochemistry and Physiology, 1998, 120: 769-775.
[40]Prestwich G D, Bruce M J, Ujvóry I et al. Binding proteins for methyl farnesoate in lobster tissues: detection by photoaffinity labeling[J]. General and Comparative Endocrinology, 1990, 80(2): 232-237.
[41]King L E, Ding Q, Prestwich G D, et al. The characterization of a hemolymph methyl farnesoate binding protein and the assessment of methyl farnesoate metabolism by the hemolymph and other tissues fromProcambarusclarkii[J]. Insect Biochemistry and Molecular Biology, 1995, 25(4): 495-501.
[42]Tamone S L, Prestwich G D, Chang E. Identification and characterization of methyl farnesoate binding proteins from the crab,Cancermagister[J]. General and Comparative Endocrinology, 1997, 105(2): 168-175.
[43]Li H, Borst D W. Characterization of a methyl farnesoate binding protein in hemolymph fromLibiniaemarginata[J]. General and Comparative Endocrinology, 1991, 81(3): 335-342.
[44]Takac P, Laufer H. Seasonal differences in methyl farnesoate(MF), esterase activity in tissues of the spider crabLibiniaemarginata[J]. Invertebrate Reproduction and Development, 1997, 31(1-3) : 211-216.
[45]马 兰, 刘 念, 信 超. 保幼激素酯酶的生化及结构特性研究进展[J]. 陕西农业科学, 2011(4): 108-112.
[46]Homola E, Chang E S. Distribution and regulation of esterases that hydrolyze methyl farnesoate inH.americanusand other crustaceans[J]. General and Comparative Endocrinology, 1997, 106(1): 62-72.
[47]Lee S O, Jeon J M, Oh C W, et al. Two juvenile hormone esterase-like carboxylesterase cDNAs from aPandalusshrimp(Pandalopsisjaponica): cloning, tissue expression, and effects of eyestalk ablation[J]. Comparative Biochemistry and Physiology, Part B, 2011, 159(3): 148-156.
[48]Zhang Q R S, Xu W H S, Chen F S, et al. Molecular and biochemical characterization of juvenile hormone epoxide hydrolase from the silk worm,Bombyxmori[J]. Insect Biochemistry and Molecular Biology, 2005, 35(2): 153-164.
[49]李真真. 青虾保幼激素环氧水解酶基因全长cDNA的克隆及时空表达分析[D]. 南京:南京农业大学, 2012.
Review of the physiological functions and their mechanisms of methyl farnesoate in crustacean
QIU Xi-er, ZHU Dong-fa, TANG Jie, CUI Xiao-yu, ZHOU Yan-qi, LIU Zhi-ye
(School of Marine Sciences, Ningbo University, Ningbo 315211, China)
Methyl farnesoate (MF) is a sesquiterpenoid hormone, a crustacean juvenile hormone (JH) analog. MF has similar structure and functions with JH and appears to have several important roles in the regulation of physiological processes, including the influence on molting, metamorphosis, osmoregulation, ovarian maturation and so on. This review highlights the progresses of studies on the functions of MF, molecular mechanism synthesis and degradation in the crustaceans. It will help to understand the mechanism of methyl farnesoate and solve the problems of sexual precocity and maldevelopment in practice.
methyl farnesoate; physiological functions; molecular mechanisms; crustacean
2014-05-26;
2014-06-06
国家自然科学基金(No. 41376152);浙江省自然科学基金(No. LY13C190006)
邱锡尔,硕士研究生,主要研究方向为甲壳动物发育生物学, E-mail: qxe2013@yeah.net;
朱冬发,教授,主要研究方向为发育生物学和遗传育种学, E-mail: zhudongfa@nbu.edu.cn。
S917.4
A
2095-1736(2015)01-0076-06
doi∶10.3969/j.issn.2095-1736.2015.01.076
