乌苏里白鲑洄游群体性腺发育组织学观察
2015-03-21李培伦王继隆
李培伦, 刘 伟, 王继隆
(1. 中国水产科学研究院 黑龙江水产研究所, 哈尔滨 150070;2. 上海海洋大学 水产与生命学院, 上海 201306)
乌苏里白鲑洄游群体性腺发育组织学观察
李培伦1,2, 刘 伟1, 王继隆1
(1. 中国水产科学研究院 黑龙江水产研究所, 哈尔滨 150070;2. 上海海洋大学 水产与生命学院, 上海 201306)
通过组织切片技术对洄游至黑龙江抚远江段的乌苏里白鲑(Coregonusussurinsis)性腺发育状况进行研究。结果表明,乌苏里白鲑洄游群体包含生殖群体和非生殖群体两部分,其中生殖群体约占78.01%,非生殖群体占总数的21.99%。乌苏里白鲑雄性非生殖群体精巢发育处于精原细胞向精母细胞分化阶段,内含大量初级精母细胞及少量精原细胞;雄性生殖群体精巢发育处于精子形成阶段,精小囊破裂,大量精子细胞向精子转变,其精巢为典型的小叶型结构;雌性非生殖群体卵巢内卵母细胞发育处于第Ⅱ时相及少量处于第Ⅰ、Ⅲ时相,处于第Ⅲ时相的卵母细胞最明显的特征为出现多层油球和单层滤泡细胞;雌性生殖群体卵巢内卵母细胞处于第Ⅳ时相晚期及第Ⅴ时相,营养物质积累基本完成且部分卵母细胞已发育成熟。乌苏里白鲑成熟卵膜分为2层,外层为特殊的蘑菇状凸起结构,厚度约7.8~13.9 μm,内层为放射带,厚度为22.8~30.8 μm,该卵膜结构有别于其它硬骨鱼类。477尾乌苏里白鲑样本中,雌雄比列为1∶0.95,这一结果历史资料差异不大。
乌苏里白鲑; 性腺; 精巢; 卵巢; 卵膜
乌苏里白鲑(CoregonusussurinsisBerg),属鲑形目(Solmoniformes)、鲑科(Solmonidae)、白鲑亚科(Coregoninae)、白鲑属(Salmo),俗称雅巴沙、兔子鱼,为北极淡水鱼类区系复合体的鱼类,分布于中国黑龙江水系及俄罗斯西伯利亚、萨哈林等水域,具有明显的溯河产卵习性[1]。乌苏里白鲑肉质细嫩,味道鲜美,营养价值高,具有较高的经济价值和广阔的市场开发应用前景,是中国黑龙江水系特产珍稀名贵冷水鱼[1-2]。近几十年来,由于不合理的渔业利用导致乌苏里白鲑的渔获量剧减,资源量呈现衰退趋势,已被列入《 中国濒危动物红皮书鱼类》名录[3],因此开展乌苏里白鲑的驯化生殖和人工养殖具有重要的意义。目前有关乌苏里白鲑的研究主要集中在资源调查、生物学特征、洄游群体结构、生化特点及遗传多样性等方面[4-7],而其繁殖生物学内容较少,尤其是其性腺发育未见报道。研究发现,黑龙江中游抚远江段乌苏里白鲑洄游群体包含生殖群体和非生殖群体2部分,本文对这2个洄游群体性腺发育情况分别进行研究与分析,旨在丰富其繁殖生物学内容,并为开展种群资源保护和人工驯化养殖提供基础资料。
1 材料和方法
1.1 样本的采集
2013年10、11月,在黑龙江抚远江段通过跟踪渔船,从渔民三层流刺网渔获物中共采集到乌苏里白鲑样本477尾。
1.2 观察和测量
对于采集到的所有样本均在新鲜状态下对其叉长(Fork Length)、体重(Body Weight)进行测定,生殖群体性别鉴定方法通过观察雌雄个体第二性征的不同来完成(其中雄鱼体侧从鳃盖后至尾柄的鳞片上出现若干列白色的追星,呈有规律的纵行排列,手摸有粗糙感,雌鱼体侧无追星,腹部膨大疏松,生殖孔红肿外突),从生殖群体中随机选取部分样本进行解剖,对于不能通过第二性征进行性别鉴定的非生殖群体,全部进行解剖,观察性腺,辨别雌雄。对所有解剖个体称量其性腺重(Gonad weight)及净体重(Net body weight),其中性腺(分别截取前、中、后3部分)在Bouin′s 液中固定24 h后,保存于70%酒精中。性成熟系数(GSI%)=性腺重/净体重。
1.3 组织学观察
乌苏里白鲑性腺组织样本处理:从80%的酒精开始,梯度酒精脱水,二甲苯透明,常规石蜡包埋与切片,切片厚度6~8 μm,苏木精-伊红(H.E)染色,中性树胶封片。Carl Zeiss显微镜观察,Motic Images plus 2.0系统拍照。
2 结果
2.1 乌苏里白鲑洄游群体组成
乌苏里白鲑洄游群体包含生殖群体和非生殖群体两部分,如图1所示。其中雄性乌苏里白鲑非生殖群体约占雄性个体总数的22.1%,生殖群体则占77.9%;雌性乌苏里白鲑非生殖群体约占雌性个体总数的21.89%,生殖群体则占78.11%;总的来说,本次调查数据显示,黑龙江抚远江段乌苏里白鲑洄游群体中非生殖群体占总数的21.99%,生殖群体约占78.01%。477尾乌苏里白鲑样本中,雌性245尾,雄性232尾,雌雄比例约为1∶0.95,这一结果与董崇智等[4]的调查结果差异不大。
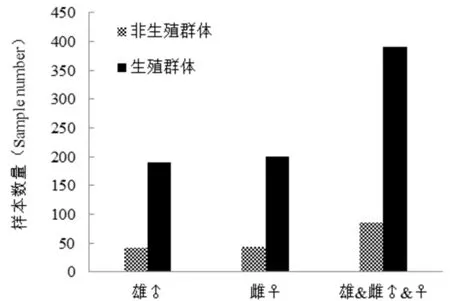
图1 乌苏里白鲑生殖群体、非生殖群体数量组成
2.2 乌苏里白鲑洄游群体性成熟系数
随机对部分乌苏里白鲑样本进行解剖观察发现,生殖群体与非生殖群体之间性腺发育状况差异较大,如表1所示。雄性非生殖群体性成熟系数(GSI)范围在0.057%~0.303%之间,平均为(0.099±0.05)%、而其生殖群体性成熟系数分布在0.885%~2.159%之间,平均为(1.455±0.28)%;雌性乌苏里白鲑非生殖群体的性成熟系数范围为0.091%~0.592%,平均为(0.274±0.11)%、而其生殖群体的性成熟系数达到13.36%~34.62%,平均为(22.62±0.71)%。可以看出雌性生殖群体性成熟系数较高,这与乌苏里白鲑个体大、怀卵量高及卵径较大等因素有关,而其它群体均相对较低。

表1 乌苏里白鲑洄游群体生物学指标测定
2.3 乌苏里白鲑精巢发育特点
乌苏里白鲑具有1对精巢,位于腹腔背部两侧,呈白色,形状如细线,中间稍粗,两端较细,两条输精管与泄殖孔处合二为一,肉眼即可分辨雌雄(图1-1)。精母细胞发育分期参考Schulz和Miura[8]对精子发生过程的分期方法。

图1 乌苏里白鲑性腺解剖观察
1—示乌苏里白鲑雄性非生殖群体精巢;2—示乌苏里白鲑雄性生殖群体精巢;3—示乌苏里白鲑雌性非生殖群体卵巢;4—示乌苏里白鲑雌性生殖群体卵巢。
2.3.1 非生殖群体精巢发育特点
洄游至黑龙江抚远江段的雄性非生殖群体,其精巢发育处于精原细胞向精母细胞分化阶段。从其精巢横切面可以看出,精小叶内部主要由少量精原细胞和大量初级精母细胞组成,其中初级精母细胞的排列比较紧密且靠近精小叶边缘(图2-1),在这一阶段精原细胞的体积最大,胞径为7.3~8.5 μm,核径2.4~3.1 μm,细胞之间界限明显,呈圆形。初级精母细胞的体积比精原细胞小,多为圆形或不规则的卵圆形,胞径4.5~6.0 μm,核径1.2~2.1 μm,细胞质不着色,细胞核嗜碱性较强,为深蓝色且呈模糊的一团,居中或者偏于一侧。
2.3.2 生殖群体精巢发育特点
洄游至黑龙江抚远江段的乌苏里白鲑雄性生殖群体,其精巢发育处于精子形成阶段,该时期的精巢呈饱满肥厚的扁带,白色或乳白色,其中精巢表面具有丰富的血管(图1-2),精细胞经变态成为成熟的精子,充满精小叶的小叶腔。精小叶的内壁主要由精子细胞和正在变态的精子组成(图1-2),随着精小囊的破裂,成熟的精子进入小叶腔,精子尾部隐约可见,成群的精子在小叶腔内成旋涡状,其中头部染色最深,为深蓝色,直径约1.6~2.1 μm。待到外界环境条件适合,成熟的精子则由小叶腔进入输精管排至体外。
2.4 乌苏里白鲑卵巢发育特点
乌苏里白鲑卵巢1对,呈长三角形的囊状器官,位于鳔两侧,2个卵巢在末端的泄殖孔处合二为一,卵巢颜色呈明亮的黄色,肉眼即可辨别(图1-3)。其中卵母细胞的发育分期参考龚启祥等[9]对香鱼(Plecoglossusaltivelis)卵母细胞的方法。
2.4.1 非生殖群体卵巢发育特点
对于洄游至黑龙江抚远江段的雌性乌苏里白鲑非生殖群体来讲,其卵巢较小,细长,卵巢一侧棱上具有一条主血管,主血管向两侧延伸出许多细小的微血管。通过组织切片观察可知,卵巢内部卵母细胞主要由第Ⅱ时相卵母细胞(早期初级卵母细胞)及部分第Ⅰ(卵原细胞)、Ⅲ时相卵母细胞(处于大生长期早期的初级卵母细胞)组成。其中第Ⅰ时相卵母细胞主要由卵原细胞构成,位于生殖上皮边缘及附近的基质中,受挤压变形,呈卵圆形或三角形,胞径33.8~69.7 μm,核径13.8~38.5 μm,细胞质含量少且分布密集,嗜碱性强,被染成深蓝色,细胞核比较大,呈圆形,约占细胞体积的1/2~2/3(图2-3)。第Ⅱ时相卵母细胞呈圆形或者不规则的多角形,胞径79.1~194.4 μm,核径为31.7~77.8 μm,胞质颗粒排列相对疏松,嗜碱性较弱,着色浅,细胞核则呈圆形,核仁区域可以看到若干着色较深的核仁(图2-3)。第Ⅲ时相卵母细胞主要的特点是胞质区域出现若干层油球及滤泡细胞层(图2-4),该时相卵母细胞胞径175.6~399.7 μm,核径63.8~117.9 μm,随着油球数量的增多,体积增大,且由核膜边缘向胞质外缘扩展,与此同时卵母细胞外层滤泡细胞逐渐由长梭型转变为卵圆形(图2-5、6),其中长梭型滤泡细胞的长径为5.4~8.1 μm,短径为1.4~3.0 μm,圆形滤泡细胞的胞径为3.3~5.1 μm,滤泡细胞这一形态的转变可能与其功能发生变化有关。

图2 乌苏里白鲑性腺发育组织学观察
1—示乌苏里白鲑雄性非生殖群体精巢切面;2—示乌苏里白鲑雄性生殖群体精巢切面;3—示乌苏里白鲑第Ⅰ、Ⅱ时相卵母细胞;4—示乌苏里白鲑第Ⅲ时相卵母细胞;5—示第Ⅲ时相卵母细胞外长梭型滤泡细胞;6—示第Ⅲ时相卵母细胞外圆形滤泡细胞;7—示第Ⅴ时相卵母细胞;8—示第Ⅴ时相卵母细胞卵膜结构。SG—精原细胞;SCⅠ—初级精母细胞; ST—精子细胞;SZ—精子;OD—油球;ZR—放射带;FC—滤泡细胞;YG—卵黄颗粒;MLB—蘑菇状凸起。
2.4.2 生殖群体卵巢发育特点
通过解剖观察可知,乌苏里白鲑雌性生殖群体三角形卵巢棱角分明,充盈饱满,内含大量卵粒,呈金黄色,血管也明显增粗(图1-4),卵巢内卵母细胞已经发育至第Ⅳ时相后期(大生长期后期的初级卵母细胞)及第Ⅴ时相卵母细胞(成熟的卵母细胞),这两个时期的卵母细胞主要区别在于是否游离于卵巢腔内。处于这两时期的卵母细胞为圆形,由于胞内充满卵黄,故呈黄色或米黄色,卵母细胞胞径2.03~2.65 mm,平均为(2.35±0.11) mm。成熟的卵母细胞游离于卵巢腔内,卵黄颗粒聚集呈块儿状,小油球不断融合形成大的油球,两者共同充满整个卵母细胞,细胞核的核膜溶解,核仁也随之消失(图2-7)。组织学观察发现成熟鱼卵卵膜由外向内可以分为2层(图2-8),即外层的特殊蘑菇状凸起结构,厚度为7.8~13.9 μm,内层为放射带,厚度达到22.8~30.8 μm,其中放射带内放射纹清晰可见。
3 讨论
3.1 乌苏里白鲑精巢结构
目前,有关硬骨鱼类的精巢结构和精子发生过程在国内外已有许多报道[8,10-12],但是未见有关乌苏里白鲑方面的研究。研究推断乌苏里白鲑同其他硬骨鱼类一样,在精子发生过程中,生殖细胞经历了精原细胞分化为精母细胞,精母细胞转化为精子细胞及精子细胞转变为精子这3个阶段,由于乌苏里白鲑的洄游特性,在组织切片中未能观察到精母细胞转化为精子细胞这一阶段。
根据精巢内生殖细胞的分布和发育特点,一般硬骨鱼类的精巢结构分为2种类型[8,13]:小叶型(lobular type),很多鱼类都属此类型,如黄颡鱼(Pelteobagrusfluvidraco)[14]、大泷六线鱼(Hexagrammosotakii)[15]、大弹涂鱼(Boleophthalmuspectinirostris)[16];小管型(tubular type),仅在银汉鱼目的某些种类中发现,属于体内受精的硬骨鱼类,如扁鳍花(Poecilialatipinna)。乌苏里白鲑的精巢亦属于典型的小叶型结构,从其精巢切面可以看出,精原细胞存在于精小叶的边缘处,初级精母细胞亦分布于小叶边缘,中间出现空腔,待到繁殖季节小叶壁上的精小囊破裂,小叶腔扩大进而充满成熟的精子,时机成熟则通过输精管将精子排至体外。小管型精巢的初级精原细胞只在小管的盲端分布,并形成小囊,随着精子的发生和精子形成的过程,小囊逐渐向中央腔移动,中央腔与输精管相通,靠近中央腔的小囊破裂而把成熟的精子释放到中央腔内。
3.2 乌苏里白鲑油球发生特点
鱼类卵母细胞在成熟过程中会出现3 种不同类型的营养物质,即皮质液泡、蛋白卵黄颗粒和脂质卵黄滴(油球)[17],其在不同鱼类卵母细胞发生过程中出现的时间和顺序存在差别。本研究发现,乌苏里白鲑油球发生过程开始于第Ⅲ时相,最早出现在核膜周围,随后向胞质边缘扩展,这一结果与黑鲷(Sparusmacrocephalus)[18]、刀鲚(Coilianasus)[19]、金钱鱼(Scatophagusargus)[20]等硬骨鱼类相似,而不同于一些鲳科鱼类中发现的油球出现在第Ⅱ时相中后期,如东海银鲳(Stromateoidesargenteus)[21]和灰鲳(Stromateoidescinereus)[22]等。在卵母细胞发育成熟的过程中,油球并未消失,而是汇聚成较大的油球,同蛋白卵黄颗粒一样作为营养物质储备,在受精卵孵化及胚胎发育过程中提供营养。
3.3 乌苏里白鲑成熟卵膜结构
从一定意义上来讲,具有一定厚度和韧性的卵膜结构是鱼类卵子抵抗外界不良环境条件及维持内环境稳定的一道有力屏障。研究表明,硬骨鱼类卵膜形态结构多样性丰富,具有物种的特性[23-25]。本研究发现,乌苏里白鲑成熟鱼卵卵膜由外层的蘑菇状突起及内层的放射带组成,这一结构有别于其它硬骨鱼类,如怀头鲇(Silurussoldatovi)[25]成熟鱼卵卵膜由外层的胶膜和内层的放射带组成;暗带锯脂鲤(Serrasalmusspilopleura)[24]的卵膜只有放射带结构;东海银鲳(Stromateoidesargenteus)[9]、大弹涂鱼(Boleophthalmuspectinirostris)[16]等成熟卵膜仅有一层胶质膜结构。从几何学角度来看,一般硬骨鱼类卵膜表层整体为致密的薄皮状平面结构,而乌苏里白鲑成熟卵膜表层呈现出排列规整的蘑菇状凸起组成的立体结构。蘑菇状凸起之间具有空隙,整体形成具有一定厚度的卵膜层,分析可能与底层鱼类体外受精或受精卵发育所处环境有关,是进化适应的结果。这种蘑菇状结构可增加卵膜与外界环境接触面积,使卵膜具有一定弹性、韧性和抗冲击强度,在底层水体环境中可以有效地减少砂砾磨损对受精卵带来的伤害,以及减缓水体流动对受精卵产生的强大冲击力,最大程度地保护受精卵免受外界不良环境的干扰,以保证子代胚胎发育与成活。
3.4 乌苏里白鲑产卵期
目前,有关乌苏里白鲑产卵期存在多种争议,尼科里斯基[26]曾在《黑龙江流域鱼类》中指出,乌苏里白鲑产卵期为10月进入山溪中产卵,11月和12月由产卵河返回;任慕莲[27]在《黑龙江鱼类》中指出,乌苏里白鲑的产卵期为10月下旬至11月初;董崇智等[4]指出乌苏里白鲑的产卵期为12月下旬至1月中旬,属于冰下产卵。本次调查发现,11月上旬黑龙江抚远江段封冰之前部分雌性乌苏里白鲑个体已发育成熟,轻压鱼腹,便有卵粒流出,12月中旬采捕到乌苏里白鲑,其卵粒已排空,故推测黑龙江抚远江段乌苏里白鲑产卵盛期为11月上旬至12月中旬,具体有待于进一步详细研究。
[1]张觉民. 黑龙江省鱼类志[M]. 哈尔滨:黑龙江科技出版社, 1995: 56-58.
[2]解玉浩. 东北地区淡水鱼类[M]. 沈阳: 辽宁科学技术出版社, 2007: 322-325.
[3]乐佩琪, 陈宜瑜. 中国濒危动物红皮书(鱼类)[M]. 北京: 科学出版社, 1998.
[4]董崇智, 夏重志, 姜作发, 等. 黑龙江乌苏里白鲑生殖群体生态学特征及资源保护[J]. 水产学杂志, 1997, 10(1): 14-21.
[5]马 波, 石连玉, 董崇智. 乌苏里白鲑的生化遗传结构[J]. 中国水产科学, 2003, 10(3):195-200.
[6]梁丽群, 常玉梅, 董崇智. 黑龙江乌苏里白鲑遗传多样性分析[J]. 中国水产科学, 2004, 11(6): 501-505.
[7]Yu D M, Ma B, Sun Y C, et al. Isolation and characterization of 16 microsatellite loci in an endangered fish Ussuri cisco,Coregonususssruensis[J]. Conserv Genet, 2010, 11:1107-1109.
[8]Schulz R W, Miura T. Spermatogenesis and its endocrine regulation[J]. Fish Physiol Biochem, 2002, 26: 43-56.
[9]龚启祥, 曹克驹, 曾 嶒. 香鱼卵巢发育的组织学研究[J]. 水产学报, 1982, 6(3): 222-234.
[10]管汀鹭, 黄丹青, 黄国屏.金鱼精巢的细胞构造与精子的发生和形成[J].水生生物学报, 1990, 14: 233-238.
[11]徐长安, 李 军, 张士璀.激素诱导欧氏六线鱼性腺发育的初步研究[J].海洋科学, 1998(3): 4-5.
[12]Santos R N, Andrade C C, Santos A F, et al. Testicular maturation ofOligosarcushepsetus(Cuvier) ( Actinopterygii, Characidae) in a brazilan tropical reservoir[J]. Braz J Biol, 2006, 66 (1A): 143-150.
[13]Billard R. Spematogenes is and spermatology of some teleost fish species[J]. Reprod Nutr Develop, 1986, 26(4): 877-920.
[14]陈伟兴, 范兆廷, 杨 洁.黄颡鱼性腺的组织学观察[J]. 东北农业大学学报, 2006, 37(2): 194-198.
[15]温海深, 王连顺, 牟幸江, 等. 大泷六线鱼精巢发育的周年变化研究[J]. 中国海洋大学学报, 2007, 37(4): 581-585.
[16]曹伏君, 罗 杰, 刘楚吾.大弹涂鱼性腺发育的组织学观察[J]. 水生生物学报, 2010, 34(2):418-425.
[17]Mayer I, Shackley S E, Ryland J S. Aspect of the reproductive biology of the bass,DicentrarchuslabaxL.I. an histological and histochemical study of oocyte development[J]. Journal of Fish Biology, 1988, 33(4): 609-622.
[18]施兆鸿. 盐度对黑鲷卵巢发育的影响[J]. 水产学报, 1996, 20(4): 357-360.
[19]徐钢春, 万金娟, 顾若波, 等.池塘养殖刀鲚卵巢发育的形态及组织学研究[J].中国水产科学, 2011, 18(3): 537-546.
[20]崔 丹, 刘志伟, 刘南希, 等.金钱鱼性腺发育及其组织结构观察[J]. 水产学报, 2013, 37(5): 696-704.
[21]龚启祥, 倪海儿, 李伦平,等.东海银鲳卵巢周年变化的组织学观察[J]. 水产学报, 1989, 13(4): 316-325.
[22]施兆鸿, 罗海忠, 高露娇, 等.灰鲳卵巢发育的组织学研究[J]. 海洋水产研究, 2006, 27(4): 1-5.
[23]Lonning S. Comparative electron microscopic studies of teleostean eggs with special reference to the ehorion[J]. Sarsia, 1972, 49: 41-48.
[24]Rizzo E, Sato Y, Barreto B P, et al. Adhesiveness and surface patterns of eggs in neotropical freshwater teleosts[J]. Journal of Fish Biology, 2002, 61: 615-632.
[25]刘 伟, 陈 军, 潘志伟, 等. 怀头鲇成熟卵膜扫描电镜观察[J]. 动物学报, 2005, 51(5): 940-946.
[26]尼科里斯基Г. В. (高岫译). 黑龙江流域鱼类[M]. 北京:科学出版社, 1960: 58-67.
[27]任慕莲. 黑龙江鱼类[M]. 哈尔滨:黑龙江人民出版社, 1980: 56-58.
Observation on the gonadal development of theSiberiangudgeonmigratory populations
LI Pei-lun1,2, LIU Wei1, WANG Ji-long1
(1. Heilongjiang River Fisheries Research Institute, Chinese Academy of Fishery Science, Harbin 150070;2. College of Fisheries And Life Science, Shanghai Ocean University, Shanghai 201306, China)
Using the conventional histological methods,the gonads developmental stage ofSiberiangudgeonmigrating to the Fuyuan sections of Heilongjiang river was observed. The results showed that the migratory population was composed of the spawning population and the non-spawning population, and the spawning population accounted for 78.01% of all the samples, while the non-spawning population accounted for 21.99%. Accounting to the histological sections, we found that the testicular development of the male non-spawning population in the spermatogonia was divided into the spermatocyte stage, and there were abundant primary spermatocytes and little spermatogonia in the testis. The testicular development of the male spawning population was in the spermiogenesis stage and the leydig broken made the spermatid turn into the sperm, and the testis ofSiberiangudgeonbelonged to lobular structure. During the process of oogenesis, the diameter of the oocytes increased from 33.8 μm to 2650 μm.The oocyte development in the ovary of the female non-spawning population was in the phaseⅠ,Ⅱ and phase Ⅲ, and the obvious feature of the phase Ⅲ oocytes appeared the multiply oil droplet and the monolayer follicle cells. The oocyte development in the ovary of the female spawning population was in the late phase of Ⅳ and in the phase Ⅴ, these oocytes were full of yolks and parts of them had already mature. The mature eggs envelope ofSiberiangudgeonhave two layers, the outer layer was made of the mushroom-like bulges and its thickness was 7.8-13.9 μm, while the inner layer was the zona radiate with the thickness of 22.8-30.8 μm. This special egg envelope structure was different to the other reported teleost. We took 477Siberiangudgeonsamples for this research and found that the sex ratio for the female and male was 1∶0.95, and this result was similar to the early survey report about theSiberiangudgeon.
Siberiangudgeon; gonad; testis; ovary; egg envelope
2014-07-10;
2014-08-21
农业部财政专项物种资源保护项目(No. 2010-2014);公益性行业(农业)科研专项(No. 201303056-5)
李培伦, 理学硕士,主要研究方向为鱼类繁殖生物学,E-mail: lpl19890925@163.com;
刘 伟,博士,研究员,主要研究方向为渔业资源保护与利用、鱼类生理生态等,E-mail: liuwei_1020@aliyun.com。
S917.4
A
2095-1736(2015)01-0034-05
doi∶10.3969/j.issn.2095-1736.2015.01.034
