骨愈搽剂的质量控制研究
2015-03-21赵淑慧
赵淑慧 高 瑛 陆 洋 温 然
(1 北京中医医院顺义医院,北京,101300; 2 北京中医药大学中药学院,北京,100102)
骨愈搽剂的质量控制研究
赵淑慧1高 瑛1陆 洋2温 然2
(1 北京中医医院顺义医院,北京,101300; 2 北京中医药大学中药学院,北京,100102)
目的:制备骨愈搽剂并对其质量进行检查。方法:根据前期工艺研究结果进行中试生产制备骨愈搽剂,采用紫外分光光度法测定骨愈搽剂中总黄酮含量;采用薄层色谱法鉴别鸡血藤、伸筋草、花椒;进行装量差异、相对密度、pH值、微生物、稳定性等项目的检查。结果:中试提取条件为70%乙醇,10倍量,回流1 h,提取3次;鸡血藤、伸筋草、花椒照薄层色谱法,点样于硅胶G薄层板,展开,检视,均与对照品色谱相应位置上显相同颜色的荧光斑点;以芦丁为对照品,采用紫外分光光度法,在511 nm处测定骨愈搽剂中总黄酮含量为6.95 g/瓶;装量差异符合相关要求;样品在室温下留样观察,在6个月内质量稳定。结论:本制剂制备工艺简便,质量稳定可控。
骨愈搽剂;总黄酮;质量控制
我院骨外科治疗骨性关节炎的经验熏洗方由鸡血藤、伸筋草、花椒等6味中药组成,具有祛风除湿,活血通络之功,在我院应用已有多年历史,治疗骨性关节炎,疗效显著。我们通过前期实验研究,已将其制成骨愈搽剂成品,以方便患者使用,现对其制剂成品进行质量检查。分别采用紫外分光光度法测定骨愈搽剂中总黄酮的含量;采用薄层色谱法鉴别鸡血藤、伸筋草、花椒;根据《中华人民共和国药典》2010版搽剂的检查项下要求进行装量差异、相对密度、pH值、微生物、稳定性检查,以评价骨愈搽剂质量的稳定可控性。
1 仪器与试药
TU-1810紫外可见分光光度计(北京谱析通用仪器有限责任公司);Sartorius BS 110S型电子分析天平(北京赛多利斯科学仪器有限公司);KQ5200DA超声波清洗器(昆山市超声仪器有限公司);硅胶G,硅胶G254。
鸡血藤、伸筋草、花椒等饮片(北京盛世龙药业有限公司),经北京中医药大学生药教研室刘春生教授鉴定均为药典中收载品种;芦丁对照品(批号:10080-200707),对照品芒柄花素(批号111703-200603),花椒对照药材(批号121106-201004),伸筋草对照药材(批号121109-201002)均由中国药品生物制品检定研究院提供;乙醇为医用乙醇,其他试剂为分析纯。
2 制剂工艺
根据前期研究结果,取700个处方量药材进行中试提取,提取条件为70%乙醇,10倍量,回流1 h,提取3次。最后浓缩至2 g生药/mL,药液中加入0.2%苯甲酸钠后,搅拌均匀,灌装成100 mL/瓶,高温蒸汽灭菌后即得。
3 质量控制
3.1 性状 本品为具有特殊香气的棕黄色液体。
3.2 鉴别[1]
3.2.1 鸡血藤的鉴别 取本品6 mL浓缩,蒸干,残渣加甲醇12 mL使溶解作为供试品溶液。取缺鸡血藤处方药材加70%乙醇10倍量回流1 h,提取3次,浓缩,蒸干,残渣加甲醇12 mL溶解作为缺鸡血藤阴性对照品溶液。另取10 g鸡血藤药材加70%乙醇10倍量回流1 h,提取3次,同法制成单味药对照品溶液。再取芒柄花素对照品,加甲醇使溶解,制成每1 mL含1 mg的溶液,作为对照品溶液。按照薄层色谱法(《中华人民共和国药典》2010年版,一部附录ⅥB)试验,分别吸取上述四种溶液各10 μL,点于同一硅胶G薄层板上,以三氯甲烷-甲醇(20∶1)为展开剂,展开,取出,晾干,置紫外光灯(254 nm)下检视。供试品溶液色谱中,在与芒柄花素对照品溶液色谱、鸡血藤单味药对照品色谱相应位置上显相同颜色的荧光斑点,阴性对照品溶液在此处无干扰。

图1 鸡血藤鉴别薄层色谱图
注:1.供试品,2.缺鸡血藤阴性对照品,3.鸡血藤单味药对照品,4.芒柄花素。
3.2.2 伸筋草的鉴别 取本品6 mL浓缩,蒸干,残渣加无水乙醇12 mL使溶解作为供试品溶液。取缺伸筋草处方药材加70%乙醇10倍量回流1 h,提取3次,浓缩,蒸干,残渣加无水乙醇12 mL溶解作为缺伸筋草阴性对照品溶液。另取10 g伸筋草药材加70%乙醇10倍量回流1 h,提取3次同法制成单味药对照品溶液。再取伸筋草药材粉末1 g,加乙醚15 mL,浸泡过夜,滤过,滤液挥发,残渣加无水乙醇1 mL使溶解,作为对照药材溶液。照薄层色谱法(《中华人民共和国药典》2010年版,一部附录ⅥB)试验,分别吸取上述四种溶液各5 μL,点于同一硅胶G薄层板上,以三氯甲烷-甲醇(40∶1)为展开剂,展开,取出,晾干,再喷以5%硫酸乙醇溶液,在105 ℃加热至斑点显色清晰。供试品溶液色谱中,在与对照药材溶液色谱相应的位置上显相同颜色的斑点,阴性对照溶液在此无干扰。
3.2.3 花椒的鉴别 取本品6 mL浓缩,蒸干,残渣加乙醚12 mL溶解作为供试品溶液。取缺花椒处方药材加70%乙醇10倍量回流1 h,提取3次,浓缩,蒸干,残渣加乙醚12 mL溶解作为缺花椒阴性对照品溶液。另取10 g花椒药材同法制成单味药对照品溶液。再取花椒对照药材2 g,加乙醚10 mL,充分振摇,浸渍过夜,滤过,滤液浓缩至1 mL,作为对照药材溶液。照薄层色谱法试验,吸取上述4种溶液各5 μL,分别点于同一硅胶G254薄层板上,以正己烷-乙酸乙酯(4∶1)为展开剂,展开,取出,晾干,置紫外光灯(365 nm)下检视。供试品溶液色谱中,在与对照药材溶液色谱相应的位置上显相同颜色的荧光斑点,阴性对照溶液在此无干扰。
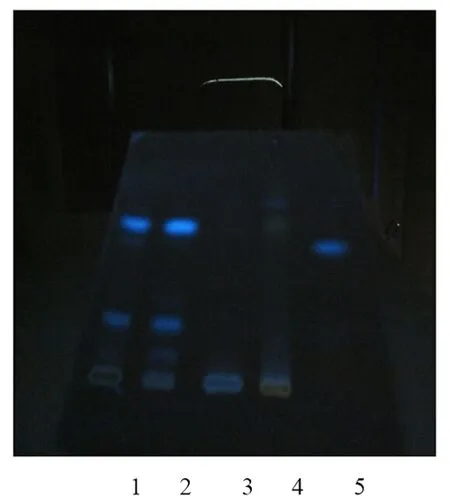
图2 伸筋草鉴别薄层色谱图
注:1、2.供试品,3.缺伸筋草阴性对照品,4.伸筋草单味药,5.对照药材。
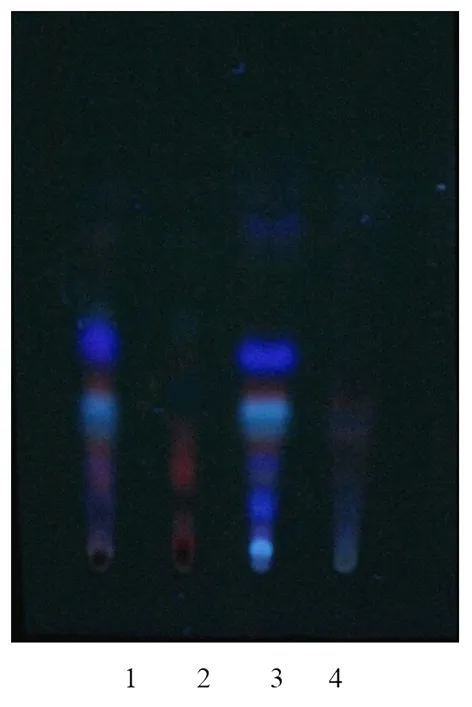
图3 花椒鉴别薄层色谱图
注:1.供试品,2.缺花椒阴性对照品,3.花椒单味药对照品,4.花椒对照药材。
3.3 含量测定
3.3.1 对照品溶液的制备 取10 mg芦丁对照品,精密称定,置50 mL量瓶中,加适量50%乙醇,超声处理使溶解,放冷,加入50%乙醇定容。精密量取20 mL,置25 mL量瓶中,加入50%乙醇定容,得0.16 mg/mL对照品溶液。
3.3.2 供试品溶液的制备及显色 取本品溶液0.1 mL置10 mL容量瓶中,再加入50%乙醇3.9 mL,以NaNO2-Al(NO3)3为显色剂显色,即加入50 mg/mL NaNO2溶液0.4 mL,摇匀后静置6 min,再加入100 mg/mL Al(NO3)3溶液0.4 mL,摇匀后静置6 min,加入100 mg/mL NaOH溶液4.0 mL,再加50%乙醇定容至刻度,摇匀后再静置15 min。
3.3.3 总黄酮的含量测定 根据前期研究结果,采用紫外分光光度法以芦丁为对照品,在511 nm处测定骨愈搽剂中总黄酮含量。以无样品溶液的阴性试剂为空白,随机抽取三瓶骨愈搽剂制备供试品溶液,在511 nm波长处测定吸光度值,根据线性回归方程计算样品中总黄酮含量(均值),测得总黄酮含量为6.95 g/瓶。
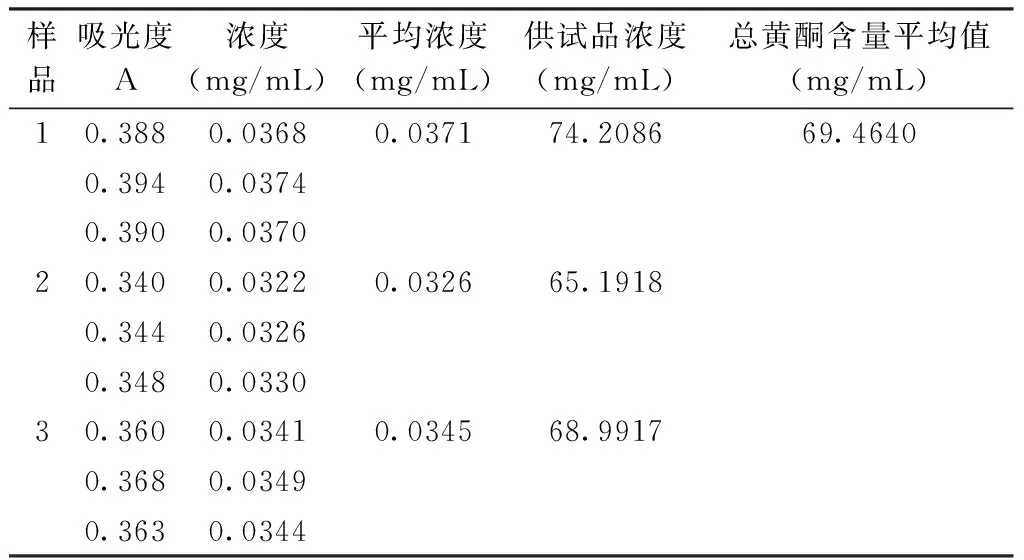
表1 总黄酮的含量测定
3.4 检查 按照《中华人民共和国药典》(2010版一部附录)要求,测得样品相对密度为1.115(附录VIIA);pH值为4.01(附录VIIG)。装量差异(附录IV)符合相关要求,结果见表2。

表2 装量结果
按照微生物限度检查法(附录XIIIC),本品中含细菌数≤100 cfu/mL,霉菌数≤100 cfu/mL,金黄色葡萄球菌未检出,铜绿假单胞菌未检出,均符合要求。
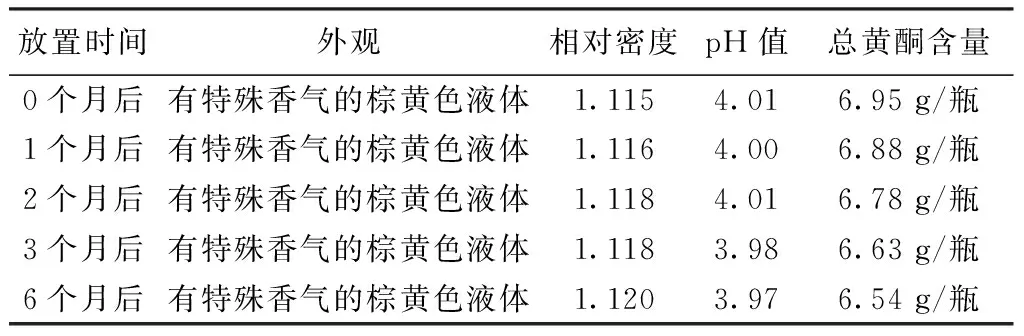
表3 骨愈搽剂6个月内稳定性试验结果
3.5 稳定性[2]样品在室温下留样观察,于0、1、2、3、6个月末取样,分别进行外观,相对密度、pH值、总黄酮含量的检查。结果表明骨愈搽剂外观性状无明显变化,总黄酮含量测定均符合要求,表明本品在6个月内质量稳定。
4 讨论
中医治疗骨关节炎已有悠久的历史和丰富的经验,方剂及单味药有效成分的临床应用均取得了较好的疗效,许多中药治疗骨关节炎的物质基础已经阐明,如雷公藤多苷和以青藤碱为代表的生物碱类、各种苷类、黄酮类物质等[3]。黄酮类化合物是指两苯环(A环与B环)通过C3联接而成的一系列化合物,即具有C6-C3-C6结构,以2-苯基色原酮为母核的化合物。由于其结构的千变万化,所以其生理活性也多种多样,具有抗炎、抗菌和抗病毒活性、抗肿瘤活性、抗氧化自由基活性等功效[4]。
黄酮类化合物治疗关节炎研究广泛,疗效确切,并已有相关制剂用于临床治疗。例如,相关实验表明,豹皮樟总黄酮通过抑制大鼠关节滑膜细胞中基质金属蛋白酶(MMP)-9的表达,减轻关节软骨破坏,抑制膝关节炎症反应,抗炎机制可能与调节免疫功能、减少细胞因子生成以及抑制基质金属蛋白酶的蛋白表达有关[5]。黄酮类化合物治疗关节炎的作用机制主要表现在抑制滑膜组织的异常增殖[6];抑制血管新生[7];抑制关节软骨病变[8];抗炎作用[9];对免疫系统的影响[10]等。目前临床常用的骨关节炎治疗药物包括抗炎药、免疫抑制剂、生物制品等,这些药物在取得治疗效果的同时产生较大的不良反应,如何找寻安全、有效的治疗药物意义重大。因此开发黄酮类药物制剂用于骨关节炎的治疗将是一个前进方向。
针对骨伤科疾病,以外敷、外搽、熏洗将药物直接作用受损部位,发挥作用充分,局部疗效优于内治法[11]。中药搽剂是指药材提取物药材细粉或挥发性药物用乙醇、水或适宜的溶剂制成的澄清或混悬的外用液体制剂,制备简单,使用携带方便,有效成分含量高且可控,适合现代社会广泛应用。本方原用法为熏洗方,研制成外用搽剂后,患者顺应性好,满足了患者的需求同时也传承和发展了传统中药制剂。
[1]国家药典委员会.中华人民共和国药典.一部[S].北京:中国医药科技出版社,2010.
[2]孔凡贞,范莹,莫宗琪,等.肤康宁搽剂的制备与质量控制[J].实用医药学杂志,2007,24(5):576-577.
[3]李斌,罗永明.中药活性成分治疗类风湿性关节炎的研究[J].中药材,2003,26(4):298-301.
[4]陈白灵.黄酮类化合物的药理活性研究新进展[J].海南医学,2012,23(9):119-121.
[5]王婷玉,李俊,葛金芳,等.豹皮樟总黄酮对大鼠佐剂性关节炎的作用及部分机制研究[J].中国药理学通报,2007,23(12):1618-1623.
[6]孙铁铮,吕厚山.IL-1β和TNF-α诱导RA成纤维样滑膜细胞ICAM-1和VCAM-1表达调控的机制研究[J].中华风湿病学杂志,2005,9(3):133-137.
[7]王聪华,陈丽娜,朱平,等.CD147分子通过VEGF促进类风湿关节炎滑膜组织中的血管新生[J].细胞与分子免疫学杂志,2007,23(5):426-428.
[8]魏平,付爽,王俊祥.基质金属蛋白酶3在类风湿关节炎中的表达及其意义[J].临床荟萃,2006,21(19):1389-1390.
[9]张骏艳,张磊,李俊,等.野菊花总黄酮对佐剂性关节炎大鼠氧自由基代谢的影响[J].中国中药杂志,2010,35(3):344-347.
[10]杨晓航,史传道,叶峥嵘,等.黄芪总黄酮对佐剂性关节炎模型大鼠IL-4、IFN-γ mRNA表达影响的研究[J].陕西医学杂志,2010,39(8):944-949.
[11]吴勇梅.中药外用在骨伤科患者中的临床应用概况[J].中国民族民间医药,2011,20(7):15-16.
(2014-10-24收稿 责任编辑:洪志强)
Preparation and Quality Control of Guyu Liniment
Zhao Shuhui1,Gao Ying1,Lu Yang2,Wen Ran2
(1ShunyiTraditionalChineseMedicineHospital,Beijing101300,China; 2SchoolofChineseMateriaMedica,BeijingUniversityofChineseMedicine,Beijing100102,China)
Objective:To prepare the Guyu liniment and to establish the quality control method for this medicine.Methods:According to the previous studies to prepare the Guyu liniment, UV spectrophotometry was used to determine the content of total flavonoids in Guyu liniment. TLC was used to identify Spatholobi Caulis, Lycopodii Herba and Zanthoxyli Pericarpium in the prescription of Guyu liniment. The content uniformity, relative density, pH, microbe and stability of Guyu liniment were measured.Results:The preparation technology of Guyu liniment is simple. The quality of Guyu liniment is stable and controllable.
Guyu Liniment; Total flavonoids; Quality control
北京市中医药科技项目(编号:JJ2011-36)
赵淑慧,主管药师,研究方向:药事管理和临床药学,E-mail:13601119829@163.com
R283;R284.2
A
10.3969/j.issn.1673-7202.2015.01.028
