水稻耐冷性研究进展及建议
2015-03-20陈慧珍江卫平谢蔚刘霞萍黄良萍
陈慧珍+江卫平+谢蔚+刘霞萍+黄良萍

摘要:低温冷害是水稻减产的主要原因之一。就低温胁迫对水稻的危害性、水稻冷害类型及鉴定指标、水稻耐冷性遗传及QTL(数量性状基因座)研究、水稻耐冷信号传导及转录因子调控方面进行了概述。介绍了水稻耐冷性研究中存在的一些问题,并提出了相应的对策和建议。
关键词:水稻;耐冷;数量性状基因座;转录因子
中图分类号:S511 文献标识码:A 文章编号:0439-8114(2015)02-0257-05
DOI:10.14088/j.cnki.issn0439-8114.2015.02.001
Advances and Suggestion of Cold Tolerance of Rice
CHEN Hui-zhen1,JIANG Wei-ping2,XIE Wei3,LIU XIA-ping1,HUANG Liang-ping1
(1.Pingxiang Municipal Institute of Agricultural Science, Pingxiang, 337000 Jiangxi, China;2.Key Laboratory of Crop Physiology/Ecology and Genetic Breeding,Ministry of Education,Key Laboratory of Crop Physiology,Ecology and Genetic Breeding of Jiangxi Province,Jiangxi Agricultural University,Nanchang 330045,China;3.The Seed Administration of Pingxiang,Pingxiang 337000,Jiangxi,China)
Abstract: Chilling injury is one of the main reasons causing the decrease of rice yield. The effects of low temperature stress on rice, types of cold injury in rice and identification indicators of cold tolerance of rice, genetics and QTLs(quantitative trait loci) of cold tolerance of rice, signal transduction and regulation of transcription factors of cold tolerance of rice were reviewed. Problems and advices of studying cold tolerance of rice were proposed.
Key words: rice; cold tolerance; QTL; transcription factor
水稻是喜温作物,对温度极为敏感,低温对水稻产量影响极大。有研究表明,中国每年因低温冷害损失30亿~50亿kg稻谷,相当于粮食产量的1%[1]。为减小低温对早籼稻的影响,除采取适当的栽培管理措施,根据不同水稻品种的特性调整播期外,选用配套的耐冷品种不失为经济、有效的措施。因此,选育出高产、稳产的耐冷水稻品种并应用于生产实际,对当今水稻的安全生产,保证水稻生产的可持续发展有着重要的意义。然而,目前水稻耐冷性育种方式主要采用育种年限长的传统育种方式,水稻耐冷性的研究也一直停留在耐冷基因的定位[2-4],以及通过基因工程等手段研究耐冷基因对水稻耐冷性的生理生化影响[5,6],并未更多地将定位出的效果显著的耐冷基因应用于水稻分子育种。随着分子标记技术的出现,分子标记辅助选择育种(Molecularassisted selection, MAS)被广泛应用于高产、优质及抗性强的水稻新品种的选育[7,8],因此利用分子标记技术与传统育种技术相结合的方式进行水稻耐冷性育种是很有必要的。
1 低温对水稻的影响
低温冷害会导致水稻生长缓慢或非正常生长的现象,这是由于低温条件下,植株体内酶活性降低,结构蛋白和非结构蛋白合成速率降低,细胞膜流动性降低,ROS(Reactive oxygen species,活性氧簇)含量的增加,抗氧化酶活性呈现先升后降趋势,活性氧产生和清除的平衡机制被打破,导致各种生理机能遭受到破坏,进而使得水稻表现出植株矮小、叶片窄小缩短,生长发育受到阻碍,严重的则导致水稻植株死亡。同时,冷胁迫下的水稻植株体内会发生一系列复杂的适应低温环境的生理生化变化,耐冷相关因子活性改变,激素的增加与减少,光合速率、呼吸作用及蒸腾速率的减弱,从而增强其对低温条件的抗性并减小低温环境对其伤害[9-12]。倒春寒是南方早稻播种育秧期的主要灾害性天气。长江中下游及华南地区的早稻孕穗扬花期还可能遭遇五月寒。寒露风是南方晚稻生育期的主要气象灾害之一。9月中下旬是长江中游双季晚稻的抽穗扬花期,易受“寒露风”危害,造成“翘穗头”、“包颈穗”、“白颖”现象。研究表明,低温冷害严重影响水稻生长发育,早稻苗期和芽期遭遇低温会导致出芽时间延长、烂种、秧苗不发、烂秧、死苗、生长发育延迟,最终导致产量减少[13];孕穗期低温往往容易造成水稻空壳率大幅上升,降低单位面积产量;而抽穗期和灌浆期低温往往降低水稻的灌浆速率和稻米品质[14]。
2 水稻冷害类型及鉴定指标
冷害是指作物在其生长所需的适温以下至冰点以上温度范围内所发生的生长停滞或生育障碍现象。水稻在最低温度8~10 ℃、最高温度40~50 ℃范围内能够维持生长,但水稻生长所需的适宜温度为15~18 ℃至30~33 ℃,粳、籼稻分别在15 ℃和 18 ℃以下就会发生冷害[15]。低温冷害对水稻的影响包括低温发生期间和低温发生后两个阶段。不同的水稻品种正常生长发育所需的温度不同,对低温的忍耐能力有差异,其中粳稻的耐低温能力显著强于籼稻[16],不同籼稻之间也有一定的差异。不同的生育阶段对低温冷害的抗性也不同,表现出的症状也不同。根据不同的区分标准,可分为不同的冷害类型;根据低温使水稻产量受损的原因,最早将水稻低温冷害分为延迟型冷害、障碍型冷害,后又增加了混合型冷害和稻瘟病型冷害;根据低温冷害发生的时期,划分为芽期冷害、苗期冷害、孕穗期冷害、开花期冷害和灌浆期冷害[17]。endprint
水稻耐冷性鉴定指标大致可分为形态指标、生长发育指标和生理生化指标。形态指标有根系发达程度、叶片的形态以及分蘖数、穗的长度等;生长发育指标有存活率、死苗率、叶赤枯度、萎蔫率及花药长度等;生理生化指标有叶片外渗电导率、MDA(Malondialdehyde,丙二醛)含量、脯氨酸含量、茎秆溢泌量及可溶性糖含量等[18]。以形态指标、生长发育指标为水稻耐冷性评价指标的研究颇为详细,韩龙植等[19]做过详细的综述,本文不再赘述。Sang-Ic等[20]利用耐冷型水稻品种M-202和冷敏感水稻品种IR50为材料,将水稻低温胁迫下生理生化变化进行量化,并转化为可视化的耐冷性鉴定指标,认为电解质泄漏率和脯氨酸含量与可视化耐冷指标显著相关。水稻不同时期的耐冷性不同,其评价指标也不同。研究者较为常用的耐冷性评价指标是不同时期低温下种子的发芽势、芽期的成苗率、幼苗期和分蘖期的叶赤枯度、孕穗期的结实率等,均有较为详细的耐冷强度等级评价标准,耐冷性的生理生化指标虽有不少研究,由于不全面而缺乏系统,还没有形成细化的评价等级标准。
3 水稻耐冷性遗传及QTL研究
水稻耐冷性是一种受基因控制的可遗传性状(表1,-表示目前没有查到相关研究)。近年来许多研究者对水稻耐冷性进行了遗传特征研究,主要有以下4种观点:①水稻耐冷性是受质量性状控制的质量性状;②水稻耐冷性是受多基因控制的数量性状;③水稻耐冷性由基因的加性效应及加性互作效应共同控制;④水稻耐冷性为加性-显性遗传模型。
同时也有部分研究认为,水稻耐冷性还受细胞质影响[18,21]。然而,在水稻不同生长期耐冷性遗传的特征不同,同一生长时期也表现出不同的遗传特征。简水溶[18]利用东乡野生稻/协青早B//协青早B构建的228个回交重组自交系群体(BC1F10),以萎蔫率和死苗率为耐冷性鉴定指标,进行苗期耐冷性遗传分析。结果表明,平均萎蔫率和死苗率分别为67.40%和70.80%,均呈偏态的连续分布,且耐冷性分离比为1∶3,故而认为东乡野生稻苗期耐冷性遗传为质量-数量性状遗传,存在耐冷性状的主效数量性状基因位点;也有研究表明基因的加性效应和加性互作效应共同控制了水稻苗期的耐冷性[20];王尚明等[22]对以东野1号与弱耐冷粳稻和籼稻品种配置的赣早籼49/东野1号和粳稻0298/东野1号的杂交后代进行了苗期耐冷性遗传研究。结果表明,东野1号在幼苗3叶期强耐冷性遗传属于加性-显性遗传模型,基因效应为加性和显性效应,受1对细胞核显性基因所控制;有研究者表明,水稻芽期耐冷性受基因的累加效应控制[23];戴陆园等[24]利用强耐冷品种昆明小白谷与弱耐冷性品种十和田配制的杂交F2、B2F1等为材料,以结实率为耐冷性指标进行水稻孕穗期耐冷性遗传研究。结果表明,水稻孕穗期耐冷性受1~2对主效基因控制;杨树明等[25]在云南省阿子营自然低温条件下,对以粳稻丽江新团黑谷耐冷基因作供体培育的近等基因系孕穗期耐冷性8个指标性状(结实率、穗颈长、株高、穗下节长、穗长、每穗实粒数、每穗秕粒数、总粒数)做了深入的遗传研究。结果表明,大多数性状检测到有主基因、多基因存在。因此,无论水稻耐冷性遗传是受质量性状控制、受数量性状控制、受加性效应及加性互作效应共同控制,还是受细胞质的影响,都需要更进一步的验证,水稻耐冷性遗传规律的研究还有待深入。
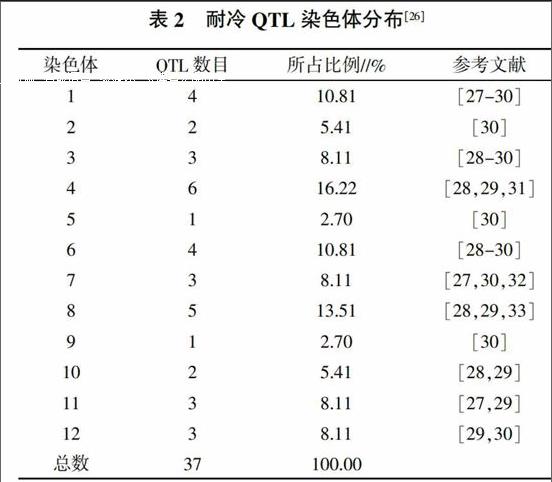
不同形态指标性状的耐冷性QTL表现出不同的遗传特点[25],随着DNA分子标记技术的日渐成熟,QTL鉴定技术也不断完善,其检测效应和定位精度也越来越高。根据Gramene数据库(http://www.gramene.org/)的统计,目前已鉴定的水稻耐冷性相关QTL有37个(表2)。由表2可知,耐冷QTL12个染色体上均有分布,其中定位在第4和第8号染色体上的数量最多,分别占16.22%和13.51%,而在第5和第9号染色体上检测到的QTL最少,均只有1个,占2.70%。
通过比较Gramene公布已经鉴定出的QTL位点可以得出,不同时期[27,28,31]、不同遗传背景[27,30]能够定位到同样的耐冷性QTL位点。聂元元等[34]通过对比研究认为QTL检测结果受不同鉴定时期影响较大,受环境和遗传背景影响较小,同样的鉴定群体和低温条件在不同的生长时期检测到的QTL所在位点共同的较少,而不同的群体或不同的低温处理也能检测相同的QTL位点。不同的遗传背景或不同的环境条件下能够检测到相同的QTL位点,将有助于相关耐冷性状的分子标记辅助选择育种,更快地培育出该性状的强耐冷品种。然而,分子标记和连锁分析存在着自身的缺点,导致置信区间较大,定位不精确,难以克隆,只能鉴定两个等位基因之间的效应,因此在不同分离群体的可重复性不好,难以更好地应用于现代分子设计育种。
4 水稻耐冷信号转导及转录因子调控
植物在感受低温信号后,通过信号转导过程调控细胞内抗冷相关蛋白的表达,进而调整自身的生理状态或形态来适应低温环境。随着检测出的耐冷相关基因的增多及转录因子对耐冷性调节的作用发现,转录因子同时调控下游许多抗逆基因的表达[35]。转录因子包括组成型和诱导型,植物抗逆性转录因子大致分为WRKY类、MYB类、bZIP类、NAC类和AP2/EREBP类五类。研究表明,耐冷信号转导包括ABA(Abscisic acid,脱落酸)依赖型和ABA非依赖型[36,37]。ABA依赖型信号转导依赖于内源ABA的积累或外源ABA的处理,其信号转导的具体调控机理尚未阐明。非依赖型是通过膜的流动性和蛋白构象的变化感受冷信号,然后激活Ca2+通道,诱导胞质Ca2+的瞬时增加[38],而Ca2+的增加导致CBF(C-repeat-binding factor)和COR (Cold-regulated protein,低温调节蛋白)基因的高表达,提高植物耐冷能力。
由植物冷驯化的信号传导网络图[39]得出,转录因子在植物耐冷信号转导中起着重要的作用,转录因子可以激发功能基因表达或抑制功能基因的表达,进而调控下游更多的耐冷功能基因发挥作用,使植物更快地适应低温环境。CBF是含有一个保守结构域AP2/EREBP,调节植物对低温、干旱等逆境分子应答的转录因子,其表达翻译受bHLH类转录激活因子ICE的调控,CBF可结合到COR基因的顺式作用元件CRT/DRE上诱导一系列COR基因的表达。ICE-CBF-COR途径是目前已知的低温信号转导途径中非常重要的环节。另一个重要的途径是FLC依赖途径SOC1-CBF-FLC,FLC又反馈抑制SOC1的表达。有研究者认为FLC能显著增强植物耐冷性[40]。Seo等[35]通过敲除和过量表达SOC1,认为SOC1可以负调控CBFs和COR等其他耐冷基因。endprint
5 存在的问题及展望
水稻在不同生育时期对低温的抗性不同,做出的反应也不同,其对低温抗性的鉴定指标也不同,韩龙植等[15,19]已对不同时期水稻耐低温能力的鉴定指标做了详细的综述。然而对以下3点的研究有所不足:①未提出不同时期之间耐冷性的相互联系和评价指标。②以低温下根系活力及根系生理变化作为耐冷性鉴定指标的研究较少且缺乏系统性。③低温下水稻生理生化指标的耐冷性指标的研究缺乏规范和标准化,已有的研究中可供参考的较为有限。植株体内生理生化指标的变化直接反映植株的生长发育状况。比起形态指标和生长发育指标,生理生化指标更快速、更准确地反映植株对逆境条件的抗性能力,值得深入的研究。虽然已有研究者对低温下水稻植株各种生理指标的含量变化进行研究,Sang-Ic等[20]利用低温下电解质泄漏率和脯氨酸含量鉴定出一些耐冷品种和冷敏感品种。然而,有待做进一步的研究和制定详细的可定量的耐冷性鉴定评级标准。
近年来,国内外定位了不少水稻耐冷性相关QTL位点,但应用于水稻耐冷性育种实践的却收效甚微,主要因为:①采用的定位方法和定位所用的群体,由于技术本身的缺陷导致所得到的图谱精度有限;②研究者对已定位出的不同QTL位点之间的内在关系知之甚少;③目前利用基因工程进行耐冷育种研究都是转入单个QTL位点,Zhang等[41]做了大量研究工作,但进展不理想,难以进行大面积推广种植。所以,要提高分子育种的效应,首先应找到改进基因定位的方法,已有研究者提出以连锁不平衡为基础的关联分析法[42],并且认为将关联作图法和连锁作图法结合起来,定位效果更加明显[43],这种基因定位方式已在玉米研究中得到应用[44];其次应加强各QTL之间内在联系的研究;最后,从耐冷性的整个调控网络来看,对单个基因来讲,转录因子对耐冷性调控的影响更大,所以应从改进转录因子的表达活性入手,达到增强水稻耐低温能力的目标。
随着分子生物学的长足进展以及分子标记、QTL定位、高通量测序及SNP(Single nucleotide polymorphisms,单苷酸多态性)等技术的创新,研究者已定位并克隆出一些水稻耐冷基因,并且试图通过在水稻中导入耐冷基因,进行水稻抗冷害育种,育种实践中,同时研究耐冷基因的耐低温的作用机理。随着分子标记的迅速发展以及水稻全基因组测序的完成,分子标记辅助选择育种(MAS)越来越凸显出其相对于传统育种方法的优势[45]。育种实践中,首先应选择有目标性状的种质资源,与当地主推种植水稻品种构建重组自交系、等基因系等标记群体,利用RFLP(Restriction fragment length polymorphism,限制性内切酶片段长度多态性)、RAPD(Random amplified polymorphic DNA,随机扩增多态性DNA标记)、SSR(Simple sequence repeats)等标记技术及已公布的耐冷标记位点,将已定位出的精细耐冷QTL位点聚合到当地种植水稻品种中,并开发优良的分子标记;然后利用田间表型观察和分子标记辅助育种相结合的方法观察不同耐冷QTL之间及其与环境间的互助效应,从而加快耐冷品种的选育进度和准确度,更快地选育出适合相应稻区稳产高产的耐冷品种,为粮食安全生产奠定基础。
参考文献:
[1] 赵正武,李仕贵,黄文章,等.水稻不同低温敏感期的耐冷性研究进展及前景[J].西南农业学报,2006,19(2):330-335.
[2] FUJINO K, SEKIGUCHI H, MATSUDA Y, et al. Molecular identification of a major quantitative trait locus, qLTG3-1, controlling low-temperature germinability in rice[J]. Proceedings of the National Academy of Sciences, 2008, 105(34): 12623-12628.
[3] KOSEKI M, KITAZAWA N, YONEBAYASHI S, et al. Identification and fine mapping of a major quantitative trait locus originating from wild rice, controlling cold tolerance at the seedling stage[J]. Molecular Genetics and Genomics, 2010, 284(1):45-54.
[4] ZHOU L, ZENG Y, ZHENG W, et al. Fine mapping a QTL qCTB7 for cold tolerance at the booting stage on rice chromosome 7 using a near-isogenic line[J]. Theoretical and Applied Genetics,2010,121(5):895-905.
[5] LIU H, MA Y, CHEN N, et al. Overexpression of stress-inducible OsBURP16, the β subunit of polygalacturonase 1, decreases pectin content and cell adhesion and increases abiotic stress sensitivity in rice[J]. Plant, Cell & Environment, 2014, 37(5):1144-1158.
[6] XIAO N, HUANG W, ZHANG X, et al. Fine mapping of qRC10-2, a quantitative trait locus for cold tolerance of rice roots at seedling and mature stages[J]. PloS One, 2014, 9(5):46-60.endprint
[7] 方珊茹,吴春珠,刘玉芹,等.分子标记辅助选择改良Ⅱ-32B的外观品质[J].分子植物育种,2013,11(6):673-679.
[8] 朱玉君,樊叶杨,王惠梅,等.应用分子标记辅助选择培育兼抗稻瘟病和白叶枯病的水稻恢复系[J].分子植物育种,2014,12(1): 17-24.
[9] 曹 可,秦玉芝,高琪昕,等.硒对低温胁迫下植物抗寒性影响的研究进展[J].中国农学通报,2014,30(11):200-204.
[10] 王春萍,雷开荣,李正国,等.低温胁迫对水稻幼苗不同叶龄叶片叶绿素荧光特性的影响[J].植物资源与环境学报,2012, 21(3):38-43.
[11] 张 蕊,高志明,吕 俊,等.外源水杨酸对水稻幼苗耐寒性的影响[J].江苏农业科学,2012,40(6):62-65.
[12] 朱 珊,熊宏亮,黄仁良,等.低温胁迫对水稻生理指标的影响[J]. 江西农业学报,2013,25(7):10-12.
[13] 陆婷婷.水稻芽期耐冷性的QTL初步定位[D].长沙:中南大学, 2012.
[14] 宋广树,孙忠富,孙 蕾,等.东北中部地区水稻不同生育时期低温处理下生理变化及耐冷性比较[J].生态学报,2011,31(13):3788-3795.
[15] 韩龙植,高熙宗,朴钟泽.水稻耐冷性遗传及基因定位研究概况与展望[J].中国水稻科学,2002,16(2):193-198.
[16] NISHIYAMA I. Effects of temperature on the vegetative growth of rice plants[A]. Proceedings of the Symposium on Climate and Rice[C]. Manila: IRRI,1976.159-185.
[17] 楼巧君.水稻耐冷性遗传基础研究[D].武汉:华中农业大学,2000.
[18] 简水溶.东乡野生稻苗期耐冷性QTL定位[D].南昌:江西师范大学,2011.
[19] 韩龙植,张三元.水稻耐冷性鉴定评价方法[J].植物遗传资源学报,2004,5(1):75-80.
[20] SANG-IC K, THOMAS H T. Evaluation of seedling cold tolerance in rice cultivars: a comparison of visual ratings and quantitative indicators of physiological changes[J]. Euphytica, 2011,178(3):437-447.
[21] CHUNG G S. The rice cold tolerance program in Korea[A]. Report of a Rice Cold Tolerance Workshop[C]. Manila: IRRI.1979.7-19.
[22] 王尚明,贺浩华,肖叶青,等.水稻东野1号苗期耐冷性遗传分析[J].湖北农业科学,2008,47(1):1-4.
[23] JUN B T, KIM J I, CHO S Y. Studies on the inheritance of quantitative characters in rice. VIII. Analysis on the low temperature germination in diallel cross of F2 generation[J]. Korean Journal of Breeding,1987,19(3):240-244.
[24] 戴陆园,叶昌荣,徐福荣,等.云南稻种昆明小白谷耐冷性指标性状的遗传分析[J].中国水稻科学,1999,13(2):73-76.
[25] 杨树明,王 荔,曾亚文,等.粳稻丽江新团黑谷近等基因系孕穗期耐冷性指标性状的遗传分析[J].华北农学报,2013,28(1):7-11.
[26] 饶玉春,杨窑龙,黄李超,等.水稻耐冷胁迫的研究进展[J].分子植物育种,2013,11(3):443-450.
[27] TAKEUCHI Y, HAYASAKA H, CHIBA B, et al. Mapping quantitative trait loci controlling cool-temperature tolerance at booting stage in temperate Japonica rice[J]. Breeding Science, 2001,51(3):191-197.
[28] ANDAYA V C, MACKILL D J. Mapping of QTLs associated with cold tolerance during the vegetative stage in rice[J]. Journal of Experimental Botany,2003,54(392):2579-2585.
[29] KASHIWAGI T, ISHIMARU K. Identification and functional analysis of a locus for improvement of lodging resistance in rice[J]. Plant Physiology,2004,134(2):676-683.endprint
[30] ANDAYA V, MACKILL D. QTLs conferring cold tolerance at the booting stage of rice using recombinant inbred lines from a japonica× indica cross[J]. Theoretical and Applied Genetics, 2003,106(6):1084-1090.
[31] ABE F, SAITO K, MIURA K, et al. A single nucleotide polymorphism in the alternative oxidase gene among rice varieties differing in low temperature tolerance[J]. FEBS Letters, 2002,527(1):181-185.
[32] 严长杰,李 欣,程祝宽,等. 利用分子标记定位水稻芽期耐冷性基因[J].中国水稻科学,1999,13(3):134-138.
[33] CAI H, MORISHIMA H. QTL clusters reflect character associations in wild and cultivated rice[J]. Theoretical and Applied Genetics,2002,104(8):1217-1228.
[34] 聂元元,蔡耀辉,颜满莲,等. 水稻低温冷害分析研究进展[J]. 江西农业学报,2011,23(3):63-66.
[35] SEO E, LEE H, JEON J, et al. Crosstalk between cold response and flowering in Arabidopsis is mediated through the flowering-time gene SOC1 and its upstream negative regulator FLC[J]. The Plant Cell Online, 2009,21(10):3185-3197.
[36] GILMOUR S J, THOMASHOW M F. Cold acclimation and cold-regulated gene expression in ABA mutants of Arabidopsis thaliana[J]. Plant Molecular Biology,1991,17(6):1233-1240.
[37] ISHITANI M, XIONG L, STEVENSON B, et al. Genetic analysis of osmotic and cold stress signal transduction in Arabidopsis: interactions and convergence of abscisic acid-dependent and abscisic acid-independent pathways[J]. The Plant Cell Online,1997,9(11):1935-1949.
[38] CHINNUSAMY V, ZHU J, ZHU J K. Gene regulation during cold acclimation in plants[J]. Physiologia Plantarum, 2006, 126(1):52-61.
[39] YANG T, ZHANG L, ZHANG T, et al. Transcriptional regulation network of cold-responsive genes in higher plants[J]. Plant Science,2005,169(6):987-995.
[40] SEO P J, JUNG J H, PARK M J, et al. Controlled turnover of CONSTANS protein by the HOS1 E3 ligase regulates floral transition at low temperatures[J]. Plant Signaling & Behavior, 2013,8(4):43277-43287.
[41] ZHANG F, HUANG L, WANG W, et al. Genome-wide gene expression profiling of introgressed indica rice alleles associated with seedling cold tolerance improvement in a japonica rice background[J]. BMC genomics,2012,13(1):461.
[42] 杨小红, 严建兵, 郑艳萍, 等. 植物数量性状关联分析研究进展[J]. 作物学报,2007,33(4):523-530.
[43] LU Y, ZHANG S, SHAH T, et al. Joint linkage-linkage disequilibrium mapping is a powerful approach to detecting quantitative trait loci underlying drought tolerance in maize[J]. Proceedings of the National Academy of Sciences, 2010, 107(45):19585-19590.
[44] YU J, HOLLAND J B, MCMULLEN M D, et al. Genetic design and statistical power of nested association mapping in maize[J]. Genetics,2008,178(1):539-551.
[45] EATHINGTON S R, CROSBIE T M, EDWARDS M D, et al. Molecular markers in a commercial breeding program[J]. Crop Science,2007,47(S3):154-163.endprint
