神经系统细胞谱系和神经束路示踪技术
2015-03-20陶华平
陶华平
(杭州师范大学浙江省器官发育与再生技术重点实验室,浙江 杭州310036)
0 引言
在脊椎动物发育过程中,中枢神经系统和周围神经系统起源于神经板层.边缘细胞分化形成神经嵴细胞.在之后的胚胎发育过程中,广泛迁移,产生了大部分的神经元以及周围神经系统中所有神经胶质细胞.剩下的神经板内陷形成神经管,随后分化成大脑和脊髓.分子克隆的发展,荧光蛋白的发现,以及转基因和电穿孔技术的应用,使得在神经系统形成过程中,细胞水平乃至分子层面的事件为人们所了解.这些技术使我们能够对细胞谱系、神经束路进行追踪,从而精确揭示神经细胞的迁移、增殖、分化以及神经回路形成的过程,增加了我们对神经系统发育过程的认识.
19世纪70年代,Nicole Le Douarin利用鹌鹑-鸡做嵌合体进行研究,使人们对神经嵴细胞的迁移路径和随之衍生而来的区域划分有了突破性的认识.18世纪80年代早期,分子克隆技术在发育生物学达到了一个黄金发展时代.某些基因限制性的特异表达在特定神经细胞中时,成为了非常宝贵的分子标记[1],使研究者可以清晰明确地辨别不同种类的神经元以及同一种类神经元的不同分化时期.19世纪90年代,就是绿色荧光蛋白GFP的应用,以及随后出现的多种颜色的荧光蛋白,使研究者可以用特异启动子启动荧光蛋白的表达以标记特定细胞种群,使我们的观察、拍照变得非常容易.由此,这些不同细胞类型以及不同发育阶段的特异标记物革命性地使得我们能够实时追踪着发育的过程.
本文重在介绍基于上述发现建立起来的,目前常用的神经示踪技术及其特点.
1 染料注射示踪
该方法是指利用能被细胞吸收并在轴浆、细胞内运输的物质来显影示踪.此法由来已久,且染料类目众多,不断地更新换代,目前仍被广泛使用.
1.1 直接显影类
主要指荧光染料.按属性又可分为水溶性(浆染)和脂溶性(膜染),或者分为蛋白类和多糖类.
1.1.1 水溶性
例,快蓝(fast blue,FB).水溶性好,颗粒细,易被神经轴索摄取,易从标记细胞扩散到周围组织,标记的神经元胞体和纤维多于其他染料.缺点是经荧光照射后淬灭快,即使低温避光,仍不能长时间保存.不利于需要标记后较长时间观察的研究.
1.1.2 脂溶性
例,DiI和DiO 及其衍生物.属于亲脂性羰花青染料.通过在胞浆膜上横向扩散达到标记的目的.是常用的顺、逆行标记物,激发光下呈现明亮的橘红色.适用于活体和固定标本.以DiI为例,由于高度亲脂性,其在组织液中不易扩散,能特异性标记目的神经元和突起,且对相邻纤维影响小.无毒性,不会明显影响摄取细胞生理功能.研究表明,DiI标记可以在体外培养组织中维持至少4周,活体超过1年的时间.该类染料的优点是染色速度快,固定组织0.2~0.6 mm/d,活体中6 mm/d.结合状态稳定,维持时间长不易降解;缺点是由于其膜染特性,无法或很难跨细胞、跨突触标记.Kulesa等利用DiI类染料追踪研究展示了神经嵴细胞完成它们的分型是一个腹侧到背侧的顺序,也解释很多的迁移行为的细节[2].目前,这一染料已广泛应用于神经嵴细胞谱系追踪、脊髓轴突投射追踪等方面.
再例如,荧光金(fluoro gold,FG),常用的逆行示踪剂,属于慢速轴桨运输类染料.优点是灵敏度高,运输和标记的距离长,且只标记细胞质不标记细胞核,能很好显示树突分支,不会有细胞外的染料渗漏.不易扩散,与周围组织分界清晰,褪色慢,且可以经受多种组织化学染色处理,因而可以与HRP、免疫组化等方法结合使用[3].缺点是此染料在细胞质内存在时间短,通常不超过3周[4].相关研究如利用FG 研究视神经纤维的分布路径和走向[5].
1.1.3 多糖类
例,罗丹明B(Rhodamine B),又称玫瑰红B,或碱性玫瑰精,俗称花粉红,是一种具有鲜桃红色的人工合成的染料.在溶液状态下,受激发有强烈的桃红色荧光.优点是光稳定性好,对PH 不敏感,波长宽,可用于多种激发光.缺点是荧光相对较弱,且经老鼠试验发现,罗丹明B 会引致皮下组织生肉瘤,被怀疑是致癌物质.
除上述以外,还有核黄素(nclear yellow,NY)、双眯基黄(diamidino yellow,DY)、台朌蓝(trypan blue,TB)等.
荧光染料的最大特点就是操作简单,易于观察和拍照,且同时注射多种不同特性和激发波段的荧光染料可实现双标或多标.但共同的缺点是荧光素通常分子量小,用于逆行追踪时,注射部位易于扩散,难以确定有效注射部位.另外,淬灭是荧光染料又一大缺点,即使在低温、避光条件下,切片保存时间仍有限,因此要求实验者在观察和拍照时要尽量缩短时间.
1.2 间接显影类
1.2.1 辣根过氧化物酶(horseradish peroxidas,HRP)及其结合物,例如WGA-HRP,CB-HRP
HRP是一种含有血红素基的植物糖蛋白.不仅能够在活体,也能够在固定后的组织中进行顺、逆行运输.早在1978年,来自耶鲁大学的研究者们就用注射游离HRP来追踪支配鸡后肢肌肉运动的运动神经元在脊髓中的分布[6].为了提高灵敏度,有很多研究者对该法进行了改进.Kristensson等将霍乱病毒B亚基结合到辣根过氧化物酶上(CB-HRP)用于追踪周围神经系统和中枢神经系统的纤维联系,创造了辣根过氧化物酶追踪神经元联系的技术.传统二氨基联苯胺(DAB)及之后改进的TMB-ST 法显影,增强了此法的简便性、灵敏度和安全性[7-8].HRP作为追踪剂的优点是无论顺、逆行标记都能取得较好的效果,偏向性较小.标记的细胞和树突结构清晰.并且可以有条件地实现跨突触标记,追踪细胞间联系.缺点是显影步骤繁琐,显色处理后,细胞失去了活性,无法进行膜片钳等神经电生理研究,限制了HRP 的应用.另外,HRP参与细胞代谢,无法长期存留,且其反应产物较不稳定,易丢失,所以HRP 在神经逆行示踪方面的应用大大局限而减少.
1.2.2 生物素葡聚糖胺(BDA)
常用的HR 示踪技术由于步骤繁琐,且存在有效注射范围难以确定、跨神经元输送、过路纤维等问题,限制了其应用范围.1986 年,Glover等首次应用了生物素化葡聚糖胺(biotinylateddextran amine,BDA)追踪神经纤维的方向[9].BDA 是一类双向神经示踪剂[9-10],常用来研究神经元的分支投射示踪.BDA 在细胞外注射后,可以被神经元及其突起摄取,然后顺行或逆行沿轴突转运至远处,经过处理的神经组织标本采用ABC免疫组化染色,用抗生物素蛋白(Avidin)与标记物中的生物素产生反应,最终经二氨基联苯胺显影,即可显示所标记区域的神经走向,相对于HRP与其他神经示踪剂,BDA 具有生物学性状稳定,转运距离远,可以采用多种免疫组化或免疫荧光技术作显影处理,能满足光镜及电镜下观察的要求等优点.另外经处理的BDA 标记组织标本保存时间长,可以保存6个月以上,且不影响最终显影结果.缺点是BDA 通常情况下不被不受损神经吸收,所以在注射时必须先切断或损伤被标记神经.
2 转基因技术示踪
指利用基因打靶和基因转导技术进行标记示踪.该技术的特点:首先,在示踪标记物方面,内源性遗传物质取代外源性,标记发生于基因水平,能够克服传统标记物的局限和缺点;其次,在标记方式上,由“宏观”的物理标记法转变为“微观”的基因打靶标记,从根本上解决了物理标记过程造成细胞损伤以及随着传代标记会被稀释的问题;最后,在示踪手段上,通过借助光学显微镜,实行活体示踪和观察,最大的好处就是能够获得高分辨率的照片.2013年,Kulesa等以转基因GFP标记某一种群的神经嵴细胞[11-12],研究其迁移过程、谁先谁后的细胞间相互作用以及不同时间的不同的发育潜能[13].
利用转基因技术的示踪分为瞬时示踪和长效示踪.
2.1 瞬时示踪
主要指以病毒感染或电穿孔技术导入,使携带有示踪基因,如绿色荧光蛋白(GFP)、β半乳糖苷酶(β-Gal、LacZ)等的目的质粒在特定细胞内瞬时表达,基因并不整合于基因组上.这一技术的缺点在于转基因的表达是瞬时的,只能维持几天至几周时间,而非永久标记.不利于长时程追踪细胞谱系和神经通路.
2.1.1 病毒感染
20世纪80年代,Kristensson将I型单纯疱疹病毒(HerpessimplexvirustypeⅠ,HSV1)注射到小鼠腓肠肌,发现它能通过坐骨神经感染脊神经、背根节及脊髓背角;而将HSV1注入兔眼时,病毒顺行感染视网膜节细胞、中脑上丘和外侧膝状体.由此,病毒在神经通路示踪方面的应用受到了越来越多的重视.目前常用的两类病毒是腺病毒(adenovirus)、腺相关病毒(adeno-associatedvirus,r AAV)和疱疹病毒.改造后的病毒带有GFP或LacZ的表达基因,可用于被感染神经的示踪观察.
腺病毒和腺相关病毒具有噬神经性,能在神经系统内繁殖并沿树突和轴突进行扩散和运动.由于病毒的复制增殖,所携带的标记蛋白,如GFP便随之到达神经元的各个部位,包括轴突和其细小分支.经固定和切片便能直接在荧光显微镜下观察,也可经免疫组化染色在光镜下观察;疱疹病毒也是具有复制能力的病毒,特点是亲神经性和跨神经元传递,主要应用于追踪外周器官与中枢神经系统间的联系及内部环路.常用的有假狂犬病病毒(Pseudorabiesvirus,PRV)和Ⅰ型单纯疱疹病毒(HSV1).PRV 能沿特异的神经通路跨突触感染,并可用免疫组织化学法显示PRV 感染的第二级神经元.随着动物存活期的延长,还能显示第三级以上神经元.HSV1与PRV 相似,均属于DNA 病毒.
DNA 病毒作为示踪剂,必须先进行改造,将其中不为病毒生存、复制所必须的序列进行加工、修饰产生变异减毒株,延长管注射动物的存活时间,以保证病毒进行跨神经元的长距离、长时间示踪.另外,病毒的株型、活性和滴度都很关键.未来,利用基因工程技术对示踪病毒进行基因重组和改造,获得新的病毒毒株应用于神经细胞谱系和通路研究将会是主要方向.
2.1.2 电穿孔基因转导
电穿孔技术是指利用DNA 带负电荷的特点,在高电场作用下向正极移动,利用细胞膜的通透性,将外源分子导入细胞.使用BTX 等公司生产的电击仪即可完成这一过程.
该技术能快速直接地使不同形式的重组质粒在体内表达,简便性上大大超过了病毒载体,促使发育生物学研究取得了一系列的进展.1999年,Akamatsu首先在从子宫取出的E8.25/E9的小鼠胚胎中实现了体内电穿孔转基因,观察到了早期中枢神经系统的发育情况[14].这对于研究小鼠神经细胞命运决定、迁移、定位和轴突导向等神经系统后期发育具有深远的意义.目前已经开发出多种发育研究特用电极,如Genetrodes、L形状针电极.许多研究人员已经在鼠、斑马鱼、蟾蜍、果蝇的研究中应用了此项技术,转染了眼、心或者肢体组织.
该技术的一大优势是不影响动物存活,且能够同时转导多个基因,并能结合神经系统发育的时空特异性进行基因转导,转导后短时间内就能观察.缺点是外源基因表达持续的时间较短,大多1~2月后表达量降至很低.代谢和酶活动旺盛的细胞尤为如此;另外,不同实验组织、物种,首次实验都需摸索条件:DNA状态(例线性或环状)、浓度、体积、电压、波形、电穿孔次数和时间等都需优化,才能形成稳定的电穿孔转导体系.
2.2 长效示踪
指的是遗传性改变细胞的基因,使其表达特异性标志物.主要指构建Cre/loxp转基因品系.Cre重组酶是一种位点特异性重组酶,特异识别loxp位点并介导位点间序列被删除或重组,无需借助任何辅助因子,可作用于多种结构DNA 底物,如线形、环状,甚至超螺旋结构,大致原理见图1(修改自Zinyk 等[15]).Joyner等最早应用Cre/loxp 系统研究大脑发育过程中细胞谱系示踪[15].他们构建了两种转基因小鼠:一种是在β-actin基因的启动子后插入标志基因LacZ,其表达被一段同向loxp锚定的“STOP”序列所抑制;另一种是在Engrailed2(En2)启动子后插入Cre基因.两种转基因品小鼠杂交后,表达En2的细胞会产生Cre酶,进而切除“STOP”序列,启动标志基因LacZ的表达.利用该方法,Joyner等证实了En2阳性的细胞在小鼠中脑发育中的重要作用.
神经系统的发育伴随着各类神经细胞的分化,意味着特异性基因的表达,所以通过组织或细胞特异性启动子启动Cre重组酶的表达,以去除loxp位点间的抑制序列,从而激活受体基因,例如LacZ、GFP等,以此标记所有带该启动子的细胞及其子代来达到示踪的目的.目前已在斑马鱼[16-17]和小鼠中广泛使用.
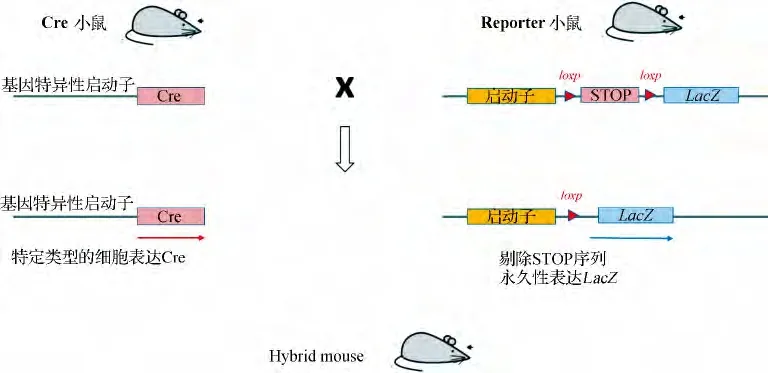
图1 Cre/loxp原理Fig 1 Schematic diagram of Cre/loxp system
2012年,Rodrigue利用Sox10[16],以及2013 年,Hochgreb-Hagele利用FoxD3[17]这些特异性启 动子,长效地追踪了神经嵴细胞的迁移和分化过程.同样,在小鼠中,也常利用特异性启动子启动CRE 重组系统来追踪周围神经系统发育过程中神经嵴细胞亚群.例如,利用Ngn1 标记pd2[18];Dbx1 标记pd6,p0[19];Oligo2标记p MN[20];Nkx2.2标记p3区细胞[21]等.但用Cre/lox转基因品系进行研究需要注意一个问题,即该基因是否特异性地表达在该组织或细胞中,如若不是,在利用CRE 敲除,影响到该基因在别的组织中的表达或功能,那么,所得结果就得另有考虑,或重新评估.例如应用最为广泛的Wnt1-cre.有研究表明,Wnt1-cre小鼠品系有可能激活了中脑中的Wnt信号通路[22-23].
最新基于CRE重组技术发展起来的,利用多荧光基因序列的随机重组,产生出更多的颜色组合,即所谓的Rainbow[24],Zebrabow[25],,以达到更多荧光颜色同时示踪多种神经前体细胞的迁移、分化、增殖过程,对神经发育生物学研究来说又是一大进步.
建立转基因品系进行示踪的最大优点是克服了瞬时转染表达时间短、不能传代的弱点,使研究者能够长效地对目的细胞及其后代进行追踪和观察.缺点是构建一个转基因品系比较困难,从载体构建到注射到细胞筛选到最终成为转基因动物,耗时长,技术难度大且成功率低,目前适用的研究模型还比较局限.转基因品系构建成功后也仅限于某类带特异性启动子细胞的研究,相对局限,不如其他方法来的灵活多变.
3 结语
神经发育生物学的一个重要研究方向是揭示发育过程中,神经前体细胞如何从它们原先产生的位置迁移到最终的目的地以及相互之间联系的形成这一过程.种种证据显示,是基因控制了这一切的发生[26].但对于神经前体细胞间存在什么样的相互作用,以及它们所处的环境如何影响它们的命运,我们还知之甚少.随着高分辨率显微镜和多种荧光蛋白的应用,双光子显微镜的发展,优质的模式生物,如斑马鱼、秀丽隐杆线虫,更多的基因操纵手段的发明,例如TALENS和CRISPR 技术都将应用到神经系统发育的研究中,为我们解答这些未知给予希望.
[1]Nusslein-Volhard C,Wieschaus E.Mutations affecting segment number and polarity in Drosophila[J].Nature,1980,287(5785):795-801.
[2]Kulesa P.In ovo time-lapse analysis after dorsal neural tube ablation shows rerouting of chick hindbrain neural crest[J].Development,2000,127(13):2843-2852.
[3]Nakajima T,Ohtori S,Yamamoto S,etal.Differences in innervation and innervated neurons between hip and inguinal skin[J].Clinical Orthopaedics &Related Research,2008,466(10):2527-2532.
[4]Sellésnavarro I,Villegaspérez M P,Salvadorsilva M,etal.Retinal ganglion cell death after different transient periods of pressure-induced ischemia and survival intervals.A quantitative in vivo study[J].Investigative Ophthalmology & Visual Science,1996,37(10):2002-3014.
[5]陈沛,王鹏,陈广理,等.Study on remodeling of astrocytes in facial neuclus after peripheral injury[J].华中科技大学学报:医学英德文版,2005,25(6):726-728.
[6]Landmesser L.The distribution of motoneurones supplying chick hind limb muscles[J].Journal of Physiology,1978,284(1):371-389.
[7]Mesulam M M.Tracing neural connections with horseradish peroxidase.Vol.1[M].New York:John Wiley &Sons Inc,1982.
[8]Guo Y.An anterograde CB-HRP study of retinal projection to the hypothalamus in the rat[J].Brain Res,1992,8:249-253.
[9]Glover J C.Fluorescent dextran-amines used as axonal tracers in the nervous system of the chicken embryo[J].J Neurosci Methods,1986,18(3):243-254.
[10]Stoll T M,Dubois G,Schwarzenbach O.The dynamic neutralization system for the spine:a multi-center study of a novel non-fusion system[J].European Spine Journal,2002,11(S2):170-178.
[11]Kulesa P M,Mckinney M C,Mclennan R.Developmental imaging:The avian embryo hatches to the challenge[J].Birth Defects Research Part C Embryo Today Reviews,2013,99(2):121-133.
[12]Mckinney M C,Fukatsu K,Morrison J,etal.Evidence for dynamic rearrangements but lack of fate or position[J].FASEB Journal,2013,27:Art.No.965.1.
[13]Wynn M L,Rupp P,Trainor P A,etal.Follow-the-leader cell migration requires biased cell-cell contact and local microenvironmental signals[J].Physical Biology,2013,10(3):035003.
[14]Akamatsu W,Okano H.Mammalian ELAV-like neuronal RNA-binding proteins HuB and HuC promote neuronal development in both the central and the peripheral nervous systems[J].Proc Natl Acad Sci USA,1999,96(17):9885-9890.
[15]Zinyk D L,Mercer E H,Harris E,etal.Fate mapping of the mouse midbrain-hindbrain constriction using a site-specific recombination system[J].Current Biology,1998,8(11):665-672.
[16]Rodrigues F S L M,Doughton G,Yang B,etal.A novel transgenic line using the Cre-lox system to allow permanent lineage-labeling of the zebrafish neural crest[J].Genesis,2012,50(10):750-757.
[17]Hochgreb-Hägele T,Bronner M E.A novel FoxD3 gene trap line reveals neural crest precursor movement and a role for FoxD3 in their specification[J].Developmental Biology,2013,374(1):1-11.
[18]Qui~nones H I,Savage T K,Battiste J,etal.Neurogenin 1(Neurog1)expression in the ventral neural tube is mediated by a distinct enhancer and preferentially marks ventral interneuron lineages[J].Developmental Biology,2010,340(2):283-292.
[19]Dyck J,Lanuza G M,Gosgnach S.Functional characterization of dI6 interneurons in the neonatal mouse spinal cord[J].Journal of Neurophysiology,2012,107(12):3256-3266.
[20]Dessaud E,Yang L L,Hill K,etal.Interpretation of the sonic hedgehog morphogen gradient by a temporal adaptation mechanism[J].Nature,2007,450(7170):717-720.
[21]Balderes D A,Magnuson M A,Sussel L.Nkx2.2:Cre knock-in mouse line:A novel tool for pancreas and CNS-specific gene deletion[J].Genesis,2013,51(12):844-851.
[22]Murdoch B,Delconte C,García-Castro M I.Pax7 lineage contributions to the mammalian neural crest[J].Plos One,2012,7(7):3597-3610.
[23]Lewis A E,Vasudevan H N,O'Neill A K,etal.The widely used Wnt1-Cre transgene causes developmental phenotypes by ectopic activation of Wnt signaling[J].Developmental Biology,2013,379(2):229-234.
[24]Loulier K,Barry R,Mahou P,etal.Multiplex cell and lineage tracking with combinatorial labels[J].Neuron,2014,81(3):505-520.
[25]Pan Y A,Freundlich T,Weissman T A,etal.Zebrabow:multispectral cell labeling for cell tracing and lineage analysis in zebrafish[J].Development,2013,140(13):2835-2846.
[26]Betancur P,Bronner-Fraser M,Sauka-Spengler T.Assembling neural crest regulatory circuits into a gene regulatory network[J].Annual Review of Cell &Developmental Biology,2010,26:581-603.
