乙肝病毒核苷类似物耐药位点分析
2015-03-20
湖北省中医院检验科 (湖北 武汉,430061)
根据世界卫生组织的统计,每年约有100 万人死于肝癌、肝硬化或肝功能衰竭,在我国肝癌、肝硬化或肝功能衰竭多与乙型肝炎病毒感染有关,目前我国约有3.5 亿HBV 携带者。乙型肝炎病程的发展与HBV 的持续高载量密切相关,一旦肝功能发生失代偿,由于并发症的发生,5年的死亡率高达85%。研究表明,抑制HBV 的复制是控制疾病进程的关键所在。但是,使用核苷类似物控制HBV 复制面临一个严峻的问题,即核苷类似物的耐药性[1,2],核苷类似物的长期使用导致患者体内不同程度的出现病毒耐药突变。
本研究采用巢式PCR 结合测序的方式检测了115例我院门诊、住院的慢性乙型肝炎(CHB)患者的耐药突变形式,对核苷类似物耐药位点特点进行了分析,为评价药物治疗效果和合理用药提供理论基础。
1 资料与方法
1.1 临床资料 选取115例2011年11月至2014年7月在湖北省中医院进行HBV 耐药位点检测的CHB 患者,诊断符合《病毒性肝炎防治方案》中CHB 的诊断标准[3],男63例,女52例,年龄在23~72岁。所有患者最短用药时间为1年,最长为4年。其中59例患者曾接受过拉米夫定或阿德福韦酯联合拉米夫定口服治疗6个月以上,定为拉米夫定组;另外56例患者中,12例使用阿德福韦、21例使用恩替卡韦、23例使用恩替卡韦、替比夫定、替诺福韦酯联合治疗,定为对照组。
1.2 主要仪器和试剂 乙肝病毒提取、检测试剂盒(上海复兴科技有限公司),KOD Dash、Buffer 及配套dNTPs(武汉大风生物科技有限公司),普通PCR 仪(Bio-rad C1000 PCR 仪),荧光定量PCR 仪(ABI-7500 型),巢式PCR 引物委托上海生工生物有限公司合成。
1.3 方法
1.3.1 巢式PCR 引物的设计 依据HBV 的基因组情况结合以往的研究成果,以P 基因的逆转录酶区域为靶序列设计巢式PCR 的引物对,并包含目前已知的所有HBV 耐药位点。通过访问美国国立卫生图书馆生物技术信息中心(NCBI)的官方网站核酸序列数据库GenBank 网页,下载相应序列,采用Beacon Designer 7.0 软件设计引物,并使用NCBI 网站的对比基本检索工具(Basic Local Alignment Search Tool,BLAST)进行验证,比对查看有无与其他病毒基因同源的情况。第一轮PCR 上、下游引物分别为AATCCTCACAATACCACAGAGTC 和TTGTATACATGCATATAAAGGCAT,第二轮PCR 上、下游引物分别为TCTCTCAATTTTCTAGGGGGA 和TTGACATACTTTCCAATCAATAGG。
1.3.2 HBV DNA 的提取和扩增 采集患者血清,所有血清均进行乙肝病毒载量检测,选取其中HBV DNA 阳性(即病毒载量103~108copies/mL)者进行巢式PCR,检测其耐药位点形式。按试剂盒要求的步骤从血清中提取HBV DNA,用1.3.1 中设计的巢式PCR 引物进行扩增,50μl 反应体系为:DEPC 水37.5μl、KOD Buffer 5μl、上游引物1μl、下游引物1μl、KOD DASH 0.5μl、DNA 模板5μl。扩增条件为:第一轮94℃6min;94℃30s,53℃5s,74℃27s,40个循环;74℃6min。第二轮94℃6min;94℃30s,54℃5s,74℃21s,40个循环;74℃6min。扩增完毕后,产物送测序公司进行基因测序。
1.3.3 HBV 耐药位点及基因分型分析 采用目前公认的P 基因RT 区的8个位点进行耐药分析,分别为rt173、rt180、rt181、rt184、rt202、rt204、rt236、rt250。用MEGA3.1 对测序结果进行分析,在MEGA3.1 中与HBV 标准序列片段进行比对,依次对上述8个位点进行氨基酸分析,如测序图中有一位点存在双峰,且低峰高度为高峰的25%,则认为存在套峰共存的现象,该位点发生突变。利用NCBI 的基因分型网页进行HBV 基因分型分析。进入网页,将测序结果输入,并在选择框中选择HBV 分型,即得到分型结果。
2 结果
2.1 HBV DNA 检测 在115例血清中,100例血清的HBV DNA 载量为阳性,巢式PCR 扩增产物经琼脂糖凝胶电泳均得到与目的片段相同大小的条带,测序结果与GenBank 上比对确证为HBV DNA 序列。测序结果如图1。

图1 HBV 野生型测序图
2.2 HBV 基因分型分析 对100例HBV DNA 阳性血清的HBV 基因分型结果显示,CHB 患者HBV B 基因型有76例,占76%;C 基因型有29例,占29%;D 基因型占1例,占1%;其中B、C 共感染的患者有5例,占5%。结果显示武汉地区CHB 患者,基因型主要为B 型(76%)和C 型(29%),兼有少量D 型和B、C 共感染的患者。
2.3 HBV 耐药位点分析 100例HBV DNA 阳性血清中有48例发生耐药位点突变,将发生耐药的48例血清定为耐药组,未发生耐药的血清定为非耐药组。耐药组耐药位点分布见表1。耐药组HBV 基因分型结果显示,HBV B 型占27例(56.3%),C型占21例(43.7%),经卡方检验耐药突变的HBV 基因分布无统计学差异(P>0.05)。
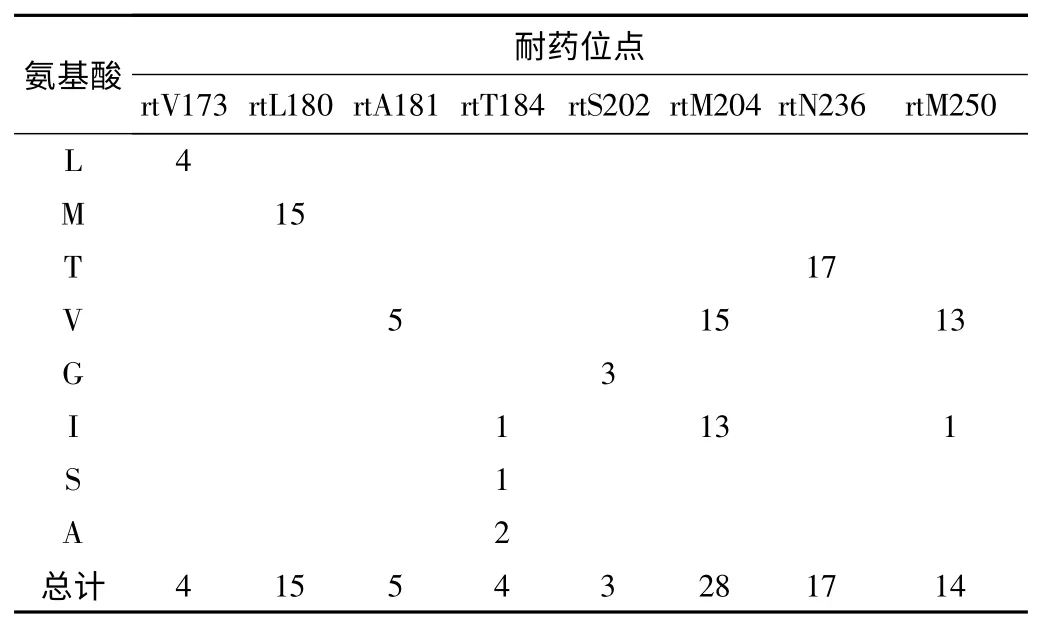
表1 耐药组患者HBV 耐药位点分布
2.4 两组患者耐药突变位点分析 研究表明,CHB 患者长期应用拉米夫定治疗会引起rt204 位点的YMDD 突变,因此以rt204 位点的突变情况检测拉米夫定的耐药突变特点。拉米夫定组59例血清中,28例发生rt204 位点的YVDD 或YIDD 突变,对照组56例血清中,7例发生rt204 位点突变,经卡方检验两组发生突变的概率差异具有统计学意义(P<0.01)。
2.5 耐药株检出与患者病情关系 对48例耐药者和67例非耐药者血清分别检测HBV DNA 病毒载量和ALT,结果显示,当HBV 病毒在患者体内发生耐药时,其ALT 和HBV DNA 定量均与非耐药患者有明显差异(P<0.01)。结果见表2。
表2 耐药者与非耐药者HBV DNA 和ALT 检测结果比较()

表2 耐药者与非耐药者HBV DNA 和ALT 检测结果比较()
与非耐药组比较,△P<0.01
3 讨论
目前,用于乙型肝炎抗病毒治疗的药物一般有两类,一类是干扰素(IFN),一类是核苷类似物(NUCs),国家食品药品监督管理总局准许临床治疗应用的核苷类似物包括拉米夫定(lamivudine)、阿德福韦(adefovir)、恩替卡韦(entecavir)和替比夫定(telbivudine)[4]。核苷类似物在临床治疗应用中为抗病毒首选药物,其治疗目的是抑制HBV 复制并最终阻止或延缓慢性乙型肝炎并发症的发生,但由于持久共价环状DNA(cccDNA)的存在并能够整合到受体肝细胞基因组中,因此,彻底根除HBV 感染是不可行的。现阶段的核苷类似物对病毒的抑制作用是通过影响反转录的启动及DNA 的延伸[5],使病毒的复制受到抑制而发挥效用。近些年来,CHB 的治疗从短期应用干扰素到短期应用核苷类似物再到今天长期应用核苷类似物的治疗,充分说明了核苷类似物的良好治疗效果,尤其是恩替卡韦、替比夫定有着良好的治疗效果和较高的耐药屏障。
拉米夫定是第一个用于治疗CHB 的核苷类似物,具有较低的耐药屏障,长期服用可导致患者204 位点产生YMDD 突变,有研究显示拉米夫定的5年耐药率为65%[6~8]。阿德福韦酯相比拉米夫定而言有更好的耐药屏障,但大剂量的阿德福韦酯会加重肾脏毒性。恩替卡韦有较强的抗病毒作用,但血清转换率较低,研究表明它对治疗拉米夫定耐药患者是最佳选择。替比夫定作为一种新的有效替代药物,其耐药屏障明显优于拉米夫定,并在抗病毒疗效和ALT 正常化的疗效明显优于拉米夫定。
有研究表明HBV DNA 的载量越高,发生耐药的概率越大,本研究中耐药组的转氨酶和病毒载量均明显高于非耐药组,进一步证实了耐药的发生与患者病情的相关性。耐药发生率最高的是拉米夫定(65%~70%,4~5年)[9],一般而言拉米夫定耐药可选择继续并联合阿德福韦或替诺福韦,在耐药的处理方面最困难的是多重耐药的出现[10],本研究中发现了几种多重耐药模式可供参考:①rt204V,rt180M/I;②rt250V/I,rt236T;③rt204V,rt202G,rt184I;一般认为rt204V,rt180M/I 是典型的恩替卡韦耐药,rt250V/I,rt236T 是典型的阿德福韦耐药。在此基础上还出现了两例rt250V/L,rt204I,rt180M 和rt204V,rt202G,rt184I 新的突变组合。这种新的突变模式是否也会引起恩替卡韦耐药或其他耐药还需进一步验证。
本研究对115例耐药位点检测患者的HBV RT 耐药位点分析发现,使用拉米夫定治疗的患者中HBV 耐药发生概率较高,多重耐药位点比率较高。为医生制定抗病毒治疗方案提供了依据,更有利于指导用药,减少多重耐药突变的发生。
[1]姚玲娣.阿德福韦酯治疗活动性代偿期乙肝肝硬化疗效观察[J].广东医学,2009,30(10):1558 -1559.
[2]冯继红.恩替卡韦治疗失代偿期乙肝肝硬化临床疗效观察[J].医学与哲学,2011,32(8):29 -30.
[3]中华医学会传染病与寄生虫子病学分会、肝病学分会、病毒性肝炎防治方案[J].中华肝脏病杂志,2000,8(6):324 -329.
[4]苏何玲,班亚珂,左晓臣,等.桂林地区乙肝患者HBV 核苷类似物耐药位点分析[J].实用医学杂志,2012,28(19):3189 -3191.
[5]Suzuki F,Akuta N,Suzuki Y,et al.Selection of a virus strain resistant to entecavir in a nucleoside-naive patient with hepatitis B of genotype H[J].J ClinVirol,2007;39:149–152.
[6]李晓霞,申文.核苷酸药物治疗乙肝耐药分析[J].当代医学,2011,17(20):127 -128.
[7]聂涌,王长本,丁显平,等.基因芯片在乙肝病毒检测中的应用[J].现代预防医学,2008,35(2):319 -321.
[8]吴红章,戴晨阳,李顺天,等.慢乙肝患者HBV P 区基因变异与病情的相关性及阿德福韦酯治疗效果观察[J].山东医药,2010,50(7):58 -59.
[9]Villet S,Pichoud C,Billioud G,et al.Impact of hepatitis B virus rtA181V/T mutants on hepatitis B treatment failure[J].J Hepatol,2008,48:747–755.
[10]潘涛.门诊乙肝患者和经拉米夫定治疗后乙肝患者基因分型和HBV P 区耐药突变检测分析[J].山西医科大学学报,2012,43(1):4 -6.
