丹参川芎嗪注射液治疗急性脑梗死的疗效及对溶血磷脂酸、P选择素的影响
2015-03-18肖建新郑天勇刘志新
蓝 宇,肖建新,郑天勇,刘志新
(南方医科大学附属小榄医院,广东 中山 528415)
丹参川芎嗪注射液治疗急性脑梗死的疗效及对溶血磷脂酸、P选择素的影响
蓝 宇,肖建新,郑天勇,刘志新
(南方医科大学附属小榄医院,广东 中山 528415)
目的 观察丹参川芎嗪注射液治疗急性脑梗死的疗效、安全性及对溶血磷脂酸(LPA)、P选择素(CD62p)的影响。方法 将80例急性脑梗死患者随机分为观察组及对照组,每组40例。2组患者均在入院后给予常规治疗,观察组在此基础上给予丹参川芎嗪注射液10mL加入5%葡萄糖液250mL(糖尿病患者用生理盐水250mL)静滴,1次/d,连续治疗14d。比较2组入院时及治疗14d后神经功能缺损(NIHSS评分)及日常生活能力Barthel指数变化情况、总体疗效以及血清LPA、CD62p水平的变化,不良反应发生情况。结果 2组治疗14d后NIHSS评分、Barthel指数、血清LPA和CD62p水平均较治疗前显著改善(P均<0.01),且观察组改善幅度显著大于对照组(P均<0.01);观察组临床总有效率为92%,对照组为75%,2组比较差异有统计学意义(P<0.05)。2组均未见全身不良反应。结论 丹参川芎嗪注射液辅助治疗急性脑梗死,可通过抑制血小板聚集,改善微循环,减少血栓形成,从而更有效地改善神经功能缺损,加速日常生活能力的恢复,且未增加不良反应,可在临床推广应用。
脑梗死;丹参川芎嗪注射液;溶血磷脂酸;P选择素
急性脑梗死为临床常见的脑血管疾病,病死率、致残率较高,现已成为我国城乡居民死亡的第2大原因,严重危害人们的生命健康,一直为学者们研究的热点[1-2]。目前,急性脑梗死的常规治疗方法包括及时治疗原发病、抗凝、维持水电解质平衡等,而最理想的方法是在缺血脑组织发生坏死前尽可能快地恢复正常血流,以获得早期重灌注,减轻神经细胞的损伤,改善预后。因此,选择安全而有效的药物十分必要。丹参川芎嗪注射液是中药复方制剂,具有活血化瘀、通脉舒络的功效,且安全性较好,适用于闭塞性脑血管病的治疗[3]。笔者观察了丹参川芎嗪注射液治疗急性脑梗死的疗效及对溶血磷酸脂(LPA)、P选择素(CD62p)的影响,现将结果报道如下。
1 临床资料
1.1一般资料 选择2011年3月—2013年4月本院收治的急性脑梗死患者80例,均符合全国第四次脑血管病学术会议制定的《各类脑血管病诊断要点》中的脑梗死诊断标准,发病72h内入院。排除:合并偏瘫、老年痴呆及其他神经系统疾病者,由脑肿瘤、脑外伤等引起卒中者,合并严重感染,肝、肾、内分泌等严重疾病者,发病前2周内使用可能影响血小板活性的药物者,有胃溃疡、胃出血、中风病史者。将80例急性脑梗死患者随机分为2组:观察组40例,男21例,女19例;年龄54~72岁;合并高血压18例,糖尿病7例,冠心病10例。对照组40例,男20例,女20例;年龄56~70岁;合并高血压21例,糖尿病8例,冠心病11例。2组性别、年龄、合并疾病情况比较差异无统计学意义(P均>0.05),具有可比性。
1.2方法 2组均在入院后均给予常规治疗,包括卧床休息、吸氧、加强呼吸道护理、甘露醇脱水降颅压、阿司匹林抗血小板聚集、控制血压、调节水电解质平衡、控制和预防感染等。观察组在此基础上给予丹参川芎嗪注射液10mL加入5%葡萄糖溶液250mL(糖尿病患者用生理盐水250mL)静滴,1次/d,连续治疗14d。
1.3观察指标 ①2组入院时及治疗14d后,分别采用美国国立卫生研究院卒中量表(NIHSS)和Barthel指数(BI)量表评估神经功能缺损及日常生活能力的恢复情况。②治疗14d后评价2组总体疗效。③治疗前及治疗14d后,分别采集2组患者清晨空腹肘静脉血5mL,3 000r/min离心10min,取上清液,采用酶联免疫吸附(ELISA)法检测血清中LPA、CD62p水平。④治疗期间观察2组不良反应发生情况。
1.4疗效评定标准 基本痊愈:神经功能缺损评分减少91%~100%,病残程度0级,工作和日常生活能力得以恢复;显著进步:神经功能缺损评分减少46%~90%,病残程度1~3级,工作和日常生活能力得以部分恢复;进步:神经功能缺损评分减少18%~45%;无变化:神经功能缺损评分减少或增加18%以下;恶化:神经功能缺损评分增加18%以上。基本痊愈+显著进步+进步为总有效。

2 结 果
2.12组治疗前后NIHSS评分和BI评分比较 2组治疗前NIHSS评分和BI评分比较差异无统计学意义(P均>0.05),治疗14d后均较治疗前显著改善(P均<0.01),而观察组改善幅度显著大于对照组(P<0.01)。见表1。
2.22组总体疗效比较 观察组临床总有效率显著高于对照组(P<0.05)。见表2。

表1 2组治疗前后NIHSS评分和BI评分比较分)
注:①与本组治疗前比较,P<0.01;②与对照组比较,P<0.01。
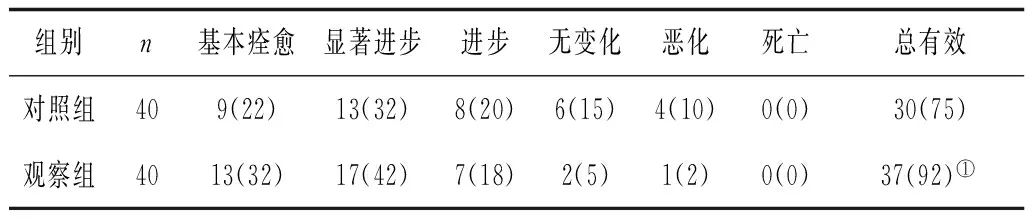
表2 2组总体疗效比较 例(%)
注:①与对照组比较,P<0.05。
2.32组治疗前后血清LPA、CD62p水平比较 2组治疗前血清LPA、CD62p水平比较差异无统计学意义(P均>0.05),治疗后均较治疗前显著下降(P均<0.01),观察组下降幅度显著大于对照组(P<0.01)。见表3。

表3 2组治疗前后血清LPA、CD62p水平比较
注:①与本组治疗前比较,P<0.01;②与对照组比较,P<0.01。
2.42组不良反应发生情况 2组均未见全身不良反应,血、尿、便常规以及肝、肾功能,心电图等检查均未发现明显异常。观察组有3例患者在静脉滴注丹参川芎嗪注射液时穿刺处出现轻度红色皮疹,未行特殊处理,2~3d后均自行消失,未影响治疗。
3 讨 论
急性脑梗死占全部脑血管病的60%左右,也是导致神经功能缺损最为常见的疾病之一。该病的发病机制较为复杂,但主要的病因为动脉粥样硬化,在此基础上,机体血管内皮损伤、凝血酶激活、血小板活性增加、纤维蛋白溶解损坏等病理因素共同参与其发生和发展。其中,病变动脉壁的血小板局部激活是血栓形成的起始步骤,随后局部血栓形成,致使血管腔变窄而堵塞,最终大量血栓形成导致脑组织血流供应障碍,发生缺血性梗死,损伤脑细胞,引起神经功能缺损[4]。LPA、CD62p是近年来研究较多的血小板活化因子,可以反映机体血小板聚集、血栓形成的情况[5]。LPA主要来源是细胞膜在磷脂合成期间产生的小分子脂质,脂肪细胞、卵巢肿瘤细胞、神经细胞等均可以在一定的刺激下产生LPA,活化的血小板及低密度脂蛋白当受到轻度氧化时也可以产生该物质[6]。LPA可以调节活化血小板与可溶性纤维蛋白原结合的受体,进而促进二者的结合,促使纤维蛋白原的水解,奠定了凝血和血栓形成的基础。LPA在血栓形成过程的起始阶段也发挥重要调控作用,可激活特异性G蛋白,引起血小板形态改变,启动血小板活化,而活化的血小板又进一步产生LPA。研究表明[7],LPA在内皮素-1的刺激下产生增加,二者相互影响,可诱发脑血管痉挛。正常情况下,脑脊液中LPA水平较低,而病理情况下LPA可通过血脑屏障进入脑脊液,从而对脑梗死的发生、发展及预后发挥一定的作用。CD62p存在于静止血小板颗粒、活化血小板质膜、血管内皮细胞膜上,当血小板活化时表达,可介导血小板与内皮细胞的聚集,参与血栓形成过程,使机体处于高凝状态[8]。CD62p与脑梗死的关系密切,对梗死后的梗死面积及梗死后的神经功能评分也有一定的影响,与梗死灶面积呈正相关,与病情严重程度也呈正相关[9]。脑梗死发生时,组织缺血再灌注产生的大量氧自由基等可以刺激血小板释放凝血酶及表达CD62p,CD62p又可导致白细胞黏附,组织因子暴露,激活凝血系统,而活化的凝血系统又可进一步活化血小板,而活化的血小板在急性脑梗死的发生、发展中发挥重要作用[10],CD62p作为血小板活化的最特异分子标记物,反映了血小板活化程度,在脑缺血早期水平增加,促进了白细胞的黏附过程,加重了脑缺血后损伤。
针对上述发病机制,急性脑梗死如果尽可能早地给予有效治疗,脑组织梗死缺血部位的血流供应和缺血组织代谢就可以得到快速改善,梗死灶周围已损伤的神经组织才有可能得以恢复,从而降低组织坏死的风险[11]。临床上,溶栓应是急性脑梗死的首选治疗方案,但最宜在发病后3~6h内完成,治疗的时间窗要求非常严格,而一般情况下,患者自发病至入院已经远远超过此时间窗,只能选择药物保守治疗。因此,选择安全而有效的药物成为决定急性脑梗死患者预后的关键所在。
丹参川芎嗪注射液的有效成分为丹参素和盐酸川芎嗪,系从中药丹参和川芎中经现代技术提取而成。研究证明,丹参素具有明显抑制血小板聚集,增加血小板膜流动性,激活纤溶酶系统等作用,可改善血液流变和微循环障碍,因此可预防脑血栓形成[12];另外,丹参素能抑制细胞内源性胆固醇合成以及抗脂质蛋白氧化,可有效预防动脉粥样硬化的发生[13]。盐酸川芎嗪可显著增加冠脉血流量,从而降低冠脉阻力,还可抑制血小板聚集,改善微循环和脑血流,因此可有效预防动脉血栓的形成。两者结合可发挥协同作用,抗血小板聚集、降低血液黏度、加速红细胞流速、改善机体微循环等作用更为显著。本研究中结果显示,观察组神经功能缺损及日常生活能力的恢复情况更好,总体疗效更为显著,说明丹参川芎嗪注射液辅助治疗急性脑梗死可明显提高疗效,有助于改善预后。同时血清LPA、CD62p水平的检测结果从微观上反映了丹参川芎嗪注射液对急性脑梗死患者脑组织血流供应的改善作用,即该药可通过降低机体LPA的生成、抑制血小板CD62p的表达,进一步减少和预防血栓形成,改善病变部位及周围微循环和脑血流供应,促进患者神经功能的恢复,有利于预后。
综上所述,在常规治疗基础上,联合应用丹参川芎嗪注射液辅助治疗急性脑梗死可进一步抑制血小板聚集,改善微循环,减少血栓形成,从而更有效地改善神经功能,加速日常生活能力的恢复,且未增加不良反应,值得临床推广应用。
[1] 魏衡,余勇飞,尹虹祥,等.hs-CRP联合ABCD2评分预测短暂性脑缺血发作后短期发生脑梗死的风险[J]. 中国神经免疫学和神经病学杂志,2014,21(1):28-31;35
[2] 李超平,李递通. 急性脑梗死溶栓治疗现状及进展[J]. 医学理论与实践,2014,10(3):305-307
[3] 严刚莉,章嵘,左文娟,等. 丹参川芎嗪注射液治疗急性缺血性脑卒中患者的安全性和有效性[J]. 中国老年学杂志,2014,20(13): 3634-3635
[4]KangJ,ParkTH,LeeKB,etal.Symptomaticsteno-occlusioninpatientswithacutecerebralinfarction:prevalence,distribution,andfunctionaloutcome[J].JStroke,2014,16(1):36-43
[5] 齐茗,王晨霞. 血小板活化标志物CD62P、PAC-1与心血管病关系研究的进展[J]. 心血管康复医学杂志,2014,23(1):98-100
[6] 李月春,刘国荣,闫洁,等. 缺氧对磷脂酶A2和脂蛋白相关磷脂酶A2及溶血磷脂酸的影响[J]. 中华老年心脑血管病杂志,2014,16(2):200-204
[7] 阳诚柏,苏玲. 溶血磷脂酸在急性心肌梗死中的研究进展及在中西医干预中的意义[J]. 中国中医药现代远程教育,2014,12(3):158-159
[8] 张徐枫,吴晓琳,吴海琴,等. 急性脑梗死患者血小板活化和凝血纤溶功能改变及其临床意义[J]. 中国血液流变学杂志,2014,16(1):52-54;152
[9] 张斤,段传志,李铁林,等. 血小板活化特异性标志物PAC-1和CD62p与急性脑梗死病情严重程度的相关性[J]. 中国神经精神疾病杂志,2011,37(11): 698-701
[10] 林志坚,吴军,张海鸥. 急性脑梗死患者血小板活化功能测定的临床意义[J]. 中国实用医刊,2012,39(13):1-3
[11] 吕俊彬. 急性脑梗死溶栓治疗的时间窗选择与疗效分析[J]. 陕西医学杂志,2013,42(8):969-970
[12] 管敏国,张宇燕,万海同,等. 丹参川芎有效成分配伍对缺氧损伤大鼠脑内皮细胞的影响[J]. 安徽中医药大学学报,2014,33(2):74-78
[13] 黄文东,杨永飞,陈建文,等. 丹参素与川芎嗪对心血管系统的协同作用[J]. 中国药理学通报,2013,29(3):432-436
10.3969/j.issn.1008-8849.2015.08.016
R743.33
B
1008-8849(2015)08-0840-03
2014-08-06
