磷酸化ERK-1及磷酸化AKT在子宫内膜癌中表达及意义
2015-03-18骆向丽付乐凡时志民肖艳莉孙冬霞沈艳峰
骆向丽,付乐凡,付 斌,时志民,肖艳莉,孙冬霞,席 丰,沈艳峰,王 蕾
(1. 河北省曲周县妇幼保健院,河北 曲周 057250;2. 河北工程大学,河北 邯郸 055901;3. 河北省邯郸市妇幼保健院,河北 邯郸 055902)
磷酸化ERK-1及磷酸化AKT在子宫内膜癌中表达及意义
骆向丽1,付乐凡2,付 斌2,时志民2,肖艳莉2,孙冬霞3,席 丰2,沈艳峰2,王 蕾2
(1. 河北省曲周县妇幼保健院,河北 曲周 057250;2. 河北工程大学,河北 邯郸 055901;3. 河北省邯郸市妇幼保健院,河北 邯郸 055902)

目的 观察子宫内膜癌组织中磷酸化ERK-1(P-ERK-1)及磷酸化AKT(P-AKT)表达情况。方法 采用免疫组织化学S-P法检测78例子宫内膜癌组织、40例正常子宫内膜组织中P-ERK-1和P-AKT的表达情况。结果 子宫内膜癌组织中P-ERK-1和P-AKT表达定位于细胞核和细胞膜,其表达率分别为74%(58/78)和77%(60/78),明显高于正常子宫内膜组织(P均<0.05);子宫内膜癌组织中,P-ERK-1和P-AKT蛋白在组织学分级G2、G3级及病理分期Ⅱ、Ⅲ~Ⅳ期的表达率分别高于G1级和Ⅰ期(P均<0.05),与肌层浸润程度有关(P<0.05);P-ERK-1表达与无淋巴结转移、病理组织类型无关(P均>0.05);P-AKT与有无淋巴结转移有关(P<0.05),而与病理组织类型无关(P>0.05);相关性分析显示,二者之间呈正相关(P<0.05)。结论 P-ERK-1和P-AKT在子宫内膜癌组织中过度表达,与子宫内膜癌的发生、发展和转移密切相关。
子宫内膜肿瘤;磷酸化ERK-1;P-AKT;免疫组化
子宫内膜癌为女性常见的恶性肿瘤之一,其发病率仅次于宫颈癌。目前子宫内膜癌的发生原因不明,但其发病率呈上升和年轻化趋势[1-2],可能由于生活水平提高,肥胖人群、高血压人群、糖尿病人群增多,还有未孕产人群增多,导致该病具有发病率高、晚期治愈率低的特点,应积极预防,做到早发现、早治疗。考虑到子宫内膜癌的发生是一个多因素、多步骤、多阶段、复杂的生物学过程,受细胞内多个肿瘤相关基因的调控,包括多种信号通路的建立,这些通路上有特有的基因蛋白控制,其中ERK-1是MAPK通路,AKT是PI3K/AKT通路中关键分子。本研究通过检测正常子宫内膜组织、子宫内膜癌组织中P-ERK-1和P-AKT蛋白表达情况,分析了二者在子宫内膜癌发生、发展中的作用,旨在为临床早期发现、治疗该病提供科学依据。
1 临床资料
1.1一般资料 选取2010年1月—2013年12月邯郸市妇幼保健院收治子宫内膜癌手术切除标本78例,术前均未行放、化疗及激素治疗。年龄49~71岁,平均59.34岁;临床病理分期:Ⅰ期20例,Ⅱ期31例,Ⅲ期15例,Ⅳ期12例;组织分级:G1级39例,G2级23例,G3级16例;病灶局限于黏膜层及浸润≤1/2肌层50例,浸润>1/2肌层28例;有淋巴结转移44例,无淋巴结转移34例;腺癌59例,非腺癌19例。另取子宫肌瘤或子宫脱垂等手术切除子宫正常内膜标本40例,年龄50~67岁,平均58.65岁。标本均通过病理科制作成病理蜡块,并由经验丰富的病理诊断医师对每一例标本进行重新诊断。
1.2试剂与方法 采用常规免疫组化试剂盒、二硝基联苯胺(DAB) 显色剂,以S-P方法严格按试剂盒说明书进行操作。子宫内膜癌和正常子宫内膜均用试剂P-ERK-1和P-AKT为一抗,选取阳性表达乳腺癌组织切片作为阳性对照,以PBS缓冲液代替一抗作为阴性对照。
1.3结果判断 P-ERK-1阳性表达定位于细胞核,P-AKT阳性表达定位于细胞浆。阳性结果判定标准:参照Parenti等[3]的标准,每张组织切片均随机观察5个高倍视野(×400),镜下观察在细胞核或胞浆内出现棕黄色颗粒为阳性信号。阳性细胞数<5%为阴性,5%~25%为弱阳性(+),25%~50%为阳性(),>50%为强阳性(),(+)~()视为阳性表达。
1.4统计学方法 采用SPSS 12.0统计软件进行数据处理,计数资料采用2检验。相互关系用等级相关分析,P<0.05为差异有统计学意义。
2 结 果
2.1P-ERK-1和P-AKT在正常子宫内膜、子宫内膜癌组织中的表达情况 正常子宫内膜组织中P-ERK-1蛋白表达阳性8例(20%),P-AKT蛋白表达阳性4例(15%);子宫内膜癌组织中P-ERK-1蛋白表达阳性58例(74%),P-AKT蛋白表达阳性60例(77%)。两者比较差异均有统计学意义(P均<0.05)。子宫内膜癌中P-ERK-1及P-AKT的表达情况见图1和图2。
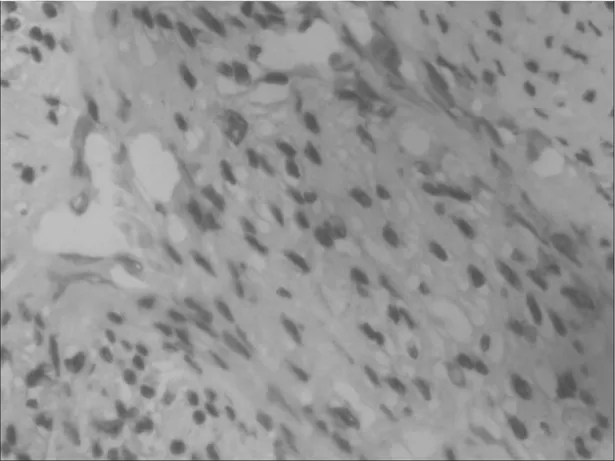
图1 子宫内膜癌中P-ERK-1的表达
2.2P-ERK-1和P-AKT在子宫内膜癌中的表达与临床病理指标的关系 不同组织学分级、病理分期、黏膜层浸润情况与P-ERK-1表达有相关性(P<0.05)。不同组织学分级、病理分期、黏膜层浸润、淋巴结是否转移与P-AKT表达有相关性(P<0.05)。见表1。
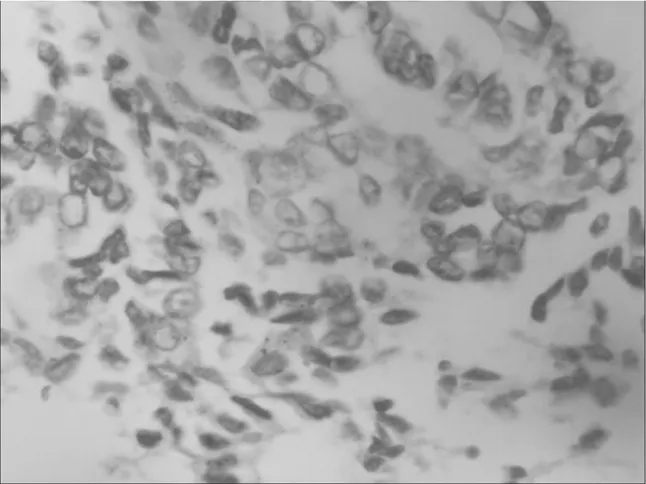
图2 子宫内膜癌中P-AKT的表达
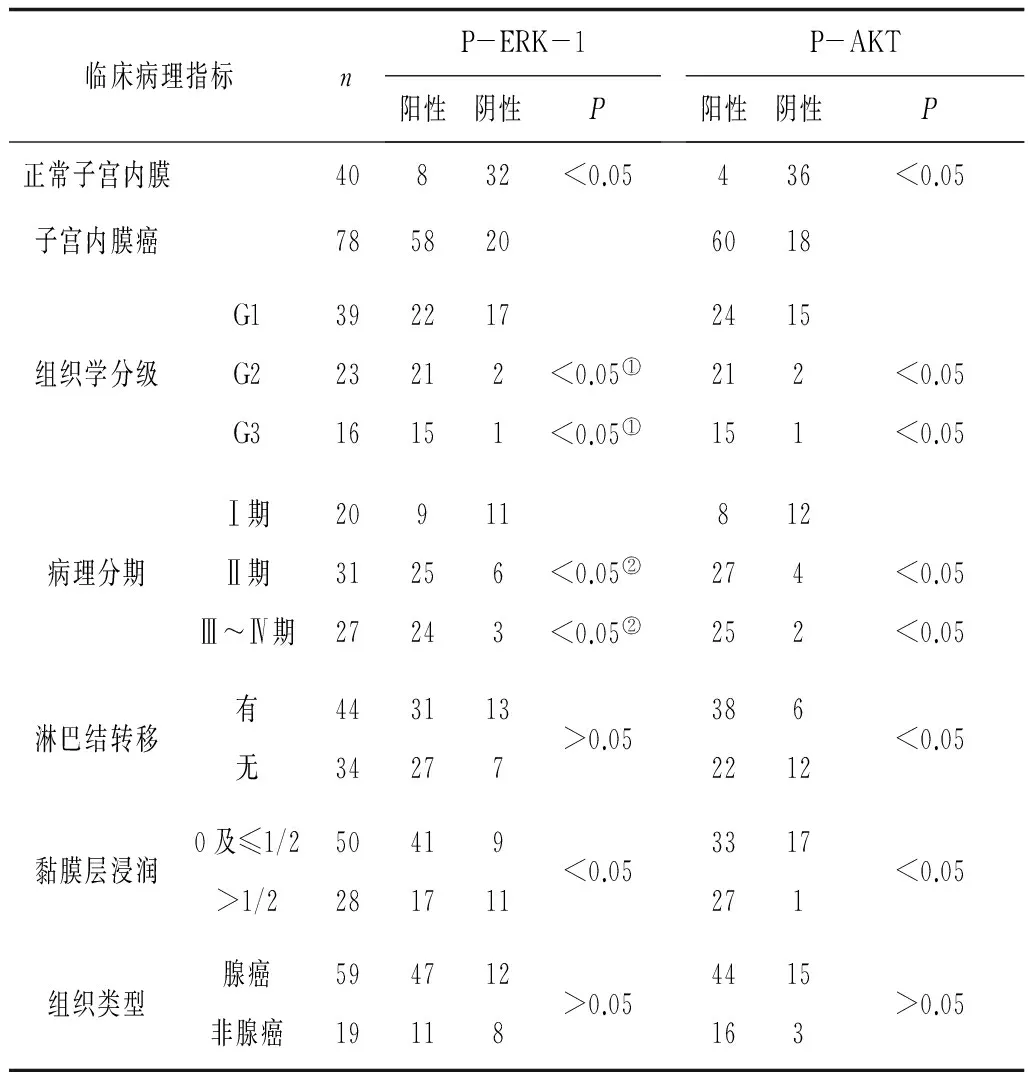
表1 P-ERK-1和P-AKT在子宫内膜癌中的表达与临床病理指标的关系 例
注:①与G1比较;②与Ⅰ期比较。
2.3P-ERK-1和P-AKT在子宫内膜癌组织中的表达相关性分析 P-ERK-1和P-AKT在子宫内膜癌组织中的表达,共同阳性48例,共同阴性8例,二者表达呈明显正相关(r=0.236,P=0.038),表明二者在子宫内膜癌的发生、发展中起到协同作用。
3 讨 论
肿瘤分子靶向治疗作为一种有的放矢的治疗方法为肿瘤治疗指明了方向[4],原因是它以肿瘤细胞的特性为靶点,真正减少对正常细胞的毒副作用,信号转导通路在肿瘤分子靶向治疗已经得到广泛应用,其中Ras/Raf/MEK/ERK 和磷脂酞肌醇-3激酶(phosphatidylinositol 3-kinase,PI3K/AKT) 信号转导通路在临床上研究较多,ERK和AKT是这两条通路的重要激酶,它们处于信号转导的枢纽位置,可以作为Ras/Raf/MEK/ERK通路和PI3K/AKT通路信号转导通路中有效的靶点。本研究通过研究子宫内膜癌中活化后ERK和AKT表达情况,探讨子宫内膜癌中靶向治疗的可行性。
Ras/Raf/MEK/ERK级联信号通路是丝裂原活化蛋白激酶(mitogen-activated protein kinases,MAPK)通路,MAPK是细胞内广泛存在的一类丝氨酸/苏氨酸蛋白激酶,活化前位于胞浆,一旦活化即进入核内激活靶基因。目前发现的MAPK信号通路有ERK、JNK、BMK及P38MAPK4条,其中ERK途径是一条主要和经典的且与人类癌症关系最为密切的途径[5]。ERK-1作为MAPK通路中的代表激酶,可经外界刺激被激活为P-ERK,进入细胞核内,参与调节细胞的生长、发育、分化、分裂等多种生理过程,也可促进多种癌基因及细胞周期调节相关基因的转录与表达,促进细胞增殖,抑制细胞凋亡[6]。临床免疫组织学研究发现P-ERK 在胃癌、肝癌、结肠癌、直肠癌、口腔鳞状上皮癌和小细胞肺癌中表达与其进展相关联[7-11]。本研究结果显示,子宫内膜癌组织中P-ERK-1蛋白表达高于正常子宫内膜组织,并且P-ERK-1表达与病理分期、浸润深度及组织学分级有关,与有无淋巴结转移、病理组织类型无关,提示P-ERK-1的过度表达使MAPK通路在子宫内膜癌中被激活。
AKT是PI3K/AKT通路中的关键分子,激活后的AKT(P-AKT)在肿瘤细胞恶性增殖、血管新生和转移中起着重要作用,在国外被视为癌细胞存活的首要通路[12]。生理状态下,AKT以低活性/失活状态存在于细胞浆,受到刺激后,其发生磷酸化而被激活,且底物呈多样性,说明其作用广泛。研究表明,肝癌、前列腺癌、结肠直肠癌、滤泡状甲状腺癌和肺癌中,P-AKT呈持续高度活化[13-15],而且P-AKT的高表达在促进细胞生长、增殖,促进细胞运动、侵袭,抑制细胞凋亡,促进血管生成,抵抗化疗和放疗中起核心作用[16]。本研究结果发现,子宫内膜癌组织中P-AKT阳性表达率高于正常子宫内膜组织,表明P-AKT与子宫内膜癌的发生有关。且组织学分级较高、肌层浸润较深、有淋巴结转移者P-AKT表达相应增高,这与在卵巢癌[17]和非小细胞肺癌[18]中的研究结果一致,P-AKT可促进子宫内膜癌的进展。AKT为靶点的抗肿瘤药物研究正在蓬勃发展,如perifosine能够抑制AKT的膜转位,并可以通过降低AKT的活性抑制肿瘤细胞的生长,是有开发前景的化合物,可以成为更有效的抗癌药物。
P-ERK-1和P-AKT在子宫内膜癌组织中的表达呈明显正相关,MAPK通路和PI3K/AKT通路控制着肿瘤发生发展中众多重要的环节,包括细胞凋亡、转录、代谢、新生毛细血管以及细胞周期的调控,抑制这两条信号通路成为肿瘤预防和肿瘤靶向治疗的关键,监测P-ERK 和P-AKT的表达情况,可为将来以AKT和ERK为靶点的药物在子宫内膜癌治疗中的应用提供理论依据。
[1] 曾艳华. 子宫内膜癌患者的危险因素Logistic回归分析[J]. 中国妇幼保健,2012,35(27):5691-5694
[2] 李小毛,刘继红,何勉,等. 年轻妇女子宫内膜癌626例临床分析[J]. 实用妇产科杂志,2012,28(7):541-545
[3] Parenti A,Leo G,Porzionato A,et al. Expression of survivin,p53,and caspase 3 in Barrett’s esophagus carcinogenesis[J]. Hum Pathol,2006,37:16-22
[4] 邱春萍,姜洁. 子宫内膜癌的分子机制和靶向治疗进展[J]. 妇产与遗传,2013,3(1):31-35
[5] 鲍伟,蔡斌,杨懿霞,等. 子宫内膜癌中ERK1/2信号转导通路与雌、孕激素受体的相关性[J]. 上海交通大学学报:医学版,2009,29(1):5-8
[6] Rice PL,Goldberg RJ,Ray EC,et al. Inhibition of extracellular signal-regulated kinase 1/2 phosphorylation and induetion of apotosis by sulindac metabolites[J]. Caneer Res,2001,61(4):1541-1547
[7] 王琦,梁涛,张更棉. ERK-1及相关蛋白在胃癌中的表达及相关性分析[J]. 现代中西医结合杂志,2013,22(9):916-918
[8] 吴小琴,杨辉,钟赟,等. 芬维A胺通过抑制ERK-1活化促进人肝癌细胞凋亡[J]. 实用医学杂志,2012,28(18):3006-3008
[9] 马广友,朱志图,陈明子,等. 17-AAG通过抑制ERK信号通路增强奥沙利铂诱导结肠癌细胞凋亡[J]. 肿瘤防治研究,2013,40(8):752-757
[10] Lioni M,Noma K,Snyder A,et al. Bortezomib induces apoptosis in esophageal squamous cell carcinoma cells through activation of thep38 mitogen-activated protein kinase pathway[J]. Mol Cancer Ther,2008,7(9):2866-2875
[11] Xie JJ,Xu LY,Xie YM,et al. Roles of ezrin in the growth and invasiveness of esophageal squamous carcinoma cells[J]. Int J Cancer,2009,124(11):2549-2558
[12] 黄海辉,梁后杰,胡绍毅,等. 磷脂酰肌醇3激酶信号通路影响凋亡在肺腺癌A549细胞群集耐药中的作用[J]. 第三军医大学学报,2004,26(9):756-760
[13] Ruggeri BA,Huang L,Wood M,et al. Amplification and overex-pression ofthe AKT2 oncogenein asubsetofhuman pancreatic ductaladenocarcinomas[J]. Molcarcinog,1998,21(2):81-86
[14] Yuan ZQ,Sun M,Feldman RI,et al. Frequent activation of AKT2 and in duction of apoptosis by in hibition of phos phoino sitide-3-OH kinase/Akt pathway in human ovarian cancer[J]. Oncogene,2000,19(19):2324-2330
[15] Roy HK,Olusola BF,Clemens DL,et al. AKT proto-oncogene overexpression is an early event during aporadic colon carcinogenesis[J]. Carcinogenesis,2002,23(1):201-205
[16] Dicholson KM,Anderson NG. The protein kinase B/Akt signaling pathy in human maliganacy[J]. Cell Signal,2002,14(5):381-395
[17] 乔玉环,程佳,郭瑞霞. 卵巢上皮性癌组织中磷酸化蛋白激酶B和PTEN蛋白的表达及其意义[J]. 中华妇产科杂志,2007,42(5):32-35
[18] Tang JM,He QY,Guo RX,et al. Phosphorylated Akt overexpression and loss of PTEN expression in non-small cell lung cancer confers poor prognosis[J]. Lung Cancer,2006,51(2):181-186
Expression and significance of ERK-1 and AKT in human endometrial carcinoma
LUO Xiangli1,FU Lefan2,FU Bin2,SHI Zhimin2,XIAO Yanli2,SUN Dongxia3,XI Feng2,SHEN Yanfeng2,WANG Lei2
(1.Maternal and Child Health Hospital of Quzhou, Quzhou 057250, Hebei, China; 2.Medical College of Hebei University of Engineering, Handan 055901, Hebei, China;3.Handan City Maternal and Child Health Hospital, Handan 055902, Hebei,China)
Objective It is to investigate the expressions of ERK-1(P-ERK-1) and AKT(P-AKT) in human endometrial carcinoma. Methods Using SP immunohistochemistry method, the expression of P-ERK-1 and P-AKT in the specimens of 78 cases with endometrial carcinoma and 40 cases with normal endometrium were determined. Results The expressions of P-ERK-1 and P-AKT in human endometrial carcinoma were located with the nucleus and the cell membrane. The positive expression rates were 74%(58/78) and 77%(60/78) respecitively, which were significantly higher than that in normal tissue (P<0.05). In the tissue of endometrial carcinoma,the expression of P-ERK-1 and P-AKT inmoderatelypoorly differentiated(G2-G3) and stageⅡ~Ⅲcases was significantly higher than that in well differentiated (G1) and stageⅠcases(P<0.05), and were related with myometrial invasion(P<0.05), and they were not related with pathology pattern of organization(P>0.05); they were positively correlated with each other (P<0.05). Conclusion P-ERK-1 and P-AKT were highly expressed in the endometrial cancinoma and their expressions were related with the development and the metastasis of this cancer.
endometrial carcinoma; P-ERK-1;P-AKT;immunohistochemistry
骆向丽,女,主治医师,研究方向为妇科疾病诊断及治疗。
时志民,E-mail:shizhimin1980@163.com
10.3969/j.issn.1008-8849.2015.08.008
R737.33
A
1008-8849(2015)08-0820-03
2014-10-08
