小肠黏膜下层与脱细胞羊膜促进大鼠损伤皮肤修复及血管形成的作用
2015-03-17魏红芳胡成栋张恩录高爱芹李东风
王 飞,魏红芳,胡成栋,张恩录,高爱芹,王 瑞,李东风
(河北省邯郸市中心医院,河北 邯郸 056001)
小肠黏膜下层与脱细胞羊膜促进大鼠损伤皮肤修复及血管形成的作用
王 飞,魏红芳,胡成栋,张恩录,高爱芹,王 瑞,李东风
(河北省邯郸市中心医院,河北 邯郸 056001)

目的 探讨小肠黏膜下层及脱细胞羊膜在促进大鼠皮肤损伤修复和血管形成中的作用。方法 取SD大鼠60只,于每只背部两侧各做一个1.5 cm×1.5 cm大小全层皮肤缺损,至深筋膜。将大鼠随机分为3组,A组创面采用小肠黏膜下层细胞覆盖,B组创面以双层脱细胞羊膜覆盖,C组创面以等渗生理盐水纱布覆盖。观察各组创面愈合情况,在1~4周时将动物处死并取材,HE染色下观察并计数炎症细胞数,免疫组化SP法染色下观察血管内皮细胞数目。结果 1周时,与C组相比,A、B组敷料与缺损创面贴合紧密,与纱布无粘连,更换敷料时创面无渗血。各时间点,A、B组创面组织内炎症因子数均明显低于C组(P均<0.05),而A组与B组比较差异无统计学意义(P>0.05)。1~3周时,A、B组血管内皮细胞数明显高于C组(P均<0.05),而A组与B组比较差异无统计学意义(P>0.05)。结论 应用小肠黏膜下层细胞及脱细胞羊膜来覆盖皮肤缺损创面,均可减少创面的出血及渗出,减轻局部炎症反应,促进内皮细胞增殖及新生血管形成,具有加快创面愈合的作用。
小肠黏膜下层;脱细胞羊膜;皮肤;血管内皮细胞生长因子
完整的皮肤具有维持肌肉软组织内的水分,避免营养物质丢失的作用,同时作为生物学屏障,能有效抵御细菌入侵从而保护机体免受感染[1]。当皮肤缺损后,临床上可用多种方法及替代组织来对缺损区域处进行修复,从而维持机体的相对完整性。小肠黏膜下层(small intestine submucosa,SIS)是天然细胞外基质类生物衍生材料,通常由猪小肠制备,人工处理后的SIS主要由Ⅰ、Ⅲ型胶原蛋白及少量Ⅴ、Ⅵ胶原构成,具有无免疫原性、抗微生物活性、优良的生物力学性能,并能促进组织再生,是组织工程优良的生物支架材料,可用于心肌、骨、血管及皮肤组织缺损的修复[2-3]。脱细胞羊膜(human acellular amniotic membrane,HAM)作为组织脱细胞材料的典型代表,在具有良好生物相容性的同时抗原性显著降低,其作为有生物活性的一种细胞-支架复合体,广泛用于缺损组织的修复,具有极大的应用前景。笔者观察了HAM和SIS对全层皮肤缺损SD大鼠创面和血管形成的影响,以期为临床选取一种更有效的生物支架材料提供依据。现将研究结果报道如下。
1 实验资料
1.1SIS的制备 取健康猪的空肠长约10 cm,冲净,机械法去除外面的浆膜层与肌层,翻转后去除黏膜层,纵向切开黏膜下层基质,浸泡于100 mmol/L EDTA与10 mmol/L NaOH(pH 11~12)溶液中,去离子水冲净,再浸泡于1 mol/L HCl与1 mol/L NaCl溶液中6~8 h,去离子水冲净,在含1 mol/L NaCl的PBS溶液(pH 7~7.4)中浸泡16 h,去离子水冲净,在PBS溶液中浸泡2 h,去离子水冲洗2 h,0.2%过氧乙酸(含5%无水乙醇)消毒30 min,用含0.05%叠氮化钠的PBS溶液清洗2 h,用2.5×10-5Gy γ射线照射。
1.2HAM的制备 取剖宫产孕妇的羊膜,生理盐水冲洗血迹后反复漂洗,以0.2%戊二醛交联,0.5% SDS反复震荡后再以0.25%的胰酶消化4 h,漂洗并冷冻干燥,备用。
1.3实验动物及仪器 选取2~3月龄,体质量在200~250 g的SD大鼠60只,雌雄不限,由河北医科大学动物实验室提供,合格证号:XS-091112。实验过程中对动物的操作及处理符合动物伦理学标准。免疫组织化学试剂盒购自上海威奥生物科技有限公司。
1.4方法 以0.4%戊巴比妥钠行腹腔注射麻醉,麻醉生效后局部消毒,在大鼠背部两侧分别切除部分全层皮肤,达深筋膜,直径在1.3 cm左右,建立全层皮肤损伤模型。随机将造模后的大鼠分为3组,每组20只。A组大鼠背部皮肤缺损处外敷SIS并用无菌纱布包裹,B组大鼠皮肤缺损处外敷双层HAM并以无菌纱布包裹,C组用等渗生理盐水冲洗创面后以无菌纱布覆盖。均2~3 d换纱布1次,观察创面愈合情况。
1.5观测指标
1.5.1创面局部愈合情况 术后更换敷料时观察皮肤缺损处创面有无红肿、渗出及出血等情况。
1.5.2创面愈合率 术后2,3,4周各处死大鼠5只,观察并测量各组缺损处创面上皮化组织形成情况。根据公式计算[4]:创面愈合率(%)=(最初创面面积-未愈创面面积)/最初创面面积×100%。
1.5.3组织学观察 术后1周、2周、3周、4周时各处死5只大鼠,在无菌条件下从缺损中央处取材,经4%多聚甲醛固定1 d后制成石蜡组织切片。HE染色后显微镜下观察。取随机的近表面视野,放大倍数400倍,显微镜下观察并计数炎症细胞数目(包括嗜碱性粒细胞、嗜酸性粒细胞、淋巴细胞、单核细胞及中性粒细胞),于每张切片上取3个视野,计数每个视野下炎症细胞的数目,取平均值。以兔抗人相关抗原为一抗,按免疫组化SP法染色,胞浆和细胞膜呈现棕黄色为阳性,可视为血管内皮细胞(计数方法与炎症细胞相同)。
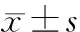
2 结 果
2.1不同时间点创面愈合情况 术后3 d,3组创面均有少许渗出物,A、B组覆盖的材料与纱布无粘连,与皮肤缺损处创面贴附紧密;C组创面与纱布粘连紧密,更换纱布时创面有出血。术后1周,3组创面均较前变浅,A、B组缺损处创面干洁,无炎性渗出,且与覆盖的纱布无粘连;C组则有较多渗出物,掀开纱布后创面渗血明显,创面肉芽组织新鲜生长。术后2周,3组创面明显变浅,几乎与正常皮肤持平,边缘有新鲜上皮组织向创面内生长,此时C组创面揭开后仍渗血。术后3周时,因上皮组织的长入,缺损创面进一步缩小,A、B组所覆盖的SIS和HAM边缘翘起,部分脱落,显露新鲜的上皮化创面;C组创面仍少量渗血,创缘部分上皮化。术后4周,A、B组创面完全愈合,C组创面结痂,部分愈合。
2.2创面愈合率 术后2周、3周、4周时,A、B组创面愈合率均明显高于C组(P均<0.05),但A、B组比较差异无统计学意义(P>0.05)。见表1。

表1 不同时间点3组创面愈合率比较
注:①与C组比较,P<0.05。
2.3炎症细胞计数 术后1周时,各组创面炎症细胞数均较多,且C组较A、B组更高(P均<0.05)。术后2周、3周、4周时,各组炎症细胞数因上皮细胞的不断生长及创面的逐步愈合均呈下降趋势;组间比较发现,C组炎症细胞数在各时间点均高于A、B组(P均<0.05),但A组与B组比较差异无统计学意义(P>0.05)。见表2。
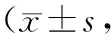
表2 不同时间点3组炎症细胞计数比较个/HP)
注:①与C组比较,P<0.05。
2.4血管内皮细胞计数 术后随着时间的推移及组织修复的逐步完成,各组血管内皮细胞数目呈逐渐减少趋势。术后1周、2周、3周时,A、B组血管内皮细胞数高于C组(P均<0.05),但A组与B组比较差异无统计学意义(P>0.05)。在术后4周时,3组血管内皮细胞数目比较差异无统计学意义(P均>0.05)。见表3。
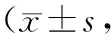
表3 不同时间点3组血管内皮细胞计数比较个/HP)
注:①与C组比较,P<0.05。
3 讨 论
SIS作为一种浅白色薄膜状细胞外基质生物材料,已广泛用于软骨、肌腱、泌尿系统、心肌和血管等组织的修复。通常借助机械方法,将猪小肠的黏膜层和肌层去除,制成厚度约为100 μm的膜性组织,保留了天然细胞外基质的三维立体结构,空隙率在60%左右,孔径大小为80 nm[3]。它具有良好的生物相容性,降解速率可控,含有多种生长因子,植入体内或覆盖于创面时可诱导细胞的黏附和增殖,促进组织再生,中间的孔隙和所具有的机械强度可对新生组织形成有力的支撑[5]。HAM多来源于胎膜,可通过机械法、化学法和垢剂-酶消化法来进行制备,去除上皮细胞层、海绵层和纤维细胞层等组织结构,只保留基底膜、致密层。已有研究表明,HAM具有纤维粘连素、胶原蛋白、蛋白多糖及多种细胞生长因子,可促进细胞黏附、迁移、增殖、分化,除可防止组织粘连外,还具有很强的组织缺损修复功能[6]。此外,HAM还含有多种蛋白酶抑制剂,可抑制相应的蛋白酶发挥抗炎作用。SIS和HAM具有很多相似的结构,如含有丰富的生长因子,可促进上皮细胞迁移、增殖并阻止上皮细胞凋亡等作用[7]。
本研究发现,A组和B组术后各时间点创面愈合率均明显高于C组,表明采用HAM和SIS覆盖皮肤缺损部位可有效促进并加快创面的愈合;A组和B组创面愈合率比较差异无统计学意义,说明HAM和SIS均有促进创面上皮化的作用,这一促进上皮生长的具体机制目前仍不清楚,可能与生物膜内含有较丰富的表皮生长因子、碱性成纤维细胞生长因子有关[5,8]。定期换药时,HAM和SIS与纱布不易黏附,创面不易渗血;术后1周时,A、B组创面就已干燥无渗出,但C组术后2周时创面仍有少量渗血,这足以说明HAM和SIS均具有有效防止组织粘连的作用。
HAM和SIS有抑制创面微生物生长的作用,可明显抑制金黄色葡萄球菌和大肠杆菌的生长和繁殖[9]。在本研究中,术后各时间点A、B组创面的炎症细胞计数均明显少于C组,这可能与2种生物膜均可保持创面相对更干燥,从而营造了一个不利于细菌生长的环境有关,亦可能与2种生物材料本身所具有的抑制细菌繁殖的作用有关[9]。另外,在创面愈合的初期(1~3周)阶段,HAM和SIS均有明显促进血管内皮细胞增殖的作用。可能是其所含有的纤维黏连蛋白可促进并调控细胞的黏附、迁移和增殖能力,血管内皮细胞能更有效地穿透生物膜并进行生长和增殖,而且这种新生血管具有很好的收缩和扩增功能[10]。到创面愈合后期(4周)时,这种促血管内皮细胞增殖的作用明显减弱,组间比较差异无统计学意义。
综上所述,HAM和SIS均可促进创面的愈合,同时减少创面的出血及渗出,减轻局部炎症反应,有效促进血管内皮细胞增殖及新生血管的形成。
[1] Khan Y,Yaszemski MJ,Mikos AG,et al. Tissue engineered periosteum fabricated using bone marrow mesenchymal stem cells and small intestinal submucosa[J]. Journal of Clinical Rehabilitative Tissue Engineering Research,2011,15(21):3801-3804
[2] 付讳,薛继銮,何晓敏,等. 应用血管脱细胞基质膜片构建组织工程血管的初步研究[J/CD]. 中华临床医师杂志:电子版,2012,6(22):7091-7093
[3] 霍艳丽,马洁华,柏树令,等. 脱细胞羊膜与小肠黏膜下层促进大鼠皮肤缺损修复和血管形成[J]. 中国组织化学与细胞化学杂志,2011,20(2):176-179
[4] 范伟杰,杨志明,罗静聪,等. 脱细胞羊膜与脱细胞小肠黏膜下层修复猪创伤性皮肤缺损的比较研究[J]. 中国修复重建外科杂志,2006,20(2):155-160
[5] 霍艳丽,张辉. 脱细胞羊膜与小肠黏膜下层对大鼠皮肤缺损修复中表皮干细胞的影响[J]. 河北北方学院学报,2011,27(2):76-79
[6] 王少云,吴迪,张丽,等. 骨髓间充质干细胞复合小肠黏膜下层构建组织工程皮肤修复糖尿病皮肤缺损[J]. 中国组织工程研究,2012,16(3):443-448
[7] Lindberg K,Badylak SF. Porcine small intestinal submucosa (SIS):a bioscaffold supporting in vitro primary human epidermal cell differentiation and synthesis of basement membrane proteins[J]. Burns,2001,27(3):254-266
[8] 吴迪,谢瑜,王少云,等. 脱细胞猪小肠黏膜下层支架复合软骨细胞构建组织工程软骨[J]. 中国组织工程研究与临床康复,2011,15(21):3829-3833
[9] Sarikaya A,Record R,Wu CC,et al. Antimicrobial activity associated with extracellular matrices[J]. Tissue Eng,2002,8(1):63-71
[10] 张歌,田伟. 小肠黏膜下层作为组织工程支架材料的研究进展[J]. 沈阳医学院学报,2011,13(1):54-56
The function of small intestinal submucosa and acellular amniotic in promotion reparation and vascularization of injured skin in rat
WANG Fei, WEI Hongfang, HU Chengdong, ZHANG Enlu, GAO Aiqin, WANG Rui, LI Dongfeng
(The Central Hospital of Handan City, Handan 056001, Hebei, China)
Objective It is to approach the function of small intestinal submucosa and acellular amniotic in promotion reparation and vascularization of injured skin in rat. Methods Two full-thickness skin defects that about 1.5 cm×1.5 cm were created on both sides of the dorsum of the 60 SD rats. Then the animals were randomly divided into 3 groups. The skin defects was covered by the small intestinal submucosa in Group A, by acellular amniotic membrane in Group B and by physiological saline gauze in group C. The wound healing condition was observed in all groups. After 1-4 weeks, the sample was harvested for histological evaluation. Results Compared with group C at 1 week, the other two groups had a more tightly wound adherence, and with little bleeding when change the dressing (P<0.05). At each time point, Group A and B had a lower level inflammatory cytokines and a higher vascular endothelial cells than Group C (allP<0.05). However, there was no significant difference between Group A and B(P>0.05). Conclusion The small intestinal submucosa and acellular amniotic can improve the wound healing rate, reduce the inflammation and promote endothelial cells proliferation and angiogenesis.
small intestinal submucosa; acellular amniotic; skin; vascular endothelial growth factor
王飞,男,硕士,主治医师,从事皮肤软组织缺损修复的基础研究。
邯郸市科技计划项目(1223108090-3)
10.3969/j.issn.1008-8849.2015.03.002
R-332
A
1008-8849(2015)03-0232-03
2014-08-10
