云芝糖肽对健康人外周血淋巴细胞的体外免疫调节作用
2015-03-17陈军浩
林 丽,吴 超,刘 勇,陈军浩
(1. 解放军第532医院,安徽 黄山 245000;2. 南京中医药大学,江苏 南京 210008;3.南京大学医学院附属鼓楼医院,江苏 南京 210008)
云芝糖肽对健康人外周血淋巴细胞的体外免疫调节作用
林 丽1,2,吴 超3,刘 勇3,陈军浩3
(1. 解放军第532医院,安徽 黄山 245000;2. 南京中医药大学,江苏 南京 210008;3.南京大学医学院附属鼓楼医院,江苏 南京 210008)

目的 探讨云芝糖肽在体外对细胞免疫和体液免疫功能调节的可能机制。方法 分离健康人外周血单个核细胞(peripheral blood mononuclear cells,PBMCs),分为PBMCs空白组、云芝糖肽20 μL与PBMCs共培养组和云芝糖肽40 μL与PBMCs共培养组,3组分别于培养24 h、48 h、72 h采用流式细胞仪检测淋巴细胞亚群的比例变化及T淋巴细胞表面CD3+/ HLA-DR+、B淋巴细胞表面CD19+/CD69+表达情况,ELISA方法检测上清液中IgG水平。结果 云芝糖肽与PBMCs共培养组CD4+T细胞比例明显上升(P<0.05),CD4+/CD8+细胞比值明显增高(P<0.05);云芝糖肽20 μL与PBMCs共培养组T细胞表面CD3+/HLA-DR+,72 h时表达水平高于24 h(P<0.05);B细胞表面CD19+/CD69+的表达显示从培养24 h到48 h表达升高而在72 h表达减少的趋势;PBMCs与云芝糖肽共培养2组上清IgG水平均明显高于PBMCs空白组(P均<0.05)。结论 云芝糖肽在体外能促进CD4+T细胞比例上升及CD8+T细胞比例下降,提高CD4+/CD8+比值,并增加IgG分泌,具有一定的免疫调节作用。
云芝糖肽;淋巴细胞亚群;外周血单个核细胞;CD3+/HLA-DR+;CD19+/CD69+;IgG
云芝糖肽( polysaccharopeptide, PSP)是一种混合蛋白多糖,是从云芝COV-1菌株菌丝体中提取出来的主要活性成分[1],在临床上广泛用于恶性肿瘤和慢性乙型肝炎等疾病的联合治疗。许多体内外试验已证明PSP具有免疫调节和抗肿瘤活性[2-3],但对于其免疫调节机制及对细胞免疫和体液免疫影响的具体环节和途径研究报道不多。为了进一步探讨PSP发挥免疫调节作用的途径,本实验在体外将PSP与健康人外周单个核细胞(PBMCs)共培养,观测PSP对健康人T细胞及其亚群以及B细胞的影响,现将结果报道如下。
1 实验资料
1.1实验材料
1.1.1标本来源 7例健康者系南京市鼓楼医院科研部研究生,其中男1例,女6例;平均年龄29岁。
1.1.2试剂与器材 PSP(南京老山药业股份有限公司,批号:080701,为棕色粉末,密封,阴凉干燥处保存,用RPMI1640培养液溶解经冷冻干燥的PSP,配制成10 g/L的PSP药液,0.22 μm 滤膜过滤,4 ℃冰箱保存);淋巴细胞分层液(Norway公司);胎牛血清(Invitrogen公司,滤膜过滤,-20 ℃储存备用); RPMI1640基础培养液(赛默飞世尔生物化学制品有限公司);混合抗体A:MultitestTMCD3/CD16+CD56/CD45/CD19、混合抗体B:MultitestTMCD3/CD8/CD45/CD4(BD BScience公司);PercP-cy5.5 conjugated Anti-human CD3、FITC Conjugated Anti-human CD4(eBioscience公司);FITC Mouse Anti-human CD8、FITC Mouse Anti-human HLA DR、PE Mouse Anti-human CD69、FITC Mouse Anti-human CD19(BD Biosciences公司);人白介素IgG酶联免疫吸附实验检测试剂盒(ALPHA DLAGNOSTIC INTERNATIONAL公司);深低温冰箱(Thermal公司);流式细胞仪(BECTON DICKINSON公司);微型离心机(Sigma公司);5 mL、50 mL离心管(美国Corning 公司); Sunrise多功能酶标仪(Tecan公司)。
1.2实验方法 无菌条件下取健康人外周静脉血25 mL,以肝素抗凝,用淋巴细胞分离液分离PBMCs,将分离到的细胞重悬于含10%胎牛血清的RPMI 1640完全培养液中,并调整细胞浓度为1×106L-1,加入到24孔培养板中,1 mL/孔。实验分为3组:A组为PBMCs空白组,B组为PBMCs+PSP 20 μL(200 mg/L)共培养组,C组为PBMCs+PSP 40 μL(400 mg/L)共培养组。将所有细胞置37℃、5%CO2条件下培养,分别在培养24 h、48 h、72 h收集细胞和上清,备用。
1.3检测指标
1.3.1淋巴细胞亚群的测定
1.3.1.1培养前淋巴细胞亚群的测定 每个健康人的外周血在分离PBMCs之前各留取抗凝血1 mL。取2个流式管,分别加入混合抗体A和混合抗体B 5 μL,再各加入外周全血50 μL,振荡,室温避光孵育20 min;加入红细胞裂解液1 000 μL,混匀,室温避光10 min;洗涤离心(1 500 r/min)5 min,弃去上清液,加入生理盐水1 mL,振荡,重复洗涤l次;重悬加入300 μL生理盐水,振荡混匀,制成单细胞悬液;用流式细胞仪检测,每个样品检测106细胞,用FCM软件分析,计算淋巴细胞中各标记细胞的百分率。
1.3.1.2培养72 h后淋巴细胞亚群的测定 当PBMCs与PSP共培养72 h后,分别收集3组的细胞悬液。用流式细胞仪检测,计算淋巴细胞亚群的比例,方法同前。
1.3.2T细胞表面CD3+/HLA-DR+和B细胞表面CD19+/CD69+抗原表达的检测 分别在PBMCs与PSP共同培养的24 h、48 h、72 h收集各组的细胞悬液。各取2个流式管,一管中添加CD3抗体和HLA-DR抗体各5 μL;另一管中添加CD19抗体和CD69抗体各5 μL;充分振荡、混匀细胞悬液,向每支流式管中添加细胞悬液各200 μL,振荡;避光孵育20 min;向每支流式管中加入生理盐水1 mL,振荡,离心(1 500 r/min)5 min;弃上清,重悬加入生理盐水200 μL,振荡混匀,用流式细胞仪检测,计算CD3+/HLA-DR+和CD19+/CD69+的表达率。
1.3.3培养上清中IgG表达水平的检测 用ELISA法检测培养上清中IgG的表达水平,操作步骤严格参照试剂盒说明书进行。
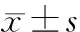
2 结 果
2.1各组外周血淋巴细胞亚群比较 A组培养前和培养72 h T细胞百分率比较差异无统计学意义;培养72 h后,C组CD4+T细胞比例及CD4+/CD8+比值均明显高于培养72 h A组(P均<0.05)。见表1。

表1 各组外周血T淋巴细胞亚群比较
注:①与培养72 h PBMCs空白组比较,P<0.05。
2.2各组T细胞表面CD3+/HLA-DR+和B细胞表面CD19+/CD69+表达情况 相同时间点时,3组间CD3+/HLA-DR+的表达C组>B组>A组,但差异无统计学意义;B组培养72 hT细胞表面CD3+/HLA-DR+的表达高于24 h(P<0.05)。B细胞表面CD19+/CD69+的表达没有显著的时间依赖性和浓度依赖性,但在均数上体现了从24 h到48 h表达的升高然后到72 h的减少的趋势。见表2。
2.3各组IgG水平比较 相同时间点上,除B组培养48 h与A组比较差异无统计学意义外,B组与C组IgG的表达水平均高于空白组(P均<0.05)。见表3。
3 讨 论
PSP是云芝的主要活性成分,具有一定的免疫调节作用。研究已经表明PSP能够提高白细胞和中性粒细胞计数和血清IgG和IgM的水平,并且可减缓非小细胞肺癌患者的恶化程度[4]。PSP也能中和环磷酰胺对于白细胞数目、IL-2产生的抑制反应和迟发型超敏反应。在食管癌、胃癌和肺癌患者化疗和放疗的过程中,给予服用PSP能够减轻症状和预防免疫状态的下降[5]。另外PSP能显著增加CD4+T细胞的数量、CD4+/CD8+的比值以及B淋巴细胞的数量和百分率,使肿瘤患者的免疫系统得以增强[6-7]。在动物实验中,Ho等[8]发现PSP可以促进鼠脾淋巴细胞的增殖,增加鼠脾淋巴细胞释放IL-2,IL-12、IFN-γ和IL-18等Th1型细胞因子;在体外细胞培养模型中,发现PSP(50~200 mg/L)可促进PHA诱导的人外周血淋巴细胞IL-6的高效表达[9]。因此PSP可以增强T、B淋巴细胞作用,促进Th1型细胞因子生成,促进抗体的产生。

表2 各组T细胞表面CD3+/HLA-DR+和B细胞表面CD19+/CD69+表达情况
注:①与同组培养24 h比较,P<0.05。

表3 各组IgG水平比较
注:①与A组比较,P<0.05。
T细胞亚群可分为CD4辅助亚群和CD8抑制亚群,在正常情况下,CD4+/CD8+比值相对恒定,以维持机体内环境的平衡[10]。CD4+辅助性T细胞通过其TCR分子对抗原肽和MHCⅡ类分子复合物的识别,辅助Tc细胞发挥杀伤功能和B细胞产生抗体。CD8+T细胞中的CTL和Ts细胞,通过TCR识别特异性抗原和MHCⅠ类分子复合物,发挥其对病毒、寄生虫、细菌以及肿瘤细胞的杀伤作用,Ts细胞同时在免疫功能的调节和抑制中发挥一定的作用,Ts比值升高时免疫功能受到抑制[11]。CD8阳性细胞对CD4阳性细胞具有调节性抑制作用,CD4+/CD8+比值可反应机体的免疫功能状态[12]。
HLA-DR是MHCⅡ类分子,表达于B淋巴细胞、单核细胞、巨噬细胞、活化T淋巴细胞表面,静止期T细胞不表达此类分子。在调节免疫应答和免疫细胞间的相互作用过程中,HLA-DR被认为是促进免疫应答的一类重要辅佐分子,在抗原提呈和胸腺选择中起作用,CD3+T淋巴细胞表达的HLA-DR被认为是晚期激活抗原,CD3+/HLA-DR+表示T细胞的激活状态[13]。CD69是由2个相同的单体经不同糖基化后构成的细胞表面双体蛋白,CD69在淋巴细胞被丝裂原或抗原刺激活化后快速产生,是最早表达的一个活化标志。大部分活化的T细胞、少量的静止期T、B细胞表达此分子。由于CD69在正常个体只有少量T细胞低水平表达,CD69在外周血淋巴细胞表面的表达可作为一个近期淋巴细胞活化的标志[14]。
本实验在体外将PSP与健康人PBMCs共培养,结果显示:健康人的PBMCs在PSP作用下培养72 h,其T淋巴细胞亚群比例出现显著变化,表现为CD4+T细胞明显增加,CD4+/CD8+比值增加。根据产生的细胞因子的类型和生物学功能,人类CD4+T细胞至少可以分为Th1、Th2 和Th0 3类亚型。Ho等[8]认为PSP可作为一种淋巴细胞致有丝分裂因子而促进Th1相关的细胞因子的产生。同时在PSP的刺激下,T细胞表面CD3+/HLA-DR+和B细胞表面CD19+/CD69+的比率均增高。CD4阳性细胞的增加、CD4+/CD8+比值增加表明宿主的免疫增强,通过MHC Ⅱ类抗原HLA-DR诱导T细胞免疫应答,导致CD4+T细胞的活化和产生各种细胞因子,同时诱导CD8+或者CD4+T细胞介导的ADCC效应增强[16]。淋巴细胞亚群的改变和T、B细胞表面分子表达的变化趋势均提示辅助性T细胞增多,抑制性T细胞减少,改善了机体内的细胞免疫状态,提示T、B细胞活化,使机体细胞免疫功能活性增强,提高了人体的免疫力。
B淋巴细胞是体内唯一能产生抗体(免疫球蛋白)的细胞,其受到抗原刺激后可分化为产生抗体的浆细胞,进而产生不同活性的抗体,与相应的抗原结合,从而在体内介导多种生理效应,引起各种抗原-抗体反应,激活补体及参与免疫调节等。B淋巴细胞受抗原或有丝分裂原刺激后,可引起分裂增殖,分化为浆母细胞,进而成熟为具有抗体生成能力的浆细胞,合成抗体,介导体液免疫应答,发挥IgG抗体的保护性功能[16]。本实验中B细胞表面CD19+/CD69+表达提高,IgG水平增加,均可表明PSP能够激活体内的体液免疫反应。
综上所述,PSP作为一种免疫调节剂,能显著增加CD4+T细胞的数量,提高CD4+/CD8+比值,促进B细胞IgG的分泌,促进T、B淋巴细胞的活化,从而增强细胞免疫和体液免疫功能,这可能是PSP发挥免疫调节作用的机制之一。
[1] Yang QY. Yun Zhi Polysaccharopeptide (PSP) and the general aspects of its research[J]. Fung Sci,1997,12(1/2):1-8
[2] Fisher M,Yang LX. Anticancer effects and mechanisms of polysaccharide-K (PSK): implications of cancer immunotherapy[J]. Anticancer Res,2002,22(3):1737-1754
[3] Chow LW,Lo CS,Loo WT,et al. Polysaccharide peptide mediates apoptosis by up-regulating p21 gene and down-regulating cyclin D1 gene[J]. Am J Chin Med,2003,31(1):1-9
[4] Tsang KW,Lam CL,Yan C,et al.Coriolus versicolor polysaccharide peptide slows progression of advanced non-small cell lung cancer. Respir[J]. Med,2003,97(6):618-624
[5] NgTB.Areviewofresearchontheprotein-boundpolysaccharide(polysaccharopeptide,PSP)fromthemushroomCoriolusversicolor(Basidiomycetes:Polyporaceae)[J].GenPharmacol,1998,30(1):1-4
[6] Bao YX,Wong CK,Leung SF,et al. Clinical Studies of Immunomodulatory Activities of Yunzhi-Danshen in Patients with Nasopharyngeal Carcinoma[J]. J Altern Complement Med,2006,12(8):771-776
[7] Wong CK,Bao YX,Wong EL,et al. Immunomodulatory activities of Yunzhi and Danshen in post-treatment breast cancer patients[J]. Am J Chin Med,2005,33(3):381-395
[8] Ho CY,Lau CB,Kim CF,et al. Differential effect of Coriolus versicolor(Yunzhi)extract on cytokine production by murine lymphocytes in vitro[J]. Int Immunopharmacol,2004,4(12):1549-1557
[9] 梁中琴,王晓霞,顾振纶,等. 云芝糖肽诱导人外周血淋巴细胞产生IL-6的研究[J]. 中国药学杂志,1999,34(10):700-702
[10] Kim KS,Hong YK,Joe YA,et al. Anti-angiogenic activity of the recombinant kringle domain of urokinase and its specific entry into endothelial cells[J]. J Biol Chem,2003,278(13):11449-11456
[11] 陈慰峰. 医学免疫学[M]. 北京:人民卫生出版社,2007:100-108
[12] Mc Michael. Monoclonal antibody in clinical medicine[M]. Academic Press,1982,24(1):366
[13] Yacyshyn MB,Poppema S,Berg A,et al. CD69+and HLA-DR+ activation antigens on peripheral blood lymphocyte populations in metatatic.breast and ovarian cancer patients: correlations with survival following active specific immunotherapy[J]. Int J Caner,1995,61(4):470-474
[14] Testi R,D Ambrosio D,De Maria R,et al. The CD69 receptor: a multipurpose cell-surface trigger for hematopoietic cells[J]. Immunol Today,1994,15(10):479-483
[15] Hong WS,Min YI,Son YS. Peripheral blood lymphocyte subsets in patients with stomach cancer[J]. J Korean Med Sci,1995,10(3):164-168
[16] Sayles PC,Gibson GW,Jonson LL. B cell are essential for vaccination-induced resistance to virulent Toxoplasma gondii[J]. Infect Immun,2000,68(3):1026-1033
Immune regulation effect of Polysaccharopeptide on human peripheral blood lymphocytes in vitro
LIN Li1,2, WU Chao3, LIU Yong3, CHEN Junhao3
(1.The 532nd Hospital of PLA, Huangshan 245000, Anhui, China; 2.Nanjing University of Chinese Medicine, Nanjing 210008, Jiangsu, China; 3.Affiliated Drumtower Hospital of Nanjing University Medical School, Nanjing 210008, Jiangsu, China.)
Objective It is to approach the mechanism of polysaccharopeptide (PSP) on immune regulation in cellular and humoral in healthy humans peripheral blood lymphocytes in vitro. Methods Peripheral blood mononuclear cells (PBMCs) from healthy donors were obtained by leukapheresis followed by ficoll-density centrifugation. The isolated cells were plated on 24-well plates (1 000 μL per well) at a concentration of 1×106cells per milliliter in RPMI1640 supplemented with 10% fetal calf serum. The PBMCs were divided into three groups and were cultured for 72 hours in vitro. Flow cytometry was used to assess the percentages of human lymphocyte subsets. The expression of CD3+/HLA-DR+T cells and CD19+/CD69+B cells were measured by Flow cytometry at 24, 48 and 72 hours. The level of IgG in the supernatant was measured by enzymelinked immuno-sorbent assay (ELISA) at 24, 48 and 72 hours. Results After 72 hours of culture, the percentage of CD4+T cells in PBMCs+PSP groups were increased significantly as compared with those in PBMCs group (allP<0.05). Moreover, the ratio of CD4+/CD8+in PBMCs+PSP groups were significantly increased compared with those in PBMCs group (P<0.05). The expression of CD3+/HLA-DR+of T lymphocytes in PBMCs+PSP 20 μL group at 72 hours was significantly higher at 24 hours (allP<0.05). PSP could obviously increase the level of IgG at 24, 48 and 72 hours. Conclusion The PSP can promote the rise of CD4+and the decline of CD8+, and increase CD4+/CD8+ratio and the secretion of IgG, so it have a certain role in immune regulation.
polysaccharopeptide; Lymphocyte subsets; CD3+/HLA-DR+; CD19+/CD69+; IgG
林丽,女,硕士研究生,住院医师,研究方向为中西医结合感染病学。
吴超,E-mail:wuchao@jlonline.com
10.3969/j.issn.1008-8849.2015.03.007
R965
A
1008-8849(2015)03-0248-04
2014-06-20
