965例新生儿听力及聋病易感基因联合筛查结果分析△
2015-03-17王莹关兵叶实明徐丽常玲美于爱民
王莹关兵叶实明徐丽常玲美于爱民
·临床研究·
965例新生儿听力及聋病易感基因联合筛查结果分析△
王莹1关兵2叶实明1徐丽2常玲美2于爱民2
目的 探讨新生儿听力及聋病易感基因联合筛查的临床意义。方法 选择出生后3~5天的965例新生儿,采集足跟血提取基因组DNA进行耳聋易感基因[线粒体12Sr RNA c.1555A>G、c.1494C>T,GJB2基因35delG、167del T、176_191del16、235delC、299_300del AT,GJB3基因538C>T、547G>A,SLC26A4(PDS)基因281C>T、589G>A、IVS7-2A>G、1174A>T、1226G>A、1229C>T、IVS15+5G>A、1975G>C、2027T>A、2162C>T、2168A>G]的位点检测;同时进行听力筛查,初筛采用筛查型耳声发射(DPOAE),复筛采用筛查型OAE结合自动判别听性脑干反应(AABR),分析两种筛查的结果。结果 965例中53例(5.49%)存在耳聋基因突变,其中,1例为线粒体12Sr RNA c.1555>G突变,33例为GJB2基因突变,18例为SCL26A4基因突变,1例为GJB3基因突变;听力初筛未通过28例,复筛未通过18例,10例在3月龄时进行了听力学诊断,最终确诊6例新生儿听力损失。965例中,听力筛查与基因筛查均通过905例,均未通过11例,听力筛查通过但基因筛查未通过42例,听力筛查未通过但基因筛查通过7例。结论 新生儿听力和聋病易感基因联合筛查,可发现单纯听力筛查不能发现的部分药物性聋和迟发性聋患儿。
新生儿; 听力筛查; 耳聋; 基因
据统计,每年有近126 000~500 000的婴儿听力受到损害,其中90%在发展中国家[1]。60%的耳聋与遗传因素有关[2]。迄今为止,已有114个耳聋基因位点被报道,40多个耳聋基因被克隆[3]。部分因基因缺陷导致的先天性听力损失患儿在出生早期可能无表现。随着聋病基因诊断技术的开展与应用,2007年王秋菊等[4]在进行了大规模聋病分子流行病学研究的基础上,提出了新生儿听力与聋病易感基因联合筛查的理念。随后部分城市已开始试点实施,意在早期发现迟发性聋患儿,达到早期发现、早期诊断、早期干预的目标。本研究以965例新生儿为研究对象,对其进行新生儿听力筛查及聋病易感基因检测,进一步探讨新生儿听力及聋病易感基因联合筛查的临床应用价值及意义。
1 对象与方法
1.1 研究对象 选择2013年4月~2014年8月在扬州市苏北人民医院进行听力筛查的965例正常分娩新生儿为研究对象,其中,男456例,女509例。本研究获得苏北人民医院伦理委员会批准,所有新生儿筛查之前,家长均被详细讲解和告知听力和基因筛查的相关知识,理解同意后填写知情同意书。
1.2 听力筛查方法 听力初筛采用筛查型耳声发射(DPOAE),复筛采用筛查型DPOAE结合自动判别听性脑干反应(AABR),初筛于出生后3~5天进行,复筛于出生后42天进行。初筛在新生儿双侧外耳道清理后进行,测试时f1、f2强度分别为65、55 d B HL,测试4个频率(范围2~5 k Hz),信噪比≥7 d B,以4个频率中3个以上通过为筛查通过标准。复筛OAE方法同前,AABR由系统自动判定测试结果是否通过。复筛未通过的新生儿生后三个月时行听力学评估和医学诊断。
1.3 聋病易感基因筛查 所有新生儿出生后3~5天内采集足跟血作为提取基因组DNA的血样,送到华大基因实验室进行耳聋易感基因的线粒体12Sr RNA c.1555A>G、c.1494C>T,GJB2基因35delG、167del T、176_191del16、235delC、299_ 300del AT,GJB3基因538C>T、547G>A,SLC 26A4(PDS)基因281C>T、589G>A、IVS7-2A>G、1174A>T、1226G>A、1229C>T、IVS15+5G>A、1975G>C、2027T>A、2162C>T、2168A>G的位点检测,检测方法采用基质辅助激光解吸电离飞行时间质谱技术,并用直接测序法进行验证[5]。任何一个位点有突变均被视为“未通过”,即筛查结果阳性。
1.4 随访 将听力筛查和基因筛查结果以短信、电话或邮件形式通知家长,对未通过新生儿重点随访,定期对其听力、语言发育情况及干预情况等进行随访及防聋指导。
2 结果
2.1 听力筛查结果 965例新生儿中,937例通过听力初筛,初筛通过率为97.10%(937/965);28例未通过初筛的新生儿均进行了复筛,18例未通过(1.87%,18/965),其中左、右耳未通过各2例,双耳未通过14例。
2.2 聋病易感基因致病突变位点的检测结果 965例中53例新生儿存在耳聋易感基因的突变,总体阳性率为5.49%(53/965)。
2.2.1 线粒体12Sr RNA基因筛查结果 965例中1例为12Sr RNA c.1555A>G阳性,为致病突变,致病突变率为0.10%(1/965),该例听力初筛、复筛双耳均通过。
2.2.2 GJB2基因筛查结果 33例为GJB2基因突变,突变率为3.42%(33/965),其中28例为GJB2 235delC杂合突变,1例为GJB2 299_300del AT杂合突变,这29例中25例听力初筛双耳通过,4例复筛双耳未通过;其余4例中2例为GJB2 235delC纯合突变,1例为GJB2 235delc&299_300del AT复合杂合突变,1例为GJB2 176_191de116&235delC复合杂合突变,均为致病突变,致病突变率为0.41%(4/965),这4例听力筛查双耳均未通过。
2.2.3 SLC26A4基因筛查结果 16例为SCL26A4 IVS7-2A>G杂合突变,1例为SLC26A4 2168A>G杂合突变,1例为SCL26A4 1226G>A杂合突变,突变率为1.87%(18/965),这18例中1例听力复筛左耳未通过,1例右耳未通过,16例听力初筛双耳通过。
2.2.4 GJB3基因筛查结果 1例为GJB3 538C>T杂合突变,听力筛查通过。
2.3 听力与聋病基因联合筛查结果 965例中,听力筛查与基因筛查均通过的有905例,均未通过的有11例,听力筛查通过但基因筛查未通过的有42例,听力筛查未通过但基因筛查通过的有7例(表1)。
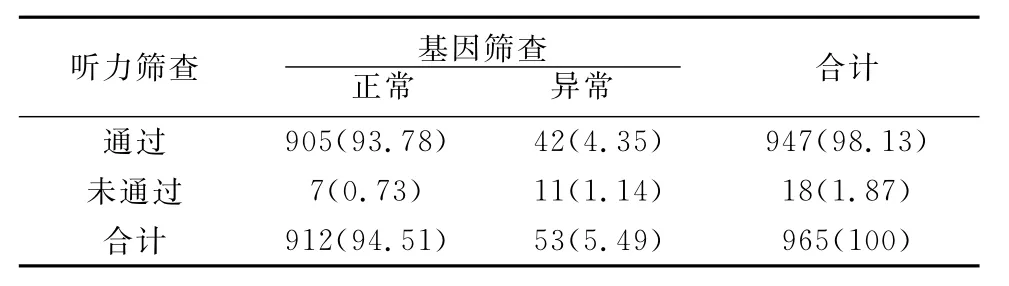
表1 听力筛查与基因筛查结果比较(例,%)
2.4 听力学诊断结果 18例复筛未通过的新生儿中10例在3月龄时进行了听力学诊断,其确诊结果见表2。复筛未通过者失访8例,耳聋基因筛查结果1例为GJB2 235delC纯合突变,1例为GJB2 235delc&299_300del AT复合杂合突变,1例为GJB2 176_ 191de116&235delC复合杂合突变,5例正常。

表2 复筛未通过的10例新生儿耳聋基因筛查结果及3月龄时听力学诊断结果
3 讨论
先天性听力障碍是新生儿最常见的先天性缺陷,新生儿听力障碍发生率约为0.1%~0.3%,每年新出生的聋儿接近2.3万(不包括迟发性聋及药物性聋),均以中重度及极重度聋为主[6]。早期发现和诊断新生儿先天性聋的目的是及早干预,使之获得最佳的听力与言语发育时机。有文献报道OAE用于新生儿听力筛查的灵敏度约为99.51%,特异性为68.65%[7],ABR的敏感性为100%,特异性为94%~99.1%不等[8],所以目前耳声发射结合听性脑干反应被认为是最有效的听力筛查方式[9],但此方法仍会漏诊一些迟发性聋及药物性聋患儿。本组965例新生儿中,28例初筛未通过,18例未通过复筛,最终确诊6例先天性听力损失,也说明了OAE和AABR联合筛查的有效性。
某些病毒感染及环境因素可导致先天性听力损失,如风疹病毒、巨细胞病毒感染,早产、脑外伤、出生前或出生后感染等。近年来随着分子生物学及遗传学的迅速发展,耳聋的遗传因素已逐步被确定,从遗传学的角度能解释50%以上的重度先天性聋[10]。文献报道[3]线粒体12Sr RNA、GJB2、GJB3、SLC26A4基因为我国最常见的引起耳聋的突变基因。因此,本研究在实施新生儿听力筛查的同时对这四个基因进行了重点筛查。GJB2基因是引起非综合型聋最常见的致病基因[10],表现为常染色体隐性遗传,也是我国耳聋患者最常见的致病基因。中国耳聋人群中13%~26.7%由GJB2突变导致,235delC是GJB2最常见的突变[3]。本研究发现2例GJB2基因c.235delC纯合突变,1例为GJB2 235delc&299_300del AT复合杂合突变,1例为GJB2 176_191de116&235delC复合杂合突变,均为致病突变,这4例新生儿出生时即表现为中度-重度聋,且听力筛查初筛与复筛均未通过,说明听力筛查与基因筛查可以相互印证。经询问家族史,1例GJB2基因c.235delC纯合突变的患儿母亲出生时即为耳聋患者,该患儿家长有再生育的打算,遂对患儿的父母均进行了基因检测,发现母亲为GJB2基因c.235delC纯合突变,父亲为GJB2基因c.235delC杂合突变,生育正常听力儿童的概率为25%,因此建议其父母在怀孕的前三个月内可行产前耳聋基因检测,避免再孕育聋儿;其余患儿家族中无耳聋患者。235delC在正常人群中其携带率为1%~2%[11],在中国,常见GJB2基因突变位点有235delC、176del16、299del AT[12]。本研究中有29例为GJB2基因突变携带者,其携带率为3.01%(29/965),其中25例初筛通过,说明正常新生儿中GJB2突变者占有一定的比例。
迄今为止SLC26A4基因被认为是仅次于GJB2突变引起遗传性感音神经性聋的遗传学病因。SLC26A4基因与前庭水管扩大及Pendred综合征密切相关。SLC26A4基因突变患者在出生时可不表现为听力损失,而在头部震荡外伤或感冒后出现听力损失。国内研究发现,92.1%的大前庭水管患者存在SLC26A4基因的突变[13]。SLC26A4基因杂合携带与GJB2基因的杂合携带不会致病,但日后与具有相同基因型的携带者婚配时,其后代有25%的可能发生听力损失,对于此类携带者应给与追踪随访,并在婚配前及怀孕时予以适当的干预,可避免耳聋患儿的出生。本组新生儿中发现18例为SCL26A4基因杂合突变,占总筛查人数的1.87%
(18/965),仅次于GJB2的突变携带率,此18例均无耳聋家族史,其中16例通过了听力筛查,需对其进行随访,防止迟发性聋的发生。
线粒体DNA突变为母系遗传,与药物性聋相关,线粒体12Sr RNA c.1555A>G、c.1494C>T为两个常见突变位点,有此类基因突变的患者禁用氨基糖苷类药物,以防“一针致聋”。本研究中1例新生儿为12Sr RNA c.1555A>G阳性,为致病突变,出生时听力正常,双耳听力筛查均通过,已告知患者家属该患儿将来禁用氨基糖苷类抗生素,从而避免出现药物性聋。经询问家族史,该患儿的母亲为氨基糖苷类药物致聋患者,通过家系分析,可对家系中尚未发病的母系家庭成员予以预警,进行宣教,是一种有效的前瞻性防聋策略。
GJB3基因能导致常染色体显性或者隐性遗传性非综合征型聋,该基因最初被发现在中国患者中导致常染色体显性遗传非综合征型聋(antosomal dominant non-syndromic semsorineural hearing loss,DFNA),其错义突变和无义突变与高频听力损失有关,其复合杂合突变423-425del ATT和423A>G能导致隐性非综合征型聋[14],该基因在正常人群中突变频率较小,本研究发现1例为GJB3 538C>T杂合突变,其听力筛查结果正常,需要定期随访。
本研究中,18例听力筛查未通过的新生儿中,有7例基因筛查未见异常,可能与目前仍有部分耳聋基因未被确定及检测手段的局限性有关。目前通过耳聋基因检测只能够诊断出60%~80%遗传性聋的准确致病基因[15,16]。基因筛查异常但听力筛查通过的有42例,一方面与某些突变为非致病突变有关,另一方面也可能与迟发性聋有关,均需加强随访,监测听力。
本研究所采用的基因检测方法具有检测位点多、覆盖率高、通量高、检测周期短、准确率高、成本低等优点[5],能够达到临床对耳聋基因检测的要求。本研究结果显示,听力及聋病易感基因联合筛查可发现部分听力筛查不能发现的药物性聋和迟发性聋患儿,但目前仍有部分耳聋基因未被确定,且当前的检测手段还难以普查到已发现的所有耳聋致病基因,故基因筛查不能替代听力筛查。李隽等[17]认为单纯通过听力筛查会遗漏相当一部分潜在的耳聋及耳聋高危儿,本研究965例新生儿中发现线粒体12Sr RNA、GJB2、GJB3和SCL26A4四个聋病易感基因突变位点阳性率为5.49%,高于听力复筛未通过率1.87%,证实了这一观点。随着分子遗传学技术的不断进步,相信不久的将来会出现一套更加完善的新生儿听力与基因联合检测的筛查模式。
1 Okhakhu AL,Ibekwe TS,Sadoh AS,et al.Neonatal hearing screening in Benin City[J].International Journal of Pediatric Otorhinolaryngology,2010,74:1323.
2 韩德民,戚以胜,黄丽辉.新生儿及婴幼儿听力筛查[M].北京:人民卫生出版社,2003.167~168.
3 刘学忠,欧阳小梅,Denise Yan,等.中国人群遗传性耳聋研究进展[J].中华耳科学杂志,2006,4:81.
4 王秋菊,赵亚丽,兰兰,等.新生儿聋病基因筛查实施方案与策略研究[J].中华耳鼻咽喉头颈外科杂志,2007,42:809.
5 曾云,姜丹,冯大飞,等.飞行时间质谱检测技术在非综合征型耳聋基因检测中的应用[J].中华耳鼻咽喉头颈外科杂志,2013,42:985.
6 许政敏,沈晓明,孙晓明.上海地区开展新生儿听力筛查工作回顾与展望[J].听力学及言语疾病杂志,2007,15:277.
7 贺鹭,曲成毅,孙喜斌.应用耳声发射技术对48 041名新生儿进行听力筛查的汇总分析[J].中国听力语言康复科学杂志,2005(1):21.
8 Stewart DL,Mehl A,Hall JW,et al.Universal newborn hearing screening with automated auditory brainstem response:a multisite investigation[J].J Perinatol,2000,20:S128.
9 卜行宽,莫玲燕,黄丽辉,等.2004年国际新生儿听力筛查诊断和干预会议侧记[J].中华耳鼻咽喉科杂志,2004,39:702.
10 Morton CC.Genetics,genomics and gene discovery in the auditory system[J].Hum Mol Genet,2002,11:1229.
11 Huculak C,Bruyere H,Nelson TN,et al.V37I connection 26 allele in patients with sensorineural hearing loss:evidence of its pathogenicity[J].Am J Med Genet A,2006,140:2394.
12 Dai P,Yu F,Han B,et al.GJB2 mutation spectrum in 2063 Chinese patients with nonsyndromic hearing impairment[J].J Transl Med,2009,7:26.
13 李军.新生儿聋病易感基因筛查2 455例分析[J].哈尔滨医药,2013,33:276.
14 Liu XZ,Xia XJ,Xu LR,et al.Mutations in connexin31 underlie recessive as well as dominant non-syndromic hearing loss[J].Hum Mol Genet,2000,9:63.
15 戴朴,于飞,康东洋,等.线粒体DNA1555位点和GJB2基因及SLC26A4基因的诊断方法及临床应用[J].中华耳鼻咽喉头颈外科杂志,2005,40:769.
16 Gardner P,Oitmaa E,Messner A,et al.Simultaneous multigene mutation detection in patients with sensorineural hearing loss through a novel diagnostic microarray:a new approach for new-born screening follow-up[J].Pediatrics,2006,118:985.
17 李隽,历建强,王智楠,等.678例新生儿听力和聋病易感基因联合筛查结果分析[J].听力学及言语疾病杂志,2010,18:419.
(2014-08-18收稿)
(本文编辑 李翠娥)
A Study of Universal Newborn Hearing Screening Combined with Deafness Predisposing Gene Screening in 965 Newborns
Wang Ying*,Guan Bing,Ye Shiming,Xu Li,Chang Lingmei,Yu Aimin
(*Department of Otorhinolaryngology,Clinical College of Yangzhou University,Yangzhou,225001,China)
Objective To investigate the clinical significance of universal newborn hearing screening for deafness predisposing genes in newborns.Methods A total of 965 newborns at Subei Hospital in Yangzhou were taken blood samples at heel and received for deafness predisposing genes screening.The most common deafness genes were detected by gene sequencing,including mt12Sr RNA c.1555A>G,c.1494C>T,GJB2 35delG,167del T,176_ 191del16,235delC,299_300del AT,SLC26A4 281C>T,589G>A,IVS7-2A>G,1174A>T,1226G>A,1229C>T,IVS15+5G>A,1975G>C,2027T>A,2162C>T,2168A>G,GJB3538C>T,547G>A.At the same time,all infants received hearing screening.Otoacoustic emission(OAE)was used as the first step screening,and OAE combined with auto-auditory brainstem response(AABR)detection were used as the second step screening. Results Fifty-three cases(5.49%)had partial gene mutation,one case of 12Sr RNA gene mutation,33 cases of GJB2 gene mutation,18 cases of SCL26A4 gene mutation,one case of GJB3 gene mutation.Of 965 cases,28 cases failed to pass hearing screening while 18 cases did not pass rescreening.There were 10 cases taking audiological diagnosis at the age of three months.Six cases were confirmed with hearing loss.There were 905 cases p assed the
Newborn; Hearing screening; Deafness; Gene
10.3969/j.issn.1006-7299.2015.03.009
时间:2015-3-4 10:26
R764.04
A
1006-7299(2015)03-0248-04
△江苏省社会发展项目(BE2012706)资助
1 扬州大学临床医学院耳鼻咽喉头颈外科(扬州 225001); 2 扬州大学医学院附属医院江苏省苏北人民医院耳鼻咽喉科
王莹,女,江苏人,在读研究生,主要研究方向为耳科学。
关兵(Email:aliceguan0685@sina.com)
网络出版地址:http://www.cnki.net/kcms/detail/42.1391.R.20150304.1026.010.html
hearing screening and genetic screening,11 failed born hearing and gene screening.Conclusion That the newborn gene screening was added into the hearing screening can be helpful to find out the deafness predisposing genes and drug-induced or late-onset hearing loss.
