布鲁菌分子分型方法应用研究进展
2015-03-17刘志国崔步云刘日宏解新霞李晓琳夏咸柱
刘志国,崔步云,刘日宏,王 妙, 解新霞, 李晓琳, 夏咸柱
布鲁菌分子分型方法应用研究进展
刘志国1,2,3,崔步云4,刘日宏3,王 妙3, 解新霞3, 李晓琳3, 夏咸柱1,5
布鲁菌属细菌是布病的病原菌。当前,用于布鲁菌属细菌分型的方法有多种,而布鲁菌分子分型方法在布病的分子流行病学调查、病原菌的快速分型鉴定、病原菌的溯源分析和菌株之间差异关系的分析过程中被广泛应用并具有十分重要的作用。本文就常用的布鲁菌的核酸探针技术(DNA probes)、聚合酶链式反应(PCR)、实时定量PCR(Real-time PCR)、16SrDNA鉴定、PCR限制性片段长度多态性( PCR-RFLP)、单核苷酸多态性分析(SNP)、脉冲场凝胶电泳(PFGE)、多位点序列分型(MLST)、多位点串联重复序列分析(VNTR/MLVA)等分子分型方法的应用研究进展予以综述。
布鲁菌;分子;分型;进展
布鲁菌是一类胞内寄生的革兰氏阴性菌,是引起人兽共患传染病布病的病原菌,也是威胁公共安全和健康的潜在生物武器[1]。布鲁菌主要宿主为牛、羊、猪、犬等家畜和野生动物,也存在于海洋动物中。动物感染布鲁菌主要引起流产;人感染后主要表现为发热、乏力、关节肌肉疼痛等。慢性患者伴有神经系统症状及多个功能器官的不同程度的损伤。不仅给流行地区造成巨大的经济损失和社会负担,更重要的是危害人类和动物的健康。
多年来,布鲁菌的分型鉴定均依靠传统的方法。但因其周期较长,约有10%~30%的布氏菌成为无法鉴定的非典型菌株[2]、还存在实验室获得性感染的风险;另外,许多编码血清的特异性基因是可以水平转移的,即血清型相同的菌株不一定有遗传相关性。由于这些问题的存在致使传统方法难以满足当前布病防控的需要。目前,已有多种分子分型方法被应用于布鲁菌的快速鉴定和溯源分析,其灵敏度、特异性、分辨力、重复性等都优于传统方法。不论在布病的分子流行病学调查、病原菌的快速分型鉴定、溯源分析、传播途径的追查,还是菌株之间差异关系分析、疫情预防控制方面都具有十分重要的作用。
1 核酸探针技术(DNA probes)
核酸探针技术也叫分子杂交技术,可定性或定量检测特异布鲁菌DNA序列片段,从而对布鲁菌进行种型鉴定。Grimont F等[3]用克隆的DNA探针进行了布鲁菌的分子分型研究。试验表明该方法可对大多数常见的如羊1、羊3、牛1、牛3、猪2和绵羊附睾种进行区分,并指出这一分型系统较为实用,并不存在生物安全问题。Fernandez等[4]以流产布鲁氏菌16S rRNA序列制备荧光核酸探针进行全菌杂交试验。该方法可将猪种布鲁氏菌2、3、4、5型和几乎全部布鲁氏菌菌属区别开。Nele Wellinghausen等[5]介绍了一种新的荧光原位杂交试验可快速、特异的鉴定所有引起人感染的布鲁菌,且该方法能直接用于检测阳性血培养物中的布鲁菌,试验的特异性和敏感性分别为100%,该方法比自动培养系统提前16~38 h检测到了布鲁菌,是一种快速、价格低廉的实验技术,但其在骨髓标本和或组织中检测布鲁菌的有效性有待进一步实验证实。该方法可直接对临床样本中的微生物行检测,并能区分致病菌与非致病菌,但分析较为主观、操作复杂,质控不严格容易产生假阴性和假阳性结果。
2 聚合酶链式反应(PCR)
聚合酶链式反应是一种体外DNA扩增技术,该方法有较强的特异性和较高的敏感性,在生物学领域广泛应用。Baily等[6]首次将PCR方法用于布鲁菌的鉴定,该方法可以在属的水平上鉴定布鲁菌。Bricke等[7]建立了AMOS-PCR方法,首次将PCR用于布鲁菌的分型。该方法可同时鉴定牛种布鲁菌1、2、4型,羊种布鲁菌1、2、3型,猪种布鲁菌1型以及绵羊附睾种布鲁菌。姜海等[8]评价AMOS-PCR方法在鉴定布鲁氏菌种型的实用性。用该方法鉴定了布鲁菌标准菌株和地方野毒株。试验结果证实了该方法是一种快速、简便、特异的布鲁菌分型鉴定方法之一。刘国栋等[9]描述了一种多重PCR方法可以在同一体系中对布鲁菌的6个种进行鉴定。试验结果表明除绵羊附睾种外该方法能将其余5种布鲁菌全部鉴定出来。该方法快速、准确,无生物风险,是布鲁菌鉴定的辅助方法。目前,这3种方法已经成为大多数试验鉴定布氏菌的常规方法,在全国各地广泛使用。
3 16SrDNA鉴定
16SrDNA核苷酸序列存在于所有细菌的基因组中,既能体现不同菌属之间的差异,被用于革兰染色差、生化反应不活跃、代谢反应和生长模式较为独特菌株的分型鉴定;又能用于发现和描述新的细菌种类,尤其是适用于表型鉴定难于定型的细菌[11]。Gee JE等[12]用16SrDNA序列分析法进行了布鲁菌分离株快速鉴别研究,表明16S rDNA可在属的水平上鉴别布鲁菌,并具有快速、低生物风险的优点,但不能进行种型鉴别。Jonas等[13]指出16S rDNA在大多数布鲁菌中高度保守,可作为种的区分标记,能够准确、快速的鉴别布鲁菌感染,不需要常规的诊断方法。汤旭等[14]对16S rDNA序列分析方法在布氏菌鉴定中的应用做了分析。指出布鲁菌中16S rDNA核苷酸序列相似性达到了99.74%,而与其他有血清型交叉反应的菌株相比较,16S rDNA序列间有统计学意义。表明16S rDNA序列分析是一种快速、简便、特异的鉴定布鲁菌的方法。总之,该方法的优点在于能对未知样品和难鉴定的布氏菌进行快速种属分析。但缺点是某些菌种由于种间差异小,单独依靠16SrDNA鉴定不能鉴定到种,如布氏菌、人苍白杆菌等,需要其它鉴定方法辅助;另外,16SrDNA鉴定是基于PCR的鉴定方法,应注意做好相应的对照[15]。
4 实时定量PCR(real-time PCR)
实时荧光定量PCR是在一个反应体系内将靶基因的扩增与探针杂交检测相结合的PCR方法,该方法能够特异、灵敏、快速、并精确定量起始模板浓度,所以被广泛的应用于各种病原菌的检测鉴定中[16]。Redkar等[17]用该方法对牛种布鲁菌的7个型,羊种布鲁菌的3个型以及猪种布鲁菌1型进行了鉴定。指出具有较好的特异性和灵敏度,灵敏度可达到0.25 pg即相当于16-25个基因拷贝,并可在25~30 min完成鉴定,也可在野外或流行现场应用。Probert WS等[18]在R.Redkar研究的基础上建立了一种实时多重PCR,可同时快速鉴定布鲁菌属、牛种布鲁菌和羊种布鲁菌。该方法最低可以检测到150 fg纯的布鲁菌DNA,具有较高的敏感性和较强的特异性,不仅省时,还可节省成本、降低劳动强度,更重要的是可以杜绝与布氏菌的接触。Debeaumont C等[19]对应用该方法检测人血清样本中布鲁菌DNA 进行了评价。结果表明该方法具有较高的特异性和选择性,并指出该方法适合布鲁菌分离培养阴性、血清试验证实与布鲁菌有交叉反应的布病病例的确证。Bounaadja L等[20]对用3种实时PCR鉴定布鲁菌的优劣进行了实验室评价。实验结果显示3种方法均能扩增到布鲁菌DNA,而最早出现扩增信号的是IS711实时PCR,并指出实时PCR比常规PCR敏感,实时PCR操作简便、快速并可以降低DNA样品污染的风险。表明该方法是一种特异、敏感、高效、快速、安全的布鲁菌鉴定方法。
5 聚合酶链式反应-限制性片段长度多态性分析技术(PCR-RFLP)
聚合酶链式反应-限制性片段长度多态性分析结合了PCR的敏感性和RFLP技术的特异性,是一种非常有用的通过用限制性内切酶对DNA选择性降解、进一步分析PCR产物的工具。不仅提高了目的DNA的含量和相对特异性,还具有分辨率高、重复性好等优点,在布鲁菌的分型和诊断等方面被广泛应用。Axel Cloeckaert等[21]用该方法进行了布鲁菌分型研究。结果显示该方法可鉴定出布鲁菌的各种和型,但是不能区分犬种和猪种布鲁菌3、4型,并指出该方法操作较繁琐,在实际应用中较困难。崔步云等[22]的研究结果表明该方法不仅能在属的水平上检测、鉴定布鲁氏菌属,而且能够将107株国内外布鲁氏菌的参考菌株和地方流行菌株分为8个组,还可对布鲁菌进行分型,可用于典型和非典型布鲁氏菌的鉴定和分型,可弥补传统分类方法的不足。Al Dahouk S等[23]的试验表明该方法是一种分辨力强、再现性好、稳定性高、并且和流行病学一致的分型方法。
6 单核苷酸多态性分析(SNP)
SNP是指基因组DNA序列中由于单个核苷酸的突变而引起的多态性,是基因组中最常见的多态性形式,数量多、分布广、遗传稳定、易于基因分型,故可用于细菌的分型鉴定[24]。为了省时和降低生物风险,Scott JC等[25]建立了一种多重SNP方法,该试验可以快速、准确的鉴定6种古典的布鲁菌种和海洋布鲁菌的各个成员。Foster JT等[26]根据布鲁菌管家基因及其他基因中存在的核苷酸多态性建立了一种SNP位点实时荧光PCR,并对338株布鲁菌进行种型检测。指出该方法可快速、灵敏的鉴别大多数布鲁菌属细菌,可检测到少于10fg的布鲁菌DNA,在临床和法医领域具有重要的应用价值。
7 脉冲场凝胶电泳(PFGE)
脉冲场凝胶电泳是将整个细菌的染色体进行限制性酶切,通过产生的DNA图谱对细菌进行鉴别分型,是鉴别能力最强且理论上适合于所有细菌的分型鉴定方法,其产生的DNA指纹模式图是追踪暴发来源的最佳工具。Annick AS等[27]用该方法进行了布鲁菌分型研究。结果显示PFGE可以在种的水平上区分除沙林鼠种布鲁菌外的另外5个布鲁菌种。崔步云等[28]对分离自我国的不同时间、地点的122株布鲁菌进行了PFGE分析,结果显示牛种、羊种和猪1、3型布鲁菌是稳定的型别,而其余菌种的相似度较差,但符合布鲁菌的分类历史,即犬种菌可能是牛种菌的转移宿主形成;其他菌株是野生动物体内自然界中循环、保存的菌株,该研究为阐明布鲁菌的进化提供了分子证据。该方法稳定性好,分辨率高,已成为许多细菌分型、调查菌株间遗传关系的可靠方法。但PFGE也有局限性,不适宜用于解释分离菌株的克隆性;另外,在耗时和人力方面,以及对图谱解释有较强的主观性,图谱的存储和分析需要专业的软件和熟练的技术人员处理,在一定程度上限制了其推广使用。
8 多位点序列分型(MLST)
多位点序列分型(MLST)是一种基于管家基因核酸序列测定的细菌分型方法。该方法既适于分子流行病学调查,也可用于细菌的分子进化研究。目前,MLST常被作为国际间菌株比较的有力工具。该方法重复性好、分辨率高,数据可实现网络共享及标准化比较。为探讨布鲁菌属各菌株间的亲缘关系,Whatmore AM等[29]针对布鲁菌的7个管家基因和2个非管家基因位点设计引物,对160株布氏菌进行MLST分析,试验将160株布氏菌分为27个序列型。种系发生树显示各ST形成的类群与传统分类基本一致,但ST18(猪种生物3、4型)与ST21(犬种)的亲缘关系更为密切,这点与MLVA-21分型结果相似,ST19(猪种生物5型)从猪种布鲁菌分支中分离出来,ST6(Tulya株)远离其他牛种ST,46株海洋哺乳动物分离株分成5个ST型,并可形成一个独立种,指出随着测序技术发展和成本降低,MLST将成为布鲁菌分型的有力工具。周晓艳等[30]对分离自我国的47株羊种3型布鲁氏菌进行MLST分析,结果显示19株布氏菌的omp25基因与目前已有的等位基因型不同,被定义为1个新的等位基因型,即ST28。其余28株与已知的ST8型的各等位基因型一致,指出国内的菌株与国外菌株的遗传背景上有差异,该方法可作为研究布鲁菌进化关系的重要手段。总之,该方法是一种较为客观、准确且适合于数据库储存和软件分析的基因分型方法,还可用于分子流行病学研究。
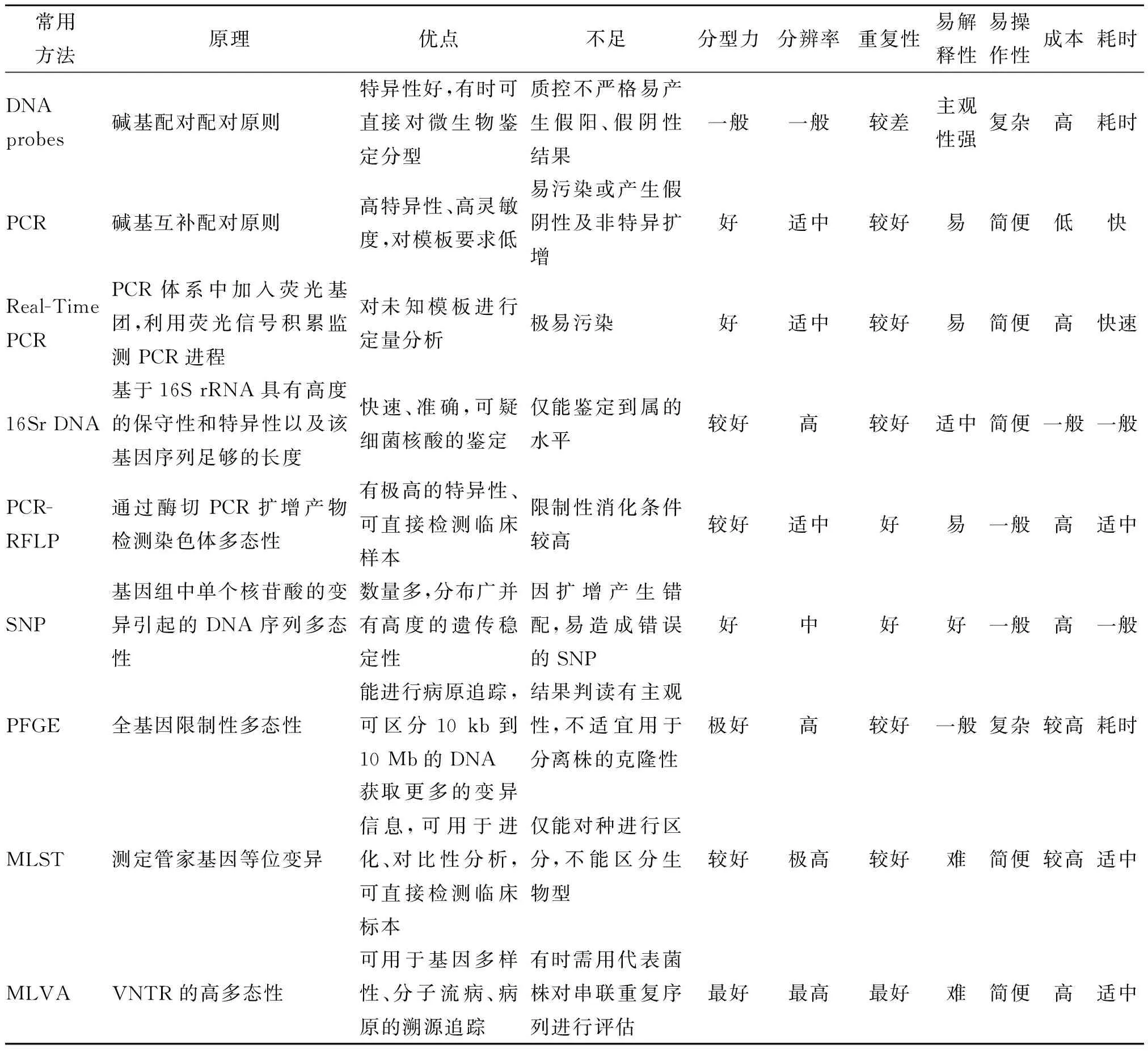
表1 几种常用布氏菌分型方法对比表
9 多位点可变数目串联重复序列分型(MLVA)
多位点可变数目串联重复序列(VNTR)在原核与真核生物基因组中广泛存在,其作为遗传标记的多态性主要来自于不同数目的串联重复,串联重复次数的改变是由细菌在复制过程中出现错配和重组而产生[31]。细菌在进化过程中不断发生的VNTR改变使高度同源性的细菌分型成为可能。Philippe LF等[32]用该方法对布鲁菌进行了分型研究。通过系列试验最终选出15个VNTR位点,并分为两组,一组为8个微卫星序列,能够在种的水平上鉴定,另一组为7个小微卫星序列,能对布鲁菌进行更进一步的辨析,并对236株布鲁菌进行了试验。结果显示该方法与传统方法有较高的一致性,能准确鉴定一些传统方法难以鉴定的布鲁菌。该方法不仅能从基因水平上准确鉴定布鲁菌,并能更加细微的区分这些菌株在基因进化方面的关系,并能阐明布病的流行病学特征。赵鸿雁等[33]根据其实验结果指出该方法是一种分辨率高且易于在省级疾控系统使用的标准化分型方法,此方法可以提高布病的监测能力。Minharro S等[34]应用MLVA-16分型方法对137株牛种布鲁菌进行了分型以及菌株分布情况的研究。证实了巴西境内分布的牛种菌主要有牛1、2、和3型,其中3型为3b型;并首次描述了有牛种4型和6型在存在。同时,根据试验分析揭示了这些菌株之间存在着高度的差异性。该方法将137株牛种菌分成了89个基因型,有些基因型存在地理群集,指出该方法对进一步了解牛种菌在巴西的流行病学有极大的帮助。MLVA方法不仅可用于阐明布鲁菌病的流行病学特征,也可用于传染源的追溯,而且标准化的MLVA方法还可用于国际间菌株的比较分析。
综上所述,一种好的分型方法须具备操作简便、成本低廉、分辨率高、重复性好、分型能力强、结果易解释、易于推广等特点。但目前未见有何种方法具备这些优点。而相对于传统的布鲁菌分型方法,分子分型方法有极大的飞跃。不仅可以快速、准确、低生物风险的对布氏菌进行分型鉴定;还可以开展遗传进化、追踪溯源、分子流行病学等多种研究。另外,分子方法能够建立数据库,在全世界范围内进行参比,能进一步深化人类对布鲁菌致病、感染机制以及微进化方面的认识,可有效的提升人类防控布病的水平。但因每一种分子分型方法的原理和侧重不同,为我们提供的分子信息也不尽相同。在布病防控形势依然严峻的当前,还未见有哪一种分子分型方法被布鲁菌分类学委员会所采用,并能够取代传统的布鲁菌分型方法。为此,我们建议,在进行布鲁菌的分型鉴定时,应因地制宜、结合实际,应多法并用,相互参考,尽可能多的提供相关的信息,为布病预防和控制提供科学的理论依据。
[1]Troy SB, Rickman LS, Davis CE. Brucellosis in San Diego: epidemiology and species-related differences in acute clinical presentations[J]. Med (Baltimore), 2005, 84(3): 174-187.
[2]Cui BY, Yin JM, Li LY, et al. Typing ofBrucellaisolates by repetitive element sequence-based polymerase chain reaction[J]. Dis Surveill, 2005, 20(8): 397-400. (in Chinese) 崔步云,尹继明,李兰玉,等.布鲁氏菌的Rep-PCR分型研究[J].疾病监测,2005,20(8):397-400.
[3]Grimont F, Verger JM, Cornelis P. Molecular typing ofBrucellawith cloned DNA probes[J]. Res Microbiol, 1992, 143(1): 55-65.
[4]Fernandez-lago L, Vallejo FJ, Trujillano I. Fluorescent whole-cellhybrization with 16S rRNA-targeted oligonucleotide probes to identifyBrucellaspp. by flow cytometry[J]. Clin Microbiol, 2000, 38(7): 2768-2771.
[5]Wellinghausen N, Nockler K, Sigge A. Rapid detection ofBrucellaspp. in blood cultures by fluorescenceinsituhybridization[J]. J Clin Microbiol, 2006, 05(44): 1828-1830. DOI: 10.1128/JCM.44.5.1828-1830.2006
[6]Baily GG, Krahn JB, Drasar BS, et al. Detection ofBrucellamelitensisandBrucellaabortusby DNA amplification[J]. J Trop Med Hyg, 1992, 95: 271-275.
[7]Bricker BJ, Halling SM. Differentiation ofBrucellaabortusbv.1, 2, and 4,Brucellamelitensis,Brucellaovis, andBrucellasuisbv 1 by PCR[J]. Clin Microbiol, 1994, 32: 2660-2666.
[8]Jiang H, Cui BY, Zhao HY, et al. Use of AMOS-PCR assay for the species identification of Brucella[J]. Chin J Zoonoses, 2009, 25(02): 107-109. (in Chinese) 姜海,崔步云,赵鸿雁,等.AMOS-PCR对布鲁氏菌种型鉴定的应用[J].中国人兽共患病学报, 2009,25(02): 107-109.
[9]Liu GD, Cui BY, Liu RZH, et al. Identification of brucella by multiplex polymerase chain reaction[J]. Dis Survill, 2008, 23(5): 271-273. DOI: 10.3784/j.issn.1003-9961.2008.5.271 (in Chinese) 刘国栋,崔步云,刘荣臻,等.布鲁氏菌多重聚合酶链反应鉴定研究[J].疾病监测,2008, 23(5): 271-273.
[10]Ocampo-Sosa AA, Aguero-Balbin J, Garcia-Lobo JM. Development of a new PCR assay to identifyBrucellaabortusbiovars 5, 6 and 9 and the new subgroup 3b of biovar 3[J]. Vet Microbiol, 2005, 110(1-2): 41-51.
[11]Liu CHJ, Shen DX. Application of 16SrDNA sequencing for identification of bacteria[J]. J Chin PLA Postgrad Med Sch, 2011, 32(7): 774-776. (in Chinese) 刘朝军,沈定霞.16SrDNA序列测定在细菌鉴定中的应用[J].军医进修学院学报,2011,32(7):774-776.
[12]Gee JE, De BK, Levett PN. Use of 16S rRNA gene sequencing for rapid confirmatory identification ofBrucellaisolates[J]. J Clin Microbiol, 2004, (08): 3649-3659.
[13]Winchell JM, Wolff BJ, Tiller R, et al. Rapid identification and discrimination ofBrucellaisolates by use of real-time PCR and high-resolution melt analysis[J]. J Clin Microbiol, 2010, 48(3): 697-702. DOI: 10.1128/JCM.02021-09
[14]Tang X, Jiang H, Zhao HY, et al. Application of the 16S rDNA sequence analysis method in identification ofBrucella[J]. Microbiology, 2013, 40(7): 68-73. (in Chinese) 汤旭,姜海,赵鸿雁,等.16SrDNA序列分析在鉴定布鲁氏菌中的应用[J].微生物学通报,2013, 40(7):68-73.
[15]Yang RF, Song YJ. Microbial forensics: theory and technology[M]. Beijing: Chemical Industry Press, 2005. (in Chinese) 杨瑞馥,宋亚军.微生物法医学:理论与技术[M].北京:化学工业,2005.
[16]Persing DH, Tenover FC, Tang TW, et al. Molecular microbiology: diagnostic principles and practices[M]. Washington: American Society for Microbiology, 2010.
[17]Redkar R, Rose S, Bricker B, et al. Real-time detection ofBrucellaabortus,BrucellamelitensisandBrucellasuis[J]. Mol Cell Probes, 2001, 15: 43-52.
[18]Willian SP, Kimmi NS, Nhi YK, et al. Real-time multiplex PCR Assay for detection ofBrucellaspp.,B.abortus, andB.melitensis[J]. J Clin Microbiol, 2004, 42(3): 1290-1293.
[19]Debeaumont C, Falconnet PA, Maurin M. Real-time PCR for detection ofBrucellaspp. DNA in human serum samples[J]. Eur J Clin Microbiol Infect Dis, 2005, 24(12): 842-845.
[20]Bounaadja L, Albert D, Chenais B, et al. Real-time PCR for identification ofBrucellaspp.: a comparative study of IS711, bcsp31 and per target genes[J]. Vet Microbiol, 2009, 137(1-2): 156-164. DOI: 10.1016/j.vetmic.2008.12.023
[21]Cloeckaert A, Verger JM, Grayon M, et al. Restriction site polymorphism of the genes encoding the major 25 kDa and 36 kDa outer-membrane proteins ofBrucella[J]. Microbiology, 1995, 141: 2111-2121.
[22]Cui BY,Yin JM,Li LY, et al. Typing ofBrucellaisolates by repetitive element dequence-based polymerase chain reaction[J]. Dis Survill, 2005, 20(8): 397-401. DOI: 10.3784/j.issn.1003-9961.2005.8.397 (in Chinese) 崔步云,尹继明,李兰玉,等.布鲁氏菌的Rep-PCR分型研究[J].疾病监测,2005, 20 (8)397-401. DOI: 10.3784/j.issn.1003-9961.2005.8.397
[23]Al Dahouk S, Tomaso H, Prenger-Berninghoff E, et al. Identification of brucella species and biotypes using polymerase chain reaction-restriction fragment length polymorphism (PCR-RFLP)[J]. Crit Rev Microbiol, 2005, 31(4): 191-196.
[24]Zhu YX, Li Y, Zhen XF. Modern molecular biology (the third edition)[M]. Beijing: Higher Education Press, 1997: 178-179. (in Chinese) 朱玉贤,李毅,郑晓峰. 现代分子生物学[M].3版.北京:高等教育出版社,1997:178-179.
[25]Scott JC, Koylass MS, Stubberfield MR, et al. Multiplex assay based on single-nucleotide polymorphisms for rapid identification ofBrucellaisolates at the species level[J]. Appl Environ Microbiol, 2007, 73(22): 7331-7337.
[26]Foster JT, Okinaka RT, Svensson R. Real-time PCR assays of single-nucleotide polymorphisms defining the majorBrucellaclades[J]. J Clin Microbiol, 2008, 46(1): 296-301.
[27]Annick AS, Gisele B, Michel R, et al. DNA polymorphism in strains of the genusBrucella[J]. J Bacteriol, 1988: 4603-4607.
[28]Cui BY. Typing ofBrucellaby pulsed field gel electrophoresis[D]. Taiyuan: Shanxi Medical University, 2006. (in Chinese) 崔步云. 布鲁菌脉冲场凝胶电泳分型研究[D]. 山西医科大学系,2006.
[29]Whatmore AM, Perrett LL, MacMillan AP. Characterisation of the genetic diversity ofBrucellaby multilocus sequencing[J]. BMC Microbiol, 2007, 7: 34-48.
[30]Zhou XY, Chen YF, Cui BY, et al. Multiple sequence typing analysis ofBrucellamelitensisserotype 3 strains[J]. Chin J Zoonoses, 2011, 27(5): 371-375. (in Chinese) 周晓艳,陈燕芬,崔步云. 我国羊种3型布鲁氏菌的多位点序列分型研究[J].中国人兽共患病学报, 2011,27(5):371-375.
[31]Bricker BJ, Ewalt DR, Halling SM.Brucella’HOOF-Prints’: strain typing by multi-locus analysis of variable number tandem repeats (VNTRs)[J]. BMC Microbiol, 2003, 3: 15-27.
[32]Philippe LF, Isabelle J, Maggy G, et al. Evaluation and selection of tandem repeat loci for aBrucellaMLVA typing assy[J]. BMC Microbiol, 2006, 6: 9-14.
[33]Zhao HY, Yang J, Zhang X, et al. Application of multiple-locus variable-number tandem-repeat analysis in brucellosis surveillance[J]. Chin J Endemiol, 2012, 31(4): 441-447. DOI: 10.3760/cma.j.issn.1000-4955.2012.04.024 (in Chinese) 赵鸿雁,杨杰,张旭,等.多位点可变数目串联重复序列分析方法在布鲁杆菌病监测中的应用[J].中国地方病学杂志, 2012, 31(4): 441-447.
[34]Minharro S, Silva Mol JP, Dorneles EM, et al. Biotyping and genotyping (MLVA16) ofBrucellaabortusisolated from cattle in Brazil, 1977 to 2008[J]. PLoS One, 2013, 8(12): e81152. DOI: 10.1371/journal.pone.0081152
Application of molecular method forBrucellatyping
LIU Zhi-guo1,2,3,CUI Bu-yun4,LIU Ri-hong3,WANG Miao3,JIE Xin-xia3,LI Xiao-lin3,XIA Xian-zhu1,5
(1.CollegeofVeterinaryMedicine,InnerMongoliaAgricultureUniversity,Hohhot01008,China;2.UlanqabCenterforEndemicDiseaseControl,Ulanqab012000,China;3.UlanqabBureauforHealth,Ulanqab012000,China;4.NationalInstituteofInfectiousDiseasesControlandPrevention,ChineseCenterforDiseaseControlandPrevention,Beijing102206,China;5.InstituteofMilitaryVeterinaryAMMS,Changchun130062,China)
Brucellaspp. are pathogenic bacteria of brucellosis. At present, there are many methods forBrucellatyping. However, molecular typing methods are used in wide range and play a very important role, especially in molecular epidemiological investigation, rapid identification, typing & tracing analysis, and variation analysis among strains of brucellosis. In the paper, we summarize the common use of molecular typing method in the typing ofBrucellaspp. These ways involve DNA probes, PCR, real-time PCR, PCR-RFLP, PFGE, 16SrDNA, SNP, MLST, and MLVA.
Brucella; molecular; typing; overview
s: Xia Xian-zhu, Email:xiaxzh@cae.cn; Cui Bu-yun, Email: cuibuyun@icdc.cn
夏咸柱, Email: xiaxzh@cae.cn; 崔步云, Email: cuibuyun@icdc.cn
1.内蒙古农业大学兽医学院,呼和浩特 010018; 2.乌兰察布市卫生局,乌兰察布 012000; 3.乌兰察布市地方病防治中心,乌兰察布 012000; 4.中国疾病预防控制中心传染病预防控制所,北京 102206; 5.中国人民解放军军事医学科学院军事兽医研究所,长春 130122
10.3969/cjz.j.issn.1002-2694.2015.02.015
R374
A
1002-2694(2015)02-0163-06
2014-06-10;
2014-10-22
内蒙古卫计委医疗卫生科研项目(No.201301094)资助

Funded by the Medicine and Health Research Project from Health and Family Planning Commission of the Inner Mongolia, China (No. 201301094)
