猪源肠外致病性大肠杆菌的分离与鉴定
2015-03-17马增军逯春香杨彩然刘谢荣王秋悦刘曜综张建文
马增军,芮 萍,逯春香,杨彩然,刘谢荣,王秋悦,刘曜综,张建文
猪源肠外致病性大肠杆菌的分离与鉴定
马增军,芮 萍,逯春香,杨彩然,刘谢荣,王秋悦,刘曜综,张建文
目的 检测猪源肠外致病性大肠杆菌(ExPEC)的血清型与毒力基因。方法 对2013-2014年间秦皇岛地区30 份组织病料采用细菌形态观察、培养特性试验、生化试验鉴定出8株肠外致病性大肠杆菌。采用玻片凝集法测定这些大肠杆菌病的血清型,并用PCR扩增法检测9种毒力基因。结果 定型菌株5株,分别属于O53、O93和 O157 3个血清型,9 种毒力基因 PCR 检测结果表明ler、iutA、irp2、fyuA、astA 5种基因检出率分别为100%、75.0%、50.0%、50.0%、25.0%。结论 所检测的猪源肠外致病性大肠杆菌以O53、O93 和O157 为主要流行血清型,同时携带fyuA、ler和iutA基因的菌株致病性较强。
肠外致病性大肠杆菌;血清型;毒力基因;猪
Supported by the Hebei Science and Technology Support Program (No. 13826616D), the Program for Hundred Excellent Talents in Hebei University (2012), and the Special Scientific Research Fund to Pig Industry System in Hebei Province (2013)
大肠杆菌是一类广泛存在于自然界,并能引起人和动物共同感染的重要人兽共患病病原。根据猪的日龄、生理与免疫状况等差异,常见的猪大肠杆菌病主要分为仔猪黄痢、仔猪白痢和猪水肿病,发病机制与危害已被人们广泛认识。近几年,北美和欧洲许多学者相继报道了可特定定殖于宿主肠道外其他组织,并严重致病的一类新的大肠杆菌菌群——肠外致病性大肠杆菌(extraintestinal pathogenicEscherichiacoli,EPEC)。肠外致病性大肠杆菌是一类能引起人和动物肠外组织感染的重要人兽共患病病原,可致使不同宿主发生脑膜炎、败血症、泌尿道感染和呼吸道感染,已引起全世界的广泛关注[1-3]。
近年来,规模猪场随着猪呼吸与繁殖综合征、圆环病毒病、猪瘟、伪狂犬病毒等免疫抑制性疾病的发生,猪链球菌、巴氏杆菌、副猪嗜血杆菌、沙门氏菌、大肠杆菌等继发感染和混合感染也多见[4-6]。2014年4月,送检病例猪发生以高热综合征、败血症、腹泻为主要临床症状。通过细菌分离培养、生化鉴定、血清型检定、毒力基因检测及小鼠致病性试验证实为肠外致病性大肠杆菌感染引起,为预防和控制该病流行提供参考依据。
1 材料与方法
1.1 病料来源 2013年12月-2014年4月,无菌采集具有高热症状濒死猪的肺脏、肾脏、脾脏、肝脏等共30份病料进行细菌的分离鉴定。
1.2 主要试剂 TaqDNA聚合酶、dNTPs、DL2000 DNA Marker均购自宝生物(大连)有限公司。标准大肠杆菌O抗原定型血清购自中国兽医药品监察所。自动生化鉴定系统ID32E鉴定试剂条(法国梅里埃公司产品)。
1.3 病原分离纯化 无菌采取疑似大肠杆菌病料肝、脾、肺、肾等器官组织,分别划线接种于MC培养基、7%家兔脱纤血琼脂平板,37 ℃恒温培养过夜,挑取圆形、不透明、直径2~3 mm的粉红色可疑菌落移接于普通营养琼脂斜面置37 ℃培养16~24 h做纯培养后,置4 ℃冰箱保存备用。
1.4 分离菌形态特征及理化特性鉴定 无菌挑取上述纯培养菌,经革兰染色镜检。将分离细菌的纯培养物分别接种于SS培养基、EMB培养基、半固体培养基,37 ℃过夜培养。将可疑菌落做TSI、氧化酶试验后,用自动生化鉴定系统ID32E鉴定试剂条进行鉴定。
1.5 O抗原血清型鉴定 取典型菌落接种于普通琼脂斜面小管,置37 ℃的恒温培养箱中培养24 h,然后用0.5%石炭酸生理盐水2 mL将菌苔洗下,置小圆底试管中用塞子塞住,制成浓稠菌悬液,经过121 ℃高压2 h,破坏其K抗原。冷却后用14种标准单因子血清进行玻板凝集反应,同时以O抗原与0.5%石炭酸生理盐水混合物作对照,观察有无自凝集现象。如0.5 min内出现明显凝集者为阳性反应。
1.6 毒力基因检测
1.6.1 引物设计 按GenBank公布的基因序列,参照文献[7-8]中有关致病性大肠杆菌的9个毒力基因iutA、papC、afa、fyuA、astA、escV、eaeA、ler、irp2共设计9对引物,由生工生物工程(上海)股份有限公司合成,引物序列见表1所示。
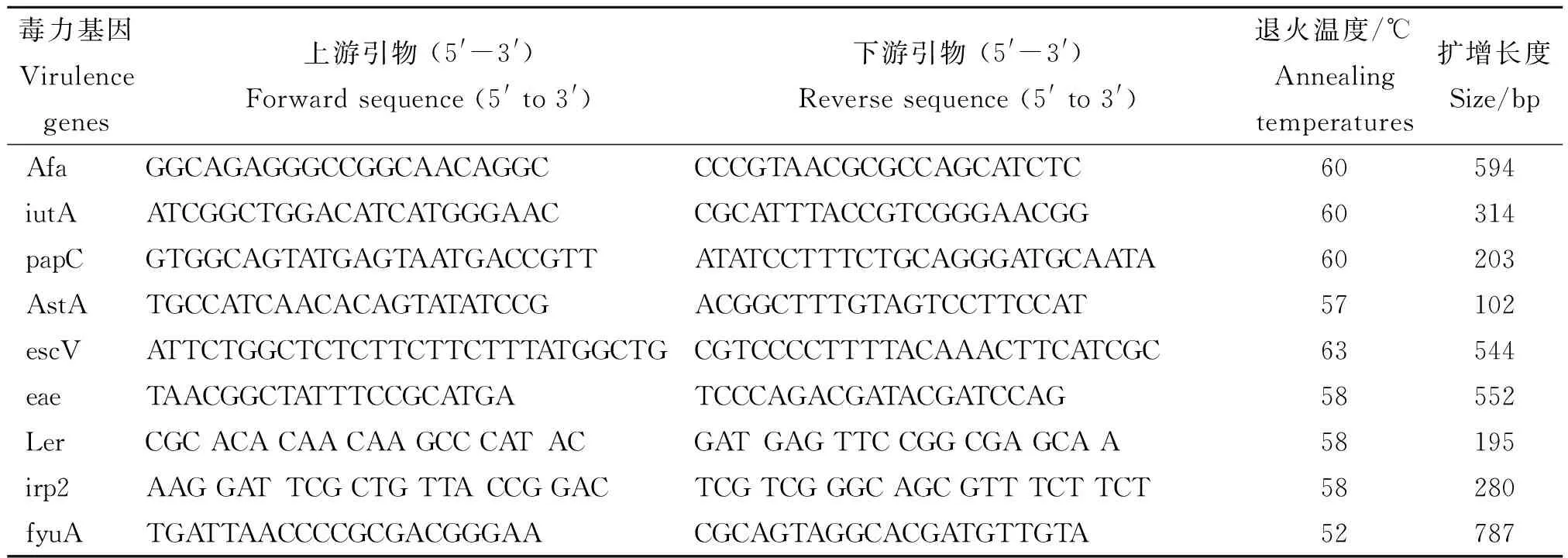
表1 致病性大肠杆菌相关毒力基因的扩增引物和扩增条件
1.6.1.2 PCR检测 用LB肉汤37 ℃培养12 h的细菌用灭菌生理盐水8 000 r/min洗涤2次后,再用生理盐水稀释为原菌液体积作为细菌DNA模板。反应体系(25 μL)为10×缓冲液 2.5 μL,2 mmol/L dNTPs 2.0 μL,10 μmol/L 上下游引物各 0.5 μL,Taq酶0.25 μL,菌液1.0 μL,灭菌ddH2O 18.25 μL。PCR反应条件为94 ℃ 预变性10 min;进入 PCR 循环,94 ℃1 min,退火1 min,72 ℃延伸1 min,30个循环后,72 ℃延伸8 min后结束反应。PCR产物经1.0%琼脂糖凝胶进行电泳验证。
1.7 小鼠致病性试验 将45只小白鼠随机分成9组,1~8组为试验组,分别用1-8号分离菌株接种营养肉汤,37 ℃培养18 h,分别腹腔注射小白鼠5只,0.1 mL/只(约含菌(2.4~3.0)×108CFU/mL)。同时设对照鼠5只,每只腹腔注入新鲜肉汤0.1 mL。接种后观察发病及死亡情况并剖检观察,无菌取其肝、肺分离细菌并鉴定。
2 结 果
2.1 形态及培养特性观察 镜检可见分离菌株为革兰氏阴性、短小的杆菌。分离的细菌在麦康凯培养基上均呈粉红色、边缘整齐、表面光滑湿润的菌落;在血琼脂上形态多样,主要有灰色、中心偏白、光滑菌落,均不溶血;在SS培养基上不生长;在伊红美兰琼脂上为黑色或棕绿色有金属反光、光滑菌落。
2.2 生化试验 8株分离菌V-P试验均为阴性,均可分解葡萄糖和乳糖产酸、产气,不产生H2S,且均有动力。经自动生化鉴定系统检测,鉴定结果为大肠埃希菌,见表2。
2.3 血清型试验 玻片凝集试验显示从8株肠外致病性大肠杆菌中鉴定2株O53,1株O93,2株O157,定型菌株占的62.5%。
2.4 毒力基因检测 对8株ExPEC进行了9种毒力基因的PCR检测、测序鉴定以验证毒力基因,检测结果见表3。ler、iutA、irp2、fyuA、astA 5种基因检出率分别为100%、75.0%、50.0%、50.0%、25.0%,所有菌株都没有扩增出afa、escV、papC、eaeA目的条带。
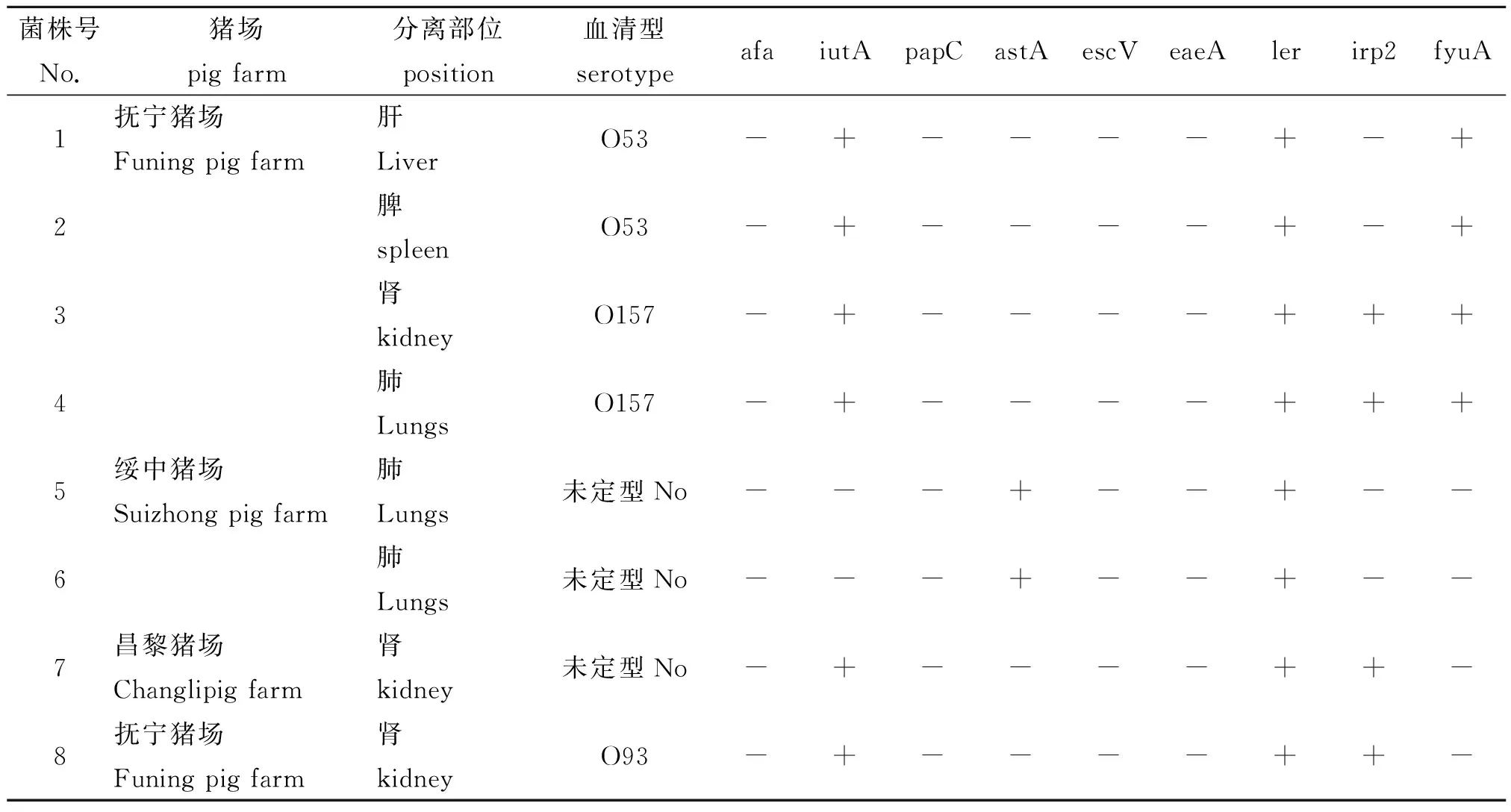
表2 8株大肠杆菌毒力基因检測结果
注:“+” 表示有目的条带,“-”表示无目的条带。
Note: “+” target band, “-” no band.
2.5 小鼠致病性试验 试验组小白鼠于6~48 h内全部发病死亡,其中1-4号菌株所接种小白鼠于8 h内死亡。7、8号菌株所接种小白鼠于12 h内死亡。5、6号菌株所接种小白鼠于36~48 h内死亡。发病小鼠主要症状为行动减少、颤抖、精神不振,急性死亡小鼠剖检结果主要为内脏充血和出血明显,个别脾脏肿大。慢性死亡小鼠胸腔积液和心包积液,肠壁变薄,肠粘膜脱落。无菌采集死亡小白鼠肝脏、肺脏接种于麦康凯琼脂平板,培养18 h后分离获得纯一的病原细菌。挑取单个菌落革兰染色后镜检,可见于接种菌一致的病原细菌。对照组2只小白鼠健康存活。致病性试验显示:同时携带iutA基因、耶尔森菌HPI毒力岛fyuA基因和LEE毒力岛ler基因的菌株致病性最强,攻毒小鼠于8 h之内发病死亡。
3 讨 论
从4个猪场中具有高热综合征病猪的8份病料中分离出8株致病性大肠杆菌,其中定型菌株5株,分别属于O53、O93和 O157 3个血清型。同一猪场的同一头猪的不同部位(肺、肝、肾、脾)能同时分离出ExPEC,且分离到不同血清型的ExPEC,可见猪ExPEC流行广,病原复杂。9 种毒力基因 PCR 检测结果表明ler、iutA、irp2、fyuA、astA 5种基因检出率较高,分别为100%、75.0%、50.0%、50.0%、25.0%。致病性试验显示8株分离菌对小白鼠均具有较强致病性。
表3 分离菌株的生化特性
注:“+”阳性,“-”阴性
Note: “+” positive,“-”negative
O抗原血清型鉴定结果显示,在被检的8份致病性大肠杆菌中,共检测出3种血清型O53、O93、O157。其中O157、O93作为致病性大肠杆菌优势血清型在我国多见报道[9-10]。O53作为致病性大肠杆菌的优势血清型未见报道,但本试验从同一头猪不同组织分离到纯一的大肠杆菌,且表现为不同血清型分别为O53和O157,说明O53 可能是流行的致病性血清型,并可能是引起猪高热综合症和高死亡率的主要血清型。另有3株未能定型,是否属于所测14种O抗原血清型之外或是新流行的血清型尚待研究。
ExPEC之所以有其特殊的组织靶标,与它具备特殊的毒力因子(VFs)密不可分的。包括菌毛编码基因:pap、sfa/foc、afa/dra分别参与了 P菌毛、S菌毛和Dr家族菌毛的合成;iutA为螯铁蛋白受体,属于铁摄取系统[11]。热稳定肠毒素 astA(EAST1)最早在肠粘附性E.coli(EAEC) 中发现有很高的检出率,后来研究发现其他一些E.coli同样携带该基因[12]。耶尔森氏菌强毒力岛(HPI)可在耶尔森氏菌和大肠杆菌之间水平传播[13],与致病性大肠杆菌的毒力进化密切相关,fyuA和 irp2基因是HPI核心区的主要结构基因。本研究检出结果显示秦皇岛地区规模化猪场流行的ExPEC 5种毒力基因ler 、iutA、fyuA、irp2、astA 的检出率分别为100%、75.0%、50.0%、50.0%、25.0%。结合小鼠致病性结果发现,8株试验菌株对小白鼠均有不同程度致病性,尤其指出同时携带iutA基因、耶尔森菌HPI毒力岛fyuA基因和LEE毒力岛ler基因的菌株致病性最强,该类菌对猪群健康具有潜在性的威胁,应引起高度重视。
[1]Smith JL, Fratamico PM, Gunther NW. Extraintestinal pathogenicEscherichiacoli[J]. Foodborne Pathog Dis, 2007, 4(2): 134-163. DOI: 10.1089/fpd.2007.0087
[2]Martinez-Medina M, Mora A, Blanco M, et al. Similarity and divergence among adherent invasiveEscherichiacoliand extraintestinal pathogenicE.colistrains[J]. J Clin Microbiol, 2009, 47(12): 3968-3979. DOI: 10.1128/JCM.01484-09
[3]Dobrindt U, Hacker J. Targeting virulence traits: potential strategies to combat extraintestinal pathogenicE.coliinfections[J]. Curr Opin Microbiol, 2008, 11(5): 409-413. DOI: 10.1016/j.mib.2008.09.005
[4]Ning YB, Zheng J, Zhang CP, et al. Research on swine high fever without confirmed pathogen(Ⅰ)--isolation and identification and pathogenic test aboutEscherichiacoli[J]. Chin J Vet Drug, 2006, 40(12): 1-4. DOI: 1002-1280(2006)12-0001-04(in Chinese) 宁宜宝, 郑杰, 张纯萍, 等. 我国南方猪高热病的研究(Ⅰ)大肠杆菌的分离、鉴定和致病性测定[J].中国兽药杂志, 2006, 40(12):1-4. DOI: 1002-1280(2006) 12-0001- 04
[5]Yang HC. Occurrence and prevalence of Swine high fever syndrome[J]. Swine Industry Sci, 2007(1): 78-80.(in Chinese) 杨汉春. 猪高热综合征的发生与流行概况[J].猪业科学,2007(1):78-80.
[6]Xu YD, Wang ZF, Zhu WH, et al. Isolation, identification and drug susceptibility of extraintestinal pathogenicEscherichiacoli[J]. J Henan Agr Sci, 2011, 40(1): 150-153. DOI: 1004-3268(2011)01-0150-04 (in Chinese) 徐引弟, 王治方, 朱文豪, 等. 猪肠外致病性大肠杆菌的分离鉴定和药敏试验[J]. 河南农业科学, 2011, 40(1):150-153. DOI: 1004-3268(2011)01-0150-04
[7]Jakobsen L, Spangholm DJ, Pedersen K, et al. Broiler chickens, broiler chicken meat, pigs and pork as sources of ExPEC related virulence genes and resistance inEscherichiacoliisolates from community-dwelling humans and UTI patients[J]. Int J Food Microbiol, 2010, 142: 264-272. DOI: 10.1016/j.ijfoodmicro.2010.06.025
[8]Muller D, Greune L, Heusipp G, et al. Identification of unconventiongal intestinal pathogenicEscherichiacoliisolates expressing intermediate virulence factor profiles by using a novel single-step multiplex PCR[J]. Appl Environ Microb, 2007, 73(10): 3380-3390. DOI: 10.1128/AEM.02855-06
[9]Wang HL, Xiong ZL, Zhou SF, et al. Serological identification of enteropathogenicE.coliin piglets in Hubei[J]. Progr Vet Med, 2002, 23(3): 68-69. DOI: 1007-5038(2002)03-0068-02 (in Chinese) 王红琳,熊忠良,周绍凤,等.湖北省仔猪致病性大肠杆菌血清型鉴定[J].动物医学进展,2002,23(3):68-69. DOI: 1007-5038(2002)03-0068-02
[10]Wang XM, Jiang HX, Liao XP, et al. Prevalence of serotypes and virulence genes and antimicrobial susceptibility of pathogenicEscherichiacoliisolates from swine[J]. Scientia Agricultura Sinica, 2010, 43(19): 4109-4115. DOI: 10.3864/j.issn.0578-1752.2010.19.025 (in Chinese) 王秀梅,蒋红霞,廖晓萍,等.猪源致病性大肠杆菌的血清型、毒力基因及抗菌药耐药性的调查[J].中国农业科学, 2010, 43(19):4109-4115. DOI: 10.3864/j.issn.0578-1752.2010.19.025
[11]Johnson JR, Murray AC, Gajewski A, et al. Isolation and molecular characterization of nalidixic acid-resistant extraintestinal pathogenicEscherichiacolifrom retail chicken products[J]. Antimicrob Agents Chemother, 2003, a(47): 2161-2168. DOI: 10.1128/AAC.47.7.2161-2168.2003
[12]Harrington SM, Dudley EG, Nataro JP. Pathogenesis of enteroaggregativeEscherichiacoliinfection[J]. FEMS Microbiol Lett, 2006, 254: 12-18. DOI: 10.1111/j.1574-6968.2005.00005.x
[13]Rakin A, Schubert S, Guilvout I. et al. Local hopping of IS3 elements into the A+T-rich part of the high-pathogenicity island inYersiniaenterocolitica1B, O∶8[J]. FEMS Microbiol Lett, 2000, 182(2): 225-229.
Isolation and identification of extraintestinal pathogenicEscherichiacolifrom swine
MA Zeng-jun,RUI Ping,LU Chun-xiang,YANG Cai-ran,LIU Xie-rong,WANG Qiu-yue,LIU Yao-zong,ZHANG Jian-wen
(KeyLaboratoryofPreventiveVeterinaryMedicineofHebei,HebeiNormalUniversityofScienceandTechnology,Changli066600,China)
To investigate the serotypes and virulence genes of extraintestinal pathogenicEscherichiacoli(ExPEC) in Qinhuangdao City, China, a total of 30 tissue samples were collected from pigs during 2013 to 2014 and 8 isolates of ExPEC were isolated which were identified by colony morphology, culture characteristics identification, and biochemical observation. The O serogroups were identified by agglutination with specific antisera. All strains were screened for virulence genes by PCR. Three O serogroups were identified for 5E.coliisolates, of which O53, O93 and O157 were dominant serogroups. In addition, the virulence genes were detected by PCR and the results showed that ler, iutA, irp2, fyuA, and astA were positive in the 8 isolates by 100%, 75.0%, 50.0%, 50.0%, and 25.0%, respectively. It is concluded that O53, O93 and O157 are dominant serogroups associate with the disease of swine. Isolates carrying pathogenicity islands geneirp2,fyuAandlerwere proved to be pathogenic to mice.
extraintestinal pathogenicEscherichiacoli; serogroups; virulence genes; pig
河北科技师范学院动科院 河北省预防兽医学重点实验室,昌黎 066600 Email:mzj6699@126.com
10.3969/cjz.j.issn.1002-2694.2015.02.008
R378
A
1002-2694(2015)02-0130-05
2014-08-05;
2014-11-24
河北科技计划项目(No.13826616D)和河北省高校百名优秀创新人才支持计划2012、河北省生猪产业体系专项资金2013资助
