产气肠杆菌连续分离株的耐药性及β-内酰胺类抗生素耐药机制的研究
2015-03-17胡丽庆史煜波翁幸鐾
胡丽庆,王 盛,史煜波,翁幸鐾
产气肠杆菌连续分离株的耐药性及β-内酰胺类抗生素耐药机制的研究
胡丽庆,王 盛,史煜波,翁幸鐾
目的 探讨临床连续分离的产气肠杆菌耐药性及耐碳青霉烯类药物菌株对β-内酰胺类药物耐药的主要机制。方法 用Vitek2-Compact仪对临床连续分离的240株产气肠杆菌进行鉴定和常规药敏试验,并筛选出耐碳青霉烯类药物的菌株;用琼脂稀释法测定其对碳青霉烯类药物的MIC值;用改良的三维试验方法分别检测耐药菌株的ESBLs与AmpC酶;改良Hodge试验法检测碳青霉烯酶;用PCR扩增法检测3种β-内酰胺酶的耐药基因;结果 240株产气肠杆菌对23种常用抗生素的耐药率在3.8%~100%之间,最高为头孢西丁(100%)、最低为亚胺培南(3.8%);筛选出10株耐碳青霉烯类产气肠杆菌;三维试验10株菌ESBLs 及AmpC酶均为阳性,Hodge试验阳性7株。PCR结果示,携带blaKPC基因7株;携带blaCTX-M基因7株,携带blaSHV基因2株;携带blaDHA基因6株,携带blaACT/MIR型ampC基因4株; 16SrRNA基因定量确定ampC基因的表达增加的3株。结论 产气肠杆菌对临床常用抗菌药物具有较高的耐药性,其主要耐药机制为产碳青霉烯酶、ESBLs与AmpC酶。
产气肠杆菌;blaKPC;ESBLs;ampC基因
Supported by the Zhejiang Medicine and Health Scientific Research Fund (No. 2011KYB099)
产气肠杆菌是条件致病菌,随着各种抗生素的广泛使用,在医院的感染中呈不断上升趋势。研究发现耐药菌株产β-内酰胺酶是其对β-内酰胺类抗生素耐药的主要机制,此种机制造成的细菌耐药占到耐药菌株的80%[1]。但近些年来有关产气肠杆菌耐药机制的研究报道相对较少,笔者对240株从临床连续分离的菌株进行了相关耐药情况分析与耐药机制的研究,现报道如下。
1 材料与方法
1.1 菌株来源 2009年1月至2012年7月从本院不同病区连续分离的产气肠杆菌保存菌株240株。质控菌株为大肠埃希菌ATCC 25922,肺炎克雷伯菌ATCC700603购自卫生部临床检验中心。
1.2 仪器与试剂 全自动微生物鉴定系统Vitek2-Compact及配套试剂革兰阴性杆菌鉴定卡(GNI)、革兰阴性杆菌药敏卡(GNS)均购自法国梅里埃公司;PE-9700 PCR仪(美国ABI公司);Eppendorf 5417R高速离心机(德国艾本得);Bio-Rad GelDoc凝胶电泳成像分析系统 (美国伯乐公司);MH琼脂干粉,头孢西丁纸片(FOX),头孢曲松纸片(CRO)均购自英国OXOID公司;邻氯西林(CLO),克拉维酸(CA)均购自上海四药有限公司,亚胺培南(IPM)、厄他培南(ETP)药物粉剂购自杭州默沙东医药公司;厄他培南药敏纸片由杭州默沙东医药公司赠送;美洛培南(MEM)药物粉剂购自日本住友制药有限公司;PCR通用试剂盒EmeraldAmpTMPCR Master Mix及DNA分子量标准DL2,000TMDNA Marker均为宝生物工程(大连)有限公司新产品,6种碳青霉烯类酶耐药基因的引物blaKPC、blaNDM-1、blaGES、blaSME、blaIMI-1 /NmcA和blaSHV-38;5种超广谱β-内酰胺酶基因;AmpC酶基因blaDHA和blaACT/MIR;AmpC基因表达检测的16SRNA引物及探针(见表1)均由生工生物工程(上海)有限公司合成。

表1 5种超广谱β-内酰胺酶基因和2种AmpC酶基因的引物及扩增产物的大小
1.3 菌株鉴定及常规药敏试验 按全自动微生物鉴定系统Vitek2-Compact及配套试剂革兰阴性杆菌鉴定卡(GNI)和革兰阴性杆菌药敏卡(GNS)使用说明书。对筛选出的10株耐碳青霉烯类药物的产气肠杆菌进行重新鉴定与药物敏感性试验,确定菌株鉴定正确及对碳青霉烯类药物仍然耐药。
1.4 MIC值测定 用M-H琼脂稀释法测定亚胺培南、美罗培南、厄他培南、阿米卡星、头孢哌酮/舒巴坦对筛选出的10株耐碳青霉烯类药物的产气肠杆菌的最低抑菌浓度(MIC),方法参照CLSI标准。操作如下,将不同剂量的药物,加入融化并冷至50 ℃左右的定量MH琼脂中,制成含不同递减浓度抗菌药物的平板(浓度梯度分别为:0.5、1、2、4、8、16、32、64、128 μg/mL琼脂),接种受试菌,孵育后观察细菌生长情况,将平板置于暗色、无反光物体表面上判断试验终点,以抑制细菌生长的琼脂平板所含最低药物浓度为MIC。
1.5 改良的Hodge试验 参照CLSI标准进行[2],0.5麦氏浊度单位大肠埃希菌ATCC25922菌液10倍稀释后均匀涂布MH平板,中间贴上ETP(10 μg)纸片,再用无菌接种环自纸片外缘向平板边缘划线,35 ℃孵育16~18 h后观察结果,结果判断:厄他培南抑菌圈内出现待检菌矢状生长者为产碳青霉烯酶菌株。
1.6 超广谱β-内酰胺酶及AmpC酶的表型检测 采用头孢曲松的三维试验方法[3]检测超广谱β-内酰胺酶(ESBLs);采用头孢西丁的三维试验法[4]检测AmpC酶。
1.7 模板DNA的提取 10株碳青霉烯类药物耐药的产气肠杆菌经血琼脂平板36 ℃培养18 h后,取菌落于装有150 μL纯水的无菌离心管中成菌悬液,于100℃水浴中煮15 min,冷却后于高速离心机中离心8 000 r/min,5 min,取上清液(模板DNA)-20 ℃保存待用。
1.8 多种β-内酰胺酶的基因检测 用PCR法检测10株碳青霉烯类药物耐药的产气肠杆菌的6种碳青霉烯酶基因,blaKPC、blaNDM-1、blaGES、blaSME、blaIMI-1 / NmcA和blaSHV-38,具体的操作方法,见参考文献[5];5种超广谱β-内酰胺酶基因blaCTX-M1、blaCTX-M2、blaCTX-M9、blaTEM、blaSHV-38;2种AmpC酶基因blaDHA和blaACT/MIR并测序,操作方法参考文献[6]。
1.9 AmpC基因表达检测 使用qRT-PCR法检测定量16S rRNA基因定量确定ampC基因表达,以临床分离ampC基因检测阴性,亚胺培南、美罗培南均敏感的产气肠杆菌作为本底对照1,以倍数来确定表达情况,具体操作见文献[7]。
2 结 果
2.1 常规药敏试验结果 240株产气肠杆菌对常用23种抗菌药物的耐药性检测结果,耐药率最高的为头孢西丁100%,其次为头孢唑林91.2%;耐药率最低的为亚胺培南3.8%,其次为美洛培南4.4%。对其他抗菌药物的耐药性检测结果见表2。
2.2 MIC值测定结果 10株碳青霉烯类耐药的产气肠杆菌对7种抗菌药物的琼脂稀释法检测的MIC值结果见表3。
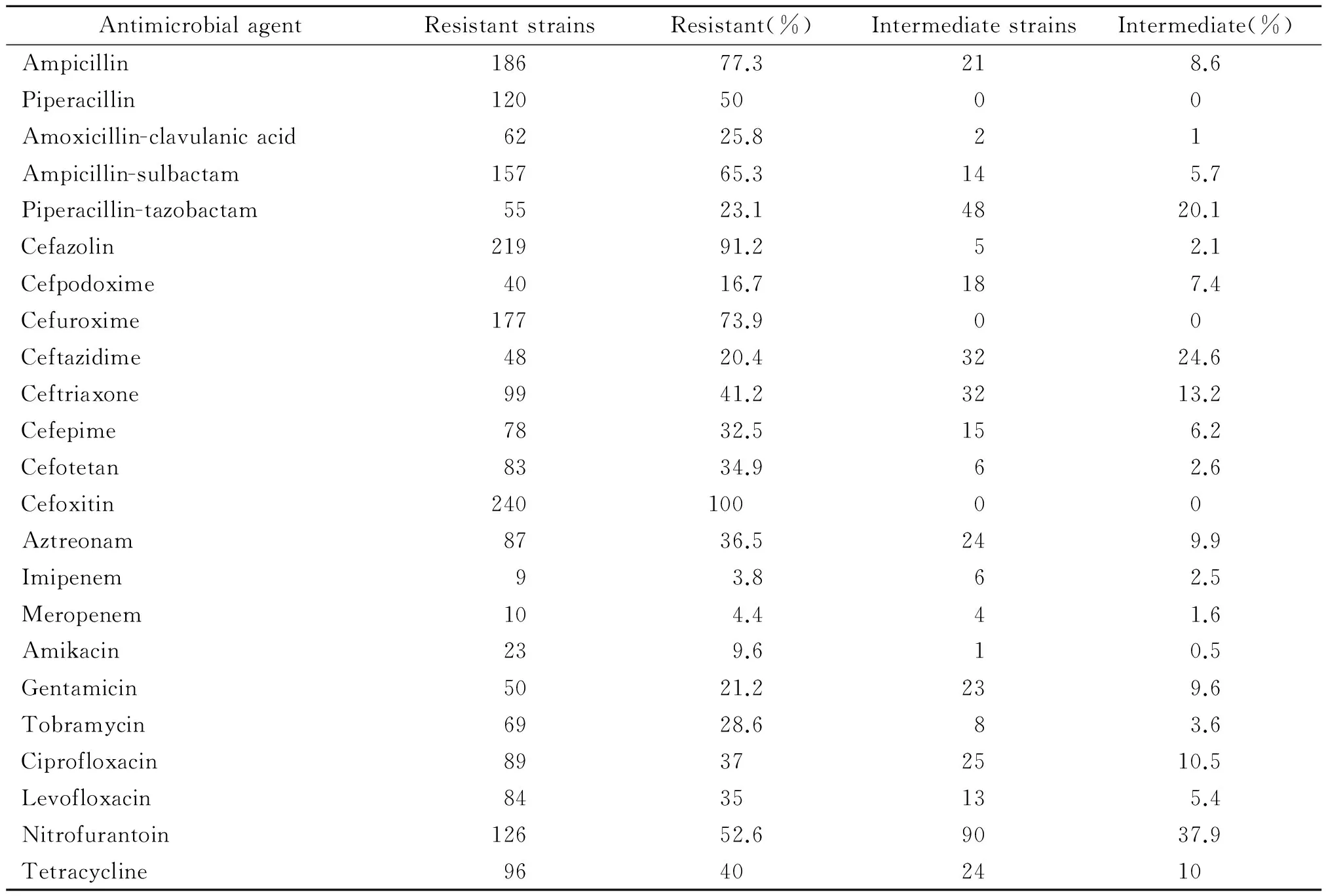
表2 240株产气肠杆菌对常用23种抗菌药物的耐药性检测结果
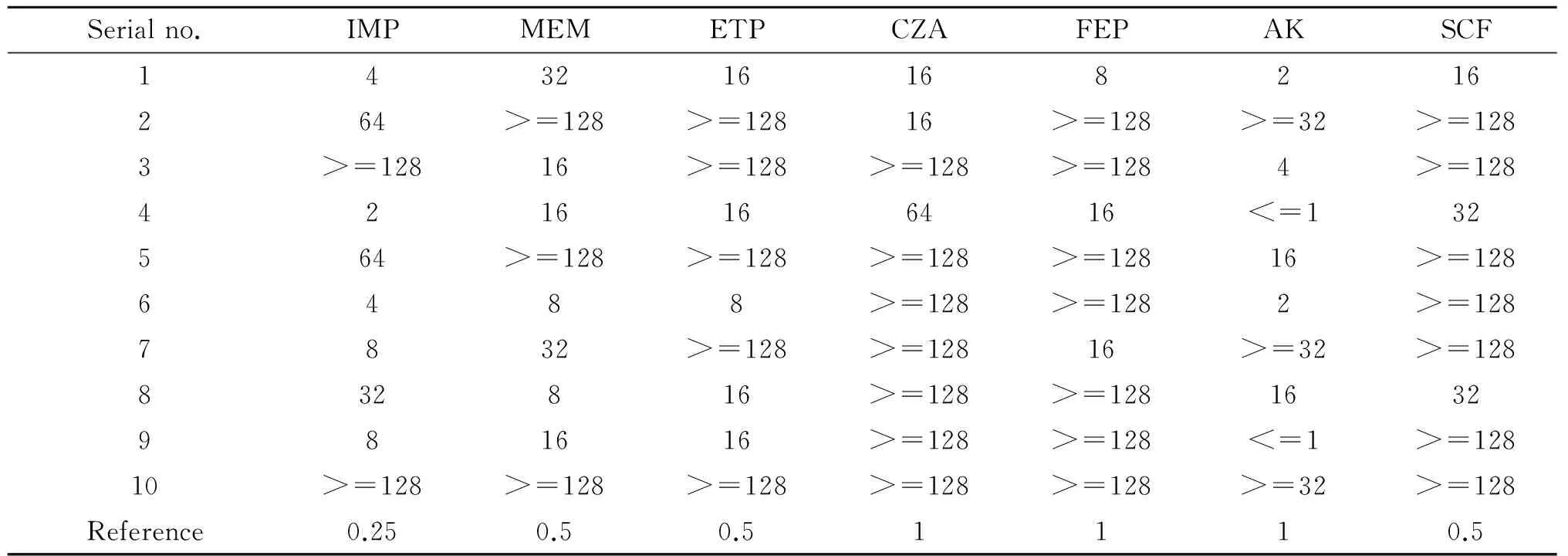
表3 10株碳青霉烯类耐药的产气肠杆菌对7种抗菌药物的MIC值(μg/mL)
2.3 改良Hodge试验、ESBLs及AmpC酶表型检测及耐药基因检测结果 10株碳青霉烯类抗菌药物耐药的产气肠杆菌,三维试验ESBLs及AmpC酶均阳性,Hodge试验阳性7株;6种碳青霉烯酶基因中检测到blaKPC基因阳性7株,未检测到blaNDM-1、blaGES、blaSME、blaIMI-1 / NmcA和blaSHV-38基因;ESBLs基因BlaCTX-M阳性7株,BlaSHV阳性2株;AmpC酶基因blaDHA阳性6株,blaACT/MIR阳性4株;16S rRNA基因定量确定ampC基因的表达增加的3株分别为1,4,7号产气肠杆菌,qRT-PCR扩增图及相对表达量见图1与图2,其他结果详见表4。
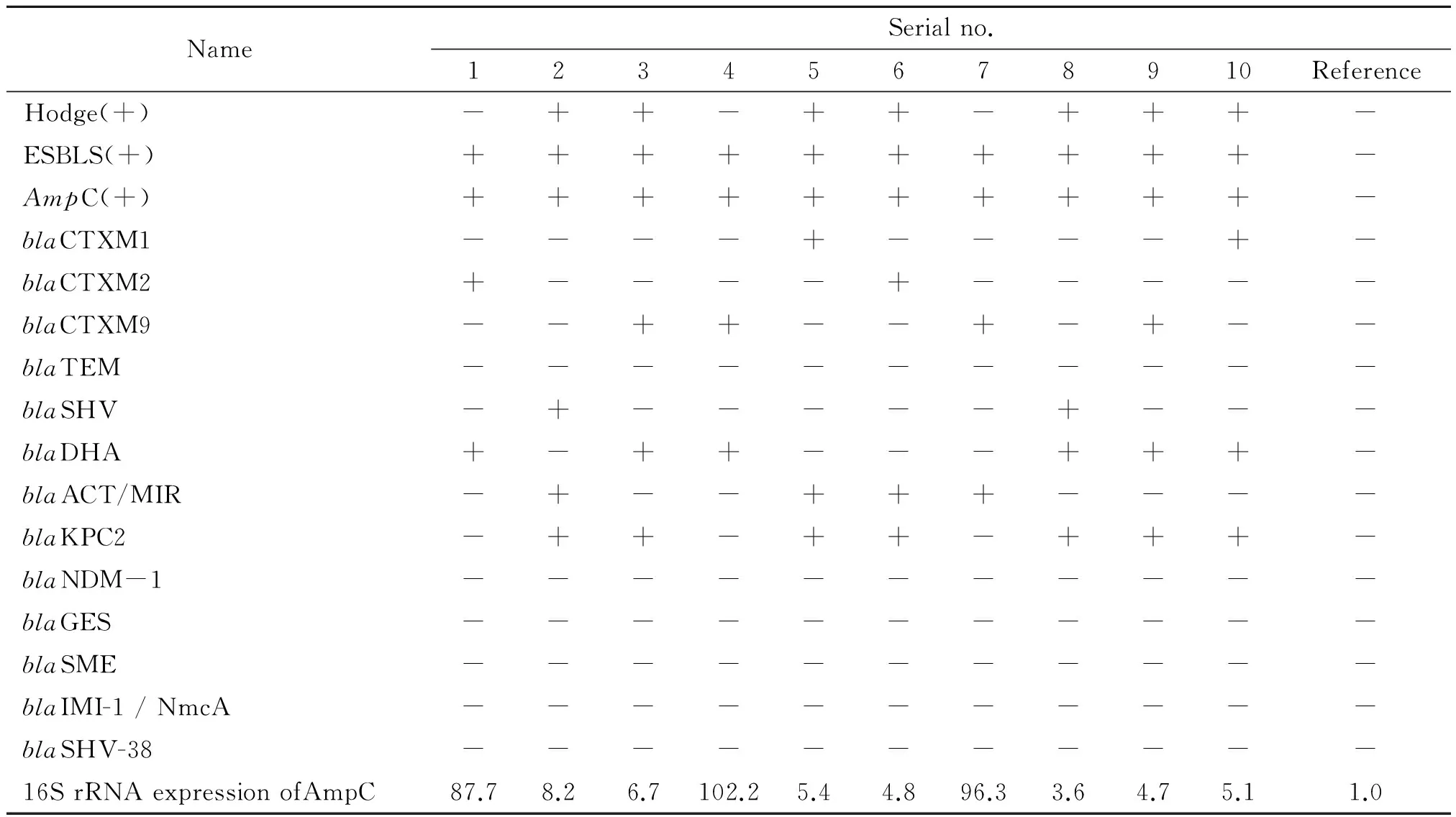
表4 10株碳青霉烯类药物耐药菌株耐药基因检测结果
3 讨 论
产气肠杆菌为肠杆菌科常见细菌,是菌血症中的主要病原菌,其死亡率可达10.2%[8]。有关报道显示,产气肠杆菌对临床常用的抗菌药物具有较高的耐药率[9],而本院连续分离的240株产气肠杆菌耐药敏率略底于文献报道,药敏结果表2显示对常
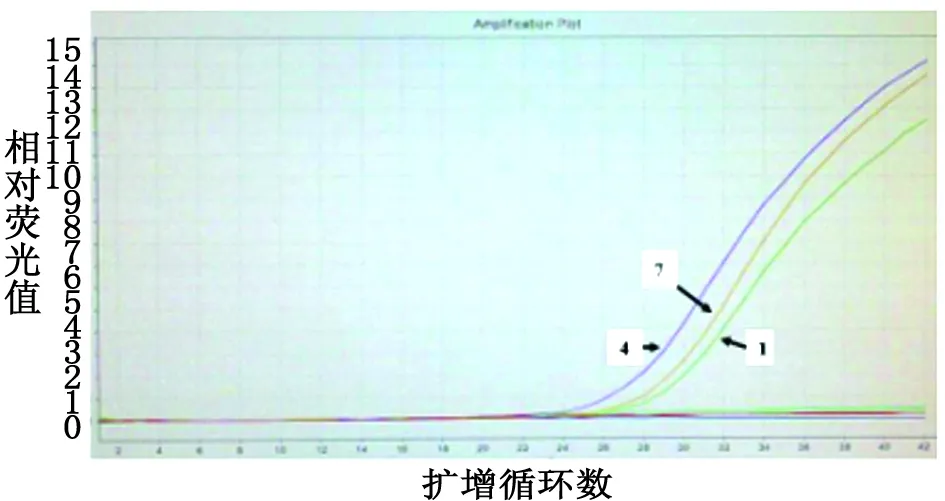
Three strains overproduced AmpC β-lactamase, no. 1, 4, and 7 curves in this map.
图1 荧光实时定量qRT-PCR检测AmpC基因表达的16SRNA扩增图
Fig.1 Amplification plot of real-time quantitative PCR for the testing chromosomal 16S rRNA ofampCgenes expression
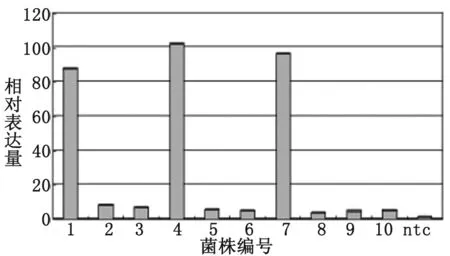
1-10:Relative expression level ofampCgenes for 10 strains; ntc: Negative control (reference strain)
图2 10株碳青霉烯类耐药的产气肠杆菌AmpC基因相对表达量
Fig.2 Relative expression level ofampCgenes for 10 strains of carbapenems resistantEnterobacteraerogens
用抗菌素耐药率最高的是一代、二代头孢及头霉素类(头孢唑啉、头孢呋辛及头孢西丁均大于90%)和氨苄西林73.9%;耐药率相对较低的是头孢曲松41.2%、头孢吡肟32.5%,由于革兰阴性菌产ESBLs 的比例较高,产AmpC酶菌的比例在增加,三代头孢作为医院内中、重度感染首选的安全性在降低,而第四代头孢菌素的头孢吡肟因能快速通过细菌外膜屏障对高产AmpC酶细菌的抗菌活性较好,若细菌不产生ESBLs等,可考虑选用;碳青霉烯类美洛培南、亚胺培南和氨基糖苷类阿米卡星的耐药率最低,均低于5%,且碳青酶烯类抗菌药物对绝大多数β-内酰胺酶,包括超广谱β-内酰胺酶(ESBLs)和AmpC稳定,对肠杆菌科细菌一直保持很高的抗菌活性,是目前治疗肠杆菌科细菌感染最有效的抗菌药物[10],但针对目前出现的为数不少的耐药株应当引起临床和实验室的重视;其中酶抑制剂复合制剂的耐药率氨苄西林/舒巴坦>阿莫西林/克拉维酸>哌拉西林/他唑巴坦,分别为65.3%、25.8%、23.1%,产AmpC酶是产气肠杆菌对三代头孢菌素和酶抑制剂复合制剂产生耐药的主要原因,复合制剂对ESBLs有效,对AmpC酶无效,覆盖面更广危重感染仍然以碳青霉烯类为首选。
为进一步深入了解本院产气肠杆菌的耐药机制,本研究对筛选出的10株碳青霉烯类药物耐药菌株进行多种β-内酰胺酶的检测。表4结果显示, ESBLs 和AmpC酶均阳性,7株Hodge试验阳性。PCR结果显示,本院的碳青霉烯酶以blaKPC2为主。KPC型碳青霉烯酶是一种非金属碳青霉烯酶,可水解碳青霉烯类、青霉素类、头孢菌素类和氨曲南等抗菌药物,也是产气肠杆菌耐碳青酶类药物的重要原因;本院产气肠杆菌携带ESBLs的基因有多种,以blaCTX-M和blaSHV为主AmpC酶基因以blaDHA和blaACT/MIR型为主;对AmpC酶过表达株的研究显示,其中1、4、7号菌株16SrRNA基因定量表达明显增加,分别为87.7、102.2、96.3。文献报道AmpC酶过度表达可造成菌株对碳青霉烯类药物的耐药[7],本研究结果显示,此3株过度表达菌,虽然碳青酶烯类药物耐药的多种基因阴性,但仍对亚胺培南与美洛培南耐药也说明这一耐药机制的存在。研究还表明,菌株同时携带多种耐药基因的重叠组合,这使细菌的耐药性起到了叠加或协同作用。
抗菌药物尤其是三代头孢菌素的应用与ESBLs的感染流行有相关性,有报道ESBLs的暴发流行与头孢他啶的消耗量成正相关,而限制头孢他啶的使用,则可减少ESBLs菌的流行[11-12]。而质粒介导的AmpC酶在细菌中的传播已呈增长趋势,新的质粒AmpC酶亚型在不同细菌中层出不穷。且由于质粒有传递性,此类酶可在不同细菌间传播,容易引起暴发流行[13]。在国外,质粒介导AmpC酶以CMY-2型最为流行[14],而本研究基因测序结果显示主要为blaDHA和blaACT/MIR型,表明我国的流行株与国外有所不同。鉴于AmpC酶可被β-内酰胺类抗菌药物诱导,属于诱导酶,不被克拉维酸抑制但可被氯唑西林抑制[15],目前第四代头孢和碳青霉烯类仍然是治疗产AmpC酶菌株的有效药物,临床经验性用药一般首选碳青霉烯类,其次是β-内酰酶类药物和酶抑制剂、头霉类抗菌药物及其他敏感抗菌药物。但为了避免产生金属β-内酰胺酶,临床上在使用碳青霉烯类药治疗时还是应考虑联合用药。
不断出现的产酶耐药株给临床抗菌治疗带来了极大的困难,对临床连续分离菌株进行耐药性及耐药机制的检测能明确某一阶段耐药菌株的耐药性变化,这有利于耐药基因分子流行机制的研究。临床实验室及时准确地对某一阶段临床分离菌株进行耐药菌株的监测,对规范临床抗生素的合理选用,控制耐药菌株的播散和流行,具有非常重大的意义。
[1]Li XZ, Mchrotra M, Ghinire S, et al. Beta-lactam resistance and beta- lactamases in bacteria of animal origin[J]. Vet Microbiol, 2007, 121(3-4): 197-214. DOI:10.1016/j.vetmic.2007.01.015
[2]Clinical and Laboratory Standards Institute. Performance standards for antimicrobial susceptibility testing: 19thinformational supplement. CLSI document M100-S19[S]. Wayne: Clinical and Laboratory Standards Institute, 2009.
[3]Shahid M, Malik A, Agrawal M, et al. Phenotypic detection of extended-spectrum and AmpC beta-lactamases by a new spot-inoculation method and modified three-dimensional extract test: comparison with the conventional three-dimensional extract test[J]. J Antimicrob Chemother, 2004, 54(3): 684-687. DOI:10.1093/jac/dkh389
[4]Coudron PE, Moland ES, Thomson KS. Occurrence and detection of AmpC beta-lactamases amongEscherichiacoli,klebsiellapneumoniae, andproteusmirabilisisolates at a veterans medical center[J]. J Clin Microbiol, 2000, 38(5): 1791-1796.
[5]Hu LQ, Lv HY. Antibiotics resistance and the carbapenems-resistant mechanisms inSerratiamarcescens[J]. Chin J Lab Med, 2012, 35(7): 625-629. (in Chinese) 胡丽庆, 吕火祥. 黏质沙雷菌耐药性及碳青霉烯类抗生素耐药机制研究[J]. 中华检验医学杂志, 2012, 35(7): 625-629.
[6]Wang H, Liu YM, Wang QT, et al. Identification of DHA-1 plasmid-mediated AmpC and CTX-M extended-spectrum β-lactamase producingklebsiellapneumoniaein Beijing[J]. Chin J Microbiol Immunol, 2005, 25(5): 419-422. (in Chinese) 王辉,刘颖梅,王清涛,等. 北京发现同时产DHA-1质粒AmpC型及CTX-M型超广谱β-内酰胺酶的肺炎克雷伯菌[J]. 中华微生物及免疫学杂志, 2005,25(5):419-422.
[7]Suh B, Bae IK, Kim J, et al. Outbreak of meropenem-resistantSerratiamarcescenscomediated by chromosomal AmpC beta-lactamase overproduction and outer membrane protein loss[J]. Antimicrob Agents Chemother, 2010, 54(12): 5057-5061. DOI:10.1128/AAC.00768-10
[8]Chang EP, Chiang DH, Lin ML, et al. Clinical characteristics and predictors of mortality in patients withEnterobacteraerogenesbacteremia[J]. J Microbiol Immunol Infect, 2009, 42(4): 329-335.
[9]Lavigne JP, Sotto A, Nicolas-Chanoine MH, et al. Membrane permeability, a pivotal function involved in antibiotic resistance and virulence inEnterobacteraerogenesclinical isolates[J]. Clin Microbiol Infect, 2012, 18(6): 539-545. DOI:10.1111/j.1469-0691.2011.03607.x
[10]Paterson LR. Antibiotic policy and prescribing strategies for therapy of extended-spectrum beta-lactamases-producingEnterobacteriaceace: the role of piperacillin-tazobactam[J]. Clin Microbiol Infect, 2008, 14(Suppl 1): 181-184.
[11]Wang YP, Wang MY, Liao ZH. Related factor analysis of extended-spectrum β-lactamase- producing bacteria infection[J]. China J Nosocomiol, 2003, 13(10): 972-974. (in Chinese) 王豫平,王慕云,廖致红. 产广谱β-内酰胺酶细菌感染相关因素分析[J]. 中华医院感染学杂志,2003,13(10):972-974.
[12]Ye JM. Analysis of ESBLs, AmpC and resistance from 120 strainsKlebsiellapneumoniae[J]. Zhejiang Prac Med, 2009, 14(1): 69-71. (in Chinese) 叶建敏. 120例肺炎克雷伯菌ESBLs和AmpC酶检测及耐药性分析[J]. 浙江实用医学,2009,14(1):69-71.
[13]Black JA, Thomson KS, Buynak JD, et al. Evaluation of beta-lactamase inhibitors in disk tests for detection of plasmid-mediated AmpC beta-lactamases in well-characterized clinical strains ofKlebsiellaspp[J]. J Clin Microbiol, 2005, 43(8): 4168-4171. DOI: 10.1128/JCM.43.8.4168-4171.2005
[14]Winokur PL, Brueggemann A, Desalvo DL, et al. Animal and human multidrug-resistant, cephalosporin-resistantSalmonellaisolates expressing a plasmid-mediated CMY-2 AmpC b-lactamase[J]. Antimicrob Agents Chemother, 2000, 44(10): 2777-2783.
[15]Jacoby GA. AmpC beta-lactamases[J]. Clin Microbiol Rev, 2009, 22(1): 161-182. DOI:10.1128/CMR.00036-08
Drug-resistance on consecutive clinical isolates
ofEnterobacteraerogenesand its resistance mechanism to β-lactamses
HU Li-qing,WANG Sheng,SHI Yu-bo,WENG Xing-bei
(ClinicalLaboratory,theFirstHospitalofNingboCity,Ningbo315000,China)
The aim is to investigate the antibiotics resistance of consecutive clinical isolates ofEnterobacteraerogensand the main resistance mechanism to β-lactamses for carbapenems resistant isolates. The Vitek 2-Compact instrument was used to identify the 240 strains ofEnterobacteraerogensfrom clinic, and the antimicrobial susceptibility was tested, while the carbapenems-resistant isolates were screened. The minimum inhibition concentration of carbapenems was tested by standard agar dilution method. The ESBLs and AmpC β-lactamase were detected with three-dimensional test. The KPC carbapenemase were detected by Hodge test and the genotypes of β-lactamses were performed by PCR method. Results showed that the resistance rates of 240Enterobacteraerogensstrains to the common antibiotics were from 3.8% to 100%. The highest one was cefoxitin (100%), and the lowest was imipenem (3.8%). Ten carbapenems-resistant strains ofEnterobacteraerogenswere screened from 240 isolates. Both ESBLs and AmpC β-lactamase were positive in all of 10 isolates, and 7 isolates in Hodge test were positive. PCR experiment showed that among the 10 strains, there were 7 strains carryingblaKPC, 7 strains carryingblaCTX-M, 2 strains carryingblaSHV, 6 strains carryingblaDHA, 4 strains carryingblaACT/MIR, and 2 strains carrying high expression levels of the chromosomalampCgene. It’s suggested that there is high antibiotic resistance to common antimicrobial agents of clinicalEnterobacteraerogens. The main cause for antibiotics resistance ofEnterobacteraerogensis producing β-lactamase such as carbapenemase, ESBLs and AmpC bate-lactamase.
Enterobacteraerogens;blaKPC; ESBLs; AmpC β-lactamase
宁波市第一医院检验科,宁波 315000 Email:54256998@qq.com
10.3969/cjz.j.issn.1002-2694.2015.02.012
R378
A
1002-2694(2015)02-0148-06
2014-05-28;
2014-10-26
浙江省医药卫生科学研究基金(2011KYB099)
