SiO2/TiO2复合气凝胶的孔道结构研究
2015-03-15傅颖怡丁新更窦天军
傅颖怡,丁新更,孟 成,窦天军,杨 辉
(1.浙江大学材料科学与工程无机所,杭州310027;2.中国工程物理研究院,四川绵阳621900)
SiO2/TiO2复合气凝胶的孔道结构研究
傅颖怡1,丁新更1,孟 成1,窦天军2,杨 辉1
(1.浙江大学材料科学与工程无机所,杭州310027;2.中国工程物理研究院,四川绵阳621900)
摘 要:为了在常压干燥下制备高比表面积且具有多级孔道结构的SiO2/TiO2复合气凝胶,以正硅酸乙酯、钛酸丁酯为原料,利用低聚体聚合将分相平行引入到溶胶凝胶过程中,获得SiO2/TiO2醇凝胶,并通过溶剂替换技术实现气凝胶的常压干燥制备.不同硅钛比气凝胶的内部结构研究表明:合成的气凝胶是由纳米SiO2和TiO2颗粒分散复合而成的介孔块体,其中Ti—O—Ti、Si—O—Si和Ti—O—Si键相互交织.气凝胶的结构变化是分相与溶胶凝胶过程相互竞争的结果.Si含量能显著改善气凝胶的结构,当n(Ti)∶n(Si)为3∶1时,比表面积高达712.2 m2/g,平均孔径为3.36 nm;当n(Ti)∶n(Si)为1.5∶1时,复合气凝胶具有明显双连续孔道,比表面积高,同时孔状结构清晰.
关键词:常压干燥;SiO2/TiO2气凝胶;硅钛比;组织结构;溶胶凝胶;分相法
SiO2/TiO2气凝胶是由纳米SiO2和TiO2颗粒分散复合而成的介孔固体材料,具有大比表面积、高孔隙率等优异性能,广泛应用于催化、分离和吸附等领域.TiO2气凝胶具有高比表面积和孔隙率[1-2],SiO2气凝胶具有网络结构牢固、比表面积高和孔体积大等特点[3-5],因此,制备SiO2/TiO2复合气凝胶,不仅能提高网络结构强度,还能利用高孔容和高比表面积等特点,提高气凝胶的吸附性能.ZHANG等[6]进行了以大孔改性硅胶为载体的超分子识别材料(Calix[4]+MODB/SiO2-P)对Cs离子的吸附试验.该材料在3 mol/L的HNO3浓度中能选择性吸附Cs(I)离子,且对Pb(II)、Ru (III)、Y(III)等其他金属离子没有表现出相同的吸附.近年来,NAKANISHI等[7-8]通过添加三嵌段表面活性剂[9](EO-PO-EO)及其他非离子性表面活性剂,合成出有多层次孔结构的硅凝胶.这种多孔硅胶本身含有大孔连续网络结构,同时由介孔凝胶结构组成其骨架,这种多层次孔材料适用于色谱分离和吸附分离等领域.
目前,SiO2/TiO2气凝胶的制备技术通常采用昂贵的硅、钛醇盐作为反应前驱体,采用溶胶凝胶法利用超临界干燥技术或低表面张力溶剂替换/非超临界干燥技术获得多孔结构[10-12].超临界干燥技术有利于获得成块性好、比表面积高的气凝胶,但技术条件控制困难,难以实现规模化生产.通过低表面张力溶剂替换在常压下干燥制备SiO2/TiO2气凝胶,获得气凝胶的比表面积和孔体积又相对较低.因此,研究在常压干燥条件下制备高比表面积、小孔径的SiO2/TiO2复合气凝胶具有重要意义[13-14].KWON等[15]将TiO2粉末掺入SiO2溶胶中,调节pH使其在3~5 min内快速凝胶,通过非超临界干燥途径制得掺杂TiO2粉末的SiO2气凝胶.TiO2以粉末颗粒形式夹杂在SiO2气凝胶中,且分布极不均匀.鉴于纯TiO2气凝胶的网络结构较差,用非超临界干燥技术制备同时具有高比表面积、双连续孔道、多层次孔结构以及均一、小孔径等优异性能的块状SiO2/TiO2气凝胶的研究至今少有报道.本实验通过调节硅钛比来有效调控SiO2/TiO2复合气凝胶的表面形貌及微观孔道结构,探讨了复合气凝胶样品的双连续孔道形成机理,并进一步表征了气凝胶的孔性质.
1 实验
1.1 实验用主要原料
钛酸丁酯(TnBT),分析纯试剂;正硅酸乙酯(TEOS),分析纯试剂;聚乙二醇(PEG),分析纯试剂;无水乙醇,分析纯试剂;去离子水.
1.2 SiO2/TiO2复合气凝胶的制备
由于正硅酸乙酯的水解速度比钛酸丁酯要慢得多,将正硅酸乙酯、钛酸丁酯直接与乙醇、水、催化剂等混合,钛酸丁酯易先水解并形成沉淀,得到分布不均匀的SiO2/TiO2凝胶,因此,需分别制备硅、钛溶胶.
1.2.1 TiO2醇溶胶的制备
将10 mL钛酸丁酯与20 mL无水乙醇混合均匀得到溶液A;将3 mL醋酸、3.5 mL二次蒸馏水及等量无水乙醇混合均匀得到溶液B.在强烈搅拌下,将溶液B逐滴加入溶液A中,钛酸丁酯水解得到TiO2溶胶.将此溶胶密封后室温陈化24 h.1.2.2 SiO2醇溶胶的制备
在搅拌条件下,将1 g PEG溶于盐酸水溶液中,继续搅拌使PEG溶解均匀,然后,添加25 mL TEOS,在室温下继续搅拌获得均匀SiO2溶胶.陈化,加入4.6 mL环氧丙烷(PO),将此溶胶密封后置于40℃烘箱中待用.
1.2.3 SiO2/TiO2气凝胶的制备
在剧烈搅拌下,将上述制备得到的SiO2溶胶和TiO2溶胶充分均匀混合,并加入1.5 mL甲酰胺,在PH为3.0~3.5条件下得到SiO2/TiO2醇凝胶.将SiO2/TiO2醇凝胶在60℃下先用无水乙醇浸泡,以置换除去醇凝胶中多余的水份,然后,用正硅酸乙酯的乙醇溶液和无水乙醇重复以上操作;最后将浸泡处理的SiO2/TiO2醇凝胶在70℃烘箱中干燥即得SiO2/TiO2气凝胶样品.
1.3 表征方法
采用扫描电子显微镜(JSM-6060SJEOL公司,日本)分析试样断面的微观形貌.利用X射线粉晶衍射仪(DMAX-RA公司,日本)分析试样气凝胶的晶型结构和晶粒尺寸.用傅里叶红外光谱仪(Paragon1000公司,美国)分析气凝胶的化学键合.采用压汞(Poremaster 60-GT,Quantachrome公司,美国)分析试样的大孔孔径分布.用氮吸附-脱附装置(BELSORP mini II,Bel公司,日本)分析试样的吸附-脱附等温线,并通过Brunauer⁃Emmett⁃Teller(BET)和Barrett⁃oyner⁃Halenda (BJH)模型分别计算所测试样的比表面积和孔径分布.
2 结果与讨论
2.1 不同硅钛比对SiO2/TiO2复合气凝胶微观结构的影响
硅、钛醇盐水解速率差异极大,以共水解方法无法制备均匀的多组分凝胶,本文采用分相法制备硅溶胶,溶胶凝胶法制备钛溶胶,通过化学方法(交联反应)在溶胶凝胶过程中平行的引入相分离,再混合均匀得到SiO2/TiO2复合醇凝胶的方法.制备过程中通过控制溶胶体系的硅钛比、水含量、陈化时间、温度、pH等影响因素,使凝胶化时间足够长,以保证复合凝胶形成稳定的网络结构.添加干燥控制化学添加剂甲酰胺有助于控制溶胶凝胶反应过程,使胶体粒子粒径分布更加均匀.
图1是硅钛摩尔比分别为4.5∶1、3∶1、1.5∶1、1.5∶2、1.5∶3的SiO2/TiO2复合气凝胶在500~4 000 cm-1波数范围内的FTIR光谱图.460、800和1 100 cm-1处的吸收峰分别是Si—O—Si键的弯曲振动峰,对称和不对称伸缩振动峰;2 900 cm-1处是—CH3基团的振动吸收峰,—CH3基团的存在是湿凝胶硅烷化作用所致,说明SiO2/TiO2复合气凝胶呈现疏水性.1 570 cm-1处是Ti—O—Ti键的振动吸收,且随着硅含量的减少,峰型越来越明显.950 cm-1处的吸收峰是Ti—O—Si键的吸收峰,Ti—O—Si键的形成主要发生在TiO2和SiO2纳米颗粒之间,表明引入Ti后,Ti—O和Si—O键共存并形成Ti—O—Si键,形成无定形网络[16].上述结果表明,本法制备的SiO2/TiO2复合气凝胶样品的物化性能与TiO2和SiO2两者简单地机械结合的产物不同.
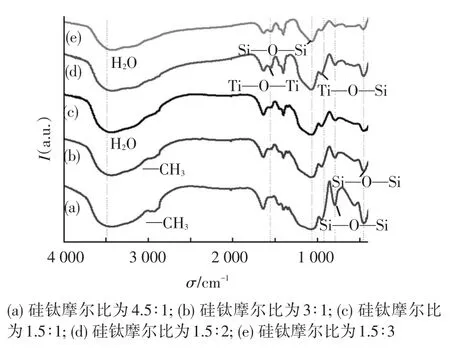
图1 不同硅钛摩尔比的SiO2/TiO2复合气凝胶FTIR光谱图
GAO等[17]还提出在复合氧化物中,TiO2与SiO2颗粒间的聚合主要依靠Ti—O—Si键和范德华力.Ti—O—Si键含量的多少是判断TiO2和SiO2颗粒是原子间混合还是分子间分散的主要依据.虽然二者均含有一定比例的Ti—O—Si键,但当TiO2与SiO2以原子间混合形式结合时,SiO2的含量通常较高,为n(Si)/n(Ti)>7.5或质量分数大于85%.在本文体系中,复合气凝胶中的n(Si)/n(Ti)比都小于4.5,且本文所用的SiO2醇溶胶和TiO2醇溶胶均是预先制备好并分别静置陈化24 h,可近似认为Ti(OC4H9)4、Si(OC2H5)4及其水解产物间的缩聚反应已经进行得比较完全,在形成复合凝胶之前TiO2和SiO2胶粒已基本形成,可以确定最终获得的SiO2/TiO2气凝胶中TiO2与SiO2小颗粒的结合只能以分子间分散为主.因此,凝胶的形成主要是TiO2和SiO2溶胶颗粒表面OH相互作用的结果,作用方式主要有氢键结合及羟基间缩聚结合.在TEOS和TnBT溶胶凝胶体系中,主要发生如图2所示水解缩聚反应及酯化反应.
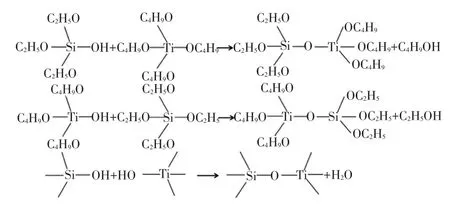
图2 TEOS和TnBT溶胶凝胶体系中的水解缩聚反应及酯化反应
图3为不同n(Si)/n(Ti)的SiO2/TiO2复合气凝胶经800℃热处理2 h后的XRD谱图.
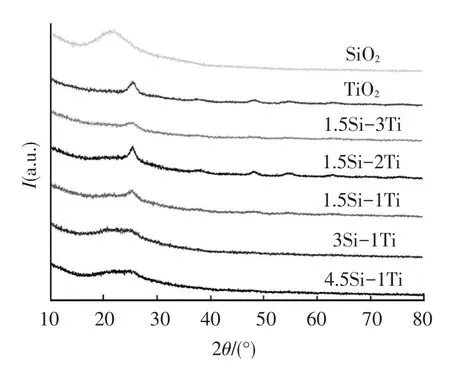
图3 SiO2/TiO2复合气凝胶经800℃热处理后的XRD谱图
理论上500~700℃是从锐钛矿型向金红石型转化的温度范围,而所有样品煅烧到800℃均没有出现金红石相,这说明引入SiO2后,TiO2由锐钛矿型向金红石型转化更加困难,其相转变温度会有不同程度的提高.此外,样品经800℃高温煅烧后的XRD谱图极其弥散,存在少量衍射峰,这些峰与锐钛矿晶型TiO2的特征衍射峰一致,说明样品中的SiO2为无定形,而TiO2主要以无定形存在,同时具有少量锐钛矿型.随着Si含量的增加,锐钛矿相TiO2衍射峰逐渐减弱.这是由于SiO2的存在会干扰Ti原子的排列,抑制其晶型转变,使锐钛矿相TiO2晶型的出现需要更长时间和更多能量.随Si含量的减少,这种抑制效果逐渐减弱,样品出现了锐钛矿相TiO2衍射峰.Si含量较高时,SiO2主要形成复合气凝胶的网络骨架,TiO2分布其中,SiO2和TiO2达到分子水平混合.煅烧温度的进一步提高将导致复合气凝胶发生烧结、多孔网络结构遭到破坏甚至坍塌,造成比表面积和孔体积骤然减小,最终导致吸附性能急剧下降.不同硅钛比的样品XRD谱图中均未出现新的特征衍射峰,也没有峰位置的移动,说明没有新的物相形成,此结果与IR测试结果相吻合[18].
2.2 不同硅钛比下SiO2/TiO2复合气凝胶的组织形貌及双孔道结构形成机理
图4为常压干燥下不同n(Ti)/n(Si)的SiO2/TiO2复合气凝胶的SEM照片,可以看出:SiO2/TiO2复合气凝胶的多孔网络结构由几十纳米的骨架颗粒交联构成,内部充满空隙,其孔径约2~13 nm;随着Si含量的增加,复合气凝胶网络结构逐渐密集.其中硅钛摩尔比为4.5∶1的SiO2/TiO2复合气凝胶多孔结构相对密集;硅钛摩尔比为1.5∶2、1.5∶3的SiO2/TiO2复合气凝胶结构相对疏松,孔结构细小而均匀;硅钛比为1.5∶1的SiO2/TiO2复合气凝胶具有明显双连续孔道结构,比表面积高,同时孔状结构清晰,机械性能高.


图4 常压干燥下不同n(Si)/n(Ti)的SiO2/TiO2复合气凝胶的SEM照片
本文推测复合气凝胶样品的双连续孔道形成机理如图5所示.
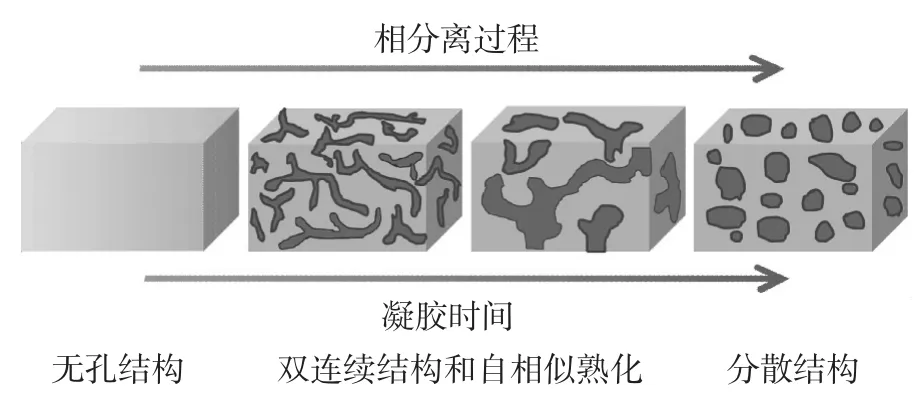
图5 分相过程中的双连续孔道形成机理示意图
SiO2/TiO2复合气凝胶的结构发生变化,实质上是分相与溶胶凝胶转变过程间相互竞争的结果.通常,分相形成的双连续相是一个暂稳态,若此结构未得到及时固化,在表面张力的驱动下体系会发生Ostwald熟化过程,连续的两相会向着具有最小表面张力的球形颗粒转变.若分相产生双连续两相的同时,平行发生溶胶凝胶过程,则这种双连续孔道结构将得以保留固定;含有较多溶剂的一相在后续干燥过程中会随着溶剂相的挥发,形成连续的孔道结构.若溶胶凝胶转变过程相对于分相过程发生的很迟,则分相形成的两相直到转变为球颗粒才被固化,样品最终形貌即是球颗粒堆积状;反之,若溶胶凝胶转变过程相对于分相过程发生的很早,则分相过程来不及充分进行,最终形成少孔的板状结构.
图6是SiO2/TiO2复合气凝胶的SEM照片.研究发现:SiO2在SiO2/TiO2复合气凝胶中起网络骨架作用,硅含量直接影响凝胶的空间网络结构.


图6 不同倍数下硅钛摩尔比为4.5∶1((a)~(c))和1.5∶1((d)~(f))的SiO2/TiO2复合气凝胶的SEM照片
硅含量高(硅钛摩尔比为4.5∶1)时形成密集的硅网络,抑制网络中TiO2颗粒的长大,网络结构强度增大,复合气凝胶孔径小,结构紧密.硅含量低时硅链彼此分开,没有足够的硅粒子来抑制钛粒子的团聚,使网络中的钛晶粒逐渐长大,复合气凝胶孔径增大,网络结构强度变差,在干燥过程中部分孔道坍塌,比表面积降低;只有二者以适当比例(硅钛摩尔比为1.5∶1)结合时才会综合各自特点,形成具有明显双连续孔道结构,孔径均匀、结构疏松、网络强度好的复合气凝胶.
图7是不同硅钛摩尔比的SiO2/TiO2复合气凝胶的热重曲线.
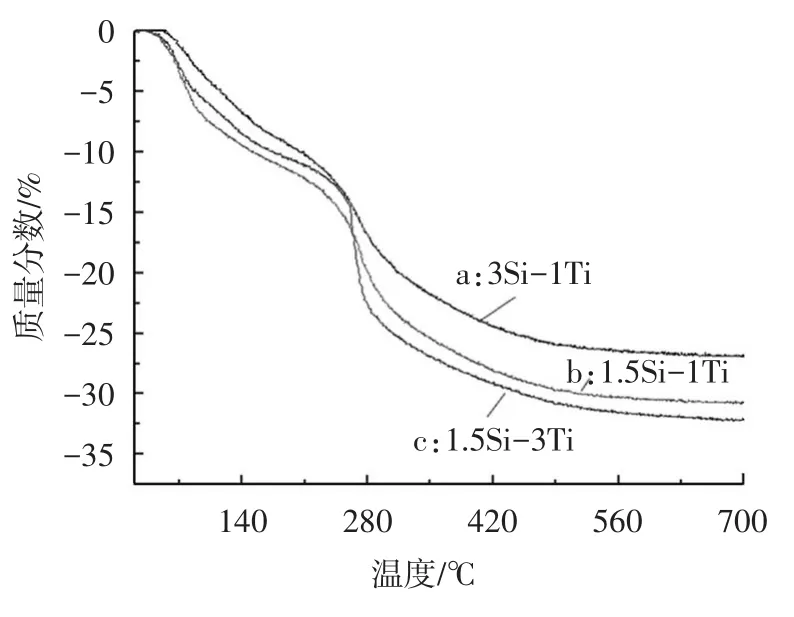
图7 不同硅钛比的SiO2/TiO2复合气凝胶样品的热重曲线
由图7可得具有不同硅钛比的气凝胶样品具有相似的失重温度,而失重的总量随硅含量的增加而逐渐减少.图7中曲线a、b、c气凝胶的失重总量分别为26.02%、29.78%和30.94%.第一个失重阶段发生在40~100℃,归因于物理吸附在纳米颗粒表面的有机物和水分的流失.失重的第二个阶段发生在100~250℃,主要是由吸附的孔道中吸附的有机物和水分的流失所引起.失重第三阶段发生在270~500℃,可以认为是由孔道及粒子表面的羟基及有机物的分解造成的.由于纳米孔道中的毛细管作用力以及溶剂分子,Si—OH和Ti—OH之间的氢键作用,溶剂的挥发温度要高于本身的沸点.不同样品相似的失重温度表明不同硅钛比的气凝胶具有相同种类的混合物,而不同的失重量则表明不同硅钛比的气凝胶样品具有不同的有机物、水分及羟基含量,这一结果与气凝胶微观结构的不同,特别是气凝胶孔隙大小、密度以及结晶度的不同有关.热重曲线结果表明,随着SiO2含量的增加,挥发性物质逐渐减少,暗示了硅含量高的SiO2/TiO2复合气凝胶具有相对高的比表面积和更小的孔道结构.
图8分别为SiO2/TiO2复合气凝胶的N2吸脱附等温线和孔径分布图.图8中吸附等温线均为IV型,属于典型的介孔吸附等温线,这说明不同硅钛比的气凝胶内部都含有介孔结构和大孔结构的共存,这一结果与超临界干燥法所制备的SiO2/TiO2复合气凝胶的十分相似.
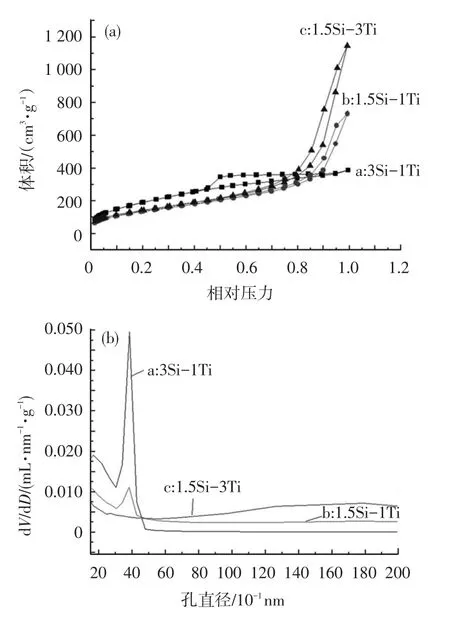
图8 不同硅钛比的SiO2/TiO2复合气凝胶样品的N2吸附-解吸等温线(a)及孔径分布图(b)
当硅钛比为3∶1、1.5∶1、1.5∶3时,3个样品的比表面积分别为712.2,501.3和524.1 m2/g,相应的平均孔径分别为3.36,9.42和13.53 nm.该结果证明本法能够有效降低湿凝胶中液体表面张力以及颗粒与液体之间的界面张力作用,可以实现常压下制备高比表面积和孔体积的SiO2/TiO2复合气凝胶.SiO2含量越高,形成的骨架越密实稳定,使得复合气凝胶的高双连续孔道结构在N2吸脱附过程中得以保存,因而测得的比表面积也越大.3个样品的孔径分布图说明了不同硅钛比的气凝胶是以介孔为主,同时含有部分微孔及大孔的多层次孔结构材料,有利于气凝胶吸附性能的提高.
3 结论
采用本文方法制备的SiO2/TiO2复合气凝胶具有Ti—O—Ti、Si—O—Si和Ti—O—Si结构.其中,SiO2起到网络骨架作用,钛颗粒均匀附着在硅骨架上.这种复合结构使SiO2/TiO2复合气凝胶具有更大比表面积、更高的热稳定性和网络结构强度.硅含量直接影响凝胶的空间网络结构.当硅钛摩尔比为1.5∶1时,形成具有均匀双连续孔道结构、网络强度好的复合气凝胶.随Si含量的增加,TiO2晶粒尺寸明显减小,TiO2结晶度不断降低,SiO2/TiO2复合气凝胶的比表面积大幅增加,平均孔径减小.SiO2/TiO2复合气凝胶的结构发生变化,实质上是分相与溶胶凝胶转变过程间相互竞争的结果.只有分相与溶胶凝胶过程平行发生,双连续孔道结构才得以固化,含有溶剂较多的相在干燥过程中因溶剂相挥发而形成连续孔洞.
参考文献:
[1] ABRAMIAN L,EL⁃RASSY H.Adsorption kinetics and thermodynamics of azo⁃dye orange II onto highly porous titania aerogel[J].Chem Eng J,2009,150(2/3):403-410.
[2] 毋伟,陈建峰,李永生,等.溶胶-凝胶法纳米二氧化硅原位改性研究[J].材料科学与工艺,2005,13 (1):41-44.WU Wei,CHEN Jianfeng,LI Yongsheng,et al.Study on in situ modification of nanometer silicon bioxide by sol⁃gel[J].Materials Science and Technology,2005,13(1):41-44.
[3] 李明愉,曾庆轩,张慧君,等.溶胶-凝胶法制备多孔纳米金属铜膜[J].材料科学与工艺,2014,22 (1):82-87.LI Mingyu,ZENG Qingxuan,ZHANG Huijun,et al.Preparation of nanoporous Cu films by sol⁃gel and template method[J].Materials Science and Technology,2014,22(1):82-87.
[4] BHAGAT S D,KIM Y H,MOON M,et al.A cost⁃effective and fast synthesis of nanoporous SiO2aerogel powders using water⁃glass via ambient pressure drying route[J].Solid State Sci,2007,9(7):628-635.
[5] 卢斌,胡科,刘琪,等.混合前驱体常压干燥制备SiO2气凝胶及其性能研究[J].硅酸盐通报,2013,32(7):1443-1448.LU Bin,HU Ke,LIU Qi,et al.Synthesis and properties of SiO2aerogel by co⁃precursor and ambient pressure drying process[J].Bulletin of the Chinese Ceramic Society,2013,32(7):1443-1448.
[6] ZHANG A,HU Q.Adsorption of cesium and some typical coexistent elements onto a modified macroporous silica⁃based supramolecular recognition material[J].Chemical Engineering Journal,2010,159(1-3):58-66.
[7] NAKANISHI K,NAGAKANE T,SOGA N.Designing double pore structure in alkoxy⁃derived silica incorporated with nonionic surfactant[J].Journal of Porous Materials,1998,5(2):103-110.
[8] NAKANISHI K,KOBAYSHI Y,AMATANI T,et al.Spontaneous formation of hierarchical macro⁃mesoporous ethane⁃silica monolith[J].Chemistry of Materials,2004,16(19):3652-3658.
[9] SATO Y,NAKANISHI K,HIRAO K,et al.Formation of ordered macropores and templated nanopores in silica sol⁃gel system Incorporated with EO⁃PO⁃EO triblock copplymer[J].Colloids and Surfaces a⁃Physicochemical and Engineering Aspects,2001,187-188(2001):117-122.
[10]LUO L,COOPER A T,FAN M.Preparation and application of nanoglued binary titania⁃silica aerogel [J].J Hazard Mater,2009,161(1):175-182.
[11]CAO S,YEUNG K L,YUE P L.An investigation of trichloroethylene photocatalytic oxidation on meso⁃porous titania⁃silica aerogel catalysts[J].Appl Catal B:Environ,2007,76(1/2):64-72.
[12]LIU M,GAN L,PANG Y,et al.Synthesis of titania⁃silica aerogel⁃like microspheres by a water⁃in⁃oil emulsion method via ambient pressure drying and their photocatalytic properties[J].Colloids Surf A:Physicochem Eng Aspects,2008,317(1-3):490- 495.
[13]BODAY D J,KENG P Y,MURIITHI B,et al.Mechanically reinforced silica aerogel nanocomposites via surface initiated atom transfer radical polymeriza⁃tions[J].Journal of Materials Chemistry,2010,20 (33):6863-6865.
[14]GURAV J,RAO A,NADARGI D,et al.Ambient Pressure dried TEOS⁃based silica aerogels:good absorbents of organic liquids[J].Journal of Materials Science,2010,45(2):503-510.
[15]KWON Y G,CHOI S Y.Ambient⁃dried silica aerogel doped with TiO2powder for thermal insulation[J].Journal of Materials Science,2000,35(24):6075-6079.
[16]陈和生,孙振亚,邵景昌.八种不同来源二氧化硅的红外光谱特征研究[J].硅酸盐通报,2011,30(4):934-937.CHEN Hesheng,SUN Zhenya,SHAO Jingchang.Investigation on FT⁃IR spectroscopy for eight different sources of SiO2[J].Bulletin of the Chinese Ceramic Society,2011,30(4):934-937.
[17]GAO X T,WACHS I E.Titania⁃silica as catalysts:Molecular structural characteristics and physico⁃chemical properties[J].Catalysis Today,1999,51 (2):233-254.
[18]冷小威,刘敬肖,史非,等.TiO2/SiO2复合气凝胶:常压干燥制备及性能表征[J].无机化学学报,2009,25(10):1791-1796.LENG Xiaowei,LIU JingXiao,SHI Fei,et al.TiO2-SiO2composite aerogel:preparation by ambient pressure drying process and characterization[J].Chinese Journal of inorganic Chemistry,2009,25 (10):1791-1796.
(编辑 吕雪梅)
Synthesis and pore structure of porous SiO2/TiO2composite aerogel
FU Yingyi1,DING Xingeng1,MENG Cheng1,DOU Tianjun2,YANG Hui1
(1.Department of Materials Science and Engineering,Zhejiang University,Hangzhou 310027,China;2.China Academy of Engineering Physics,Mianyang 621900,China)
Abstract:In order to prepare SiO2/TiO2composite aerogels with high specific surface area and multi⁃level pore structure under ambient pressure drying,the porous SiO2/TiO2gel was synthesized via sol⁃gel process with phase separation using TEOS and TnBT as raw materials.Using the solvent replacement technique,SiO2/TiO2aerogels were prepared via a drying process at ambient pressure.The effects of silicon titanium content on microstructure were investigated.The as⁃prepared SiO2/TiO2aerogel is a composite mesoporous solid bulk formed by dispersed nano⁃SiO2and TiO2particles Ti—O—Ti bonds,Si—O—Si bonds and Ti—O—Si bonds are intertwined in this SiO2/TiO2aerogel,which make composite aerogels have smaller crystal size,higher specific surface area and better thermal stability.Structure change of the composite aerogel is the result of competition between split phase process and sol⁃gel process essentially.Proper silicon content can refine the structure TiO2/SiO2composite aerogels dramatically.The prepared SiO2/TiO2aerogels with a mole ratio n(Ti)∶n(Si)=3∶1,have high specific surface area of 712.2 m2/g and small pore diameter of 3.36 nm.When mole ratio n(Ti)∶n(Si)=1.5∶1,the prepared SiO2/TiO2aerogels not only have double continuous channel structure,high specific surface area,but also clear pore structure.
Keywords:drying process at ambient pressure;SiO2/TiO2composite aerogel;mole ratio n(Ti)∶n(Si);microstructure;sol⁃gel;phase⁃separation
通信作者:丁新更,E⁃mail:msedxg@zju.edu.cn.
作者简介:傅颖怡(1989—)女,硕士研究生;丁新更(1977—),女,副教授,博士生导师;杨 辉(1962—)男,教授,博士生导师.
收稿日期:2014-05-26.
doi:10.11951/j.issn.1005-0299.20150201
中图分类号:O648
文献标志码:A
文章编号:1005-0299(2015)02-001-07
