不锈钢在熔融NaCl中的电化学-化学-稀释模型
2015-03-15王军伟王智平李文生董洪峰
路 阳,成 波,王军伟,王智平,3,李文生,董洪峰
(1.兰州理工大学材料科学与工程学院,兰州730050;2.省部共建有色金属先进加工与再利用
国家重点实验室(兰州理工大学),兰州730050;3.甘肃省有色金属及复合材料工程研究中心,兰州730050)
不锈钢在熔融NaCl中的电化学-化学-稀释模型
路 阳1,2,成 波1,王军伟1,王智平1,2,3,李文生1,2,董洪峰1
(1.兰州理工大学材料科学与工程学院,兰州730050;2.省部共建有色金属先进加工与再利用
国家重点实验室(兰州理工大学),兰州730050;3.甘肃省有色金属及复合材料工程研究中心,兰州730050)
摘 要:为分析不锈钢在熔融NaCl中的腐蚀机制,通过850℃熔融NaCl完全浸没实验,测量了168 h内3种不锈钢的腐蚀动力学曲线,借助SEM、EPMA、EDS等设备表征了试样横截面形貌、元素分布等特征,研究了Ti元素对合金耐蚀性影响机制,采用X射线衍射仪检测了腐蚀24 h后熔融盐成分和168 h后试样表面成分,建立了电化学-化学-稀释联合作用腐蚀模型.结果表明:在熔融NaCl腐蚀介质中,金属材料作为阳极被溶解,吸附氧得到电子变成O2-作为阴极;金属阳离子与O2-在熔融NaCl中发生化学反应,生成易挥发性氯化物逃逸系统;熔融盐作为传质媒介,稀释腐蚀层区域的腐蚀产物浓度,提高腐蚀速度.合金中电极电位最负的微量组元优先溶解后形成微小孔隙,增大了微阳极表面积,加速腐蚀反应过程.
关键词:腐蚀;高温;熔融盐;NaCl;不锈钢
无机盐高温相变储热装置可以延长太阳能热发电装置在阳光辐射不足时候的工作稳定性[1-2].将无机盐封装在储热腔中,阳光辐射充足时,无机盐熔化,将富裕热量储存,阳光不足时,熔化的无机盐凝固,释放结晶潜热,为设备补充热量[3].NaCl同其他无机盐高温相变储热介质一样,不仅储热密度大,液-固相变吸放热过程中温度恒定,而且无毒性、成本低廉,作为高温储热介质熔化温度合适,所以更适合作为碟式斯特林发动机高温相变储热介质规模化应用[4-5].但是,大量关于NaCl腐蚀性的研究表明,它对结构材料具有强烈腐蚀性[6-7].
目前,关于NaCl腐蚀性的研究主要针对2种腐蚀情况:第1种是针对船舶、海水泵、海上采油平台等设备,腐蚀介质是NaCl水溶液,腐蚀机理是原电池模型,即金属为阳极,溶解在海水中氧气发生氧去极化电化学腐蚀[8-9];第2种情况是关于NaCl混合盐热腐蚀的研究[10],在近海工作的发动机燃烧室内壁往往沉积一层含NaCl的混合无机盐膜,该盐膜以Na2SO4、NaVO3、Na2CO3等含氧酸盐为主要成分[11-14].发动机工作时,盐膜熔化,含氧酸盐分解的酸基和碱基成分,燃烧内壁的金属氧化物保护膜发生酸性溶解或碱性溶解,重新生成无保护性的金属氧化物,加速金属氧化腐蚀过程[15-16].该腐蚀机理即目前被广泛接受的熔盐模型,或称作溶解/再沉积模型[17-18].
但是,本文所述NaCl储热介质对储热腔材料腐蚀条件与以上2种情况均不相同.首先,腐蚀成分差异很大,本研究只针对850℃纯熔融NaCl;其次,与第1种腐蚀情况相比,腐蚀温度不同,本文所述是在熔融NaCl介质中,腐蚀温度在801℃以上;再次,与第2种腐蚀情况相比,腐蚀系统不同,本研究是大量熔融盐完全浸没储热腔材料,不仅熔融盐中氧含量较低,钝化膜难以形成,并且流动性很强的熔融盐可能将促进腐蚀产物的传质过程.
因此,在NaCl水溶液中原电池腐蚀机理和热腐蚀中的熔盐机理模型并不完全适用本研究所述腐蚀情况.本文基于3种不锈钢完全浸没在850℃熔融NaCl中的腐蚀实验研究,分析其腐蚀机理,提出合金在NaCl熔融盐介质中的电化学-化学-稀释联合作用腐蚀模型,为设计盛装熔融NaCl高温相变储热介质腐蚀的容器材料提供理论依据.
1 实验
1.1 实验过程
实验采用3种市售冷轧不锈钢板,实测化学成分见表1.其使用态为退火态,退火工艺如下:加热至1 050~1 150℃后,适当保温一段时间,迅速冷却至350℃以下,要求退火速度达到55℃/s.将退火处理后的试样切割成10 mm×10 mm× 5 mm,分别采用240、320、400和600碳化硅砂纸磨光,再用1 μm的氧化铝抛光后用去离子水和酒精清洗,烘干,测量表面积并称重后备用.将分析纯NaCl置于3只50 mL氧化铝坩埚中,在干燥箱中500℃温度下烘烤2 h,最大程度地去除盐和坩埚中的水分,然后置于箱式马弗炉中以5℃/min升温速度加热至850℃,NaCl熔化后将3种材料不锈钢试样分别放入3只坩埚中,每个坩埚中放3块.熔融NaCl完全浸没试样,关闭炉门并密封,开始850℃恒温腐蚀实验.

表1 实验所用不锈钢的实测化学成分(质量分数/%)
腐蚀24 h后,拿出3只坩埚并取出试样,分别留存部分腐蚀后的熔融盐,采用XRD分析其成分,倒掉其余腐蚀残液,再重新装入烘干的分析纯NaCl加热熔化.空冷到室温的试样在去离子水和酒精中分别超声清洗30 min,去除表面残余盐分和腐蚀产物.试样烘干后采用精度为0.1 mg的电子天平称重,使用游标卡尺测得每个试样尺寸,计算平均质量损失率.然后放回盛有熔融NaCl的坩埚中,进行第2次腐蚀过程.
如上过程重复7次,即腐蚀时间共168 h.采用XRD测得凝固后腐蚀残液和腐蚀后试样表面成分物相;用碳化硅砂纸磨出试样横截面并抛光后,采用带有能谱分析(EDS)的扫描电子显微镜(SEM)、电子探针显微镜(EPMA1600)分析试样腐蚀横截面形貌、元素变化特征.
1.2 实验结果
168 h内,3种试样的腐蚀动力学曲线如图1所示,它们均近似呈现线性规律.拟合直线的斜率分别表示为ki,i为试样号,k1>k3>k2,斜率越大,腐蚀速率越大.
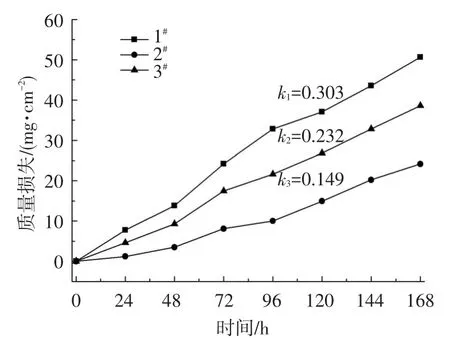
图1 3种试样在850℃NaCl中的腐蚀动力学曲线
试样表面腐蚀层产物XRD谱图如图2所示,分析表明:3种试样表面成分相似,主要是Fe、Fe-Cr、(Fe,Ni)和Ni-Cr-Fe,及少量Fe0.64Ni0.36和Cr0.19Fe0.7Ni0.11.
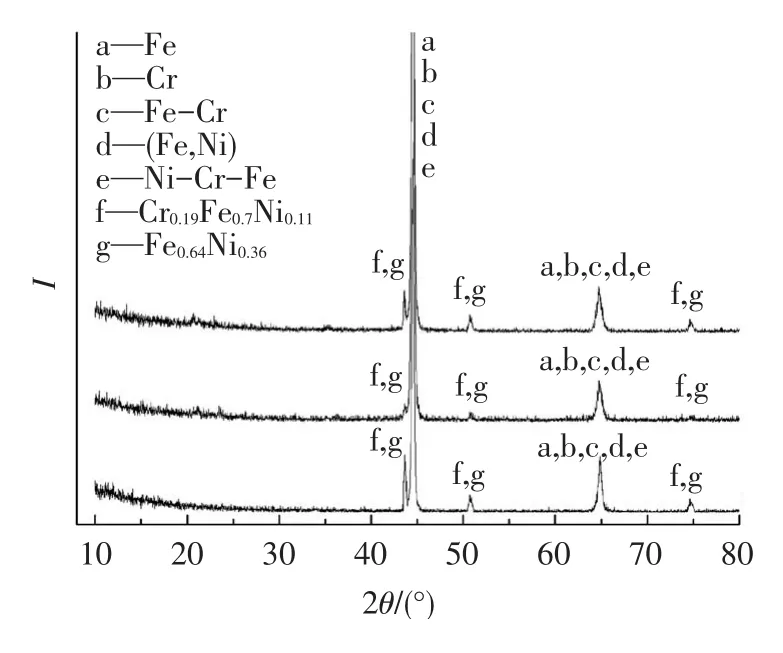
图2 24 h后3种试样表面腐蚀产物的XRD谱图
腐蚀24 h后,3种试样所在熔融盐中均有少量黑棕色渣滓,其成分的XRD分析结果如图3所示,除3#试样所在熔融盐中检测出微量TiO2外,其余2种试样所在熔融盐中除NaCl外并没有明显检测出其他物质.

图3 24 h后3种试样所在熔融NaCl的XRD谱图
腐蚀168 h后,试样横截面EPMA成分分析表明,所有试样腐蚀层中Cr元素均严重降低,而Fe和Ni元素含量未降低,所以,Cr的贫化是造成试样在熔融NaCl中质量减小的主要因素.图4(a)和(b)所示分别为1#和3#试样的横截面背散射电子照片和主要元素变化趋势.试样腐蚀层附近的横截面均可分为3个区域,Ⅰ区、Ⅱ区和Ⅲ区.Ⅰ区为合金基体,Fe、Cr、Ni等主要元素含量与空白样相同,组织致密;Ⅲ区为腐蚀层,与Ⅰ区相比,组织疏松,Cr元素严重贫化,并且在整个区域内,其质量分数始终保持很低水平.在Ⅰ区和Ⅲ区之间是扩散层Ⅱ区,Cr的质量分数由Ⅰ区基体含量逐渐下降为Ⅲ区较低含量,如图中虚线箭头所示.

图4 熔融NaCl中腐蚀168 h后试样1#和3#的横截面照片和元素变化趋势
图5所示是未采用蒸馏水和酒精清洗的3#试样腐蚀层横截面的EDS元素分布照片.从图5看到,腐蚀层合金中主要是Fe和Ni元素.在腐蚀层缝隙中,富集大量的Cr、Na和Cl元素.由于试样浸没在熔融NaCl中腐蚀,并根据Na和Cl元素分布形态,推测腐蚀过程中熔融NaCl渗进了试样腐蚀层.
另外,3#试样除添加有质量分数0.9%的Ti元素外,其余元素含量与2#试样相似.但从图1看到,3#试样腐蚀动力学曲线斜率比2#试样大,即3#试样比2#试样耐蚀性差.并且从图3所示的熔融残盐成分分析结果发现,腐蚀24 h后,3#试样所在熔融盐中检测到了微量TiO2.此外,2#试样和3#试样被腐蚀168 h后的横截面SEM照片分别如图6(a)和(b)所示,2#试样腐蚀层厚度约150 μm,表现出晶间腐蚀特征;3#试样腐蚀层超过200 μm,大量联通的小孔洞将合金基体分割成众多小块.所以推测,除Cr之外,Ti从合金基体也迁移至熔融盐中,在合金基体中留下孔隙,熔融渗入孔隙加剧腐蚀过程.

图5 3#试样腐蚀层横截面的EDS照片

图6 熔融NaCl中腐蚀168 h后2#试样和3#试样的横截面SEM照片
2 分析与讨论
从图1看到,在168 h腐蚀时间内,所有试样的腐蚀动力学曲线均严格满足直线规律.由于熔融NaCl是强电介质,合金表面电化学不均匀会导致形成众多微电池,所以必然存在电化学腐蚀过程[14].晶界上原子排列比较疏松、紊乱,相比晶粒内而言电极电位更负,易于形成微电池阳极而优先被腐蚀,所以图4(a)中表现出晶界被明显腐蚀的特征.具体而言,合金中的金属元素M(M代表Cr、Fe、Ni等金属元素)失去n个电子,发生如下阳极反应:
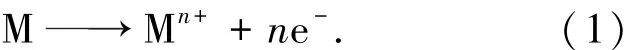
尽管氧气在熔融盐中的溶解度很小[19],但熔融NaCl上表面直接与高温空气接触,高温气氛中的氧分子与熔融盐表面碰撞时仍然可以吸附在熔融盐表面,并分解为吸附氧[10]:

吸附氧在高温熔融盐中扩散到合金表面附近后获取电子变成电化学吸附:
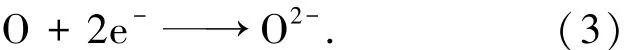
式(1)和式(3)分别作为阳极反应和阴极反应构成微电池,生成O2-.在试样表面发生反应

在熔融NaCl中不能稳定存在的金属氧化物M2On发生如下反应,生成易挥发性氯化物MCln逃逸系统[16]:
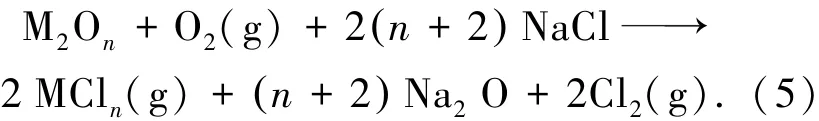
所以,生成的CrCl3将以气体形态逃逸腐蚀系统.另外,可能CrCl3在熔融NaCl中的溶解度很低,所以在腐蚀后的残液中并没有检测到CrCl3.生成的Cl2部分溶解在NaCl熔融盐中,与Na2O继续发生如下反应[6]:

部分Cl2逃逸熔融盐进入大气.实验过程中也确实产生了强烈的刺激性气味.参考标准电极电位值,Cr电极电位(-0.913 V)比Fe(-0.44 V)和Ni(-0.25 V)的更负,它优先替代式(1)中的M,首先被腐蚀,所以该实验的所有试样的区均表现出贫Cr现象,如图3所示.
将式(5)和式(6)相加得到

氧气尽管参加了式(5)和式(6)的反应,但从式(7)看到,它并没有损耗,而被认为是化学反应(5)和(6)的催化剂.因此,虽然氧气在熔融NaCl中的溶解度很小,但这2个化学反应可以进行.
由于TiO2性质稳定,M2On被TiO2代替时,式(5)未能发生或反应不完全[10],所以腐蚀后的熔融盐残液中检测到微量TiO2腐蚀产物.
该腐蚀过程主要由上面的式(1)和式(3)~(6)组成,其中式(1)和式(3)属电化学过程,式(4)~(6)属于化学反应.基于该机理,建立图7所示模型.

图7 电化学-化学-稀释联合作用腐蚀模型
模型中,Ⅰ区、Ⅱ区和Ⅲ区定义与前文相同,分别为合金基体区、扩散层和腐蚀层.熔融NaCl充斥在Ⅲ区间隙中.化学及电化学反应过程如图中虚线箭头所示.在Ⅱ区的合金/熔盐界面上发生式(1)所示阳极反应,并且金属原子M从基体侧向界面附近扩散,所以Ⅱ区的金属原子M (Fe-Cr-Ni合金中主要是Cr原子)浓度从合金侧向腐蚀层方向逐渐降低,而Mn+在Ⅲ区富集.
电子向Ⅲ区转移过程中被该区的吸附氧捕获,发生式(3)所示阴极反应,产生O2-.由于Ⅲ区Mn+和O2-浓度较高,所以化学反应式(4)~式(6)也相继在该区域进行.导致该区将产生大量孔隙,组织逐渐变得疏松,如图4和图6所示.在这些孔隙中,MCln、Na2O等腐蚀产物浓度逐渐升高,化学反应(5)和(6)的速度可能将降低.高温NaCl熔融盐作为传质媒介,通过自然对流过程和稀释作用,如图中细实线箭头所示,为腐蚀介质从Ⅲ区向熔融盐传输提供了连续的盐路通道,如图7中粗实线箭头所示,促进式(5)和式(6)化学反应向正方向进行,加速腐蚀过程,所以,该模型被称作电化学-化学-稀释联合腐蚀模型.
合金中添加微量Ti元素后,在腐蚀层中产生大量微小孔隙,增加了微阳极表面积,促进了合金在熔融NaCl中的腐蚀过程,腐蚀层厚度增加.如图5(b)所示.参考Ti的标准平衡电极电位,其值(-1.63 V)远比Cr的值负.所以推测,当合金中存在微量的电极电位更负的组元A时,反应式(1)中M被A代替优先发生阳极溶解.但是A含量较低,该反应程度较弱,处于次级地位;M仍主要被电极电位比A略高的其它主要合金元素代替,占据阳极溶解主导地位(3#试样中Ti的阳极溶解为次级地位,Cr的阳极溶解处于主导地位).不过,虽然A的阳极溶解程处于次级地位,但由于该过程优先发生,在扩散层(zone Π)产生大量微小孔隙,熔融NaCl通过毛细作用渗透进入微孔,增大了熔融盐与合金接触面积,相当于增大了微阳极面积,促进阳极溶解过程,如图8所示.所以,电极电位更负的微量组元A的添加对合金在熔融NaCl中的腐蚀起到“开路先锋”的作用.
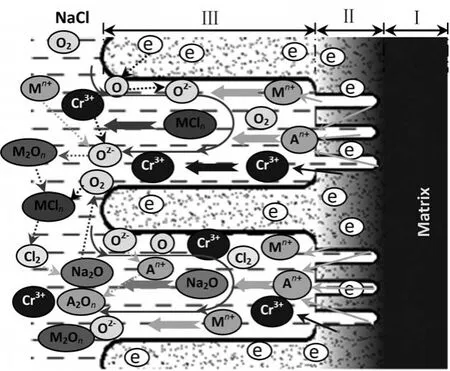
图8 含有微量元素A的电化学-化学-稀释联合作用腐蚀模型
3 结论
1)本文所研究不锈钢在熔融NaCl中的腐蚀包括电化学过程、化学反应过程和熔融盐稀释作用过程;合金因阳极溶解而被腐蚀,生成的金属阳离子以非稳定金属氯化物形式逃逸系统;溶解在熔融盐中的氧作为化学反应环节的催化剂;熔融盐稀释了腐蚀层中的腐蚀产物浓度,加速腐蚀过程.
2)在熔融NaCl介质中,合金内电极电位更负的微量组元优先发生阳极溶解(如合金中添加的Ti元素),熔融盐通过毛细作用渗入孔隙,合金与熔融盐接触面积增加,进一步促进金属的阳极溶解过程.
3)在NaCl储热介质容器材料设计中,应当避免添加Cr元素.同时,应当尽量减小材料不同组元之间的电位差,抑制电化学-化学-稀释联合作用腐蚀过程.
参考文献:
[1] ROEB M,SÄCK J P,RIETBROCK P,et al.Test operaten of a 100 kW pilot plant for solar hydrogen production from water on a solar tower[J].Solar Energy,2010,85(4):634-644.
[2] XU Ershu,YU Qiang,WANG Zhifeng,et al.Modeling and simulation of 1 MW DAHAN solar thermal power tower plant[J].Renewable Energy,2011,36(2):848-857.
[3] GIL A,MEDRANO M,MARTORELL I,et al.State of the art on high temperature thermal energy storage for power generaten.Part 1:Concepts,materials and modellization[J].Renewable and Sustainable Energy Reviews,2010,14(1):31-55.
[4] HOSHI A,MILLS D R,BITTAR A,et al.Screening of high melting point phase change materials(PCM)in solar thermal concentrating technology based on CLFR[J].Solar Energy,2005,79(3):332-339.
[5] KENISARIN M M.High⁃temperature phase change materials for thermal energy storage[J].Renewable and Sustainable Energy Reviews,2010,14(3):955-970.
[6] CUI Chongwei,HUANG Junli,XIU Jing.Study on metal corrosion caused by chlorine dioxide of various purities[J].Journal of Harbin Institute of Technology,2004,11(6):593-596.
[7] 孙兆栋,杜敏,张静,等.316不锈钢在海水中的阴极极化行为研究[J].材料科学与工艺,2011,19 (1):36-40.SUN Zhaodong,DU Min,ZHANG Jing,et al.The cathodic polarization behavior of 316L stainless steel in seawater[J].Materials Science&Technology,2011,19(1):36-40.
[8] ZHAN Jun,CHEN Guiming,LIU Xiaofang,et al. Corrosion mechanism of HVOF silicate glass coating in 5%NaCl solution[J].Journal of Harbin Institute of Technology,2010,17(2):264-268.
[9] 魏宝明.金属腐蚀理论及应用[M].北京:化学工业出版社,2004,192-193.
[10]朱日彰,何业东,齐慧滨.高温腐蚀及耐高温腐蚀材料[M].上海:上海科学技术出版社,1995:192-193.
[11]赵双群,谢锡善.新型Ni-Cr-Co基高温合金的热腐蚀行为[J].材料科学与工艺,2006,14(5):506-509.ZHAO Shuangqun,XIE Xishan.Hot corrosion behaviors of new Ni-Cr-Co base superalloy[J].Materials Science&Technology,2006,14(5):506-509.
[12]LEI Zheng,ZHANG Maicang,DONG Jianxin.Hot corrosion behavior of powder metallurgy rene95 nickel⁃based superalloy in molten NaCl-Na2SO4salts[J].Materials and Design,2010,32(4):1981-1989.
[13]LEE K N,SHORES D A,Transport consideratens in the hot corrosion of Ni by molten alkali carbonates [J].Journal of Electrochem Science,1990,137(3):859-871.
[14]ESPINOSA⁃MEDINA M A,CARBAJAL⁃DELA T G,LIU H B,et al.Hot corrosion behaviour of Fe-Al based intermetallic in molten NaVO3salt[J].Corrosion Science,2009,51(6):1420-1427.
[15]RAPP R A.Chemistry and electrochemistry of the hot corrosion of metals[J].National Association of Corrosion Engineers,2002,44(6):209-221.
[16]MOHANTY B P,SHORES D A.Role of chlorides in hot corrosion of a cast Fe-Cr-Ni alloy.part I:experimental studies[J].Corrosion Science,2004,46(12):2893-2907.
[17]RAPP R A.Hot corrosion of materials:a fluxing mechanism[J].Corrosion Science,2002,44(6):209-221.
[18]HAN Chao,LIU Yong,WANG Yan,et al.Hot corrosion behavior of Ni-xCr-6.8Al based alloys[J].Transactions of Nonferrous Metals Society of China,2011,21(11):2348-2357.
[19]张允书.热腐蚀的熔盐机理及其局限性[J].中国腐蚀与防护学报,1992,12(1):1-9.ZHANG Yunshu.Molten salt hot corrosion mechanism and its limitations[J].Journal of Chinese Society of Corrosion and Protection,1992,12(1):1-9.
(编辑 程利冬)
Electrochemical⁃chemical⁃dilution corrosion model of stainless steel in molten NaCl
LU Yang1,2,CHENG Bo1,WANG Junwei1,WANG Zhiping1,2,3,LI Wensheng1,2,DONG Hongfeng1
(1.College of Materials Science and Engineering,Lanzhou University of Technology,Lanzhou 730050,China;2.State Key Laboratory of Advanced Processing and Recycling of Non⁃ferrous Metals(Lanzhou University of Technology),Lanzhou 730050,China;3.Research Center of Gansu Non⁃ferrous Metal Materials and Composite Materials Engineering,Lanzhou 730050,China)
Abstract:To analyze the corrosion mechanism of stainless steel in molten NaCl,corrosion kinetic curves of three kinds of stainless steel specimens were measured,the specimens were submerged in 850℃molten NaCl for 168 h.Elements mass fraction and cross⁃section morphology were detected by scanning electron microscopy (SEM),X⁃ray energy dispersive spectrometry(EDS)and electron probe micro⁃analyzer(EPMA).The composition of residual salt after being corroded for 24 h and the corrosion products on specimen surfaces for 168 h were detected by X⁃ray diffraction(XRD).Corrosion behavior was analyzed,and the effects of Ti on corrosion resistance were presented.Finally,a new coactions corrosion model of electrochemical⁃chemical⁃dilution was built.The result showed that,in molten NaCl,adsorbed oxygen changes into O2-and acts as cathode,alloy dissolves and acts as anode.Volatile metal chloride produces during the reaction between metal cations and O2-in molten NaCl and then escapes from corrosion system.What′s more,corrosion products are diluted by the medium of molten salt in corrosion layer,therefore,corrosion rate increases.Moreover,in the alloy,after the preferentially dissolution of very tiny amounts of Ti into molten salt,many small pores form and the micro⁃anode surface area is increased,which speeds up the corrosion rate.
Keywords:corrosion;high temperature;molten salt;NaCl;stainless steel
通信作者:成 波,E⁃mail:chengbo_o@126.com.
作者简介:路 阳(1957—),女,教授,博士生导师.
基金项目:甘肃省科技重大专项计划资助项目(01ZSB117).
收稿日期:2014-04-09.
doi:10.11951/j.issn.1005-0299.20150213
中图分类号:TG174
文献标志码:A
文章编号:1005-0299(2015)02-0075-06
