肝转移瘤血供对肝动脉灌注化疗栓塞近期疗效的影响
2015-03-14武中林刘玉芝吴勇超王光大李顺宗
武中林,刘玉芝,吴勇超,王光大,刘 亮,李顺宗*
(1.河北医科大学第四医院放射科,河北 石家庄050011;2.石家庄铁道大学电气与电子工程学院自动控制教研室,河北 石家庄050011)
肝脏是终末期恶性肿瘤常见的转移器官,是导致患者死亡的主要原因,人们正尝试多种治疗策略控制其发展或根治肝转移瘤(liver metastases,LM),延长患者生存期[1]。临床上有很多方法治疗LM[2-4],手术切除是主要治疗手段,但只有10%~20%的患者适宜手术治疗[5]。随着介入技术及器材的飞速发展,肝动脉灌注化疗栓塞(transcatheter arterial chemoembolization,TACE)在LM 治疗上日趋得到重视,并取得了较好的治疗效果[6-8]。TACE治疗LM的理论基础是LM由肝动脉供血,门静脉是否参与供血,目前还存在争议。因此,分析LM的血供来源及血供对TACE疗效的影响,对于LM患者的治疗具有重要的指导意义。现将本研究观察结果报告如下。
1 资料与方法
1.1 一般资料 选择2007年1月—2013年12月河北医科大学第四医院介入科收治的原发灶切除术后LM患者326例,男性197例,女性129例,年龄28~73岁,平均(61.5±2.3)岁。肿瘤原发部位:食管癌28例,贲门癌37例,胃癌44例,胰腺癌23例,结直肠癌101例,乳腺癌28例,肺癌41例,肾癌7例,膀胱癌5例,卵巢癌8例,宫颈癌4例。术后发现LM时间:3个月~6.5年。首次TACE术前所有患者均由CT、MRI或超声至少2种影像学检查诊断,卡氏功能状态评分>60分,肝功能均为Child-Pugh A和B级,证实无肝外其他部位转移。依据原发肿瘤病理类型结合患者一般情况、既往化疗病史及肝功能情况,于TACE术前确定两药或两药以上的标准化疗方案。
1.2 DSA造影及TACE治疗 患者平卧于数字减影血管造影(digital subtraction angiography,DSA)检查床上,右侧股动脉穿刺成功后,置换5F血管鞘,引入5F导管,将导管插至肝动脉(或变异肝动脉)及肠系膜上动脉造影,肝动脉造影图像采集包括动脉期、实质期,间接门静脉造影(肠系膜上动脉)图像采集尽可能延长。根据肝内病变情况行肝固有动脉或肝左、右动脉灌注化疗,如肝内病灶局限于肝脏某段时,利用同轴微导管技术行超选择。根据LM血供及肝功能情况,在透视监视下缓慢行肿瘤供血动脉化疗栓塞,栓塞剂为碘化油与化疗药物混合的乳剂,碘化油用量在3~25mL,平均6.7 mL,部分患者用自制明胶海绵碎末或明胶海绵颗粒加强栓塞。栓塞效果:复查造影肝内病灶染色消失、主干存在。
1.3 DSA造影结果分析 根据肿瘤的染色程度、血管多少及间接门静脉造影表现,由1名正主任医师、1名副主任医师及1名主治医师对首次DSA造影图像进行分析。
1.3.1 LM由肝动脉供血表现 肝动脉造影,动脉期可见肿瘤供血血管,实质期可见不同程度的肿瘤染色;门静脉不参与LM供血表现:肠系膜上动脉造影,无门静脉分支进入肿瘤内部,实质期肿瘤无染色,肿瘤密度低于周围正常肝组织密度,部分可见门静脉分支围绕肿瘤呈环形缺损。
1.3.2 LM血供分类 多血供型:肝动脉造影显示,肝动脉明显增粗,动脉期可见肿瘤供血血管,粗细不均,排列紊乱,实质期可见团块状、结节状或巨块状肿瘤染色,染色明显高于周围正常肝组织,部分LM由于中心坏死于实质期可见中心淡染的环形或囊状染色。中等血供型:肝动脉造影显示,肝动脉增粗或稍增粗,动脉期可见肿瘤供血血管,密集、纤细、排列紊乱呈网状,实质期可见稍高于周围正常肝组织的肿瘤染色或环形染色。少血供型:肝动脉造影显示,肝动脉稍增粗或正常,动脉期可见肿瘤供血血管,纤细、稀少、呈枯树枝状,实质期肿瘤染色较淡,在周围正常肝组织的衬托下形成大小不一的类圆形充盈缺损影,部分病例可见被肿瘤牵拉变直或呈弧形移位的肝动脉。
1.4 介入术后处理 术后常规给予保肝及水化治疗,对于部分患者继续给予介入术前拟定的化疗方案化疗。介入术后4~7d复查,恢复良好者出院。治疗间隔一般4~6周,对于肝内转移瘤碘油沉积良好者、肝肾功能较差者、体质量明显异常者,适当延长治疗间隔时间。
1.5 并发症及不良反应 TACE术后无严重介入治疗相关并发症,主要不良反应为恶心、呕吐及食欲下降等消化系统反应和轻度的骨髓抑制。栓塞后综合征,主要为发热、肝区不适或肝区疼痛等经对症处理后缓解。
1.6 疗效评定 介入术后4~6周复查肝脏CT和(或)MRI,认真评价肝内转移瘤数量、大小及范围的变化,与TACE术前CT和(或)MRI仔细对比,按照WHO实体瘤的疗效标准判断疗效。疗效分为:完全 缓 解 (complete response,CR)、部 分 缓 解(partial response,PR)、无变化(no change,NC)、进展(progressive disease,PD),CR+PR 计有效,NC+PD计无效。如LM疗效判断为CR、PR或NC则继续行TACE治疗,如LM疗效判断为PD则停止TACE治疗,更换其他治疗方案。
1.7 病例随访 以首次TACE治疗为起点,以患者死亡或随访时间截止为终点,主要通过电话方式进行随访,观察6、12个月的生存率,随访率100%。
1.8 统计学方法 应用SPSS13.0软件进行统计学分析。计数资料比较采用χ2检验;等级资料比较采用有序变量多组独立样本的秩和检验。P<0.05为差异有统计学意义。
2 结 果
2.1 血供来源及分类 LM血供来源于肝动脉,门静脉不参与供血。326例LM根据DSA造影表现分为多血供型83例,中等血供型69例,少血供型174例。
2.2 疗效比较 TACE治疗LM有效(CR+PR)171例,总有效率为52.45%(171/326);少血供型LM总有效率明显低于多血供型和中等血供型LM(Z=161.589,P<0.01),见表1。

表1 多血供、中等血供及少血供型肝转移瘤近期疗效比较Table 1 The short-term effect of rich blood type,median blood type and poor blood type(例数,%)
2.3 生存率比较 326例LM 6个月生存率为89.9%(293/326),12个月生存率为59.8%(195/326);多血供、中等血供及少血供型LM 6个月生存率分别为100%、100%、81.0%,12个月生存率分别为81.9%、66.7%、46.6%;少血供型LM 6、12个月生存率均明显低于多血供型和中等血供型LM(P<0.05)。见表2。
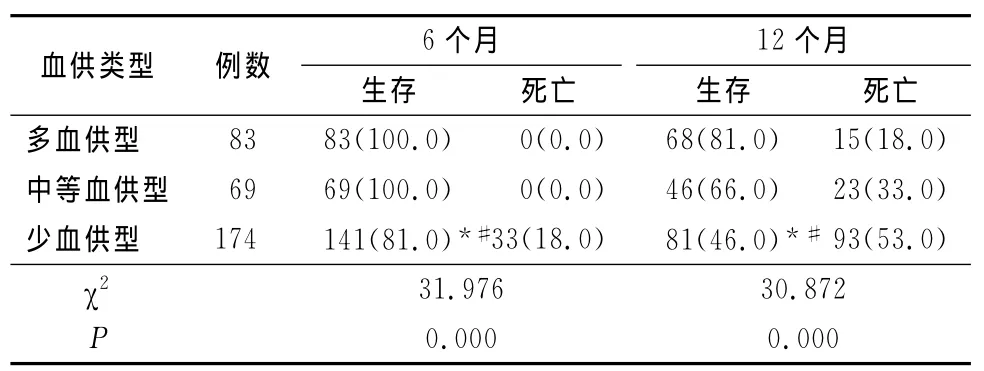
表2 多血供、中等血供及少血供型肝转移瘤6、12个月生存率比较Table 2 Survival rate of 6and 12months of lifetime in rich blood type,median blood type and poor blood type(例数,%)
3 讨 论
肝动脉参与LM血供已经得到了广泛共识,而门静脉是否参与供血,目前国内外学者尚存较多争议。有学者认为,LM不仅接受肝动脉供血也接受门静脉供血,以肝动脉供血为主,门静脉主要参与肿瘤边缘的供血[9-11]。但也有学者认为,LM完全由肝动脉供血,门静脉不参与供血[12-14]。研究LM血供的方法有很多,应用最多的是CT和MRI技术,CT和MRI可行三期动态扫描,在行门脉期或平衡期扫描时,肝动脉内仍然含有造影剂,因此无法准确分析LM的血供特征[12]。DSA可将导管直接超选入目标血管,在使用少量对比剂的情况下,即可获得清晰的血管显示和强化效果,并且不受全身血流动力学影响,成为研究判断肿瘤血供程度的理想手段[15-17]。本组326例LM肝动脉造影显示,动脉期可见肿瘤供血血管,实质期可见不同程度的肿瘤染色,肿瘤染色峰值时间在9.0s左右,排除了对比剂经循环进入门静脉的影响,说明肝动脉参与了LM的供血。陈赜等[15]、王煊等[16]应用 DSA对LM 进行造影,同样证实LM由肝动脉供血。本研究326例LM间接门静脉造影显示,无门静脉分支进入肿瘤内部,实质期肿瘤无染色,肿瘤密度明显低于周围正常肝组织密度,部分可见门静脉分支围绕肿瘤呈环形缺损,说明门静脉不参与LM的供血。李智岗等[12]用肠系膜上动脉插管进行单纯门静脉CT灌注成像,证实门静脉不参与LM的供血。本研究326例LM根据肿瘤的染色程度、血管多少分为多血供、中等血供及少血供型LM,与文献报道一致[15-17]。在增强CT或MRI中门静脉期LM为什么会出现环形强化,研究发现,LM在门静脉期的环形增强表现并非由肿瘤形成,而与瘤周的纤维基质有关,即肿瘤周边存在促结缔组织生成反应、炎症反应、血管增生和炎症细胞浸润或动静脉短路所致[18-19],从病理学方面否定了门静脉参与LM供血。近年来越来越多的研究显示,LM由肝动脉供血,门静脉不参与供血[6、8、12、15-17]。
LM的血供情况直接影响着患者的TACE治疗效果及预后[8,17]。本研究结果显示,少血供型LM总有效率明显低于多血供型和中等血供型LM(P<0.05),提示随着LM血供的减少,TACE治疗LM有效率也逐渐下降。本研究结果还显示,少血供型LM 6个月和12个月生存率均明显低于多血供型和中等血供型LM(P<0.05),提示随着LM血供的减少,TACE治疗LM生存率也逐渐下降。LM的血供情况决定着TACE治疗效果,随着LM血供的减少,TACE治疗LM的有效率和生存率也逐渐下降。笔者分析,LM血供越丰富,碘油沉积越多,肿瘤血管阻断越完全,由于携带大量化疗药物的碘油聚集在肿瘤内,使化疗药物在肿瘤内缓慢释放,达到持续杀灭肿瘤的作用,导致肿瘤组织坏死越多,疗效越好,生存率越高。由于LM的血供直接影响着TACE治疗效果,提示我们在介入治疗中应根据LM的血供类型选择不同的治疗方案,如DSA造影证实为多血供或中等血供型LM可行TACE治疗,甚至多次TACE治疗,介入术中尽量行肿瘤供血动脉化疗栓塞,尽可能多的注入碘化油乳剂,最后可用自制明胶海绵碎末或明胶海绵颗粒栓塞近端肿瘤供血血管,以期达到最大疗效;对于少血供型LM,由于碘化油在肿瘤内沉积较少,疗效差,应联合其他治疗方法。肿瘤的治疗已经进入了综合治疗时代,临床实践证明采用任何单一的治疗方法都常难以取得最佳的效果,综合治疗不是多种治疗方法的简单组合,是依据影响治疗效果因素而制定的一个有计划、有步骤、有顺序的个体化治疗集合体。
肝脏是恶性肿瘤最常见的转移器官之一,仅次于淋巴转移而居第二位。曹卫刚等[20]研究显示,LM手术组、TACE组和化疗组的生存时间比较差异有统计学意义,手术治疗LM最能够延长患者生存时间,其次是TACE、化疗。本研究结果显示,虽然TACE治疗少血供型LM有效率及生存率明显低于多血供及中等血供型LM,但能明显的延缓肿瘤进展,提高生存质量及延长生存期。
[1] 叶颖江,申占龙,王杉.转移性肝癌的治疗理念和策略[J/CD].中华普外科手术学杂志:电子版,2014,8(1):26-29.
[2] 任晔,戴卓捷,崔迪,等.陀螺刀治疗肝转移癌的近期疗效分析[J].临床荟萃,2012,27(16):1400-1402.
[3] 范晴敏,陆正华.肝转移癌的微创治疗[J/CD].中华临床医师杂志:电子版,2013,7(6):2635-2637.
[4] 牛洪欣,徐忠法.转移性肝癌的微创治疗策略[J].肝胆胰外科杂志,2014,26(3):258-261.
[5] Adam R,Hoti E,Bredt LC.Oncosurgical strategies for metastatic liver cancer[J].Cir Esp,2011,89(1):10-19.
[6] 李闯,张跃伟,刘影,等.明胶海绵微粒栓塞治疗肝转移癌[J].中国介入影像与治疗学,2014,11(5):259-262.
[7] de Baere T,Deschamps F.Arterial therapies of colorectal cancer metastases to the liver[J].Abdom Imaging,2011,36(6):661-670.
[8] 刘开林.经肝动脉介入治疗肝转移瘤的疗效影响因素[J].牡丹江医学院学报,2014,35(1):45-47.
[9] 周春泽,吕维富,张行明,等.选择性门静脉栓塞术联合肝动脉化疗栓塞术治疗肝转移癌的对照研究[J].介入放射学杂志,2012,21(5):384-390.
[10] 独建库,何伟华,邹洋,等.经肝动脉化疗栓塞术联合经皮肝穿门静脉大剂量热碘油栓塞治疗肝转移癌[J].介入放射学杂志,2014,23(2):115-117.
[11] Voboril R.Blood supply of metastatic liver tumors an experimental study[J].Int Surg,2005,90(2):71-77.
[12] 李智岗,时高峰,李顺宗,等.应用DSA、CT和经肠系膜上动脉门静脉灌注CT成像研究肝转移瘤的血液供应[J].中华放射学杂志,2008,42(9):949-953.
[13] Liu Y,Matsui O.Changes of intratumoral microvessels and blood perfusion during establishment of hepatic metastases in mice[J].Radiology,2007,243(2):386-395.
[14] Kitajima K,Kuwata Y,Hayashi M,et al.Ring enhancement on T1-weighted GRE images after ferucarbotran administration for hepatic metastasis:comparison with pathological findings:case report[J].Radiat Med,2005,23(1):75-79.
[15] 陈赜,张志勇,赵霄,等.269例肝转移瘤血管造影影像分析[J].吉林医学,2010,31(25):4360-4361.
[16] 王煊,黄加胜,陈卫.肝转移瘤169例的数字减影血管造影表现[J].山西医药杂志,2012,41(3):244-245.
[17] 李国文,梁赵玉,于小平,等,肝转移瘤血供对肝动脉化疗栓塞的近期疗效影响[J].介入放射学杂志,2010,19(6):493-496.
[18] Terayama N,Matsui O,Ueda K,et al.Peritumoral rim enhancement of liver metastasis:hemodynamics observed on single-level dynamic CT during hepatic arteriography and histopathologic correlation[J].J Comput Assist Tomogr,2002,26(6):975-980.
[19] Kunishima S,Taniguchi H,Yamaguchi A,et al.Changes in hepatic parenchymal blood flow with colorectal metastases:increase in arterial and decrease in portal blood flow[J].Hepatogastroenterology,2003,50(53):1457-1462.
[20] 曹卫刚,邱宝安.肝转移癌的治疗及预后因素的Cox模型分析[J/CD].中华临床医师杂志:电子版,2012,6(2):489-191.
