17-丙烯胺-17-去甲氧格尔德霉素对人肝癌HepG2细胞凋亡的影响
2015-03-14陈美霓郭巍赵菊梅魏晓丽
陈美霓,郭巍,赵菊梅,魏晓丽
(1.延安大学医学院实验中心,延安 716000 ;2.延安大学医学院附属医院泌尿外科)
·基础研究·
17-丙烯胺-17-去甲氧格尔德霉素对人肝癌HepG2细胞凋亡的影响
陈美霓1,郭巍2,赵菊梅1,魏晓丽1
(1.延安大学医学院实验中心,延安 716000 ;2.延安大学医学院附属医院泌尿外科)
[摘要]目的观察17-丙烯胺-17-去甲氧格尔德霉素(17-AAG)对肝癌HepG2细胞增凋亡的影响,并探讨其机制。方法采用吖啶橙/溴乙锭(AO/EB)荧光染色,通过荧光显微镜观察HepG2细胞凋亡情况;采用流式细胞仪分析细胞凋亡率的变化;逆转录聚合酶链反应检测17-AAG处理肝癌HepG2细胞前后bax和bcl-2的mRNA蛋白表达。结果AO/EB荧光染色结果显示对照组呈均匀绿色荧光,实验组随着药物浓度的增加,呈红色荧光凋亡细胞逐渐增多;流式细胞仪结果显示17-AAG促进肝癌HepG2细胞凋亡;RT-PCR结果显示17-AAG能使bax的mRNA蛋白表达水平升高、bcl-2的mRNA蛋白表达水平下降,其作用呈剂量效应关系。结论17-AAG具有促进肝癌HepG2凋亡作用,其机制可能与其上调bax、下调bcl-2蛋白表达有关。
[关键词]肝肿瘤;Hep G2细胞;细胞凋亡;bcl-2相关X蛋白质;bcl-X蛋白质
WHO癌症研究中心(IARC)统计,2008年肝癌是全球第5位常见癌症,其病死率占所有癌症死亡率的第3位[1]。17-丙烯胺-17-去甲氧基格尔德霉素(17-AAG)是热休克蛋白90(HSP90)抑制剂,对多种肿瘤细胞具有抑制生长、诱导凋亡的作用。本文通过体外实验探讨17-AAG对HepG2细胞凋亡的作用,并通过检测bax和bcl-2mRNA蛋白的变化对其作用机制做了初步研究。
1材料和方法
1.1材料(1)实验细胞:人肝癌细胞株HepG2由延安大学医学院实验中心实验室提供。(2)主要试剂:RPMI-1640培养基(赛默飞世尔公司),17-AAG、氮唑蓝、二甲亚砜及碘化丙啶(美国Sigma公司),AnnexinV FITC细胞凋亡检测试剂盒(美国BD pharmingen 公司),Trizol(南京凯基生物技术有限公司),胎牛血清(美国Hyclone公司),Bcl-2、Bax、β-actin引物由上海生工设计合成,RevertAidTM First Strand cDNA Synthesis Kit(中国Fermentas 公司)。(3)主要仪器:荧光倒置显微镜及CCD(日本Nikon),凝胶成像系统GENE(英国Syngene公司),流式细胞仪FACS Calibur(美国Becton Dickinson公司)。
1.2方法
1.2.1细胞培养人肝癌HepG2细胞于RPMI-1640培养液中培养,内含10%胎牛血清、100 μg/mL青霉素和100 μg/mL链霉素,置37 ℃、5%CO2培养箱中。实验选取对数生长期细胞进行研究。实验设健康对照组和实验组,血清浓度均为5%,实验组17-AAG浓度为0.63、1.25、2.5、5.0 μmol/L。
1.2.2吖啶橙/溴乙锭(AO/EB)双重荧光染色观察细胞形态取对数生长期的HepG2细胞,以2×105/mL的密度接种于内有干净无菌盖玻片的6孔板中24 h后,加入含药培养基,并设对照组。培养48 h后弃培养液,PBS 洗涤3次后滴浓度为100 μg/mL的 AO/EB混合液于爬片上30 s,夹出盖玻片置于载玻片上,用波长为490 nm处的荧光显微镜观察拍照。
1.2.3流式细胞仪检测细胞凋亡率将HepG2细胞制成细胞悬液以2×105/mL的密度接种6孔板内,细胞贴壁后设实验组和对照组作用48 h,胰酶消化离心收集细胞,按照AnnexinV FITC细胞凋亡检测试剂盒使用说明染色,流式细胞仪检测细胞凋亡率。
1.2.4逆转录聚合酶链反应(RT-PCR)收集实验组和对照组处理48h的HepG2细胞,按照Trizol试剂盒说明书操作提取总RNA,取少量样品用紫外分光光度仪在A260nm/A280nm处测定其浓度和纯度,并合成cDNA,合成样品于-80 ℃保存。取cDNA反应原液2 μL,DEPC水39 μL,dNTP 1 μL,10×PCRbuffer 5 μL,上游、下游引物各1 μL,Taq聚合酶1 μL,总体积为50 μL。PCR反应条件:预变性为94 ℃ 3 min,30个循环程序为94 ℃ 30 s、55 ℃ 30 s、72 ℃60 s,72 ℃延伸5 min。引物序列、大小及退火温度见表1。PCR扩增产物用1.5%琼脂糖凝胶进行电泳分离,以β-actin 作为内对照,用凝胶成像系统进行拍照及图像分析。
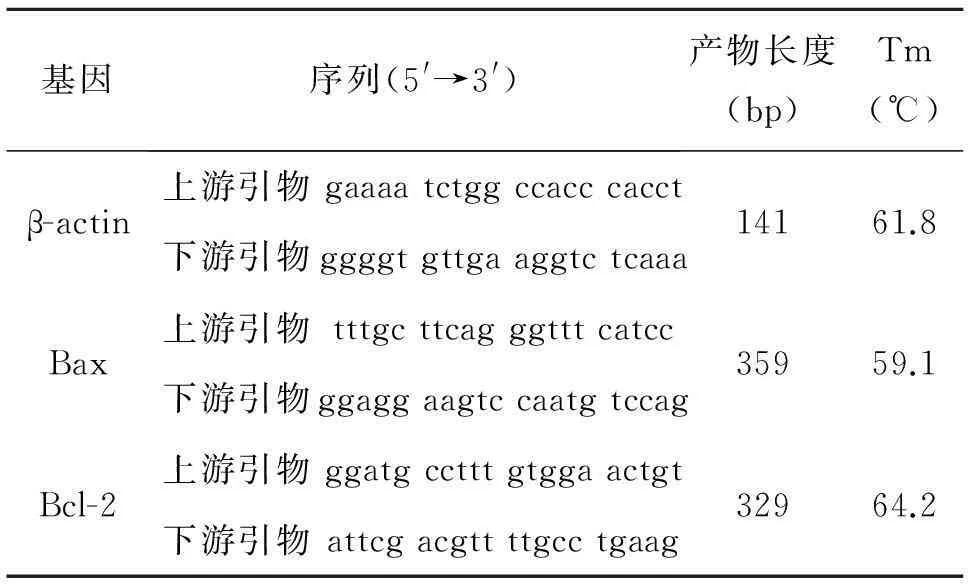
表1 被检测基因所使用的引物序列
1.3统计学处理采用SPSS17.0统计软件包进行分析,各组间差异比较采用t检验。
2结果
2.1吖啶橙/溴乙锭(AO/EB)双重荧光染色观察细胞形态17-AAG作用于HepG2细胞48 h后对活细胞进行AO/EB双染染色显示,健康对照组细胞可见细胞核呈绿色荧光,细胞核形态完整,大小一致,着色均匀;实验组可见凋亡细胞和死亡细胞。凋亡细胞核呈染色增强,均匀一致固缩状或片段状的红色荧光,死亡细胞核形态结构正常,呈橘红色荧光。随着药物浓度的增加,可见细胞数逐渐减少,凋亡细胞和死亡细胞逐渐增多,见图1。
2.2流式细胞仪检测细胞凋亡率流式细胞术分析显示,HepG2细胞在17-AAG作用48 h后,细胞凋亡率随着药物浓度的增加而升高,与对照组凋亡率比较差异有统计学意义(P<0.05),见表2。
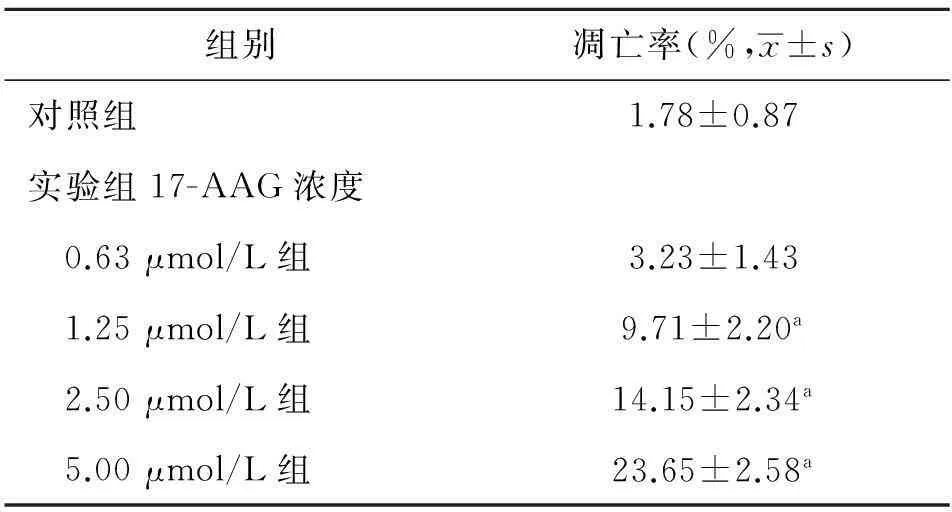
表2 17-AAG作用HepG2细胞48 h的凋亡率(n=4)
注:与对照组比较,aP<0.05
2.3RT-PCR检测bax和bcl-2的mRNA表达RT-PCR结果显示,与健康对照组比较,17-AAG作用的HepG2细胞中bax mRNA表达随着药物浓度的增加而增加,bcl-2 mRNA表达逐渐减少,bax和bcl-2的mRNA表达具有剂量相关性,实验组不同浓度药物对HepG2细胞bax和bcl-2 mRNA表达差异有统计学意义(P<0.05),见表3,图2。实验组17-AAG浓度为0.63、1.25、2.5、5.0μmol/L的bcl-2/ bax比值分别为0.701、0.551、0.474、0.433,均低于健康对照组的比值1.366,呈一定的剂量关系。
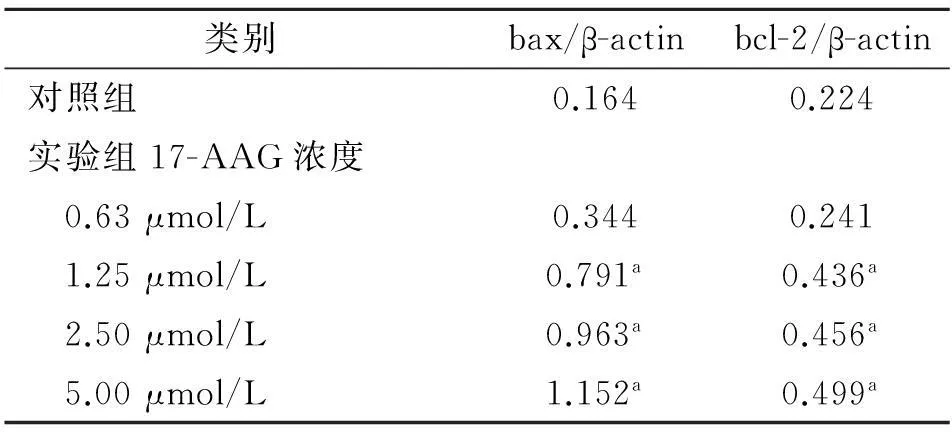
表3 HepG2细胞的bax、bcl-2 mRNA表达水平
注:与对照组比较,aP<0.05
3讨论
HSP90是众多热休克蛋白的一种,是细胞内最活跃的分子伴侣蛋白之一,在应激条件下维持细胞必需的蛋白质空间构象保护细胞生命活动,它具有特殊的分子伴侣功能[2-3]。HSP90在众多肿瘤中呈高表达状态,并随着肿瘤侵袭逐渐加深,HSP90的表达也逐步增加[4]。而肿瘤细胞中的HSP90过表达、蓄积,几乎控制了所有恶性细胞表型组成成分及细胞信号传导通路[5]。HSP90还参与肿瘤血管的生长侵袭及转移,在药物耐受﹑增加肿瘤细胞辐射敏感性及抗凋亡信号通路活化等起重要作用[6-8]。Hsp90已经成为肿瘤治疗的新靶点[9]。
17-AAG是HSP90特异抑制剂。研究证实17-AAG能与肿瘤来源的HSP90靶向结合,优先杀死肿瘤细胞,同时通过阻断多个信号通路的多个靶点,使肿瘤细胞周期停滞、诱导凋亡,并且可以增加肿瘤对其他化疗药物的敏感性[10-11]。本实验发现AO/EB双重荧光染色下,17-AAG处理的HepG2细胞可见体积小、核浓缩、强荧光的红色凋亡小体,随着药物浓度的增加,凋亡小体也逐渐增多,并出现细胞核形态正常的橘红色死亡细胞。经细胞流式仪检测结果证实,17-AAG有诱导人肝癌HepG2细胞凋亡,随着时间延长,凋亡作用明显增强的作用。
细胞凋亡是细胞的一种基本生物学现象,是多基因严格控制的过程。其中bcl-2家族是细胞凋亡的重要调节因子,其中bax与bcl-2是一对互相拮抗的蛋白。bcl-2蛋白属于线粒体蛋白,通过阻止线粒体里细胞色素C 释放,抑制caspase蛋白酶的活化[12];同时抑制Ca2+的跨膜流动,抑制PT孔的开放[13],从而抑制细胞凋亡。bax蛋白通过二聚体形式改变线粒体膜的通透性,诱导细胞凋亡[14]。本次试验RT-PCR结果显示,不同浓度的17-AAG作用HepG2细胞后,bax蛋白的表达随着药物浓度的上升而上调,而bcl-2蛋白则相反。有实验研究表明,Bax和bcl-2可以形成同源或异源bcl-2/bax二聚体,其比值增大时抑制细胞凋亡,当比值减小时加速细胞凋亡[15]。本研究表明,17-AAG作用HepG2细胞后,可随药物浓度的增加而降低bcl-2/bax的比值,从而促进HepG2细胞的凋亡。
综上所述,HSP90抑制剂17-AAG能诱导HepG2细胞发生凋亡,其机制可能上调bax蛋白的表达、下调bcl-2蛋白的表达,并同时下调bcl-2/bax比值有关。
(本文图1,2见插图1-1)
参考文献
[1]俞顺章,郑莹,吴春晓,等.上海市肝细胞癌防治40年[J].中华流行病学杂志,2013,34(6):637-641.
[2]Pearl LH,Prodromou C,Workman P,et al.The Hsp90 molecular chaperone:an open and shut case for treatment[J].The Biochemical Journal,2008,410(3):439-453.
[3]Hemandes MP,Sullivan WP,Toft DO.The assemblyandintermdecular properties of the hsp70-Hop-hsp90 molecular chaperonecomplex[J].J Biol Chem,2002,277(41):38294-38304.
[4]Badowska-Kozakiewicz AM,Malicka E.Immunohistochemical evaluation of expression of heat shock proteins HSP70 and HSP90 in mammary gland neoplasms in bitches[J].Polish journal of veterinary sciences,2012,15(2):209-214.
[5]Soroka J,Wandinger SK,Musbacher N,et al.Conformational Switching of the Molecular Chaperone Hsp90 via Regulated Phosphorylation[J].Molecular cell,2012,45(4):517-528.
[6]Whitesell L,Lindquist SL.HSP90 and the chaperoning of cancer[J].Nat Rev Cancer,2005,5(10):76l-772.
[7]Kabakow AE,Makarova YM,Malyutina YV.Radiosensitization of Human Vascular Endothelial Cells Throulgh Hsp90 Inhibition With 17-N-Allilamino-17-Demethoxygeldanamycin[J].Int J Radiat Oncol Bio Phys,2008,71(3):858-865.
[8]Wang X,Ju W,Renouard J,et al.17-Allylamino-17-Demethoxygeldanamycin synergistically potentiates tumor necrosis factor-induced lung cancer cell death by blocking the nuclear factor-kb pathway[J].Cancer Res,2006,66(2):1089-1095.
[9]Franco MC,Ye Y,Refakis CA,et al.Nitration of Hsp90 induces cell death[J].PNAS,2013,110(12):4449-4450.
[10] Tao Zhang.MEK inhibition potentiates the activity of Hsp 90 inhibitor 17-AAG against pancreatic cancer cells[J].Mol Pharm,2010,7(5):1576-1584.
[11] Lu X,Xiao L,Wang L,et al.Hsp90 inhibitors and drug resistance in cancer:the potential benefits of combination therapies of Hsp90 inhibitors and other anti-cancer drugs[J].Biochem Pharmacol,2012,83(8):995-1004.
[12] Zhao L,He F,Liu H,et al.Natural diterpenoid compound elevates expression of bim protein,which interacts with antiapoptotic protein Bcl-2,converting it to proapoptotic bax-like molecule[J].J Boil Chem,2012,287(2):1054-1065.
[13] Rong YP,Aromolaran AS,Bultynck G,et al.Targeting Bcl-2-IP3 receptor interaction to reverse Bcl-2's inhibition of apoptotic calcium signals.[J].Molecular Cell,2008,31(2):255-265.
[14] Sheridan C,Delivani P,Cullen SP,et al.Bax-or Bak-induced mitochondrial fission can be uncoupled from cytochrome C release[J].Molecular Cell,2008,31(4):570-585.
[15] Burguilles MA,Hajji N,Englund E,et al.Apoptosis-inducing factor mediates dopaminergic cell death in response to LPS-induced inflammatory stimulus evidence in Parkinson’s disease pafieum[J].Neurobiol Dis,2010,9(17):1-12.
Effects of 17-allylamino-17-demethoxygelda-namycin(17-AAG) on apoptosis of human hepatoma carcinoma cell lines HepG2 in vivo
CHENMeini*,GUOWei,ZHAOJumei,WEIXiaoli
(*CenterofMedicalExperiment,Yan'anMedicalCollege,Yan'anUniversity,Yan'an716000,China)
[Abstract]ObjectiveTo observe the influence of 17-allylamino-17-demethoxygelda-namycin(17-AAG) on cell apoptosis of Human hepatoma carcinoma cell Lines HepG2,and explore the possible mechanism.MethodsCellular morphological alterations were observed after AO/EB staining;the apoptosis and cell cycle of HepG2 cells were assayed by flow cytometry;the expression of apotosis related proteins bax and bcl-2 in HepG2 cells treated with 17-AAG were detected by RT-PCR.ResultsThe result of AO/EB double staining showed that the control homogeneously were green fluorescence;the experimental group were red fluorescent,and the red fluorescent was increased with drug concentration gradually;Flow cytometry result showed 17-AAG promote hepatocellular carcinoma HepG2 cell apoptosis;RT-PCR results showed that 17-AAG can increased bax mRNA expression levels of protein,decreased the BCL-2 mRNA protein expression levels,the effect was related with drug dose.Conclusion17-AAG can inhibit proliferation and induce apoptosis of HepG2 cells,and the mechanism may be related to its effect in up-regulating bax protein expression and down-regulating the BCL-2 protein expression.
[Key words]Liver neoplasms;Hep G2 Cells;Apoptosis;bcl-2-Associated X Protein;bcl-X Protein
(收稿日期:2014-08-22)
Corresponding author:GUO Wei,Email:15756560@qq.com
中图分类号:R735.7
文献标识码:A
DOI:10.3969/J.issn.1672-6790.2015.01.016
通信作者:郭巍,主治医师,Email:15756560@qq.com
作者简介:陈美霓,实验师,Email:25677435@qq.com
基金项目:陕西省教育厅科学研究项目(12JK0713);延安市科学技术研究发展计划项目(2013-KW15); 2012年延安大学自然科学专项基金项目
