基于尿液人乳头瘤状病毒检测对宫颈人乳头瘤状病毒感染诊断价值的Meta分析
2015-03-13林美丽陈伟马闪珊等
林美丽 陈伟 马闪珊等
[摘要] 目的 评价尿液人乳头瘤状病毒(HPV)检测诊断宫颈HPV感染的价值。 方法 电子检索PubMed、EMBase、Cochrane Library、SCI-E,全面搜集尿液HPV检测与金标准(聚合酶链式反应)比较诊断宫颈HPV感染的相关研究,检索时限均从建库至2013年10月。2名研究者以事先制订的纳入、排除标准独立地完成文献筛查、原始资料提取和偏倚风险评估后,采用Metadisc 1.4软件进行Meta分析,评价敏感度(Sen)、特异度(Spe)、阳性似然比(+LR)、阴性似然比(-LR)、诊断比值比(DOR)和综合受试者工作特征曲线(SROC曲线)下面积(AUC)。 结果 最终纳入14项符合定量合并的合格研究,共计1431例患者。Meta分析结果显示:尿液人乳头瘤状病毒(HPV)检测对诊断宫颈HPV感染的敏感度(Sen合并)=0.84(95%CI=0.81~0.86,P=0.000),特异度(Spe合并)=0.86(95%CI=0.83~0.89,P=0.000),阳性似然比(+LR合并)=7.7(95%CI=3.6~16,P=0.000),阴性似然比(-LR合并)=0.20(95%CI=0.13~0.30,P=0.000),诊断优势比(DOR合并)=57.5(95% CI=17.7~186.3,P=0.000)。AUC=0.9368(SE=0.0241),Q*=0.8735(SE=0.0300)。 结论 尿液HPV检测诊断宫颈HPV感染敏感、特异、稳定性好,适合临床推广应用。
[关键词] 人乳头瘤状病毒;Meta分析;诊断性试验
[中图分类号] R446 [文献标识码] A [文章编号] 1673-7210(2015)02(c)-0064-07
人乳头瘤状病毒(human papillomaviru,HPV)是最常见的性传播疾病之一,大约80%有性生活的女性一生中都会感染HPV,其中10%~20%患者将发展为持续感染[1],感染特定类属的HPV毒株已被证实与宫颈癌形成密切相关[2]。常规的宫颈细胞学筛查,能够早期地发现宫颈上皮内瘤变(cervical intraepithelial neoplasi,CIN),对早期实施干预,从而预防宫颈癌的发生具有积极作用。尽管通过筛查可以早期发现处于宫颈癌前病变的人群,但是由于HPV的高感染率,宫颈癌仍是当前威胁青年女性生命的罪魁祸首,并且其发病已趋向低龄化[3-4]。宫颈HPV检测用于宫颈癌筛查的研究已有开展,而且该方法已被推荐作为有效的二级预防手段[5]。来自于4项随机对照试验(randomized controlled trials,RCTs)和一项综合系统综述的结果一致认为,与当前的筛查措施相比,宫颈HPV检测在早期发现CIN 3级和浸润性宫颈癌方面更具优势[6-9]。但是,宫颈HPV检测与宫颈细胞学检查一样存在诸多不足,侵入性操作、费事等因素直接阻滞宫颈HPV检测在CIN和宫颈癌筛查中的推广应用。文献研究显示,尿液HPV检测可能弥补宫颈HPV和细胞学检查的不足[10]。已发表的综述认为,尿液取样是一种可以替代宫颈取样用于HPV检测的有效途径,但是已开展的关于尿液HPV检测用于诊断宫颈HPV感染的研究存在样本量不足及结论不一致等诸多缺陷[11-12]。尽管已有学者通过系统评价和Meta分析的方法做过类似的研究[13],但是此篇研究关注的结局指标及分析的效应量指标过于局限,因此本研究仅通过Meta分析方法合并相关研究,明确尿液HPV检测诊断宫颈HPV感染的精确性和可行性。
1 资料与方法
1.1 纳入标准
1.1.1 研究类型 正式发表的关于通过尿液HPV检测诊断宫颈HPV感染的诊断性研究,仅英文文献符合本次研究。
1.1.2 研究对象 ①有性生活的HPV感染或宫颈癌妇女;②研究结果中含有或通过计算可得四格表数据。
1.1.3 纳入研究诊断方法 尿液HPV检测法为目标诊断方法,诊断金标准为聚合酶链式反应(PCR)检查宫颈HPV DNA。
1.1.4 结局评价 敏感度(sensitivity,Sen)、特异度(specificity,Spe)、阳性似然比(positive likelihood ratio,+LR)、阴性似然比(negative likelihood ratio,-LR)、诊断比值比(diagnostic odds ratio,DOR)和综合受试者工作特征曲线(SROC)下面积(AUC)。
1.2 排除标准
①文献未阐释具体的诊断标准;②研究未设置对照金标准;③研究报告数据不充分,不足以进行合并分析,且与通讯作者联系未果;④专家观点、动物实验、综述、述评及个案研究及病例系列研究等;④重复发表研究,纳入样本量较大且研究设计严谨者。
1.3 文献检索
两名研究者通过计算机独立电子检索PubMed、EMBase、Cochrane Library和SCI-E数据库,并对纳入文献的参考文献逐一核查,数据信息不完整的研究,通过与通讯作者联系获取。具体检索词包括urin*,self,home,test*,detect*,screen*,diagnos*,DNA,deoxyribonucleic acid,polymerase chain reaction,NAAT,NAT,nucleic acid test,nucleic acid amplification test,HPV,human papillomavir*,cervical cancer,and cervical pre-cancer。研究者参考The Bayes Library of Diagnostic Study and Reviews[14],依据不同数据库的特点,制订初检检索式,并采用检索主题词、摘要和关键词3个字段的方式,多次预后确定最终检索式,不同研究者就独立检索结果进行交叉核对,如遇争议,通过共识原则解决。
1.4 文献筛查、数据提取与方法学质量评价
两名系统评价员严格依照事先制订的纳入、排除标准,独立地完成文献筛查、资料提取和合格研究的偏倚风险评估,对存在的争议通过共识原则解决。采用提前设计的标准数据提取表(Excel数据表)提取如下信息:原始研究基本信息(第一作者、发表年限、执行国家、检测内容和目的)、患者特征(平均年龄、人类免疫缺陷病毒感染状况、宫颈细胞学和活检结果)、检查指标特征(尿液样本类型、尿液取样量、样本存放温度、HPV DNA提取方法、HPV DNA扩增方法及检测时间)及结局评价指标(真阳性值、真阴性值、假阳性值、假阴性值、Sen、Spe)。
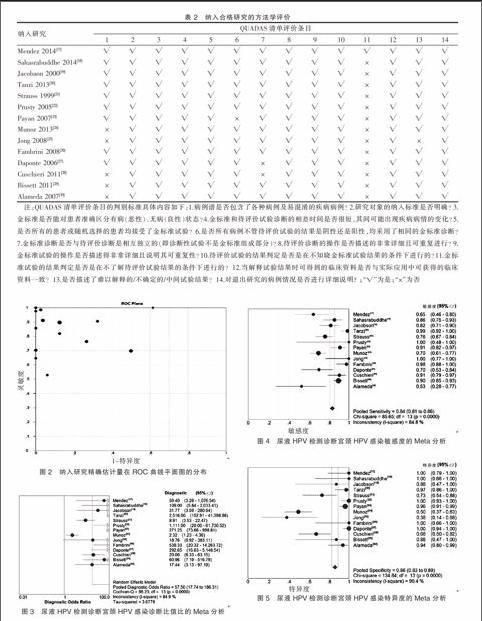
纳入研究的方法学质量,采用QUADAS[15]清单进行评价,依据清单的每个条目,两名评价员独立地按“是”、“否”、“不清楚”完成纳入研究方法学质量评价。其中“是”代表合格研究达到了清单所陈述的标准,“否”为合格研究未达到清单所陈述的标准,从合格原始研究仅部分满足或从文献中无法获取足够的信息判别则对应条目被评为“不清楚”。
1.5 统计学方法
数据合并前,研究者首先通过MetaDisc 1.4[16]软件检验研究间异质性,异质性主要来源于阈值效应和非阈值效应。其中,通过视觉检核SROC曲线平面图,定性判断研究间是否存在阈值效应:若SROC曲线表现为“肩臂状”,则表明研究间有阈值效应存在。以P值判定异质性存在与否,I2评估异质性程度,若P > 0.10,I2≤50%,提示研究间不存在统计学异质性,如若研究间临床特质和方法学同质,则选用固定效应模型合并数据;若P ≤ 0.10,I2 > 50%,则提示纳入研究见存在统计学异质性,如纳入如研究临床特质方法学同质,则采用随机效应模型进行Meta合并,并探寻异质性可能来源。计算合并Sen、Spe、+LR、-LR和DOR,绘制SROC曲线,并计算AUC。
进行数据合并时,如果纳入研究间有阈值效应,则拟合SROC曲线,并计算AUC或Q*指数等;反之,如若统计学异质性主要来源于非阈值效应,则可在分析异质性来源基础上,尝试在同质的特征因素下进行数据合并[15]。
2 结果
2.1 文献检索
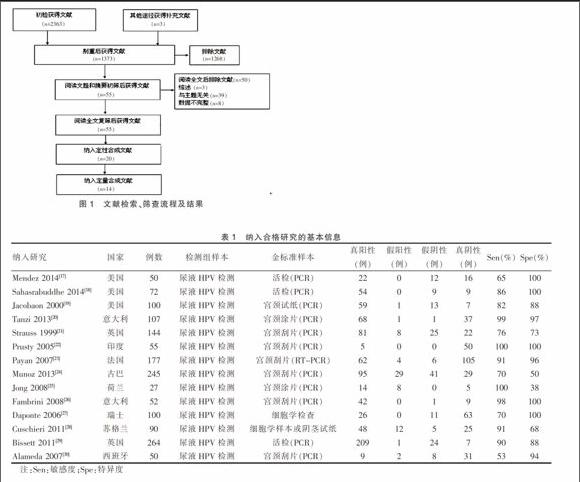
通过计算机电子检索,初步获得相关记录2363条,通过EndNote7.1文献管理软件剔重、阅读文献题目与摘要及全文阅读后,最终纳入定量合并文献14篇[17-30],包括1431例患者。文献检索、筛查流程及结果见图1。
图1 文献检索、筛查流程及结果
2.2 合格文献基本特征与方法学评价
本次研究共纳入合格文献14篇,发表于1999~2014年,包含样本50~264例,11项研究对照金标准采用PCR法,1项研究采用RT-PCR,1项研究采用细胞学检查,1项研究采用细胞学样本或阴茎试纸法,纳入研究的基本特征见表1,方法学评价如表2所示。
2.3 Meta分析
本次研究中,有14项合格研究[17-30](n=1431)比较了与金标准对比,基于尿液HPV检测诊断宫颈HPV感染的相关结局。ROC曲线平面图视觉检核发现曲线未呈现“肩臂状”分布(图2),表明研究间并无阈值效应。进而通过步计算敏感度对数(logSen)与(1-特异度)对数[log(1-Spe)]的Spearman相关系数(r),定量检核阈值效应存在与否,结果(r=-0.004,P=0.988)支持研究间不存在阈值效应。为了分析是否存在来自于非阈值效应导致的异质性,研究者合并了DOR,合并结果显示单项研究的精确估计值与合并值并非直线分布(图3),且Cochrane Q=86.23,(P=0.0000),提示非阈值效导致了研究间的异质性。
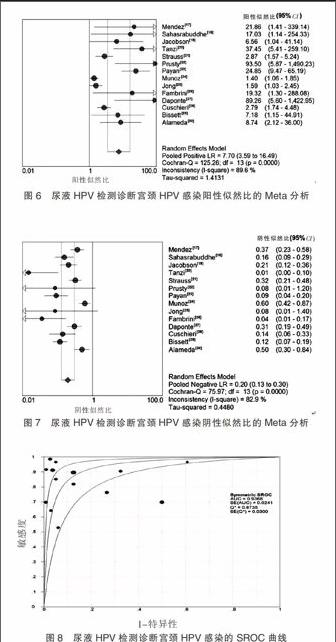
随机效应模型Meta分析结果显示Sen合并=0.99(95%CI=0.98~0.99,P=0.000)(图4)、Spe合并=0.98(95%CI=0.98~0.99,P=0.000)(图5)、+LR合并=42.53(95%CI=18.05~100.23,P=0.000)(图6)、–LR合并=0.02(95%CI=0.01~0.03,P=0.0262)(图7)和DOR合并=57.5(95%CI=17.74~186.31,P=0.000)(图3)。绘制SROC曲线,其AUC为0.997 7(SE=0.0008),Q*=0.9833(SE=0.0036)(图8)。
3 讨论
HPV病毒是一种属于乳多空病毒科的乳头瘤空泡病毒A属,是球形DNA病毒,能引起人体皮肤黏膜的鳞状上皮增殖[31]。HPV病毒感染可导致包括宫颈癌、阴道癌、阴茎癌和头颈部肿瘤等恶性病变的发生,同时也会促使尖锐湿疣和复发性呼吸道乳头状瘤病等良性疾病的发生与发展[32-33]。一项关于伊朗人群系列肿瘤调查的研究发现,宫颈癌患者HPV检出率达到77.5%[34],证实HPV感染与宫颈癌发生发展密切相关。目前,临床关于HPV检测的方法较多,常用的包括宫颈细胞学检查、宫颈HPV DNA检测和宫颈组织学检查等,但这些方法都属于侵入性操作,诊断精确性不足,同时还较为费时。尿液HPV DNA检测用于诊断宫颈HPV感染已有系列研究,该方法为非侵入性操作、易于操作、耗时少,在宫颈病毒感染方面应用广泛[35]。
本次研究分析了纳入文献的异质性,合并分析结果表明存在统计学异质性(I2=84.9%,P=0.00)。随机对照试设计在诊断试验中很难实现,而且不同的研究者对实验结果的判断所选取的阈值也存在差异,这些因素都是诊断性试验研究间异质性的潜在来源。由阈值效应、非阈值效应导致的异质性及由其他因素引起的异质性是诊断精确性研究间变异的3个来源。阈值效应存在与否的判断可通过三种方法实现,其一是视图法,亦即在森林图中,敏感度增加的同时特异度降低,表明存在阈值效应,其二是SROC曲线法,亦即SROC曲线平面图呈“肩臂状”分布,其三为Spearman相关系数法,如若Sen的对数与(1-Spe)的对数成正相关,也表明存在阈值效应[16]。本次研究中,SROC曲线平面图及Spearman相关系数分析结果表明不存在阈值效应引起的异质性(r=-0.004,P=0.988)。而在探讨非阈值效应引起的异质性时,DOR的Cochran Q检验分析表明存在其他原因引起的异质性(Cochrane Q=86.23,P=0.000),包括人群(如年龄、并发病症等)、检测条件(如差异性检测技术及非定员操作等)、试验标准等。
本次Meta合并表明示,基于尿液HPV DNA检测的宫颈HPV感染诊断方法具有较好的Sen及显著的Spe,具有很好的诊断价值。对患者而言,以非侵入性易于操作等优势为特点的尿液HPV DNA检测易于接受和推广[31],检测尿液所含特定成分的方法已用于包括沙眼衣原体和淋病奈瑟菌感染等多种性传播疾病[32]。Meta分析表明,尿液HPV DNA检测可代替宫颈HPV DNA检测,精确地诊断宫颈HPV感染。假阳性结果将致使患者为确诊是否感染而接受宫颈细胞学检测、阴道镜或宫颈或组织检查等不必要的侵入性检查。本次研究证实,尿液HPV DNA检测阳性者,宫颈感染HPV的概率是未感染的15倍,能够极为准确地诊断HPV感染,降低了假阳性结果,避免患者遭受不必要的侵入性操作。另外,Meta分析显示尿液HPV DNA检测具有很好的特异度,也支持该方法能够增加宫颈HPV感染阳性检出率。
关于尿液HPV DNA检测已有3篇传统综述发表,Somayeh等[33]研究表明,与宫颈HPV DNA检查相比,尿液HPV DNA检测并不能很好地诊断CIN,来自于Enerly等[12]的研究则主要关注青春期女性,而在此年龄段的人群不符合纳入宫颈癌筛查项目,由Vorsters等[11]完成的研究主要评价了不同尿液取样、样本储存及检测方法在检测HPV DNA方面的价值,来自于Enerly等[12]和Vorsters等[11]的结论一致认为,尿液HPV DNA检测可用于患者宫颈HPV感染诊断。值得注意的是,尽管各研究在结论上存在差异,已发表的这三篇综述都未采用循证医学方法对合格研究进行系统评价来支持结论。本研究通过Meta分析对合格研究进行定量合并,结果表明,尿液HPV DNA检测诊断宫颈HPV感染具有很好的特异度和灵敏度。
尽管本次研究严格依据Cocharane协作网提供的DTA系统评价制作手册完成,但是研究存在的以下不足却不可否认:①本次研究仅纳入英文发表文献,会导致选择性偏倚;②本次研究检索了国外几大主流数据库,基本囊括了正式发表的文献,然而对于灰色文献的获取尚存不足,此外阳性结果的研究往往比阴性结果的研究更容易发表,所以可能存在发表偏倚;③纳入研究均未对试验所需样本量进行估计,大多数研究未提及盲法方案,存在测量偏倚的可能性;④部分纳入文献就病例谱有无包含各种病例及易混淆的疾病病例,以及是否纳入健康对照人群未作详细描述,将导致研究存在测量偏倚。
综上所述,尿液HPV DNA检测对诊断宫颈HPV感染具有较高的诊断价值,然而鉴于本次Meta分析纳入研究在人群选择上存在差异,各研究对尿液标本的检测也未使用统一的检测手段,因此对本次研究结果应用于临床应结合患者的个体特征等因素。
[参考文献]
[1] Einstein MH,Schiller JT,Viscidi RP,et al. Clinician's guide to human papillomavirus immunology:knowns and unknowns [J]. Lancet Infect Dis,2009,9(6):347-356.
[2] Smith JS,Lindsay L,Hoots B,et al. Human papillomavirus type distribution in invasive cervical cancer and high-grade cervical lesions:a Meta-analysis update [J]. Int J Cancer,2007,121(3):621-632.
[3] Trent Cancer Registry. Profile of cervical cancer in England:incidence,mortality and survival. National Cancer Intelligence Network,2012[EB/OL]. http://www.cancerresearchuk.org/cancer-info/cancerstats/types/cervix/incidence/
[4] National Cancer Intelligence Network. Cervical cancer incidence and screening coverage. 2014[EB/OL]. www.ncin.org.uk/publications/data_briefings/cervical_incidence_and_ screening 2011.
[5] Saslow D,Solomon D,Lawson HW,et al. American Cancer Society,American Society For Colposcopy and Cervical Pathology,and American Society for clinical pathology screening guidelines for the prevention and early detection of cervical cancer [J]. CA Cancer J Clin,2012,62(3):147-172.
[6] Ronco G,Dillner J,Elfstr■m KM,et al. Efficacy of HPV-based screening for prevention of invasive cervical cancer:follow-up of four European randomised controlled trials [J]. Lancet,2014,383(9916):524-532.
[7] Rijkaart DC,Berkhof J,Rozendaal L,et al. Human papillomavirus testing for the detection of high-grade cervical intraepithelial neoplasia and cancer:final results of the POBASCAM randomised controlled trial [J]. Lancet Oncol,2012,13(1):78-88.
[8] Kitchener HC,Gilham C,Sargent A,et al. A comparison of HPV DNA testing and liquid based cytology over three rounds of primary cervical screening:extended follow up in the ARTISTIC trial [J]. Eur J Cancer,2011,47(6):864-871.
[9] Ronco G,Giorgi-Rossi P,Carozzi F,et al. Efficacy of human papillomavirus testing for the detection of invasive cervical cancers and cervical intraepithelial neoplasia:a randomised controlled trial [J]. Lancet Oncol,2010,11(3):249-257.
[10] Sellors JW,Lorincz AT,Mahony JB,et al. Comparison of self-collected vaginal,vulvar and urine samples with physician-collected cervical samples for human papillomavirus testing to detect high-grade squamous intraepithelial lesions [J]. Can Med Assoc J,2000,163(5):513-518.
[11] Vorsters A,Micalessi I,Bilcke J,et al. Detection of human papillomavirus DNA in urine. A review of the literature [J]. Eur J Clin Microbiol Infect Dis,2012,31(5):627-640.
[12] Enerly E,Olofsson C,Nygard M. Monitoring human papillomavirus prevalence in urine samples:a review [J]. Clin Epidemiol,2013,5:371.
[13] Neha P,Julie D,Javier Z,et al. Accuracy of urinary human papillomavirus testing for presence of cervical HPV:systematic review and Meta-analysis [J]. BMJ,2014,349:g5264.
[14] Liehtinghagen R,Bahr M. Noninvasive diagnosis of fibrosis in chronic liver disease [J]. Expert Re Mol Diagn,2004,4(5):715-726.
[15] Whiting PF,Rutjes AWS,Westwood ME,et al. QUADAS-2:a revised tool for the quality assessment of diagnostic accuracy studies [J]. Ann Intern Med,2011,155(8):529-536.
[16] Zamora J,Abraira V,Muriel A,et al. Meta-DiSc:a software for metaanalysis of test accuracy data [J]. BMC Med Res Methodol,2006,6:31.
[17] Mendez K,Romaguera J,Ortiz AP,et al. Urine-based human papillomavirus DNA testing as a screening tool for cervical cancer in high-risk women [J]. Int J Gynecol Obstetr,2014,124(2):151-155.
[18] Sahasrabuddhe VV,Gravitt PE,Dunn ST,et al. Comparison of human papillomavirus detections in urine,vulvar,and cervical samples from women attending a colposcopy clinic [J]. J Clin Microbiol,2014,52(1):187-192.
[19] Jacobson DL,Womack SD,Peralta L,et al. Concordance of human papillomavirus in the cervix and urine among inner city adolescents [J]. Pediatr Infect Dis J,2000,19(8):722-728.
[20] Tanzi E,Bianchi S,Fasolo MM,et al. High performance of a new PCR-based urine assay for HPV-DNA detection and genotyping [J]. J Med Virol,2013,85(1):91-98.
[21] Strauss S,Jordens JZ,McBride D,et al. Detection and typing of human papillomavirus DNA in paired urine and cervical scrapes [J]. Eur J Epidemiol,1999,15(6):537-543.
[22] Prusty BK,Kumar A,Arora R,et al. Human papillomavirus (HPV)DNA detection in self-collected urine [J]. Int J Gynecol Obstetr,2005,90(3):223-227.
[23] Payan C,Ducancelle A,Aboubaker MH,et al. Human papillomavirus quantification in urine and cervical samples by using the Mx4000 and Light Cycler general real-time PCR systems [J]. J Clin Microbiol,2007,45(3):897-901.
[24] Munoz M,Camargo M,Soto-De Leon SC,et al. Human papillomavirus detection from human immunodeficiency virus-infected Colombian women's paired urine and cervical samples [J]. Plos One,2013,8(2):7.
[25] Jong EE,Mulder JW,van Gorp ECM,et al. The prevalence of human papillomavirus (HPV)infection in paired urine and cervical smear samples of HIV-infected women [J]. J Clin Virol,2008,41(2):111-115.
[26] Farnbrini M,Penna C,Pieralli A,et al. PCR detection rates of high risk human papillomavirus DNA in paired self-collected urine and cervical scrapes after laser CO2 conization for high-grade cervical intraepithelial neoplasia [J]. Gynecol Oncol,2008,109(1):59-64.
[27] Daponte A,Pournaras S,Mademtzis I,et al. Evaluation of high-risk human papillomavirus types PCR detection in paired urine and cervical samples of women with abnormal cytology [J]. J Clin Virol,2006,36(3):189-193.
[28] Cuschieri K,Nandwani R,McGough P,et al. Urine testing as a surveillance tool to monitor the impact of HPV immunization programs [J]. J Med Virol,2011,83(11):1983-1987.
[29] Bissett SL,Howell-Jones R,Swift C,et al. Human papillomavirus genotype detection and viral load in paired genital and urine samples from both females and males [J]. J Med Virol,2011,83(10):1744-1751.
[30] Alameda F,Bellosillo B,Fuste P,et al. Human papillomavirus detection in urine samples: an alternative screening method [J]. J Low Genitl Tract Dis,2007,11(1):5-7.
[31] Anna RG. Human Papillomavirus in Head and Neck Cancer [J]. Cancers,2014,6(3):1705-1720.
[32] Munoz M,Camargo M,Soto-De Leon SC,et al. Classical molecular tests using urine samples as a potential screening tool for human papillomavirus detection in human immunodeficiency virus-infected women [J]. J Clin Microbiol,2013,51(11):3688-3693.
[33] Somayeh J,Zabihollah S,Rasool H. Human papillomavirus burden in different cancers in Iran:a systematic assessment [J]. Asian Pac J Cancer Prev,2014,15(17):7029-7035.
[34] Allameh T,Moghim S,sadi-Zeidabadi M. A survey on the prevalence of high-risk subtypes of human papilloma virus among women with cervical neoplasia in Isfahan University of Medical Science [J]. Arch Gynecol Obstet,2011, 284(6):1509-1513.
[35] Nahar Q,Sultana F,Alam A,et al. Genital human papillomavirus infection among women in Bangladesh:findings from a population-based survey [J]. PLoS One,2014,9(10):e107675.
(收稿日期:2014-10-09 本文编辑:任 念)