千岛湖次生林优势种植物光合生理生态特性
2015-03-13金则新李月灵
管 铭,金则新,*,李月灵,2,王 强,2
1 台州学院生态研究所, 临海 317000 2 上海师范大学生命与环境科学学院, 上海 200030
千岛湖次生林优势种植物光合生理生态特性
管 铭1,金则新1,*,李月灵1,2,王 强1,2
1 台州学院生态研究所, 临海 317000 2 上海师范大学生命与环境科学学院, 上海 200030
对千岛湖次生林优势种马尾松(Pinusmassoniana)、苦槠(Castanopsissclerophylla)、石栎(Lithocarpusglaber)、青冈(Cyclobalanopsisglauca)在不同季节的光合作用日变化、光响应、CO2响应以及相对叶绿素含量进行了分析,以期了解群落演替的内在机制。结果表明:(1)马尾松的净光合速率(Pn)日变化在4个季节均呈“单峰”曲线;苦槠在8月呈“双峰”曲线,其他3个月份均呈“单峰”曲线;石栎和青冈在5月、8月和11月的Pn日变化均为“双峰”曲线,有明显的光合“午休”现象,2月为“单峰”曲线。(2)马尾松和苦槠的Pn日积累值为8月最高,石栎和青冈为11月最高,且均与其他3个月均差异显著。4种优势种在4个季节的Pn日积累值的平均值大小为马尾松>苦槠>青冈>石栎,差异显著。(3)4个季节中,光饱和点(LSP)、光补偿点(LCP)、最大净光合速率(Amax)、暗呼吸速率(Rd)、最大羧化速率(Vcmax)、最大电子传递速率(Jmax)均以马尾松最高,表观量子效率(AQY)为马尾松最低。青冈在4个季节中具有最低的LSP、Rd和最高的AQY。苦槠和石栎的光合特性介于马尾松和青冈之间。(4)相对叶绿素含量以青冈最高,马尾松最低。总之,马尾松属强阳性树种,苦槠为阳性树种,石栎具有一定的耐荫性,青冈的耐荫性较强。
千岛湖; 次生林; 优势种; 光合特性; 季节动态
自John Adlum于1806年首次应用演替(succession)于生态学以来[1],生态学家通过对多种植物群落类型的研究,总结出了植物群落演替的规律,提出了一些关于植物群落演替的假说[2- 3],但多数仅仅是对群落演替的定性描述或宏观分析。直到20世纪80年代,美国植物生理生态学家Bazzaz提出通过比较“优势种生理生态特性”的方法来研究从先锋群落到顶极群落演替的机理,生理生态才成为研究植物群落演替的本质、揭示植物群落演替机理的新途径[4- 5]。越来越多的生态学家开始研究不同演替时期植物生理生态特性的差异[6- 8]。有相当一部分生理生态学的研究集中于光合作用,这是因为光合作用体现物种本身的生物学特性,是决定其在群落中地位的重要因素[9]。因而,通过研究群落中优势种植物的光合作用特征对其演替地位的影响,对了解植物群落演替的内在机制、退化生态系统的恢复和重建、全球气候变化对植被的影响和人类社会的可持续发展等方面都有重要影响[10- 12]。
在演替的早期,植被郁闭度较小,光照充足,使得演替早期植物(先锋种)具有阳生植物的特性,生长需要光照条件较好的生境;相应地,演替后期的植物具有阴生植物的特性,能够耐受荫蔽的生境[13]。通常情况下,阳生植物的最大净光合速率(Amax)大于阴生植物[14]。演替早期的木本植物的Amax较演替中、后期植物高[15]。演替早期物种的光量子效率(AQY)较低,光饱和点(LSP)和光补偿点(LCP)较高,在光强较低时光能利用效率较低;演替后期物种的AQY较高,LSP、LCP较低,在低光强时有较高的光能利用效率[15- 16]。因此,研究优势种植物的光合特性,比较它们的Amax以及光响应的差异,分析优势种属于演替早期种还是后期种,将有助于揭示他们在群落中地位的变迁、群落的演替方向及更替的机理。
浙江千岛湖是1959年新安江水电站建设蓄水形成的人工湖,湖区的原生植被为亚热带常绿阔叶林。千岛湖蓄水之前,库区森林几乎破坏殆尽,形成大量次生裸地。后经过封山育林并人工补植,这些次生裸地经过50a自然演替后形成了以马尾松(Pinusmassoniana)为主要优势种的次生群落,是研究次生演替规律的理想场所[17]。过去对千岛湖植被的研究主要集中在对当地群落外貌描述和区系分析[18]、群落的种类组成[17]以及片段化生境对物种多样性和常绿阔叶树种种群的维持与更新的影响[19- 20]等。但对其光合生理生态方面的研究资料较少,仅对夏季千岛湖次生林中优势种幼苗在林窗和林下2种生境中的光合特性进行了测定[21],而从群落演替的角度对该次生林优势种幼树在不同季节的光合生理生态变化的研究尚未报道。因为幼树对群落结构的更新和生物多样性的维持有重要作用[22],所以研究林下幼树叶片的光合生理生态特征具有重要意义。
基于以上原因,对千岛湖次生林优势种幼树在不同生长季节的光合作用日变化、光响应和CO2响应特征进行了测定,拟验证以下假说:(1)优势种在次生林中地位的变迁及相互间的更替与其物质的合成能力,即光合速率有关;(2)优势种本身的生物学特性(喜光/耐荫性)决定了次生林演替的方向,即阳性树种在次生林的演替过程中会被淘汰,而耐荫树种将成为群落演替顶极阶段的优势种;(3)优势种光合特性的种间差异是群落演替能够顺利进行的主要原因之一。这些研究结果为确定千岛湖次生林的演替阶段、演替方向及其控制,常绿阔叶林的抚育与改造,人工群落的恢复与重建提供科学依据。
1 材料与方法
1.1 研究地区自然概况
样地位于千岛湖姥山岛,地理坐标为N 29°11′—30°02′,E 118°21′—119°20′,海拔108—350 m,位于中亚热带季风气候北缘。年均温度17 ℃,≥10 ℃积温5410 ℃。1月气温最低,月平均5 ℃,7月气温最高,月平均28.9 ℃,无霜期263 d,年平均降水量1430 mm,年雨日155 d,年平均相对湿度76%。土壤主要有红壤和岩性土两大类。土层较薄,保水保肥能力较差。群落的优势种为马尾松、苦槠(Castanopsissclerophylla)、石栎(Lithocarpusglaber)、青冈(Cyclobalanopsisglauca)[23]。其它常见的植物还有尖连蕊茶(Camelliacuspidata)、短柄桴(Quercusglandulifera)、盐肤木(Rhuschinensis)、枫香(Liquidambarformosana)等。
在千岛湖次生林内,经踏查,选取一个因人工樵采后面积约1000 m2的林窗为样地,海拔约220 m。林窗近似椭圆形,4种优势种个体数多,密度大,多位于林窗中央,近似全光环境,光照强度强,气温高,湿度低。在样地中随机选取大小相对一致,树龄在8 a左右的马尾松、苦槠、石栎和青冈的幼树各3株,植株高度约1.5 m左右。
1.2 测定方法
1.2.1 光合日变化测定
实验分别于2011年5月上旬(春季)、8月上旬(夏季)、11月上旬(秋季)和2012年2月中旬(冬季)晴朗的天气下进行。选取植物冠层阳面健康成熟的功能叶进行测定,事先挂牌标记。采用Li- 6400XT便携式光合测定系统(LI-COR, Inc., USA)测定气体交换参数,从8:00到18:00(2月为6:00到16:00,8月为6:00到18:00),每隔2 h测定1次,每次连续测定2 d。每次测定3个样叶,每个样叶重复3次,结果取平均值。测定时保持叶片自然着生角度和方向不变,采用开放气路,以空气中CO2浓度为气源,测定参数包括:叶片净光合速率(Pn, μmol m-2s-1)、胞间CO2浓度(Ci, μmol/mol)、气孔导度(Gs, mmol m-2s-1)等。
Pn日积累值为在AutoCAD软件中计算出的Pn日变化曲线与坐标轴围成区域的面积,是相对值[24]。
1.2.2 光响应和CO2响应测定及参数估算
(1)光响应测定
以测定光合日变化的植株为测定对象,使用Li- 6400XT便携式光合作用系统测定叶片的Pn。使用开放气路,空气流速为0.5 L/min,叶片温度25 ℃,叶室中相对湿度70%—75%,CO2浓度380 μmol/mol。诱导光强约为2000 μmol m- 2s-1,诱导时间30 min。测定时光强由强到弱依次设定光量子通量密度(PFD)为2000、1500、1200、1000、800、600、400、200、150、100、50、20、0 μmol m- 2s-1,测定时每一光强下最大等待时间4 min。依据非直角双曲线模型[25],拟合Pn-PFD的曲线方程,并据此用 Photosyn Assistant软件计算下列参数:最大净光合速率(Amax)、光饱和点(LSP)、光补偿点(LCP)、表观量子效率(AQY)和暗呼吸速率(Rd)。
(2)CO2响应测定
光照强度设定采用光响应曲线计算的饱和光强,CO2的浓度从高到低依次设为1500、1200、1000、800、600、400、200、150、120、100、80、50 μmol/mol,测定时每一浓度下最大等待时间5 min。采用 Photosyn Assistant软件拟合CO2曲线,并计算出最大羧化速率(Vcmax)和最大电子传递速率(Jmax)[26]。
1.2.3 相对叶绿素含量的测定
相对叶绿素含量采用CCM- 200 手持式叶绿素测定仪(OPTI-SCIENCES,USA)测定。以测定光合日变化的植株为测定对象,每株选择2片叶片,在各个叶片中脉两侧均匀选取3个点,取平均值作为该叶片的相对叶绿素含量。
1.3 数据处理
采用SPSS 16.0数据处理软件对实验数据进行方差分析、计算标准误差,用Origin 8.0进行图表绘制。
2 结果与分析
2.1 优势种叶片净光合速率日变化
马尾松不同月份的净光合速率(Pn)日变化均为单峰型(图1),峰值除8月出现在 10:00左右外,其他月份均出现在12:00左右,其峰值大小为 8月>11月>5月>2月。苦槠叶片的Pn日变化,除8月呈“双峰”曲线外,其它月份均为“单峰”曲线(图1)。5月,峰值出现在14:00左右;在8月份,Pn第1次峰值出现在10:00左右,中午下降,出现短暂的光合“午休”现象,午后上升,至16:00左右出现第2次峰值。11月、2月的峰值出现在12:00左右。石栎、青冈的Pn日变化在5月、8月和11月均为双峰型(图1),其第1次峰值均出现在10:00左右,午间有不同程度的降低,出现光合“午休”现象, 5月、11月的第2次峰值出现在14:00左右,8月的第2次峰值出现在16:00左右。2月的Pn日变化为单峰型,12:00左右最高。
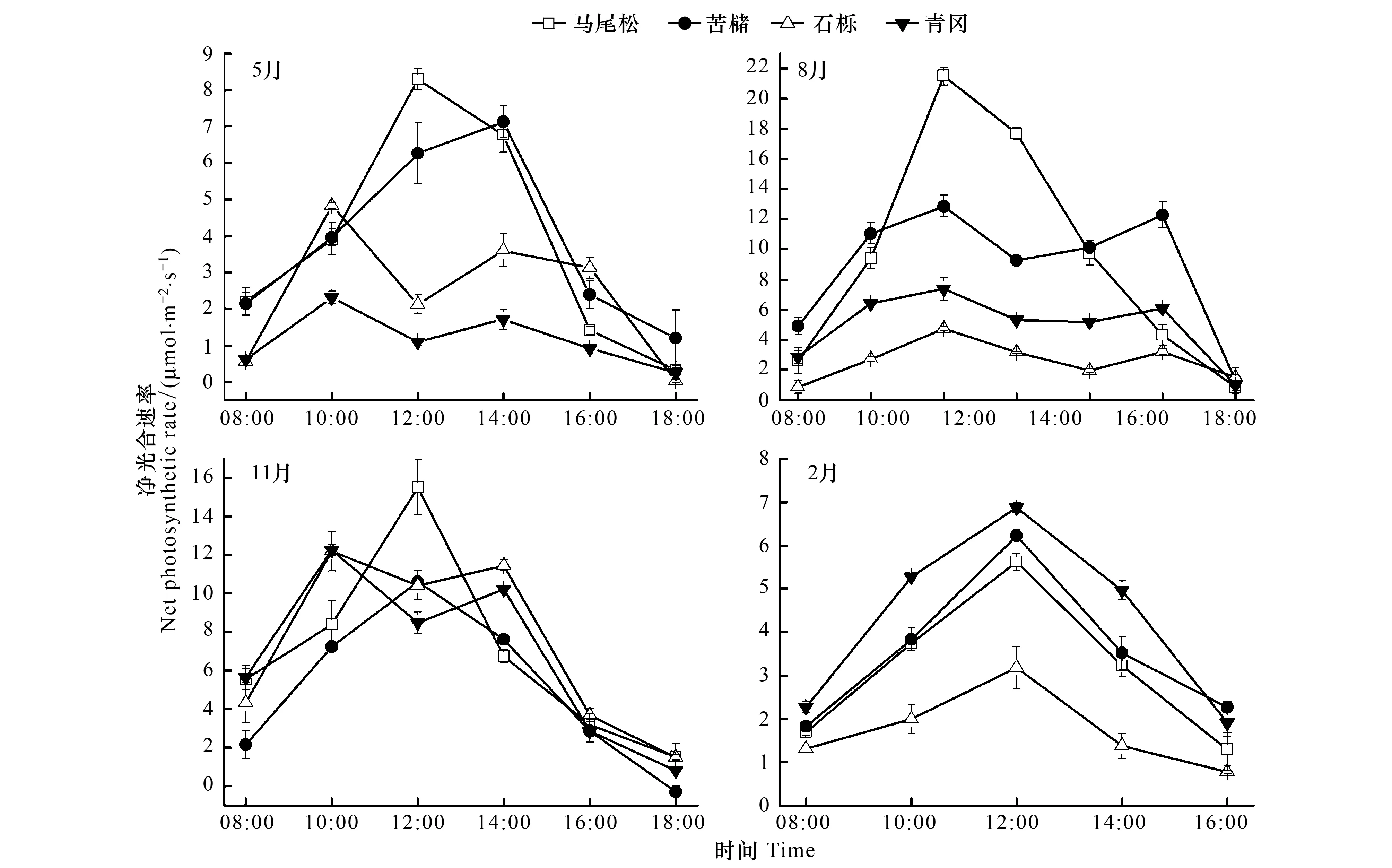
图1 优势种叶片净光合速率日变化Fig.1 Diurnal dynamics of net photosynthetic rate in leaves of the dominant species
2.2 优势种不同季节光响应及CO2响应
2.2.1 优势种不同季节光响应
4 种优势种在4个季节的光饱和点(LSP)见表1,马尾松、苦槠的LSP为8月>11月>5月>2月,它们之间均差异显著(P<0.05);石栎、青冈的LSP为11月>8月>5月>2月,不同月份之间均差异显著(P<0.05)。5月、11月的LSP为马尾松、苦槠显著高于石栎、青冈(P<0.05),石栎显著高于青冈(P<0.05);2月为马尾松、苦槠显著高于石栎、青冈(P<0.05);8月为马尾松显著高于其他3种优势种(P<0.05),苦槠次之,显著高于石栎、青冈(P<0.05)。总之,4种优势种的LSP在不同季节均以马尾松最高,青冈最低。

表1 优势种不同季节的光响应Table 1 Responses of photosynthesis to light in leaves of the dominant species in difference seasons
数据为平均值±标准误差,不同小写字母表示同一列差异显著(P<0.05),不同大写字母表示同一行差异显著(P<0.05)
由表1可看出,不同季节马尾松的光补偿点(LCP)为8月>5月> 2月> 11月,它们之间均差异显著(P<0.05);苦槠和石栎的LCP为5月显著高于其他3个月(P<0.05),8月次之,显著高于2月、11月(P<0.05);青冈的LCP为5月>8月> 2月> 11月,它们之间均存在显著差异(P<0.05)。不同优势种的LCP,2月为马尾松最高,与其他3种优势种差异显著(P<0.05)。5月为马尾松、苦槠显著高于石栎、青冈(P<0.05)。8月为马尾松最高,与其他3种优势种差异显著(P<0.05);苦槠次之,显著高于石栎、青冈(P<0.05)。11月为马尾松最高,显著高于其它3种优势种(P<0.05),其次是苦槠、石栎,与青冈差异显著(P<0.05)。总体上,马尾松的LCP较高,石栎、青冈较低。
由表1可知,不同季节马尾松的最大净光合速率(Amax)为8月>11月>5月>2月,它们之间均差异显著(P<0.05);苦槠的Amax为8月显著高于其他3个月份(P<0.05),11月次之,显著高于2月、5月(P<0.05);石栎的Amax为11月最高,与其他3个月差异显著(P<0.05),其次是5月、8月,与2月差异显著(P<0.05);青冈的Amax为11月显著高于其他3个月(P<0.05),8月次之,与2月差异不显著,与5月差异显著(P<0.05)。4种优势种的Amax,2月为马尾松最高,显著高于其他3种优势种(P<0.05),苦槠次之,显著高于石栎、青冈(P<0.05);5月为马尾松显著高于其他3种优势种(P<0.05),其次是苦槠、石栎,与青冈差异显著(P<0.05);8月为马尾松>苦槠>石栎>青冈,它们之间均存在显著差异(P<0.05);11月为马尾松、石栎显著高于苦槠、青冈(P<0.05),青冈显著高于苦槠(P<0.05);马尾松高于石栎,但差异不显著。由此可见,在4个月份中,马尾松的Amax均为最高;马尾松、苦槠的Amax为8月最高,石栎、青冈的的Amax为11月最高。
青萝向来对自己的容貌自信,但当看到女子的那张脸时,仍不免惊叹世间竟有如此美人!她看起来比自己年长不了几岁,也就十七八岁的模样,肤色白皙,面容姣好灵透,带着一种不食人间烟火的纯净和圣洁。她的身体纵然沾染了血污,她的衣服纵然残破不堪,却也丝毫不能影响到她的圣洁和美好。
4种优势种的暗呼吸速率(Rd)在同一月份中均呈现出马尾松>苦槠>石栎>青冈(表1)。其中2月、5月和11月,优势种间均存在显著差异(P<0.05);8月为马尾松显著高于苦槠(P<0.05),苦槠显著高于石栎、青冈(P<0.05)。马尾松的Rd为11月最低,与其他3个月份差异显著(P<0.05);苦槠的Rd为5月最高,显著高于其他3个月份(P<0.05),8月次之,显著高于2月、11月(P<0.05);石栎和青冈的Rd大小为5月>8月>2月>11月,石栎各月份之间差异显著(P<0.05),青冈为5月、8月显著高于2月(P<0.05),2月显著高于11月(P<0.05)。不难看出,4种优势种的Rd在不同季节中均以马尾松最高,青冈最低,苦槠和石栎介于马尾松和青冈之间。
4个月份中,马尾松的表观量子效率(AQY)为5月>2月>11月>8月,它们之间差异显著(P<0.05);苦槠的AQY为2月最高,显著高于5月、8月(P<0.05),与11月无显著差异,8月显著高于5月(P<0.05);石栎为2月最高,显著高于其他3个月份(P<0.05),11月次之,显著高于5月、8月(P<0.05);青冈为2月显著高于其他3个月份(P<0.05),其次为8月、11月,与5月差异显著(P<0.05)。2月和11月的AQY大小为青冈>石栎>苦槠>马尾松,其中2月各优势种之间差异显著(P<0.05),11月为青冈最高,显著高于苦槠、马尾松(P<0.05),与石栎差异不显著,苦槠显著高于马尾松(P<0.05);8月为青冈显著高于其他3种优势种(P<0.05),其次为石栎、苦槠,与马尾松差异显著(P<0.05);5月为青冈最高,显著高于其他3种优势种(P<0.05),石栎次之,显著高于马尾松、苦槠(P<0.05)。总之,4种优势种的AQY在不同季节中均以青冈最高,马尾松最低。
2.2.2 优势种不同季节CO2响应
不同季节马尾松的最大羧化速率(Vcmax)和最大电子传递速率(Jmax)为11月最高(表2),显著高于其他3个月份(P<0.05);苦槠为8月显著高于其他3个月份(P<0.05);石栎和青冈为11月最高,显著高于2月、5月(P<0.05),与8月差异不显著。4个月份中,马尾松均具有最高的Vcmax和Jmax,显著高于其他3种优势种(P<0.05)。
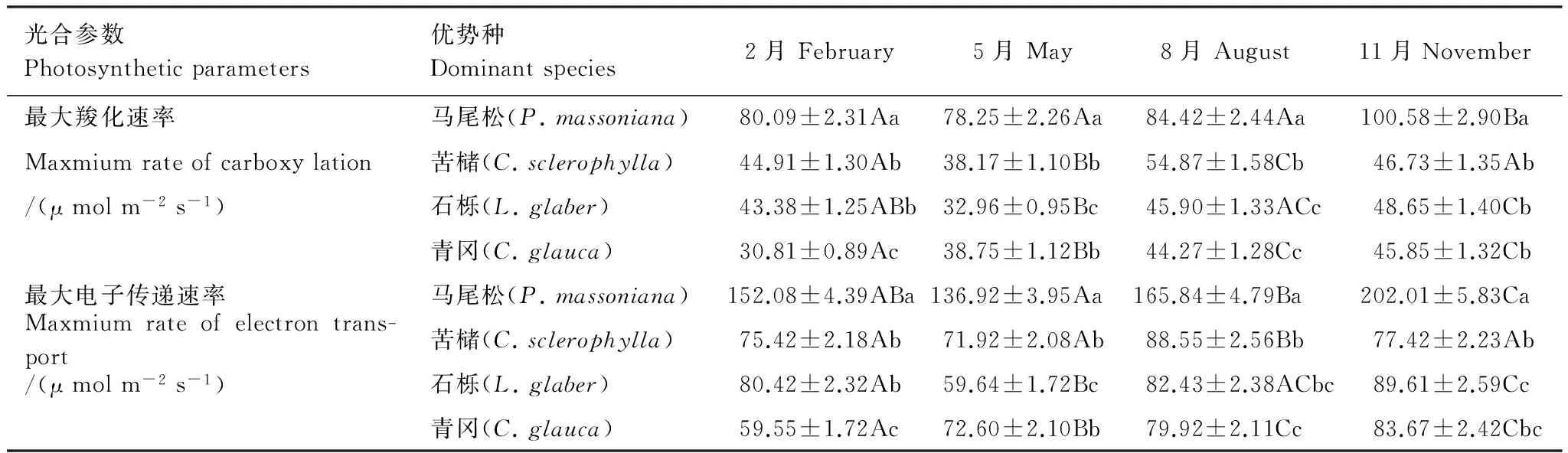
表2 优势种不同季节的CO2响应Table 2 Responses of photosynthesis to CO2 in leaves of the dominant species in difference seasons
数据为平均值±标准误差,不同小写字母表示同一列差异显著(P<0.05),不同大写字母表示同一行差异显著(P<0.05)
2.3 优势种净光合速率日积累值的季节变化
马尾松、苦槠的Pn日积累值为8月>11月>5月>2月(表3),它们之间差异显著(P<0.05)。石栎的Pn日积累值为11月>8月>5月> 2月,各月份之间差异显著(P<0.05)。青冈的Pn日积累值大小为11月>8月>2月>5月,各月份之间存在显著差异(P<0.05)。
4种优势种Pn日积累值在不同季节表现出不同的规律。2月为青冈显著高于其他3种优势种(P<0.05),其次为苦槠、马尾松,与石栎差异显著(P<0.05)。5月份,马尾松和苦槠的Pn日积累值显著高于石栎和青冈(P<0.05),马尾松与苦槠差异不明显,石栎显著高于青冈(P<0.05)。而在8月份,4种优势种的Pn日积累值大小为马尾松>苦槠> 青冈>石栎,它们之间差异显著(P<0.05)。11月为石栎最高,显著高于其它3种优势种(P<0.05),其次是青冈、马尾松,与石栎差异显著(P<0.05)。从4个月的Pn日积累值的平均值可看出,4种优势种的大小为马尾松>苦槠>青冈>石栎,各优势种之间存在显著差异(P<0.05)。

表3 优势种净光合速率日积累值的季节变化/(μ mol m-2 s-1)Table 3 Seasonal variations of the diurnal integral value of net photosynthetic rate in the dominant species
数据为平均值±标准误差,不同小写字母表示同一列差异显著(P<0.05),不同大写字母表示同一行差异显著(P<0.05)
2.4 优势种相对叶绿素含量的季节变化
由表4可知,2月和11月的相对叶绿素含量大小为青冈>石栎>苦槠>马尾松,各优势种间差异显著(P<0.05);5月为青冈显著高于其他3优势种(P<0.05),苦槠次之,与马尾松、石栎差异显著(P<0.05);8月为青冈最高,显著高于石栎、马尾松(P<0.05),与苦槠无显著差异,马尾松显著高于石栎(P<0.05)。不同季节马尾松的相对叶绿素含量为8月最高,与其他3个月差异显著(P<0.05);苦槠为8月最高,显著高于2月、5月(P<0.05),与11月差异不显著;石栎为11月显著高于其他3个月(P<0.05),其次为2月、8月,与5月差异显著(P<0.05);青冈为11月最高,显著高于5月、8月(P<0.05),与2月差异不显著。从4个月的平均值可看出,青冈的相对叶绿素含量显著高于其他3种优势种(P<0.05),其后依次是石栎、苦槠和马尾松,它们之间无显著差异。总之,在4个月份中,相对叶绿素含量以青冈最高,马尾松最低。青冈、石栎的相对叶绿素含量为11月最高,马尾松、苦槠为8月最高。
结合4种优势种4个月份的Pn日积累值可以看出,在自然光照条件下,对于同种植物而言,不同生长阶段相对叶绿素含量的变化与Pn日积累值具有一定的相关性。不同种类之间相对叶绿素含量与Pn日积累值不呈相关性。
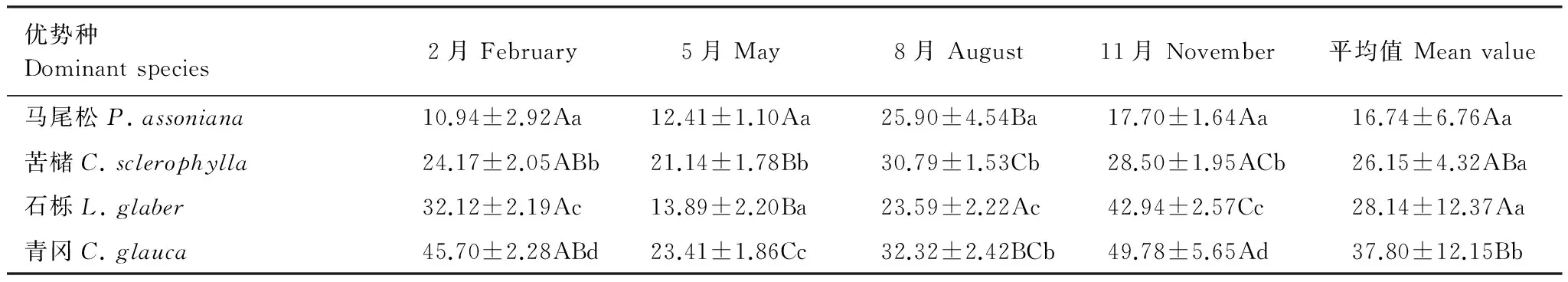
表4 优势种相对叶绿素含量的季节变化Table 4 Seasonal variations of relative content of chlorophyll in the dominant species
数据为平均值±标准误差,不同小写字母表示同一列差异显著(P<0.05),不同大写字母表示同一行差异显著(P<0.05)
3 讨论
3.1 4种优势种的光合作用日变化
植物叶片光合作用的日变化反映了不同植物对环境因子的适应性和对各种环境因子的利用能力,因植物种类、生长状态和环境因子的不同而异。研究群落中优势种光合作用日变化的特性,对分析优势种光合生产和干物质积累以及在群落中的更新具有重要意义[27]。在本研究中,马尾松Pn日变化在整个生长季节均呈“单峰”曲线,即使在8月的强光天气下,也不会产生光抑制,显示出马尾松对高光强的适应和利用能力。苦槠8月的日变化,石栎和青冈5月、8月和11月的日变化均为双峰型,出现明显的光合“午休”现象。这与幼龄拷树(Castanopsisfargesii)[28]在春、夏、秋3季为“双峰”曲线,而在冬季为“单峰”曲线相类似。根据Farquhar等[29]的观点,如果Pn和Ci变化方向相同,并且Gs降低时Pn的降低是气孔因素造成的;如果Pn和Ci变化方向相反,并且Gs增大,则Pn的下降主要是由非气孔限制,即叶肉细胞同化能力的降低引起的。8月苦槠Pn午间下降,此时测得Ci和Gs也同时下降,可见苦槠光合“午休”是由气孔因素导致的。引起这种现象的主要原因可能是,8月该地区的气温和光照强度都很高,苦槠叶片蒸腾旺盛,为了控制水分的散失,气孔开度逐渐降低,阻断了与外界气体交换的正常进行,使Ci大幅度降低,导致苦槠光合作用原料——CO2的供应不足,使Pn降低。石栎和青冈在5月、8月和11月,Pn午间下降,而石栎和青冈的Ci和Gs同时升高,说明它们的光合“午休”是非气孔因素造成的。造成这种现象的原因可能是光能过剩,即光强已经超过了石栎和青冈叶片光合机构所能利用的数量,表现出明显的光抑制。下午石栎和青冈的Pn略有回升,说明它们的光抑制是保护性反应,而非光合机构的破坏[30]。本研究中,马尾松在整个生长季节均无光合“午休”现象,在光照强度充足的群落中其物质积累能力最强,生长最快,因而在次生林演替前期是绝对优势种。与石栎和青冈相比,苦槠Pn较高,“午休”程度小,仅8月存在光合“午休”,一天中高光合速率持续的时间长,在高光环境下物质积累比石栎和青冈多,生长快,故在次生林演替前期也具有一定的优势。石栎和青冈在3个季节中都存在光合“午休”,光能利用率较低。因而在次生林演替前期,石栎和青冈均无法取得优势地位。
3.2 4种优势种的光响应及CO2响应
植物的LCP与LSP反映了植物对光照条件的要求,一般LCP、LSP均较高是典型的演替前期阳性植物,反之是后期耐荫植物。同样Amax、Rd也表现为演替早期植物>中期植物>后期植物[31]。本研究中,马尾松在4个季节中均具有最高的LCP、LSP、Amax、Rd,为典型演替前期强阳性植物。通常阳性植物都表现出较高的Vcmax[32],马尾松在整个生长季均具有最高的Vcmax,亦能说明马尾松具强阳性树种的特点。LSP和Amax高,表明马尾松耐强光,在强光生境中有较多的光合积累;但马尾松的LCP、Rd也较高,表明其不耐荫,对弱光的利用能力差,在郁闭的环境中马尾松经常处于LCP之下,常常处于“饥饿”状态,难以存活而被淘汰。在4个季节中,青冈的LCP、LSP、Amax及Rd最低,表现出对弱光环境的适应性更高,在弱光环境中具更强竞争力,为演替后期耐荫植物。苦槠和石栎的光合特性介于马尾松和青冈之间,其中苦槠4个月的LSP,2月、5月和8月的Amax高于石栎,表明苦槠对强光的利用能力和适应性高于石栎。此外,其Rd显著高于石栎,说明其对林下等弱光环境的耐受能力低于石栎。分析各优势种的AQY也可以反映物种对弱光的利用能力以及对荫蔽环境的适应能力[33]。青冈在4个季节中均具有最高的AQY,表明青冈对弱光的利用能力最强,弱光下仍具有较高的光量子利用效率,具有极强的适应林下等荫蔽环境的能力。石栎在2月、5月和8月的AQY高于苦槠,说明石栎在这3个月对荫蔽环境的适应能力比苦槠强,与苦槠相比,具有一定的耐荫性。丁圣彦和宋永昌[34]也发现石栎具有一定的耐荫性, 并在一定程度上适应郁闭的生境而表现一定的生长速率。而马尾松在整个生长季的AQY均最低,表明其对弱光的利用能力最差,在林下等荫蔽环境中将无法生存而逐渐退出该群落。
3.3 4种优势种Pn日积累值的季节变化
Pn决定着植物物质积累能力的高低,在一定程度上也决定了植物生长的快慢[34]。已有的研究表明,常绿阔叶林群落的演替方向及更替的机理主要与优势种光合速率有关[34]。丁圣彦[35]研究指出,栲树和木荷(Schimasuperba)的光合速率明显地高于石栎和苦槠,为栲树和木荷在常绿阔叶林演替系列中最终成为优势种奠定了生理生态学的基础。而在本研究中,马尾松和苦槠4个月的Pn日积累值的平均值显著高于石栎和青冈,表明马尾松和苦槠的光合能力比石栎和青冈强,在自然光照下,能通过叶片光合组织固定更多的碳量,积累更多的物质,而在次生演替前期阶段的群落中成为优势物种。其中,马尾松对光强的利用能力高于苦槠。但从综合各种因素来看,马尾松为针叶树种,树冠稀疏,总叶面积小;而苦槠为常绿阔叶树种,分枝强烈,树冠较大。这就使得马尾松植株的总光合量小于苦槠,在与苦槠竞争过程中很难取得优势地位。石栎和青冈4个月的Pn日积累值的平均值低于马尾松和苦槠,在次生林演替前期无法与阳性树种马尾松和苦槠竞争。但石栎和青冈对弱光利用能力强于马尾松和苦槠。随着演替的进行,群落内光照减弱,耐阳性树种马尾松和苦槠将逐渐被耐荫性强的石栎和青冈所取代。
从以往的研究可看出,处于不同演替阶段的物种,其生理生态特性以及对环境的适应性有很大差别,这些物种的生理生态差异使得物种更替现象经常发生,从而保证演替能够顺利进行[10]。在本实验中,马尾松和苦槠的Pn日积累值8月最高,而石栎和青冈11月最高。从地区气候特点和4种优势种的光合速率来看,8月是阳性树种马尾松和苦槠光合作用的最适合季节,它们能高效利用8月高光照合成自身物质。11月是耐荫性较强树种石栎和青冈光合作用的最适合季节,此时它们的叶片已完全发育成熟,温度和光照等条件适宜,净光合速率可达全年最高。由此可见,4种优势种Pn日积累值季节变化的种间差异是环境条件和植物自身生长节律共同作用的结果,正是这种光合生理生态特性的差异,才使得群落演替能够顺利进行。
总之,马尾松是一个强阳性树种,在光照充足的生境中其物质积累能力强,生长快,因而是演替前期群落的优势种。随着进展演替,群落郁闭度的增大,马尾松将逐渐退出群落。苦槠为阳性树种,在群落演替的前期光合速率较高,发育良好,但一旦群落较为郁闭,其生存将受到威胁,将可能退出演替最终结果的常绿阔叶林。耐荫性较强的石栎和青冈,在低光环境下具有较高的AQY和相对叶绿素含量,有充分利用弱光的能力,在群落演替后期、郁闭度较大的常绿阔叶林中生长、发育良好,将成为顶极群落的优势种。
[1] Spurr S H. Origin of the concept of forest succession. Ecology, 1952, 33(3): 426- 427.
[2] McCook L J. Understanding ecological community succession:Causalmodelsandtheories,areview. Vegetatio, 1994, 110(2): 115- 147.
[3] Travis S E, Hester M W. A space-for-time substitution reveals the long-term decline in genotypic diversity of a widespread salt marsh plant,Spartinaalterniflora, over a span of 1500 years. Journal of Ecology, 2005, 93(2): 417- 430.
[4] Bazzaz F A. The physiological ecology of plant succession. Annual Review of Ecology and Systematics, 1979, 10: 351- 371.
[5] Bazzaz F A, Carlson R G. Photosynthetic acclimation to variability in the light environment of early and late successional plants. Oecologia, 1982, 54(3): 313- 316.
[6] Houghton J T, Callander B A, Varney S K. Climate Change 1992: the Supplementary Report to the IPCC Scientific Assessment. Cambridge: Cambridge University Press, 1992: 18- 27.
[7] Vitousek P M. Beyond global warming: ecology and global change. Ecology, 1994, 75(7): 1861- 1876.
[8] Woodwell G M, Maekenzie F T. Biotic Feedbacks in the Global Climatic System; Will the Warming Feed the Warming? New York: Oxford University Press, 1995: 2- 12.
[9] 常杰, 葛滢, 陈增鸿, 潘晓东, 刘珂, 陈启瑺. 青冈常绿阔叶林主要植物种叶片的光合特性及其群落学意义. 植物生态学报, 1999, 23(5): 393- 400.
[10] 李庆康, 马克平. 植物群落演替过程中植物生理生态学特性及其主要环境因子的变化. 植物生态学报, 2002, 26(S1): 9- 19.
[11] 蔡锡安, 彭少麟, 夏汉平. 不同演替阶段树种的光合和生长对增强UV-B辐射的响应. 中山大学学报: 自然科学版, 2007, 46(2): 72- 76.
[12] 安慧, 上官周平. 黄土高原植被不同演替阶段优势种的光合生理特性. 应用生态学报, 2007, 18(6): 1175- 1180.
[13] Lambers H, Champin F S III, Pons T L. Plant Physiological Ecology. New York: Springer-Verlag, 1998; 34- 34.
[14] Boardman N K. Comparative photosynthesis of sun and shade plants. Annual Review of Plant Physiology, 1977, 28: 355- 377.
[15] Braatne J B, Bliss L C. Comparative physiological ecology of lupines colonizing early successional habitats on Mount St. Helens. Ecology, 1999, 80(3): 891- 907.
[16] Bazzaz F A. Plants in Changing Environments: Linking Physiological, Population, and Community Ecology. New York: Cambridge University Press, 1996: 264- 280.
[17] 余树全, 李翠环, 姜礼元, 谢吉全. 千岛湖天然次生林群落生态学研究. 浙江林学院学报, 2002, 19(2): 138- 142.
[18] 陈鑫锋. 千岛湖地区主要森林植被类型及其演替. 浙江林学院学报, 1989, 6(2): 202- 206.
[19] 卢剑波, 丁立仲, 徐高福. 千岛湖岛屿化对植物多样性的影响初探. 应用生态学报, 2005, 16(9): 1672- 1676.
[20] 张欣, 徐高福, 沈栋伟, 顾泳洁, 高辉, 罗小华, 陈小勇. 千岛湖岛屿苦槠(Castanopsissclerophylla)种群的维持和天然更新. 生态学报, 2007, 27(2): 424- 431.
[21] 金则新, 熊能. 千岛湖次生林优势种幼苗光合特性及其对群落演替的指示意义. 浙江大学学报: 理学版, 2011, 38(5): 570- 578.
[22] Harms K E, Wright S J, Calderón O, Hernández A, Herre E A. Pervasive density-dependent recruitment enhances seedling diversity in a tropical forest. Nature, 2000, 404(6777): 493- 495.
[23] 熊能, 金则新, 顾婧婧, 王小伟, 宋文静. 千岛湖次生林优势种种群结构与分布格局. 生态学杂志, 2010, 29(5): 847- 854.
[24] 姜卫兵, 李刚, 翁忙玲, 姜武, 曹晶, 汪良驹. 五种木兰科树种在南京地区冬春季节的光合特征. 应用生态学报, 2007, 18(4): 749- 755.
[25] Farquhar G D, von Caemmerer S, Berry J A. Models of photosynthesis. Plant Physiology, 2001, 125(1): 42- 45.
[26] Long S P, Bernacchi C J. Gas exchange measurements, what can they tell us about the underlying limitations to photosynthesis? Procedures and sources of error. Journal of Experimental Botany, 2003, 54(392): 2393- 2401.
[27] 李昊民. 常绿阔叶林演替系列主要优势种光合生理生态特性比较研究 [D]. 开封: 河南大学, 2004.
[28] 周莉, 钟章成. 四川缙云山常绿阔叶林幼龄栲树光合生理生态研究. 西南师范大学学报: 自然科学版, 1994, 19(2): 187- 195.
[29] Farquhar S P, Sharkey T D. Stomatal conductance and photosynthesis. Annual Review of Plant Physiology, 1982, 33: 317- 345.
[30] 许大全, 张玉忠, 张荣铣. 植物光合作用的光抑制. 植物生理学通讯, 1992, 28(4): 237- 243.
[31] 吴统贵, 吴明, 萧江华. 杭州湾湿地不同演替阶段优势物种光合生理生态特性. 西北植物学报, 2008, 28(8): 1683- 1688.
[32] Farquhar G D, Caemmerer S V. Modeling of photosynthetic response to environmental conditions // Lange O L, Nobel P S, Osmond C B, Ziegler H. Physiological Plant Ecology, Vol. Ⅱ. Encyclopedia of Plant Physiology 12B. Berlin: Springer-Verlag, 1982: 549- 587.
[33] 刘飞虎, 梁雪妮, 刘小莉. 4种野生报春花光合作用特性的比较. 园艺学报, 2004, 31(4): 482- 486.
[34] 丁圣彦, 宋永昌. 浙江天童常绿阔叶林演替系列优势种光合生理生态的比较. 生态学报, 1999, 19(3): 318- 323.
[35] 丁圣彦. 浙江天童常绿阔叶林演替系列栲树和木荷成为优势种的原因. 河南大学学报: 自然科学版, 2001, 31(1): 79- 84.
Photo-ecological characteristics of the dominant plant species in the secondary forest surrounding Qiandao Lake, Zhejiang, China
GUAN Ming1, JIN Zexin1,*, LI Yueling1,2, WANG Qiang1,2
1InstituteofEcology,TaizhouUniversity,Linhai317000,China2CollegeofLifeandEnvironmentalSciences,ShanghaiNormalUniversity,Shanghai200030,China
The main factors that influence community succession in an evergreen broadleaf forest are differences in the ecological adaptability and eco-physiological traits of the various dominant plant species. Studies of the eco-physiological traits of these dominant species allow researchers to better understand the physiological demands and ecological traits of dominant species in their forest habitat and these studies also help researchers to recognize and understand the intrinsic mechanisms involved in forest regeneration and the mechanisms driving ecological succession in an evergreen broadleaf forest at the individual species level. In this study, we used a portable photosynthesis system to determine various physiological parameters associated with plant growth. We investigated the seasonal dynamics of the diurnal variations of photosynthesis, the responses to both light and CO2, and the relative chlorophyll content of the dominant plant species in the secondary forest surrounding Qiandao Lake, Zhejiang, China. The species includedPinusmassoniana,Castanopsissclerophylla,LithocarpusglaberandCyclobalanopsisglauca. The results showed the following. (1) Diurnal variations of the net photosynthesis rate (Pn) ofP.massonianaexhibited a monomodal curve in all four seasons, while the variations inPnforC.sclerophyllawere bimodal in August but had a single curve in the other three time seasons investigated. Diurnal variations ofPnofL.glaberandC.glaucaexhibited a typical bimodal curve with obvious “midday depression” in May, August and November but had a monomodal curve in February. (2) The diurnal integral values ofPnofP.massonianaandC.sclerophyllawere significantly higher in August than those in the other three seasons, while those ofL.glaberandC.glaucawere significantly higher in November than those in the other three time periods investigated. The average value of the diurnal integral value ofPnin the four dominant species differed significantly in all four seasons and was ranked in the order of:P.massoniana>C.sclerophylla>L.glaber>C.glauca; (3) Compared with the other three dominant species, forP.massoniana, the light saturation point (LSP), light compensation point, maximum net photosynthetic rate, dark respiration rate (Rd), maximum rate of carboxylation and maximum rate of electron transport were highest in all four seasons, while the apparent quantum yield (AQY) was the lowest. The LSP andRdofC.glaucawere the lowest, while the AQY ofC.glaucawas the highest in the four seasons. Photosynthetic characteristics ofC.sclerophyllaandL.glaberwere moderate among the four species. (4) In all four seasons, the relative chlorophyll content ofC.glaucawas the highest among the four dominant species, while that ofP.massonianawas the lowest. All these results indicate thatP.massonianaandC.sclerophyllaare shade intolerant species and moderately shade intolerant species, respectively, whileL.glaberandC.glaucaare strongly shade tolerant species, althoughC.glaucais more strongly shade tolerant when compared withL.glaber. Based on these findings, we concluded thatP.massonianaandC.sclerophyllawill withdraw from the community during the succession.L.glaberandC.glaucawill become the dominant species in the secondary forest surrounding Qiandao Lake as these forests mature.
Qiandao Lake; secondary forest; dominant plant species; photosynthesis traits; seasonal variation
浙江省自然科学基金项目(Y507660); 台州学院培育基金资助项目(2013PY21)
2013- 06- 04;
日期:2014- 05- 08
10.5846/stxb201306041323
*通讯作者Corresponding author.E-mail: jzx@tzc.edu.cn
管铭,金则新,李月灵,王强.千岛湖次生林优势种植物光合生理生态特性.生态学报,2015,35(7):2057- 2066.
Guan M, Jin Z X, Li Y L, Wang Q.Photo-ecological characteristics of the dominant plant species in the secondary forest surrounding Qiandao Lake, Zhejiang, China.Acta Ecologica Sinica,2015,35(7):2057- 2066.
