适宜加工凝胶型和溶解型蛋白质花生品种的SSR标记分析
2015-03-11于宏威沈敏江刘红芝
于宏威 王 强 沈敏江 王 丽 刘 丽 刘红芝
(中国农业科学院农产品加工研究所农业部农产品加工综合性重点实验室,北京 100193)
花生是我国重要的经济作物、食用作物和油料作物[1]。2012年我国花生产量为1 686万t,占世界总产量的 40.88%,居世界首位[2]。花生中含有25%~30%的蛋白质,含量仅次于大豆,而高于芝麻、油菜籽和葵花籽[3]。研究发现花生蛋白质不仅具有良好的溶解性、持水性和凝胶性,而且比大豆蛋白质更易吸收,这些因素决定了花生蛋白质是继大豆蛋白质之后的又一个新的优质蛋白质资源[4-5]。由于花生蛋白具有良好的加工特性和营养特性以及花生的良好风味,花生蛋白已经被应用于许多食品加工中,如利用花生蛋白溶解性,生产代乳品和饮料等蛋白质强化食品[6];利用花生蛋白凝胶性,添加于火腿和香肠中,以增加产品的口感和营养[7]。王丽等[8]研究发现不同花生品种的蛋白质凝胶性和溶解性存在显著差异,其中鲁花11、花育22和双纪2号等品种蛋白质具有较好的凝胶性,白沙1016、五彩花生和白花生的品种蛋白质具有较好的溶解性。品种间蛋白质加工特性的差异源自于遗传特性的差异,因此通过寻找花生蛋白加工特性与基因之间的关系,定向选育加工性状较好的品种,预测其蛋白加工特性,扩大花生蛋白在食品工业中的应用范围。
SSR称为简单重复序列(Simple Sequence Repeats),或称为微卫星 DNA(Microsatellite DNA)。SSR标记是基因组中保守性较强的单一序列,可以人工合成引物并PCR扩展,扩展产物长度上的变化会产生多态性,可以用于作物的资源多态性分析和基因定位[9]。花生SSR分子标记已取得了显著进步,王金彦等[10]统计已经有800多个基因组SSR分子标记以及200多个EST-SSR分子标记得到开发。目前花生SSR分析的研究主要集中在品质性状和花生抗病性等方面。赵新燕[11]对野生花生的含油量与SSR标记作了关联分析,检测到65个位点与油脂性状相关。李卫青[12]从80对花生SSR引物中筛选出7对多态性丰富的引物,利用这7对引物对59种花生进行了SSR多态性分析和聚类分析,结果能很好地体现这些花生品种间存在的地域特性和品种特性,并由此构建了花生的SSR指纹图谱。唐荣华等[13]采用36对SSR引物,其中10对引物可以区别24个珍珠豆型花生品种,每对SSR引物扩增出1~6个DNA片段,聚类分析将这24个珍珠豆型花生品种划分为4个品种群。洪彦彬等[14]从100对SSR引物筛选出了1个与黄曲霉浸染指数相关联的标记,并推断其与1个贡献率较大的抗黄曲霉基因连锁。姜慧芳等[15]利用重组近交系群体检测了花生青枯病抗性SSR标记,获得了与2个与青枯病抗性相关的SSR标记。
SSR标记已对品质性状和花生抗病性有了初步的研究,并取得了较好的效果。但不同花生品种蛋白质凝胶性和溶解性差异性的研究还没有涉及到基因方面。因此,本研究在对花生蛋白凝胶性和溶解性研究基础上,利用SSR标记技术分析不同花生品种,并找出两者间的内在联系,从而阐述花生蛋白凝胶性和溶解性与基因之间存在的关系,找出相关的引物,为定向育种和预测未知品种的加工特性提供参考。
1 材料与方法
1.1 材料与试剂
选用河南、山东等主载省份主栽花生品种共计80个,对其进行编号,如表1所示。
参考国内外文献[12,16-18],选取文献中扩增效果较好的35对SSR引物(表2),由北京奥科鼎盛生物科技有限公司合成。

表1 试验选用的花生品种

表2 试验选用的引物

表2 (续)
1.2 仪器与设备
KJELTEC 2300自动凯氏定氮仪:丹麦FOSS公司;90-4数显控温磁力搅拌器:上海振荣科学仪器有限公司;M-CENTRIFUGE小型离心机:美国Andy bio;Veriti温度梯度PCR仪:美国Applied Biosystems公司;Mini-PROTEAN Tetra垂直电泳系统:美国BIO-RAD。
1.3 试验方法
1.3.1 蛋白质凝胶性的测定
制备蛋白质凝胶。取一定量花生分离蛋白质溶于磷酸盐缓冲液(pH 7.0,含有 0.06 mol/L CaCl2)中,室温下搅拌120 min。取10 mL于15 mL烧杯中,用保鲜膜封口后置于90℃水浴中加热60 min,取出后用流动水冷却至室温后,置于4℃冰箱中,放置18 h后测定。蛋白质凝胶型的测定和计算参照王丽[19]的方法。
1.3.2 蛋白质溶解性的测定
准确称取1.000 g花生蛋白质(N)(蛋白质纯度为P)于三角瓶中,加40 mL蒸馏水摇匀,置于30℃恒温水浴振荡器中,150 r/min震荡120 min,然后将混合液转移至50 mL(V1)容量瓶中,加水定容,静置5 min后,取上清液1 500 r/min离心10 min,上清液用定量滤纸过滤,量取15 mL(V2)于消化管中,置于150℃烘箱中浓缩120 min,采用凯氏定氮法测定浓度(C,mg/mL),用氮溶解指数表示花生蛋白质溶解性[19],氮溶指数的计算公式如下:

1.3.3 DNA 的提取
取未展开花生叶片0.2~0.3 g,在液氮冷冻下迅速研磨成粉末,DNA提取参照 Haymes[20]的 CTAB法。将提取DNA进行分装,5μL/管放入冰箱中保存。
1.3.4 PCR 反应
采用20μL反应体系进行 SSR扩增:2×Taq PCR MasterMix10 μL(天根公司),100 ng/μL DNA 模板1μL,10μmol/L引物各1μL,双蒸水7μL。PCR反应程序:94℃ 5 min;94℃ 40 s,53℃ 40 s,72℃1 min,循环35次;72℃ 10 min;4℃保存。
1.3.5 制胶
玻璃板清洗干净后晾干,在制胶架上固定,用2%的琼脂封住玻璃板的底部,配胶(6%PAGE胶40 mL,加入 200μL 10%的过硫酸铵和 40μL的TEMED,混匀),用5 mL移液枪将配好的胶液灌入制好的胶板间,插入梳子,室温放置40 min即可使用。
1.3.6 电泳流程
将胶板安装在电泳槽上,上下槽中各加1×TBE约500 mL,拔出梳子,迅速上样PCR产物4μL,用PowerPac基础电泳仪110 V电压下电泳90 min。
1.3.7 快速银染法
电泳完毕后,将胶从胶板上剥离,采用快速银染法,分别加入固定液、前处理液、染色液、显色液、终止液等试剂。经过固定、前处理、染色、显色、终止后将胶拍照保存。
1.4 数据分析
数据处理是采用MSExcel 2010、NTSYS-2.1和SPSS 20.0软件,所有试验均重复3次。
2 结果与分析
2.1 不同花生品种蛋白质的溶解性和凝胶性测定
不同花生品种蛋白质的溶解性和凝胶性数据本课题组已完成测定,结果如表3所示。
花生蛋白质凝胶性和溶解性数据分析(表4)表明,2个指标的中位数均接近其均值,说明这些数据的离群点较少;2个指标的变异系数<15%(分别是14.85%和4.17%),变异系数较小,说明它们的离散程度较小;2个指标的数据变差均较少,在3%以内,说明所选花生品种蛋白质的凝胶性和溶解性数据分布均匀,品种选择合理。
2.2 SSR引物对各花生品种的多态性分析
35对SSR引物中,有14对引物无扩增产物,14对引物有扩增产物,但产物无多态性。显示多态性的引物为7对,这7对引物的多态性扩增结果如表5所示。

表3 不同花生品种蛋白质的凝胶性和溶解性

表4 花生蛋白质凝胶性和溶解性的分析
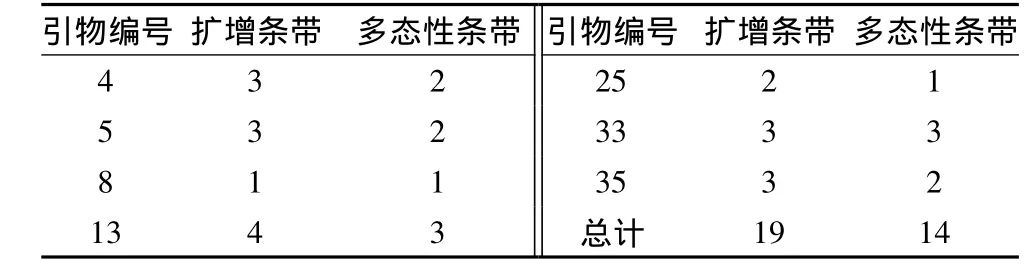
表5 SSR标记多态性
表5中可以看出,7对引物共扩增出19条带,其中14条带具有多态性,平均每对引物2条,多态频率为74.7%,其中多态性最好的是13号引物和33号引物,扩增出3条带特异性条带。最差的8号引物和25号引物,扩增1条带。表明花生品种之间存在着丰富的变异性。在SSR标记电泳的读取过程中,经常会出现一些大于或小于真实等位基因的条带,被称为“影子带”,出现影子带的原因是在PCR扩增时,SSR复制的过程中双核苷酸重复序列发生滑动错配,导致产生各种不同长度的片段[21]。
根据4号引物扩增条带的大小(图1),可以将花生分为2类,其中泉花551、白沙1016、五彩花生、粤油25、桂花35、花育20、白花生、鲁花 12、豫花14、粤油551、莆花23、中花4、远杂 9307、湘花509 -77和远杂9102这些品种扩增出来的条带较小,归为一类。从不同花生品种蛋白质凝胶性和溶解性的表3中可以看出上述花生品种蛋白质凝胶性都比较差,因此推断4号引物可能与花生蛋白的凝胶性存在关系。35号引物扩增出3条条带,其中2条具有多态性,从图2中可以看出蛋白质凝胶性较好的品种之间,存在着不同基因类型,蛋白质凝胶性的差异性表现出基因型条带的差异。不同SSR引物扩增产物可能与花生蛋白的凝胶性和溶解性有关系,可以初步判断这些条带的差异会导致花生蛋白加工特性的差异。

图1 SSR引物4的扩增产物电泳图

图2 SSR引物35的扩增产物电泳图
2.3 花生品种的聚类分析

图3 80个花生品种的SSR聚类图
根据7对引物扩增产物的电泳图,在相同迁移位置上,有清晰条带的记为1,无清晰条带的记为0,建立0-1 EXCEL 矩阵[8],用 NTSYS-2.1软件对数据进行聚类分析,绘制树状图(图3)。聚类结果将具有相似加工性质的品种归为一类,类与类之间存在较大差异。在相似系数0.67处,80个花生品种可以分为4大类群,其中第3类群为鲁花11、双纪2号、丰花1号、开农30、丰花3、花冠王、山花7、豫花 15、潍花 6 号、花 27、花 37、山花 9、双基 22、花育 16、中花8、青兰8、徐花13、豫花11、豫花9327、黑花生、豫花9326、莆花23,该类群中花生蛋白凝胶性都较好;第2类群为闽花9号、桂花166、闽花10、白沙 101、徐花 14、花育 20、白花生、泉花 551、豫花 14、鲁花 12、桂花 35、粤油 25、远杂 9307、白沙1016、粤油551、远杂9102、五彩花生、中花4、湘花509-77,该类群中花生蛋白凝胶性都较差,与上述电泳图结果保持一致。在第2类群中,相似系数为0.77处,可以看出蛋白质溶解性较好的白沙1016、五彩花生、白沙 101、白花生、粤油 25等品种聚为一类。但同时也发现,本研究筛选出的7对引物虽然可以区分大多数的花生品种并将加工特性相似的聚类到一起,但还有花生品种无法区分,有一些加工特性相近的品种不能聚到一起。这是由于花生栽培品种间分子多态性相对缺乏,目前开发的花生SSR标记较少,选用的引物数量不够多,且已建立的花生遗传图谱信息量较少[22],许多基因的功能还没有确定,所以只能通过大批量地筛选才能够保证覆盖花生全基因组的信息。
2.4 SSR标记与加工特性的关联分析
对每个引物的电泳图谱条带进行赋值,最大迁移位置的条带记为1,随着迁移位置变小,条带赋值依次加1,最后对每个花生品种的条带赋值求和作为该品种的基因型数据[14],并采用SPSS 20.0软件对花生的SSR基因型与功能特性数据进行关联分析,结果如表6所示。4号引物和33号引物与蛋白质凝胶性的相关系数分别为0.481和0.421,表现出一定的相关性,可以初步判断引物4号和33号扩增的片段与花生蛋白凝胶性有一定的关系。溶解性的相关性不高,一是由于筛选的引物较少,不能将所有花生基因涵盖,二是与花生群体结构的组成有较大的关系,因为具有高度遗传多样性的种质群体是进行表型与SSR标记关联分析的前提[14],本研究选用的花生品种数量只有80个,而这80个品种可能没有包含该物种所有的遗传变异。下一步的研究将增加花生品种的数量,并且加入加工特性表现较差的品种来增加花生群体结构的多样性。

表6 SSR标记与加工特性的关联分析
3 结论
3.1 本研究比较了35对引物多态性,其中7对引物具有多态性,扩增出19条带,其中14条带具有多态性,平均每对引物2条,多态性频率为74.7%。多态性最好的是13号引物和33号引物,扩增出3条带特异性条带;最差的8号引物和25号引物,扩增1条带。表明SSR在花生中的信息量很高。
3.2 4号引物扩增条带及关联分析的结果表明:4号引物与花生蛋白凝胶性存在关系,扩增出较小片段的花生品种,蛋白质凝胶性一般较差。故可以用4号引物预测未知花生品种蛋白质的加工特性,如果扩增出较小片段,则可初步推断该品种蛋白质凝胶性较差。
3.3 利用SSR标记技术有效得将不同加工特性花生品种进行分类。聚类分析将80个花生品种划分为4品种群。将蛋白质凝胶性好的花生品种归为第3类;将蛋白质凝胶性差的花生品种归为第2类;将蛋白质溶解性好的花生品种也归为一类。
3.4 花生SSR标记与加工特性的关联分析结果表明:4号引物和33号引物与花生蛋白凝胶性的相关系数分别为0.481和0.421,表现出一定的相关性;7对引物中,无与溶解性存在关系,主要是由于筛选的引物较少,不能将所有花生基因涵盖。下一步将增加引物和花生品种,来寻找控制花生蛋白凝胶性和溶解性的基因,进而定向地培育具有高溶解性或高凝胶性花生蛋白的品种,解决花生蛋白在实际应用中所遇到的难题,扩大花生蛋白在食品工业中的应用范围,促进花生产业健康发展。
[1]汤松,禹山林,廖伯寿,等.我国花生产业现状,存在问题及发展对策[J].花生学报,2010,39(3):35 -38
[2]FAO:http://faostat3.fao.org/faostat- gateway/go/to/download/Q/QC/E[EB/OL]
[3]万书波,封海胜,王秀贞.花生营养成分综合评价与产业化发展战略研究[J].花生学报,2004,33(2):1 -6
[4]吴海文,王强,马铁铮.不同制备方法对花生蛋白功能性质的影响[J].农业工程学报,2009(4):304-308
[5]封小龙,刘红芝,刘丽,等.冷沉法制备花生球蛋白及伴花生球蛋白工艺研究[J].中国粮油学报,2014:57-62,73
[6]Mouecoucou J,Fremont S,Sanchez C,et al.In vitro allergenicity of peanut after hydrolysis in the presence of polysaccharides[J].Clinical& Experimental Allergy,2004,34(9):1429 -1437
[7]Yu J.,Mohamed A.,Ipek G.Peanut protein concentrate:production and functional properties as affected by processing[J].Food Chemistry,2007,103(1):121 -129
[8]王丽,王强,刘红芝,等.不同品种花生分离蛋白凝胶性评价方法的研究[J].中国油脂,2012(7):20-23a
[9]王强.花生加工品质学[M].北京:中国农业出版社,2013
[10]王金彦,杨庆利,禹山林.花生SSR分子标记的开发与利用[J].中国油料作物学报,2009(3):401-406
[11]赵新燕.野生花生含油量与SSR标记的关联分析[D].北京:中国农业科学院,2011
[12]李卫青.丰花系列花生品种特异SSR标记筛选及其生理性状的遗传分析[D].泰安:山东农业大学,2009
[13]唐荣华,庄伟建,高国庆,等.珍珠豆型花生的简单序列重复(SSR)多态性[J].中国油料作物学报,2004,26(2):20-26
[14]洪彦彬,李少雄,刘海燕,等.SSR标记与花生抗黄曲霉性状的关联分析[J].分子植物育种,2009,7(2):360 -364
[15]姜慧芳,陈本银,任小平,等.利用重组近交系群体检测花生青枯病抗性 SSR标记[J].中国油料作物学报,2007,29(1):26 -30
[16]Guohao He,Ronghua Meng,Melanie Newman,et al.Microsatellites as DNA markers in cultivated peanut(Arachis hypogaea L.)[J].BMCPlant Biology,2003(3):3
[17]唐荣华.花生属种质资源遗传多态性和分子分类研究[D].福州:福建农林大学,2004
[18]张建成.分子标记技术在花生品种鉴定中的应用研究[D].北京:中国农业大学,2005
[19]王丽.蛋白用花生加工特性与品质评价技术研究[D].北京:中国农业科学院,2012
[20]Haymes K.Mini2prep method suitable for a plant breeding program[J].Plant Molecular Biology Report,1996,14:280-284
[21]Testolin R,Marrazzo T,Cipriani G,et al.Microsatellite DNA in peach(Prunus persica L.Batsch)and its use in fingerprinting and testing the genetic origin of cultivars[J].Genome,2000,43(3):512-520
[22]洪彦彬,梁炫强,陈小平,等.花生栽培种SSR遗传图谱的构建[J].作物学报,2009,35(3):395 -402.
