UPLC-MS/MS法测定玉米中13种真菌毒素
2015-03-11辛媛媛王松雪贺小蔚
辛媛媛 张 艳 王松雪 吴 宇 贺小蔚
(国家粮食局科学研究院,北京 100037)
玉米是我国主要的粮食作物,由于含有丰富的营养物质,在田间和储存过程中常受到多种真菌的污染而产生真菌毒素,例如镰刀菌产生脱氧雪腐镰刀菌烯醇(Deoxynivalenol,DON)、玉米赤霉烯酮(Zearalenone,ZEN)和伏马毒素(Fumonisins,FBs),黄曲霉产生黄曲霉毒素(Aflatoxins,AFs)。欧盟已制定了玉米中DON、ZEN、AFs、FBs、赭曲霉毒素(OTA)、T -2和 HT -2 等真菌毒素的法规限量和推荐限量[1-2],我国食品安全国家标准规定玉米原粮中DON限量为1 000μg/kg,ZEN限量为60μg/kg,黄曲霉毒素 B1(AFB1)限量为20 μg/kg,OTA 限量为5 μg/kg[3]。
相比较基于免疫技术的色谱和光谱法,液相色谱质谱法(LC-MS)具有更高的灵敏度和选择性,可以进行多种毒素同时确证和精确定量[4-5]。Berthiller等[6]使用MycoSep 226多功能净化柱建立了同时检测玉米中单端孢霉烯族毒素和ZEN的LC-MS方法。Lattanzio等[7]使用2次溶剂提取和六合一多毒素免疫亲和柱净化的方法建立同时检测DON、ZEN、AFs、FBs、OTA、T-2和 HT-2等真菌毒素的方法。由于毒素理化性质差异较大,净化不可避免造成某些毒素的损失,例如MycoSep 226多功能净化柱吸附FBs、糖苷化DON和OTA等毒素[8],而六合一免疫亲和柱柱容量有限、价格昂贵、对操作者要求高,推广应用受到一定限制。
近年来,超高压液相色谱串联质谱仪(UPLCMS/MS)使用高柱效的亚微米级填料色谱柱和高灵敏度、高选择性的串联质谱检测器,大大提高了真菌毒素检测灵敏度,在满足限量标准对定量限要求的前提下,可以将提取液稀释后直接注入LC-MS仪器进行检测,有效避免了净化过程中目标物的损失,减少对特殊材料的依赖,实现多种毒素同时快速检测。本试验采用UPLC-MS/MS法,通过优化提取溶剂和色谱质谱条件降低基质干扰,建立了一种不需要使用特殊净化材料可快速准确测定玉米中DON及其乙酰化衍生物、ZEN、AFs、FBs、OTA、T -2 和 HT -2等13种重要真菌毒素的方法。
1 试验方法
1.1 材料与试剂
脱氧雪腐镰刀菌烯醇(DON)、3#乙酰基脱氧雪腐镰刀菌烯醇(3#AcDON)、15#乙酰基脱氧雪腐镰刀菌烯醇(15#AcDON)、T#2毒素(T#2)、HT#2毒素(HT#2)、玉米赤霉烯酮(ZEN)、赭曲霉毒素 A(OTA)、黄曲霉毒素 B1(AFB1)、黄曲霉毒素 B2(AFB2)、黄曲霉毒素 G1(AFG1)、黄曲霉毒素 G2(AFG2)、伏马毒素B1(FB1)、伏马毒素B2(FB2):奥地利Biopure公司和美国Sigma公司;甲醇、乙腈(色谱纯):Fisher公司;乙酸铵、甲酸、乙酸:Sigma公司;0.2$m PTFE膜针头过滤器:PALL公司。
1.2 仪器与设备
ACQUITY UPLC超高压液相色谱仪:美国Waters公司;TSQ QUANTUM ULTRA四级杆串联质谱仪:美国Thermo Fisher Scientific公司;3-30K离心机:美国Sigma公司;GT10-1高速台式离心机:北京时代北利离心机有限公司;Roto-Shake Genie多用途旋转摇床:美国Scientific Industries公司。
1.3 标准溶液配制
AFB1、AFB2、AFG1、AFG2、OTA 分别用乙腈配制成1 mg/L的标准储备液,3-AcDON、15-AcDON、HT-2、ZEN分别用乙腈配制成40 mg/L的储备液,DON用甲醇配制成100 mg/L的储备液,T-2用乙腈配制成10 mg/L储备液,FB1、FB2用乙腈∶水(1∶1,V/V)配制成40 mg/L的标准储备液。标准储备液均于#20%C保存。
将上述各毒素标准储备液用乙腈稀释成浓度如下的混合标准溶液,其中:AFB1、AFB2、AFG1、AFG2、OTA为0.1 mg/L,DON 为10 mg/L,3#AcDON 为4 mg/L,15#AcDON、ZEN、FB1、FB2为 2 mg/L,T#2 为0.2 mg/L,HT-2为1 mg/L。使用前将混合标准溶液用乙腈∶水(40∶60,V/V)或空白玉米提取液(按照1.4制备)进行逐级稀释,配制成不同浓度的净溶液标准工作液和基质匹配标准工作液,备用。
1.4 样品前处理
样品经粉碎(90%通过40目筛)混匀后,称取5.00 g,加入 20 mL 乙腈∶水∶乙酸(80∶19∶1,V/V/V)混合溶剂,涡旋混匀1 min,振荡30 min。然后4 000 r/min离心10 min使固液分离。准确转移0.5 mL上清液于1.5 mL离心管中,加入0.5 mL超纯水稀释,涡旋混匀1 min,然后12 000 r/min离心10 min,取上清液用0.22μm的PTFE滤膜过滤,待测。
1.5 仪器条件
色谱条件:色谱柱,Agilent ZORBAX Eclipse XDB C18柱(100 mm ×2.1 mm,1.8$m);流速,0.25 mL/min;柱温,30%C;进样量,5$L;流动相,A相为甲醇,B相为含0.1%甲酸和0.5 mM乙酸铵的水溶液;洗脱条件,0~1 min 20%A,1~10 min 20%~35%A,10~16 min 35%~95%A,16~20 min 95%A,20~20.1 min 95%~20%A,20.1~24 min 20%A。
质谱条件:离子源,ESI源;质谱扫描方式,选择反应监测模式(SRM),正负切换;喷雾电压,3.0 kV(+)/2.5 kV(-);加热气温度,100℃;鞘气流速,40 L/h;辅助气流速,20 L/h;离子传输毛细管温度,350℃;碰撞气为氩气,碰撞压力为1.5 mTorr;质谱扫描循环时间0.7 Sec。各真菌毒素质谱条件、母离子及定量、定性子离子见表1。

表1 13种真菌毒素质谱条件
2 结果与讨论
2.1 仪器条件的优化
色谱柱的选择 液相检测真菌毒素一般使用反相C18色谱柱,试验对比了Waters BEH C18柱(100 mm ×2.1 mm,1.7$m)、Waters HSST3柱(100 mm ×2.1 mm,1.7$m)和 Agilent ZORBAX Eclipse XDB C18(100 mm×2.1 mm,1.8$m)3种亚微米级粒径的色谱柱对13种真菌毒素的分离效果。结果表明,大多数毒素在3种色谱柱上都能实现较好的分离,即使不能实现基线分离的毒素,由于母离子和子离子不同亦不影响定性和定量。其中DON的乙酰基化代谢产物3-AcDON和15-AcDON为同分异构体,具有相似的分子结构,选择[M+H]+母离子339经碰撞后两者都同时存在 m/z为231、203、213、321、137、261的子离子,只是相对丰度不同,2个分子之间存在“Cross talk”效应,影响质谱准确定性定量。为了准确鉴定3-AcDON和15-AcDON这2种镰刀菌毒素的化学分型,应在色谱上实现两者分离。试验表明,在较短的梯度洗脱时间内,使用BEH C18和HSST3色谱柱,3-AcDON和15-AcDON几乎完全重合,而XDB C18柱能较好的分离2种同分异构体,分离度R可达0.9(见图1),因此选用 Eclipse XDB C18色谱柱。
流动相的选择 对比甲醇、乙腈为强洗脱流动相和含有不同比例的甲酸、乙酸、乙酸铵的水溶液为弱洗脱流动相对13种真菌毒素保留时间以及质谱响应的影响。结果表明,甲醇为强洗脱流动相,含有0.1%甲酸的0.5 mM NH4Ac的水相为弱洗脱流动相,各毒素具有较高的灵敏度和稳定的质谱响应。质谱条件的选择 在上述优化流动相条件下,使用ESI源分别优化13种毒素的母离子、透镜电压、碰撞能量、1个定量子离子和2个定性子离子,各毒素的质谱参数请见表1。

图1 SRM模式下,13种真菌毒素的总离子流(TIC)叠加图
2.2 样品提取溶剂的优化
提取溶剂对回收率的影响 目前粮食中真菌毒素的提取主要选择甲醇、乙腈、水、酸以不同比例混合作为提取溶剂[9-10],试验对比了甲醇∶水(75∶25,V/V)、乙腈∶水(50∶50)、乙腈∶水(75∶25)、乙腈∶水∶乙酸(75∶24∶1)、乙腈:水(80∶20)、乙腈∶水∶乙酸(80∶19∶1)、乙腈∶水(84∶16)作为提取溶剂对 13 种毒素回收率的影响。采用基质匹配外标法定量结果表明,除了FB1和FB2,其他毒素回收率均在70%~120%之间。FB1和FB2的回收率在乙腈∶水(50∶50)中最高,为100%左右。随着提取溶剂中乙腈比例的提高,FB1和FB2的回收率逐渐降低,在乙腈∶水(84∶16)提取溶剂中回收率仅为40%。试验中还发现在乙腈∶水的提取溶剂中加入少量乙酸可以显著提高FB1和FB2的回收率。Beltran等[11]也得到相同的结论,这可能与FBs结构中含有多个羧基,具有一定亲水性和酸性有关。
提取溶剂对质谱响应的影响 试验重点对比了毒素回收率较高的甲醇∶水(75∶25)、乙腈∶水(50∶50)、乙腈∶水∶乙酸(75∶24∶1)、乙腈∶水∶乙酸(80∶19∶1)4 种提取溶剂对玉米基质的影响。从外观看,乙腈水混合提取液呈黄色,经净化后颜色变浅;而甲醇水提取液虽然外观看色素较少,但在使用0.22$m PTFE滤膜过滤时有较大的阻力,这可能是由于甲醇水提取液中含有较多大分子蛋白。使用4种玉米空白基质配制相同浓度的基质匹配标准溶液进行质谱检测。多数真菌毒素在甲醇∶水(75∶25)玉米基质中响应最低,在乙腈∶水∶乙酸(80∶19∶1)玉米基质中响应最高。进一步采用ESI(+)全扫描(m/z 150~900)方式对4种空白玉米基质进行检测。在保留时间1.5~4 min和 11~16 min的范围内,甲醇∶水(75∶25)和乙腈∶水(50∶50)的空白玉米基质本底较高,而乙腈∶水∶乙酸(80∶19∶1)的空白玉米基质本底最低,对毒素离子化效率的干扰最小,因此选择乙腈∶水∶乙酸(80∶19∶1)混合溶剂作为提取液。
2.3 基质效应
试验采用基质匹配标准曲线斜率与净溶液标准曲线斜率的比值来评估基质对真菌毒素质谱响应的抑制或增强效应(Signal Suppression/Enhancement,SSE)。13种毒素在玉米提取液中的基质效应见表2,其中 AFG2、AFG1、AFB2、AFB1和 ZEN 的响应受到较强的抑制作用SSE%在31%~67%之间,FB1表现为基质增强效应 SSE%为127%,DON、3-AcDON、15-AcDON、HT-2、T -2、OTA、FB2受基质效应的影响较小SSE%在88%~112%之间。与文献[12]报道毒素在玉米中的基质效应相比,除了ZEN,本试验所建立方法中毒素的基质效应均显著低于文献的方法。

表2 玉米中13种真菌毒素的线性范围、相关系数、检出限、定量限和基质效应
2.4 方法学验证
采用空白基质液逐级稀释方法获得各真菌毒素的检出限(LOD,S/N≥3)和定量限(LOQ,S/N≥10)。表2列出了13种真菌毒素的线性范围、检出限和定量限。在各自的线性范围内,13种真菌毒素线性关系良好,相关系数(R2)均大于0.99,LOD和LOQ均低于欧盟和我国规定的粮食中真菌毒素限量标准,满足限量检测的要求。
取空白玉米样品,分别添加3个浓度水平的混合标准溶液,按“1.4”样品处理方法进行处理,每个加标水平进行6次重复实验,回收率结果见表3。13种真菌毒素3个添加水平回收率在80%&114%之间,相对标准偏差在0.9%&10.9%之间,符合欧盟法规的要求[13]。

表3 玉米中13种真菌毒素的加标回收率(n=6)
为了进一步验证方法的准确度和适用性,对真菌毒素的玉米粉基体标准物质进行测定。如表4所示,9种毒素的检测值均在标准值±不确定度的范围内,表明本研究所建立的方法准确可靠。
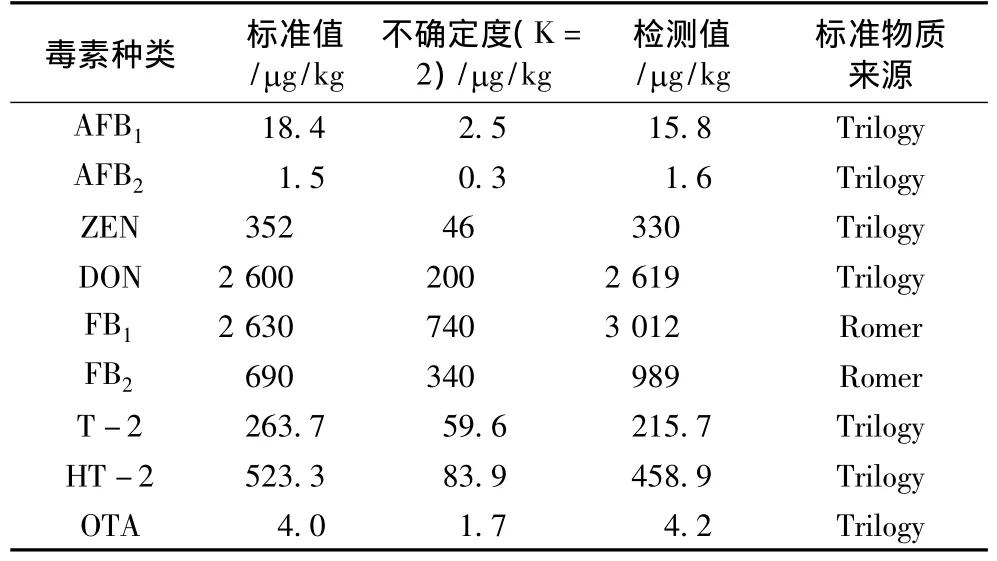
表4 对玉米粉基体标准物质的检测结果
3 结论
采用UPLC-MS/MS方法建立了玉米中13种真菌毒素的检测方法,样品经过提取、稀释、离心和过滤等简单净化过程即可进样检测,通过优化提取溶剂和仪器条件有效降低基质干扰。采用加标回收法和测定基体标准物质验证了方法的准确度和精密度,方法定量限在1~200μg/kg之间,满足国内外对粮食中真菌毒素限量的要求。与其他真菌毒素检测方法相比,本试验的方法快速简单,不需要使用特殊的净化材料,适合实验室进行批量样品准确测定。
[1]Commission Regulation(EC)No 1881/2006,setting maximum levels for certain contaminants in food stuffs[S]
[2]Commission Recommendation of 27 March 2013 on the presence of T -2 and HT -2 toxin in cereals and cereal products[S]
[3]GB2761—2011,食品安全国家标准食品中真菌毒素限量[S]
[4]Zollner P,Mayer- Helm B.Trace mycotoxin analysis in complex biological and food matrices by liquid chromatography - atmospheric pressure ionisation mass spectrometry[J].Journal of Chromatography A,2006,1136:123-169
[5]Wang Y,Xiao C,Guo J,et al.Development and application of a method for the analysis of 9 mycotoxins in maize by HPLC - MS/MS[J].Journal of Food Science,2013,78:M1752-M1756
[6]Berthiller F,Schuhmacher R,Buttinger G,et al.Rapid simultaneous determination of major type A-and B-trichothecenes as well as zearalenone in maize by high performance liquid chromatography - tandem mass spectrometry[J].Journal of Chromatography A,2005,1062:209-216
[7]Lattanzio V M T,Solfrizzo M,Powers S,et al.Simultaneous determination of aflatoxins,ochratoxin A and Fusarium toxins in maize by liquid chromatography/tandem mass spectrometry after multitoxin immunoaffinity cleanup[J].Rapid Communications in Mass Spectrometry,2007,21:3253-3261
[8]郑翠梅,张艳,王松雪,等.液相色谱-飞行时间质谱同时测定粮食中13种真菌毒素[J].分析测试学报,2012,31:383-389
[9]任一平,章宇,邵双良,等.液质联用检测污染食品和饲料中的多组分霉菌毒素[C].中国科学技术学会第五届年会暨第四届东西方食品业高层论坛论文,2007
[10]Sulyok M,Berthiller F,Krska R,et al.Development and validation of a liquid chromatography/tandem mass spectrometric method for the determination of 39 mycotoxins in wheat and maize[J].Rapid Communications in Mass Spectrometry,2006,20:2649-2659
[11]Beltran E,Ibanez M,Sancho J V,et al.Determination of mycotoxins in different food commodities by ultra-highpressure liquidchromatography coupled to triple quadrupole mass spectrometry[J].Rapid Communications in Mass Spectrometry,2009,23:1801-1809
[12]Frenich A G,Martinez Vidal JL,Romero-Gonzalez R,et al.Simple and high-throughput method for the multimyco-toxin analysis in cereals and related foods by ultra-high performance liquid hromatography/tandem mass spectrometry[J].Food Chemistry,2009,117:705 -702
[13]Commission Regulation(EU)No 519/2014,Amending Regulation(EC)No 401/2006 as regards methods of sampling of large lots,spices and food supplements,performance criteria for T-2,HT-2 toxin and citrinin and screening methods of analysis[S].
