1 株短短芽孢杆菌产抗菌物质发酵培养基的优化
2015-03-11夏尚远
夏尚远
(山东省枣庄市畜牧兽医局,山东 枣庄277100)
自20世纪50年代美国食品与药物管理局(FDA)首次批准饲料中可以添加抗生素后,抗生素迅速在畜禽养殖中得到推广,抗生素在动物疫病预防、控制,促进畜禽生长和稳定社会发展中发挥了重要作用。然而随着抗生素的滥用和药物敏感性下降,耐药菌对畜产品质量安全和人类健康造成了巨大威胁,据统计,我国每年抗生素生产量约为21 万吨,其中养殖业上用量约9.7 万吨,每年约有8 万人因滥用抗生素死亡[1]。近年来,随着人们生活水平的提高和环保意识的增强,全球许多国家和地区都禁止或限制在养殖业中添加抗生素,解决抗生素滥用问题刻不容缓,1986 年,瑞典全面禁止在畜禽饲料中添加抗生素。2006 年1 月1 日起,欧盟禁止所有预防性抗菌促生长剂用于食品动物[2],我国农业部也将全面禁止在动物饲料中添加抗生素。为有效解决食品动物源细菌耐药性问题,一方面应“谨慎、负责地”使用抗菌药物;另一方面是加大技术研发力度,研发并推广应用抗菌肽、中成药、益生菌等抗生素替代品。
抗菌肽是一类存在于多种生物体内并具有广谱杀菌特性的一类肽类活性物质,1974 年,瑞典科学家Boman 等人在天蚕蛾蛹血淋巴细胞中首次发现多肽类物质[3],Yang.J.H[4]等人从水稻样本中分离出203株抗水稻真菌病害的细菌,其中短短芽孢杆菌1Re14防治水稻叶瘟的效果最高,其防治率高达68.5%。目前科学家已经在细菌、两栖动物、昆虫等体内或分泌物中发现出上千种抗菌肽[5]。本实验室成功分离并鉴定出1 株能对多种动物源性病原菌产生拮抗作用的短短芽孢杆菌,通过对菌株发酵产物分离纯化得到了其中一种具有抗菌活性的物质,被命名为Tostadin,该抗菌物质能有效的抑杀多种动物病菌的生长,如大肠杆菌、鸡白痢沙门菌、葡萄球菌、黑曲霉、黄曲霉等,应用前景十分广阔[6]。为进一步提高发酵物质产量,本试验在前期发酵配方基础上通过响应面法对配方进一步优化,以期为益生菌工业化生产提供重要的理论依据。
1 材料与方法
1.1 菌株 拮抗菌:短短芽孢杆菌(Brevibacillus brevis)由本实验室分离鉴定并保存。
指示菌:大肠杆菌K12(E.coli K12)由山东农业大学微生物实验室提供。
1.2 培养基 基础培养基:土豆200.0 g,葡萄糖20.0 g,牛肉膏5.0 g,(NH4)2SO41.0 g,MgSO41.0 g,KH2PO40.6 g,CaCO33.0 g,H2O 1 L。
种子培养基:蛋白胨10.0 g,牛肉膏5.0 g,Na-Cl 5.0 g,蒸馏水1 000 mL。
活化培养基:土豆200.0 g,葡萄糖20.0 g,牛肉膏5.0 g,(NH4)2SO41.0 g,MgSO41.0 g,KH2PO40.6 g,CaCO33.0 g,琼脂15.0 g,蒸馏水1 000 mL。
初始发酵培养基:葡萄糖2.0%,黄豆饼粉3.0%,淀粉0.6%,CaCO30.2%,MgSO40.4%,蒸馏水1 000 mL。
抗菌物质效价生物测定培养基:上层培养基:牛肉膏5.0 g,蛋白胨10.0 g,NaCl 5.0 g,琼脂15.0 g,蒸馏水1 000 mL;下层培养基:琼脂18.0 g,蒸馏水1 000 mL。
1.3 培养条件 斜面菌种培养条件:接种环划线接种于活化斜面培养基中,30 ℃培养18 h,4 ℃保存备用。
种子培养条件:刮取斜面菌体2 环接种于装有50 mL 种子培养基的250 mL 三角瓶中,30 ℃,200 r/min 摇床培养20 h。
发酵培养条件:将上述培养好的种子按照2%接种量,接种于装有50 mL 液体发酵培养基的250 mL 三角瓶中,30 ℃,200 r/min 摇床培养48 h。
1.4 抗菌物质效价的测定
1.4.1 双层平板的制备 量取15 mL 已熔化的下层培养基,倒入90 mm 的培养皿中,待冷却后再倒入8 mL 含3%大肠杆菌K12 菌悬液的上层培养基。
1.4.2 效价的测定 效价的测定采用牛津杯法[7]。将发酵液100 ℃灭菌10 min,冷却后于5 000 r/min 离心10 min,取250 μL 上清液注入到牛津杯(内径6±0.1 mm,高10±0.1 mm,外径8±0.1 mm)中,30 ℃培养6 h,每个样品重复2 次,采用十字交叉法测量抑菌圈直径,根据抑菌圈的直径大小计算其效价,其效价计算公式为:Y=10[(X-2.6475)/5.9311)]×n(11.3 >X >14.5),[Y 为浓度U,X 为直径(mm),n 为发酵液稀释倍数][8]。
1.5 培养基优化试验
1.5.1 Plackett-Burman(PB)试验设计 在前期试验的基础上,选取5 种培养基组分(葡萄糖、黄豆饼粉、淀粉、CaCO3、MgSO4)进行PB 试验设计。其因素水平及编码见表1,其中低水平“-1”值采用培养基成分的原始浓度,高水平“+1”值为低水平的1.25 倍,响应值为抗菌物质的效价。
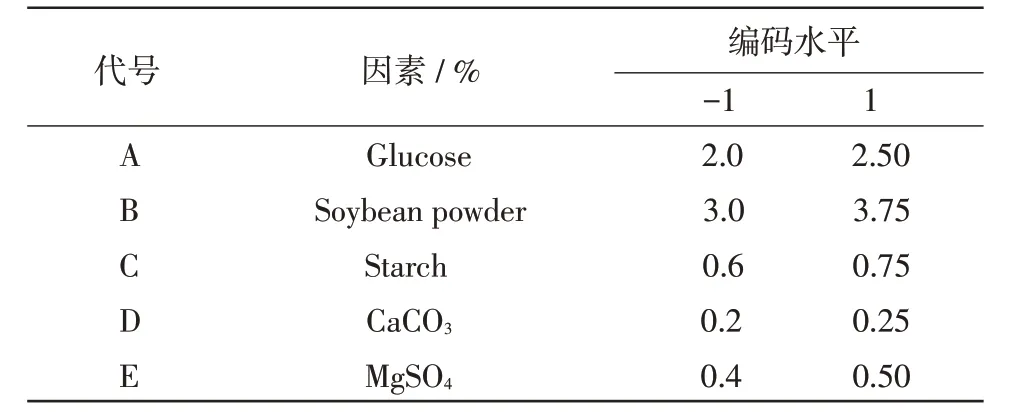
表1 PB 试验设计的因素及其编码值
1.5.2 最陡爬坡试验 利用SAS9.0 对PB 试验数据进行一元线性回归分析,根据试验拟合的一次多项式方程找出主要影响因子,并确定最陡爬坡的方向及步长,由此接近最大响应区域,具体的设计参照文献[9]。
2 结果与分析
2.1 发酵产抗菌物质主要影响因素的筛选 PB试验设计及结果见表2。
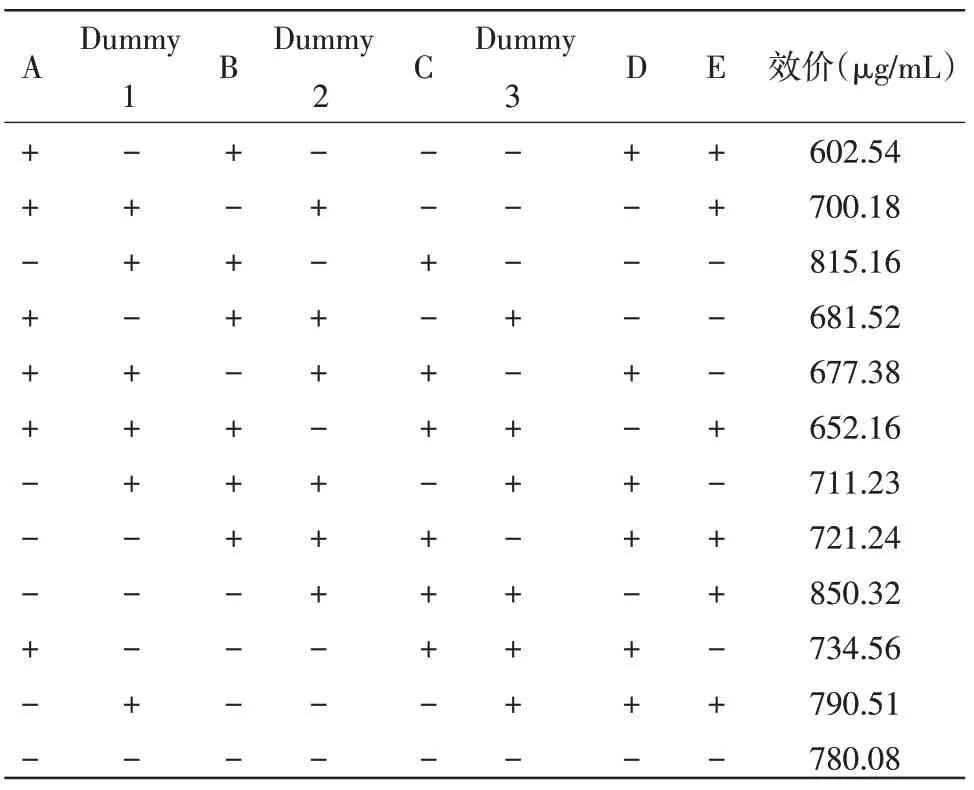
表2 n= 12的PB 试验设计及响应值
采用软件SAS9.0 对PB 试验结果进行方差分析,得到各因素对响应值Y(效价,μg/mL)的影响效果,见表3。
对试验数据进行分析,并拟合一次回归方程,其模型为:
抗菌物质效价Y=1566-140A-99B+195C-776D-123E(1)
该方程的R2(adj)为79.3%,表明该回归方程拟合良好。
由表3 可以看出,影响XDH 发酵产抗菌物质的显著因素有:葡萄糖(P=0.001)和黄豆饼粉(p=0.020)。而且他们对产素产生负影响,因此要应适当降低这两个因素的浓度以获得更大产量。对产素影响不很显著的其他因素则维持在低水平。
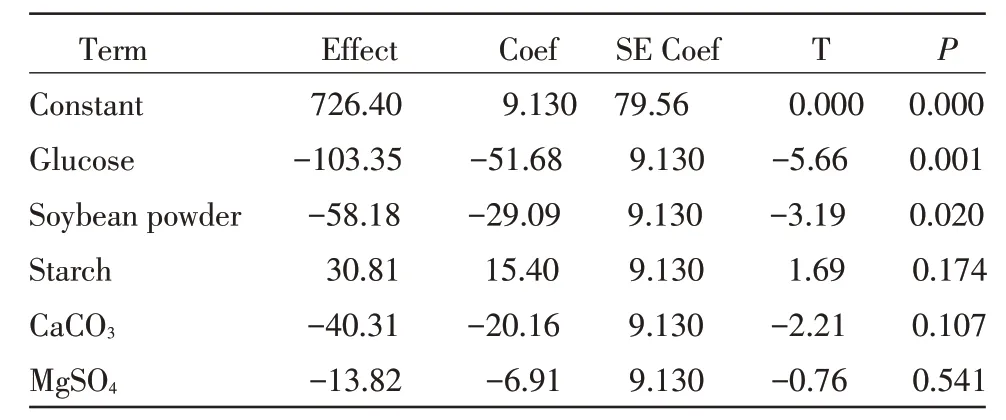
表3 各因素的主效应
2.2 最陡爬坡试验 根据PB 试验结果,我们选择葡萄糖与黄豆饼粉这两个极显著的因素进行爬坡试验,试验设计及结果见表4。可以看出,当葡萄糖为1.50%,黄豆饼粉为2.72%时,抗菌物质的效价达到了1228.46 μg/mL。

表4 最陡爬坡试验设计及结果
3 讨论
3.1 本试验对发酵培养基优化过程为:首先通过Plackett-Burman 试验确定主要的影响因素葡萄糖与黄豆饼粉,然后通过最陡爬坡试验确定了其最佳浓度。其效价比初始发酵培养基提高了69.27%。但此研究仅限于摇瓶发酵,仍需要上罐分批发酵进一步验证。
3.2 几乎所有的微生物都能利用葡萄糖,选择适宜的糖浓度将会大大提高产素,然而当糖浓度太高时对菌体生长会产生“葡萄糖效应”,因此为防止葡萄糖效应,在培养基中加入了淀粉,考虑到淀粉的溶解性不好的特点,我们将其浓度定在0.6%。本试验中选择了黄豆饼粉作为有机氮源,这不仅节约成本,更重要的是它有利于菌体的生长和生产能力的提高。
3.3 本实验室分离得到的菌株抑菌谱极广,对大肠杆菌、沙门菌、黑曲霉、黄曲霉等致病菌有强烈的抑制作用,其中对鸡白痢沙门菌的MIC 为0.6274 μg/mL,MBC 为1.2548 μg/mL;对大肠杆菌的MIC 为2.3438 μg/mL,MBC 为4.6875 μg/mL;对葡萄球菌的MIC 为9.3750 μg/mL,MBC 为18.7510 μg/mL,因此具有着广阔的应用前景[10]。
[1] 成雪.养殖业抗生素滥用的危害及应对措施[J].养殖技术顾问,2013,9:194-195.
[2] 谷巍.抗菌肽在畜牧养殖业中的应用[J].养殖与饲料,2010,10:66-68.
[3] Haizhen Mo,Yang Zhu,Zongmao Chen.Microbial fermented tea-a potential source of natural food preservatives[J].Food science and technology,2007,1-7.
[4] Yang J H,Liu H X,Zhu G M,et al.Diversity analysis of antagonists from rice-associalted bacteria and their application in biocontrol of rice disers [J].Journal of Applied Microbiology,2007.104(1):91-104.
[5] Enzo A.Tosi,Edmundo Re,Marta E.Ortega,et al.Food preservative based on propolis:Bacteriostatic activity of propolis polyphenols and flavonoids upon Escherichia coli[J].Food Chemistry,2007,104:1025-1029.
[6] Song Z,Liu Q,Guo H,et al.Tostadin, a novel antibacterial peptide from an antagonistic microorganism Brevibacillus brevis XDH[J].Bioresource Technology,2012,111:504-506.
[7] 国家药典委员会.中国药典(二部).北京:化学工业出版社,2005.
[8] 薛东红.短短芽孢杆菌XDH 的鉴定及其抗菌物质的分离、纯化与部分性质研究[D].泰安:山东农业大学,2006:39.
[9] 袁志发,周静芋.实验设计与分析[M].北京:高等教育出版社,2000:339-346.
[10] 夏尚远.短短芽孢杆菌(Brevibacillus brevis)XDH 抗菌物质的发酵、分离纯化与结构鉴别[D].泰安:山东农业大学,2008:49.
